
қысқа мерзімді сабақ жоспарларын

Фосфор және оның қосылыстары
Сатылымнан түскен қаражат авторға автоматты түрде аударылады. Толығырақ
беріледі

Дипломдар мен сертификаттарды алып үлгеріңіз!




1 слайд
Фосфор және оның қосылыстары
жөнінде білімдерін кеңейту.
Оқушылардың химиядан алған
білімін тиянақтап,пәнге деген
қызығушылығын арттыру .Сабақтың мақсаты: Сабақтың тақырыбы:
Фосфор және
оның қосылыстары

2 слайд
Кім көп біледі ?
1.Азотты ең алғаш ашқан кім?
(1772ж.Д.Резерфорд)
2.Азот қышқылының физикалық қасиеттері
(түссіз,исі бар,сұйықтық)
3.Азот қышқылы металдармен әрекеттескенде сутек газын
бөлмейді....
(NO, NO
2, N
2 )
4.Нитратқа сапалық реакция
(NO
2 бөлінеді,Си пен НNO
3 )
5.Ляпис дегеніміз не?
(AgNO
3 )
6.Нитраттардың қолданылуы
(селитра,қопару ісіне,отшашулар,пиротехника)
7.Калий нитратының қыздырғанда ыдырайды...
(нитрит,оттек)
8.Нитраттардың қолданылуы
(селитра,қопару ісіне,отшашулар,пиротехника)
9.Күміс нитраты қыздырғанда ыдырайды.....
(металл,оттек)

3 слайд
•
Сендер мына тұжырымдамалармен келісесіңдер ме:
•
1. Азот қышқылы күшті тотықтырғыш болып саналады.
•
2. Азот қышқылы еритін негіздермен ғана әрекеттеседі.
•
3. Азот қышқылы жарықта ыдырайды.
•
4. Азот қышқылының тұздарын нитриттер деп атайды.
•
5. Азот қышқылы металдардың электрохимиялық қатарында
сутегіне дейінгі металдармен әрекеттеседі.
•
6. Азот қышқылы алюминийді пассивтейді.
•
7. Азот қышқылы өндірісте аммиактан алады.
•
8. Азот қышқылы металдармен әрекеттескенде сутегі
бөлінбейді.

4 слайд
•
І.«Сөзжұмбақ»
•
1.Азотты сипаттаған ғалым.
•
2.Ауа құрамындағы 78% газ
•
3.Күміс нитратының атауы
•
4.Атмосфераға азот бөліп жанатын зат.
•
5. NH+4 ионының аталуы
•
6.Азоттың металдармен қосылысы

5 слайд
•
Сандарды сөйлетейік
•
1669
•
31
•
15, ,5,,,
•
56, 600

6 слайд
•
Фосфор (лат. Phosphorus), P – элементтердің периодтық
жүйесінің V тобындағы хим. элемент . Бірнеше түрі бар:
ақ Ф. – тығызд. 1,828 г/см3; балқу t – 44,14° С; қызыл Ф.
– тығызд. 2,31 г/см3; балқу t – 593° С.
•
Химиялық элементтердің периодтық жүйесінде фосфор
III периодта, V топтың негізгі топшасында орналасқан.
Салыстырмалы атомдық массасы 31, реттік нөмірі (ядро
заряды) 15.

7 слайд
Фосфордың атом
құрылысы Периодтық жүйедегі орны
ТОП
Период -3, 0, +3, +5 тотығу
дәрежесі тән
орын
1669 жыл неміс
алхимигі Бранд ашқан
8 слайд
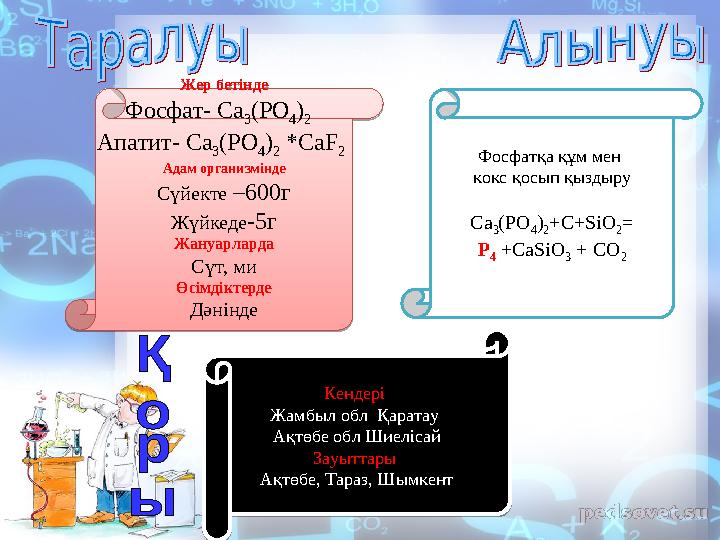
Жер бетінде
Фосфат - Ca
3 (PO
4 )
2
Апатит - Ca
3 (PO
4 )
2 *CaF
2
Адам организмінде
Сүйекте –600г
Жүйкеде -5г
Жануарларда
Сүт, ми
Өсімдіктерде
Дәнінде Фосфатқа құм мен
кокс қосып қыздыру
Ca
3 (PO
4 )
2 +C+SiO
2 =
P
4 +CaSiO
3 + CO
2
Кендері
Жамбыл обл Қаратау
Ақтөбе обл Шиелісай
Зауыттары
Ақтөбе, Тараз, ШымкентЖер бетінде
Фосфат - Ca
3 (PO
4 )
2
Апатит - Ca
3 (PO
4 )
2 *CaF
2
Адам организмінде
Сүйекте –600г
Жүйкеде -5г
Жануарларда
Сүт, ми
Өсімдіктерде
Дәнінде Кендері
Жамбыл обл Қаратау
Ақтөбе обл Шиелісай
Зауыттары
Ақтөбе, Тараз, Шымкент

9 слайд
Ақ түсті кристалл зат
ρ = 1,83г/см 3
Қараңғыда
жарқырайды
Кәдімгі жағдайда
тотығады
От алғыш, су астында
сақтайды
Суда ерімейді, CS
2
ериді
Өте қауіпті, улы
t
қай = 280 ° С, t
б = 44 ° С Аморфты зат ρ = 2,20г/см 3
Қараңғыда жарқырамайды
260 ° С-та тотығады
Отқа қауіпті емес,
қыздырғанда от алады
Судада, CS
2 де ерімейді
Улы емес
t
б = 400 ° С Қара түсті, металдық
жылтыры бар, кристалл
зат
Сирек кездеседіt t
10 слайд
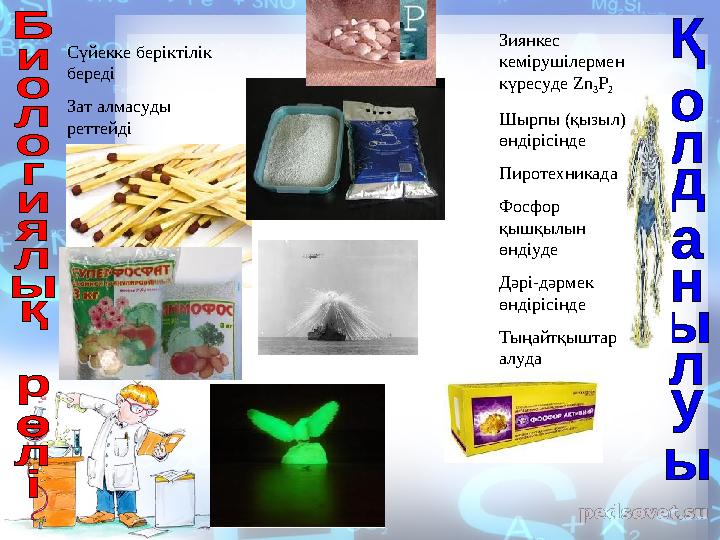
Сүйекке беріктілік
береді
Зат алмасуды
реттейді Зиянкес
кемірушілермен
күресуде Zn
3 P
2
Шырпы (қызыл)
өндірісінде
Пиротехникада
Фосфор
қышқылын
өндіуде
Дәрі-дәрмек
өндірісінде
Тыңайтқыштар
алуда

11 слайд
I. Фосфаттың құрамындағы PO
4 ионын қалай анықтайды ? (күміс нитраты)
II. Натрий фосфатында индикатордың түсі қалай өзгереді ? (гидролиз жүреді )
III. Сіріңкені жаққанда қандай реакция жүреді ? (5КСІО
3 + 6Р → 5КСІ+ 3Р
2 О
5 )

12 слайд
Бекіту сұрақтары
1.Фосфор,Фосфор (V ) оксиді,фосфор қышқылындағы фосфордың тотығу дәрежесі
2.Фосфиннің формуласы,тоығу дәрежесі,физикалық қасиеті
(РН
3, -3,түссіз исібар өте улы зат)
3.Фосфордың қандай түр өзгерістері бар?
(Ақ,қызыл қара фосфор )
4.Кемірушілерге қарсы қолданатын мырыш,алюминий фосфидтерінің теңдеулерін
жаз
Zn
3 P
2 , AL P
5.Фосфордың мына тұздарын ата:
Мg
3 (PO
4 )
2, ВаНРО
4, Мg(Н
2 PO
4 )
2, Nа
2 НРО
4 К
2 NaРО
4 , КН
2 РО
4
6.Азот пен фосфордың ұқсастығы айырмашылығын сипатта
(бос күйінде кездеспейді, Фосфин улы тез тотығып кетеді
7.Фосфор қышқылы азот және күкірт қышқылымен қандай ерекшелігі бар ?
(қатты,ұшпайтын,мөлдір кристалл зат,суда нашар ериді)
НN О
3 –(тұншықтырғыш иісті ылғалды тез сіңіреді )
H
2 SO
4 – (Май тәрізді ауыр сұйықтық,сумен бұрқырап қайнайды )
13 слайд
14 слайд
Үйге тапсырма: 20 Фосфор және оның қосылыстары №8,9
жаттығулар
Сіз үшін 400 000 ұстаздардың еңбегі мен тәжірибесін біріктіріп, ең үлкен материалдар базасын жасадық. Төменде пәніңізді белгілеп, керек материалды алып сабағыңызға қолдана аласыз
 Дайын ҚМЖ. Барлық пәндерден 2022-2023 оқу жылына, жаңа бұйрыққа сай жасалған
Дайын ҚМЖ. Барлық пәндерден 2022-2023 оқу жылына, жаңа бұйрыққа сай жасалған