

Ашық сабақ "Кремний және оның қосылыстары" презентациясы
Дипломдар мен сертификаттарды алып үлгеріңіз!



1 слайд
Кремний және оның
қосылыстары
Silicon and its compounds
1 слайд
Кремний және оның қосылыстары Silicon and its compounds

2 слайд
9.2.1.24 Кремнийдің қолданылу аймағын және
оның жартылай өткізгіш ретінде қолданылуын
түсіндіру
9.1.4.8 Кремний оның диоксиді мен карбидіндегі
химиялық байланыс түрін және кристалдық тор түрін
сипаттау
9.2.1.25 Кремний мен оның қосылыстарының негізгі
химиялық қасиеттерін сипаттау және реакция теңдеулерін
құрастыруСабақтың мақсаты:
2 слайд
9.2.1.24 Кремнийдің қолданылу аймағын және оның жартылай өткізгіш ретінде қолданылуын түсіндіру 9.1.4.8 Кремний оның диоксиді мен карбидіндегі химиялық байланыс түрін және кристалдық тор түрін сипаттау 9.2.1.25 Кремний мен оның қосылыстарының негізгі химиялық қасиеттерін сипаттау және реакция теңдеулерін құрастыруСабақтың мақсаты:

3 слайд
3 слайд

4 слайд
4 слайд

5 слайд
5 слайд

6 слайд
Si
SiO
2 H
2 SiO
3
Si + 4F = SiF
4 SiO
2 + 2NaOH = Na
2 SiO
3 +
H
2 O H
2 SiO
3 + 2NaOH = Na
2 SiO
3
+ 2H
2 O
Si + 2Cl
2 = SiCl
4 K
2 O + SiO
2 = K
2 SiO
3
H
2 SiO
3 = SiO
2 + H
2 O
Si + C = SiC
CaO + SiO
2 = CaSiO
3
2Mg + Si = Mg
2 Si
6 слайд
Si SiO 2 H 2 SiO 3 Si + 4F = SiF 4 SiO 2 + 2NaOH = Na 2 SiO 3 + H 2 O H 2 SiO 3 + 2NaOH = Na 2 SiO 3 + 2H 2 O Si + 2Cl 2 = SiCl 4 K 2 O + SiO 2 = K 2 SiO 3 H 2 SiO 3 = SiO 2 + H 2 O Si + C = SiC CaO + SiO 2 = CaSiO 3 2Mg + Si = Mg 2 Si
7 слайд
7 слайд

8 слайд
8 слайд

9 слайд
9 слайд

10 слайд
Ең көп тараған
SiO 2 – кремнезем
(кварц немесе
құм). Кремнезем -атомдық кристальдық торлы,қиын
балқитын зат. Оның балқу температурасы-1713С.
Балқыған кремнезем суығанда аморфты кварц
шынысына айналады . Құрамында SiO
2 өзі ғана
болса, ақ түсті құм, ал темір қосылыстары араласса,
сары немесе қызғылт қоңыр түсті болады.
Кремнезем ( SiO
2 )
n – табиғи
полимер, трепел деп аталатын аморфты
кремнеземнен қопарылғыш зат-динамит
даярлайды. Кристалдық кремнеземді кварц дейді,
оның алты қырлы призма тәрізді мөлдір түрі тау
хрусталі деп аталады, одан бағалы тастар,
оптикалық линзалар алынады. Ал күңгірттеу түстісі
— аметист , одан зергерлік бұйымдар жасайды.
Кварцтың майда кристалдары өзен суына
жиналатын құмды құрайды.
10 слайд
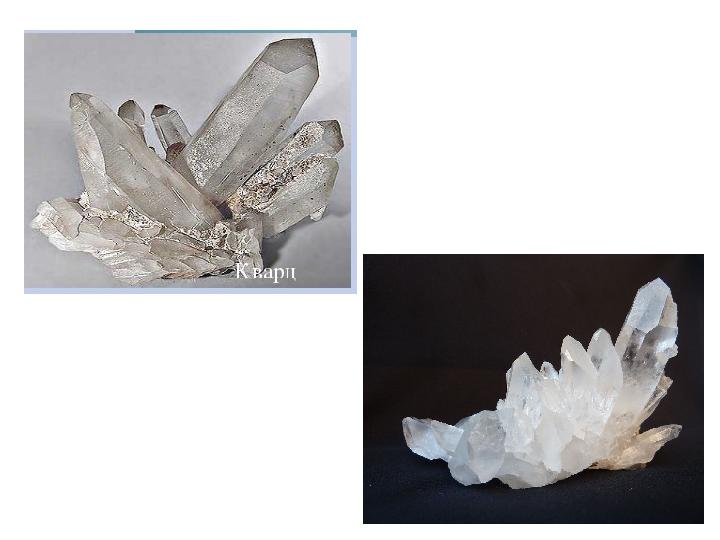
Ең көп тараған SiO 2 – кремнезем (кварц немесе құм). Кремнезем -атомдық кристальдық торлы,қиын балқитын зат. Оның балқу температурасы-1713С. Балқыған кремнезем суығанда аморфты кварц шынысына айналады . Құрамында SiO 2 өзі ғана болса, ақ түсті құм, ал темір қосылыстары араласса, сары немесе қызғылт қоңыр түсті болады. Кремнезем ( SiO 2 ) n – табиғи полимер, трепел деп аталатын аморфты кремнеземнен қопарылғыш зат-динамит даярлайды. Кристалдық кремнеземді кварц дейді, оның алты қырлы призма тәрізді мөлдір түрі тау хрусталі деп аталады, одан бағалы тастар, оптикалық линзалар алынады. Ал күңгірттеу түстісі — аметист , одан зергерлік бұйымдар жасайды. Кварцтың майда кристалдары өзен суына жиналатын құмды құрайды.
11 слайд
11 слайд

12 слайд
Каолинит
(ақбалшық) және
алюмосиликаттардың
Al2O3*2 SiO2*2H2O, Каолинит – силикаттар класындағы сазды
минерал. Химиялық формуласы Al4[S і4 O10]
(OH)8. Қытайдағы фарфор сазы өндірілетін Коо-
Лин тауының атымен аталған. Түсі таза күйінде
ақ, көкшіл, қоспаларына қарай – қызыл, қара,
ашық жасыл. Қатты 1 – 3, менш. салм. 2,6 г/см3.
Каолинит топырақ құрамында, үгілу
қабаттарында, ылғалды климат жағдайында
континенттік су алаптары түбінде түзілген
көмірлі тау жыныс қабаттарында кездеседі.
Каолиниттің диккит және накрит деген
полиморфтық түрлері бар. Бұл минералдарды
650 – 800°С-қа дейін қыздырғанда толығымен
судан арылады. Каолинит керамика өндірісінде,
фарфор мен фаянс, металлургияда шамот
кірпішін, бұрғылау ерітіндісін дайындауға,
құрылыста, қағаз өндірісінде, алюминий тотығын
алуда қолданылады. Каолинит негізінен
алюмосиликатты таужыныстардың морылуынан
және төмен температуралы метасоматозда пайда
болады
12 слайд
Каолинит (ақбалшық) және алюмосиликаттардың Al2O3*2 SiO2*2H2O, Каолинит – силикаттар класындағы сазды минерал. Химиялық формуласы Al4[S і4 O10] (OH)8. Қытайдағы фарфор сазы өндірілетін Коо- Лин тауының атымен аталған. Түсі таза күйінде ақ, көкшіл, қоспаларына қарай – қызыл, қара, ашық жасыл. Қатты 1 – 3, менш. салм. 2,6 г/см3. Каолинит топырақ құрамында, үгілу қабаттарында, ылғалды климат жағдайында континенттік су алаптары түбінде түзілген көмірлі тау жыныс қабаттарында кездеседі. Каолиниттің диккит және накрит деген полиморфтық түрлері бар. Бұл минералдарды 650 – 800°С-қа дейін қыздырғанда толығымен судан арылады. Каолинит керамика өндірісінде, фарфор мен фаянс, металлургияда шамот кірпішін, бұрғылау ерітіндісін дайындауға, құрылыста, қағаз өндірісінде, алюминий тотығын алуда қолданылады. Каолинит негізінен алюмосиликатты таужыныстардың морылуынан және төмен температуралы метасоматозда пайда болады

13 слайд
13 слайд
14 слайд
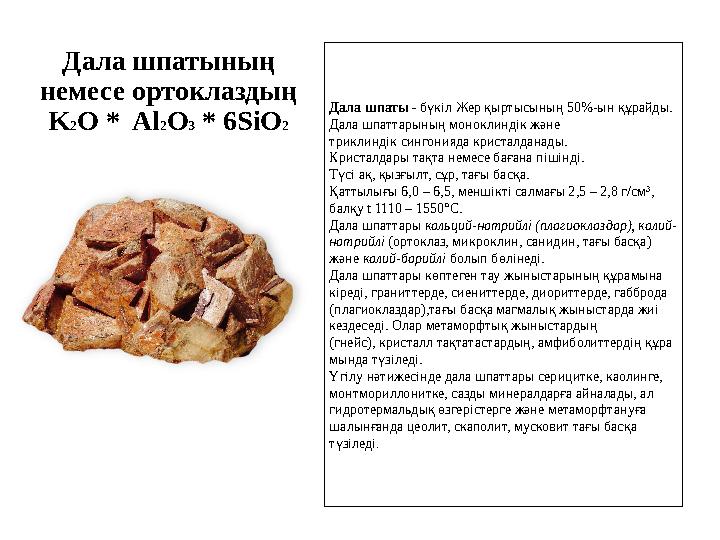
Дала шпатының
немесе ортоклаздың
K 2 O * Al 2 O 3 * 6SiO 2 Дала шпаты - бүкіл Жер қыртысының 50%-ын құрайды.
Дала шпаттарының моноклиндік және
триклиндік сингонияда кристалданады.
Кристалдары тақта немесе бағана пішінді.
Түсі ақ, қызғылт, сұр, тағы басқа.
Қаттылығы 6,0 – 6,5, меншікті салмағы 2,5 – 2,8 г/см 3
,
балқу t 1110 – 1550° С.
Дала шпаттары кальций-натрийлі (плагиоклаздар), калий-
натрийлі (ортоклаз, микроклин, санидин, тағы басқа)
және калий-барийлі болып бөлінеді.
Дала шпаттары көптеген тау жыныстарының құрамына
кіреді, граниттерде, сиениттерде, диориттерде, габброда
(плагиоклаздар),тағы басқа магмалық жыныстарда жиі
кездеседі. Олар метаморфтық жыныстардың
(гнейс), кристалл тақтатастардың, амфиболиттердің құра
мында түзіледі.
Үгілу нәтижесінде дала шпаттары серицитке, каолинге,
монтмориллонитке, сазды минералдарға айналады, ал
гидротермальдық өзгерістерге және метаморфтануға
шалынғанда цеолит, скаполит, мусковит тағы басқа
түзіледі .
14 слайд
Дала шпатының немесе ортоклаздың K 2 O * Al 2 O 3 * 6SiO 2 Дала шпаты - бүкіл Жер қыртысының 50%-ын құрайды. Дала шпаттарының моноклиндік және триклиндік сингонияда кристалданады. Кристалдары тақта немесе бағана пішінді. Түсі ақ, қызғылт, сұр, тағы басқа. Қаттылығы 6,0 – 6,5, меншікті салмағы 2,5 – 2,8 г/см 3 , балқу t 1110 – 1550° С. Дала шпаттары кальций-натрийлі (плагиоклаздар), калий- натрийлі (ортоклаз, микроклин, санидин, тағы басқа) және калий-барийлі болып бөлінеді. Дала шпаттары көптеген тау жыныстарының құрамына кіреді, граниттерде, сиениттерде, диориттерде, габброда (плагиоклаздар),тағы басқа магмалық жыныстарда жиі кездеседі. Олар метаморфтық жыныстардың (гнейс), кристалл тақтатастардың, амфиболиттердің құра мында түзіледі. Үгілу нәтижесінде дала шпаттары серицитке, каолинге, монтмориллонитке, сазды минералдарға айналады, ал гидротермальдық өзгерістерге және метаморфтануға шалынғанда цеолит, скаполит, мусковит тағы басқа түзіледі .

15 слайд
15 слайд

16 слайд
Өте таза кристалл күйдегі
кремний оксиді тау хрусталі деп
аталатын минерал түрінде
кездеседі. Тау
хрусталь зергерлік және пьезооптикалық шикі
зат ретінде қолданылатын кварцтың ірі түрі. Ол
химиялық құрамы жағынан таза, түссіз,
мөлдір, кейде солғын, сарғылт болып
келеді. Гексагонал призма кейіптес друзалар,
үлкен жеке кристалдар құрайды, салмағы
бірнеше т-ға жететін түрлері де болады. Орта
және төмен температуралы гидротермалдық
процестер кезінде жаралған. Тау
хрусталқ кварцты, дала шпатты , кварцты -
карбонатты желілер мен гранит
пегматиттерінің қуыстарында
орналасады. Электртехника мен радиотехникад
а кеңінен
қолданылады. Қазақстанның Сарыарқа өңіріне
н табылған. Жоғарғы сапалы Тау хрусталығын
жасанды жолмен де алуға болады.
16 слайд
Өте таза кристалл күйдегі кремний оксиді тау хрусталі деп аталатын минерал түрінде кездеседі. Тау хрусталь зергерлік және пьезооптикалық шикі зат ретінде қолданылатын кварцтың ірі түрі. Ол химиялық құрамы жағынан таза, түссіз, мөлдір, кейде солғын, сарғылт болып келеді. Гексагонал призма кейіптес друзалар, үлкен жеке кристалдар құрайды, салмағы бірнеше т-ға жететін түрлері де болады. Орта және төмен температуралы гидротермалдық процестер кезінде жаралған. Тау хрусталқ кварцты, дала шпатты , кварцты - карбонатты желілер мен гранит пегматиттерінің қуыстарында орналасады. Электртехника мен радиотехникад а кеңінен қолданылады. Қазақстанның Сарыарқа өңіріне н табылған. Жоғарғы сапалы Тау хрусталығын жасанды жолмен де алуға болады.

17 слайд
Агат — минерал, ақықтың (халцедон бір түрі.
Химиялық формуласы SiO
2 , қаттылығы 6,0—6,5.
Түрлі түсті жұқа қабаттардың қатпарлануынан
тұратын жасырын кристалды агрегаттары
талшықты немесе радиал сәулелі түрде кездеседі.
Агаттың түсі құрамындағы темір, марганец т.б.
металдардың тотықтары мен органикалық
қоспаларға байланысты болады.
Қабатшаларындағы түстердің кезектесіп келуіне
қарай арабониксі ( ақ және
қара ), карнеолоникс ( қызыл және
ақ ), сардоникс ( күрең және ақ ) т.б. түрлерге
бөлінеді. Шығыс халықтары Агаттың ақаусыз, өте
әдемі түрлерін әшекей тас ретінде ертеден
қолданып келеді. Эффузивті тау
жыныстарында түзілуіне
байланысты Қазақстанда Агаттың кен орындары
көп (Орталық Қазақстан, Шығыс Қазақстан, Ақтөбе
облысы).Ақық немесе агат,
формуласы SiO 2
17 слайд
Агат — минерал, ақықтың (халцедон бір түрі. Химиялық формуласы SiO 2 , қаттылығы 6,0—6,5. Түрлі түсті жұқа қабаттардың қатпарлануынан тұратын жасырын кристалды агрегаттары талшықты немесе радиал сәулелі түрде кездеседі. Агаттың түсі құрамындағы темір, марганец т.б. металдардың тотықтары мен органикалық қоспаларға байланысты болады. Қабатшаларындағы түстердің кезектесіп келуіне қарай арабониксі ( ақ және қара ), карнеолоникс ( қызыл және ақ ), сардоникс ( күрең және ақ ) т.б. түрлерге бөлінеді. Шығыс халықтары Агаттың ақаусыз, өте әдемі түрлерін әшекей тас ретінде ертеден қолданып келеді. Эффузивті тау жыныстарында түзілуіне байланысты Қазақстанда Агаттың кен орындары көп (Орталық Қазақстан, Шығыс Қазақстан, Ақтөбе облысы).Ақық немесе агат, формуласы SiO 2

18 слайд
18 слайд

19 слайд
Асбест . ἄσβεστος ) -
силикаттар класының серпентиндер мен амфиболдар топтарында
ғы аса жіңішке талшықты минерал. Асбест грекше asbestos –
сөнбес, бұзылмас дегенді білдіреді. Химиялық құрамы
жөнінен магний мен темірдің, ішінара натрийдің
сулы силикаты болып
табылады. Серпентин тобындағы хризотил абсеттің химиялық
формуласы: Mg
6 [S і
4 O
10 ] [OH]
8 . Ол монклиндік
сингонияда кристалданады, кесектерінің түсі жасыл, сұрғылт
сары келеді, ажыратылған талшықтары – ақшыл, боз, жібектей
жылтыр. Қаттылығы 2 – 2,5, тығыздығы 2,4 – 2,6 г/см3,
талшықтары иілгіш, майысқыш, балқу температурасы 1500ӘС-қа
жуық, жылу мен электр тогын нашар өткізеді. Талшықтарының
ұзындығы 50 мм-ге, кейде 250 мм-ге жетеді. 14 минералды
қамтитын амфибол асбесттің қышқылға төзімділігі мен жылуға
беріктігі аса жоғары. Олардың ішіндегі ең маңыздылары әрі
көбірек пайдаланылатындары
– крокидолит, антофиллит, амозит, родусит. Хризоти-
асбест гидротермалдық ерітінділердің әсерінен
серпентинденген, магнитке бай ультранегізді
жыныстарда, доломиттенген әктастарда, ал амфиболасбест
шөгінді және метаморфтанған магмалық жыныстарда кездеседі.
Хризотил-асбесттен отқа, ыстыққа төзімді тоқыма бұйымдары,
құрылыс материалдары, қағаз, резина, пластмасса, электр
техникасы, асбестцемент бұйымдарына толтырма дайындайды.
Амфибол асбестті жылу мен отқа, жебір ортаға
(қышқыл, сілті, теңіз суы) төзімді бұйымдар жасауға қолданады.
Қазақстандағы Жітіқара хризотил-асбест, Бөгетсай антофиллит-
асбест, Қумола родусит-асбест кендерінің өндірістік маңызы
зор.Асбестке жіңішке берік талшыңтарға оңай тарқатылатын
силикаттар жатады. Олар екі топқа бөлінеді: хризотил-асбест
(серпентин) пен амфибол-асбест . Өнеркәсіпте ең көп
пайдаланатыны хризотил-асбест ( Mg,Fe)
6 [Si
4 O
10 ](OH)
8 . Асбест Mg
6 [S і
4 O
10 ] [OH]
8
19 слайд
Асбест . ἄσβεστος ) - силикаттар класының серпентиндер мен амфиболдар топтарында ғы аса жіңішке талшықты минерал. Асбест грекше asbestos – сөнбес, бұзылмас дегенді білдіреді. Химиялық құрамы жөнінен магний мен темірдің, ішінара натрийдің сулы силикаты болып табылады. Серпентин тобындағы хризотил абсеттің химиялық формуласы: Mg 6 [S і 4 O 10 ] [OH] 8 . Ол монклиндік сингонияда кристалданады, кесектерінің түсі жасыл, сұрғылт сары келеді, ажыратылған талшықтары – ақшыл, боз, жібектей жылтыр. Қаттылығы 2 – 2,5, тығыздығы 2,4 – 2,6 г/см3, талшықтары иілгіш, майысқыш, балқу температурасы 1500ӘС-қа жуық, жылу мен электр тогын нашар өткізеді. Талшықтарының ұзындығы 50 мм-ге, кейде 250 мм-ге жетеді. 14 минералды қамтитын амфибол асбесттің қышқылға төзімділігі мен жылуға беріктігі аса жоғары. Олардың ішіндегі ең маңыздылары әрі көбірек пайдаланылатындары – крокидолит, антофиллит, амозит, родусит. Хризоти- асбест гидротермалдық ерітінділердің әсерінен серпентинденген, магнитке бай ультранегізді жыныстарда, доломиттенген әктастарда, ал амфиболасбест шөгінді және метаморфтанған магмалық жыныстарда кездеседі. Хризотил-асбесттен отқа, ыстыққа төзімді тоқыма бұйымдары, құрылыс материалдары, қағаз, резина, пластмасса, электр техникасы, асбестцемент бұйымдарына толтырма дайындайды. Амфибол асбестті жылу мен отқа, жебір ортаға (қышқыл, сілті, теңіз суы) төзімді бұйымдар жасауға қолданады. Қазақстандағы Жітіқара хризотил-асбест, Бөгетсай антофиллит- асбест, Қумола родусит-асбест кендерінің өндірістік маңызы зор.Асбестке жіңішке берік талшыңтарға оңай тарқатылатын силикаттар жатады. Олар екі топқа бөлінеді: хризотил-асбест (серпентин) пен амфибол-асбест . Өнеркәсіпте ең көп пайдаланатыны хризотил-асбест ( Mg,Fe) 6 [Si 4 O 10 ](OH) 8 . Асбест Mg 6 [S і 4 O 10 ] [OH] 8
20 слайд
20 слайд

21 слайд
сапфирин – көгілдір
агат яшма
Цитрин- лимон түстес кварц топаз
21 слайд
сапфирин – көгілдір агат яшма Цитрин- лимон түстес кварц топаз

22 слайд
22 слайд
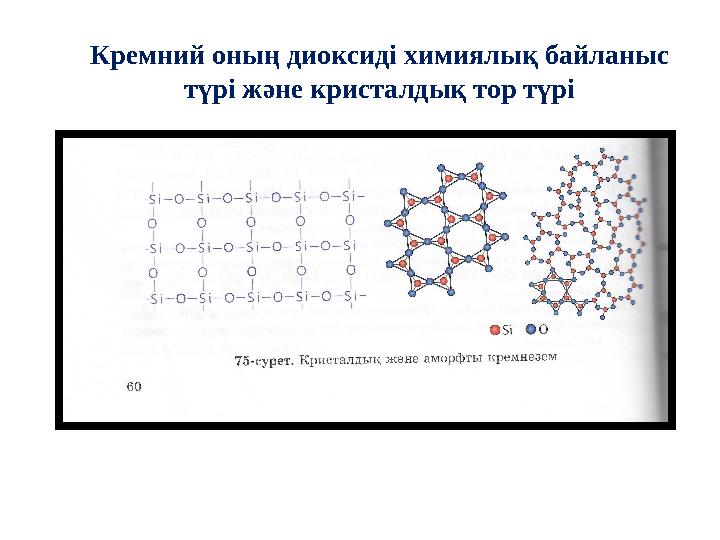
23 слайд
Кремний оның диоксиді химиялық байланыс
түрі және кристалдық тор түрі
23 слайд
Кремний оның диоксиді химиялық байланыс түрі және кристалдық тор түрі
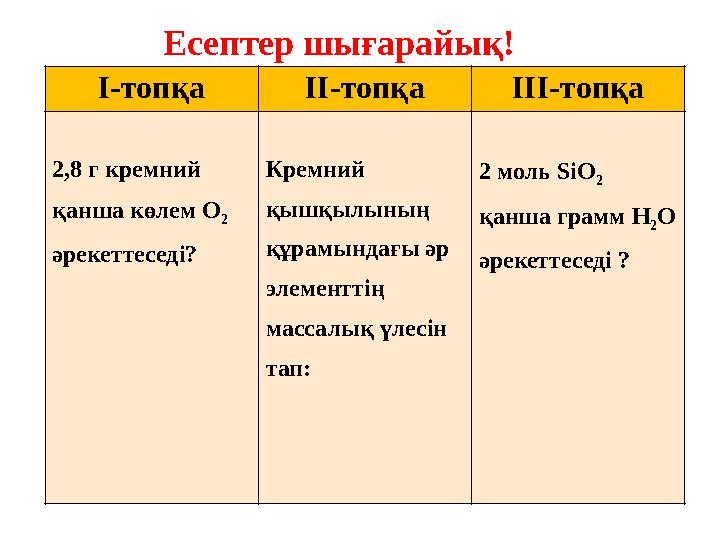
24 слайд
Есептер шығарайық!
I -топқа II -топқа III -топқа
2,8 г кремний
қанша көлем О
2
әрекеттеседі? Кремний
қышқылының
құрамындағы әр
элементтің
массалық үлесін
тап: 2 моль SiO
2
қанша грамм H
2 O
әрекеттеседі ?
24 слайд
Есептер шығарайық! I -топқа II -топқа III -топқа 2,8 г кремний қанша көлем О 2 әрекеттеседі? Кремний қышқылының құрамындағы әр элементтің массалық үлесін тап: 2 моль SiO 2 қанша грамм H 2 O әрекеттеседі ?
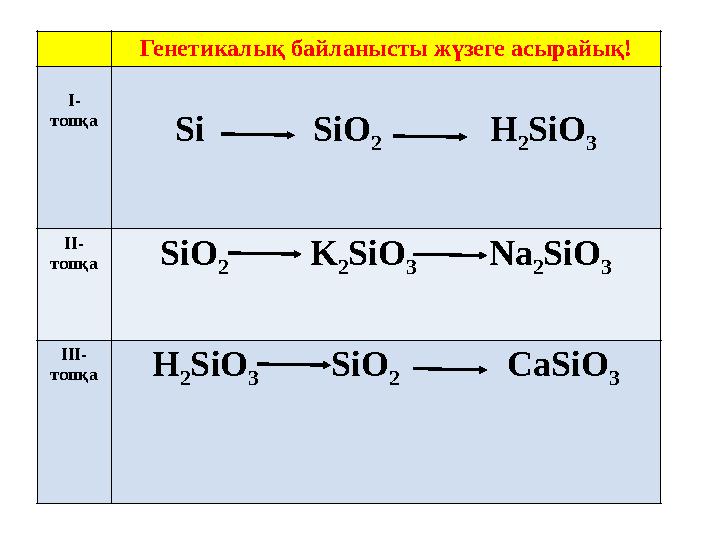
25 слайд
Генетикалық байланысты жүзеге асырайық!
I -
топқа
Si SiO
2 H
2 SiO
3
II -
топқа SiO
2 K
2 SiO
3 Na
2 SiO
3
III -
топқа H
2 SiO
3 SiO
2 CaSiO
3
25 слайд
Генетикалық байланысты жүзеге асырайық! I - топқа Si SiO 2 H 2 SiO 3 II - топқа SiO 2 K 2 SiO 3 Na 2 SiO 3 III - топқа H 2 SiO 3 SiO 2 CaSiO 3
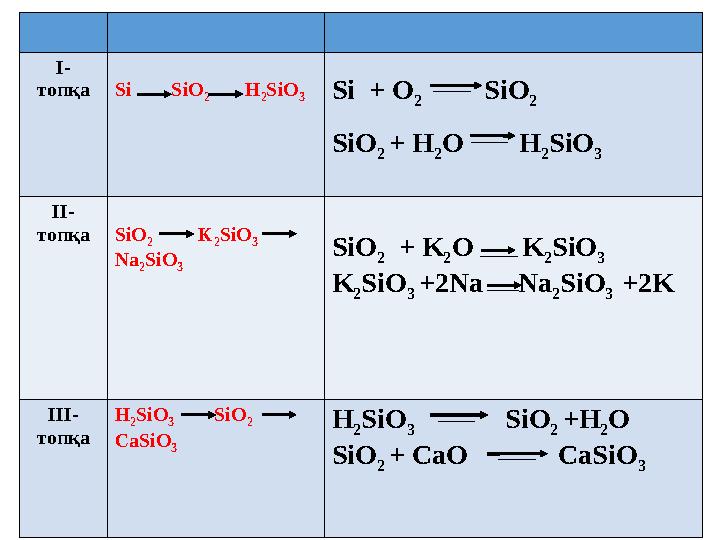
26 слайд
I -
топқа Si SiO
2 H
2 SiO
3
Si + O
2 SiO
2
SiO
2 + H
2 O H
2 SiO
3
II -
топқа SiO
2 K
2 SiO
3
Na
2 SiO
3
SiO
2 + K
2 O K
2 SiO
3
K
2 SiO
3 +2Na Na
2 SiO
3 +2K
III -
топқа H
2 SiO
3 SiO
2
CaSiO
3
H
2 SiO
3 SiO
2 +H
2 O
SiO
2 + CaO CaSiO
3
26 слайд
I - топқа Si SiO 2 H 2 SiO 3 Si + O 2 SiO 2 SiO 2 + H 2 O H 2 SiO 3 II - топқа SiO 2 K 2 SiO 3 Na 2 SiO 3 SiO 2 + K 2 O K 2 SiO 3 K 2 SiO 3 +2Na Na 2 SiO 3 +2K III - топқа H 2 SiO 3 SiO 2 CaSiO 3 H 2 SiO 3 SiO 2 +H 2 O SiO 2 + CaO CaSiO 3

27 слайд
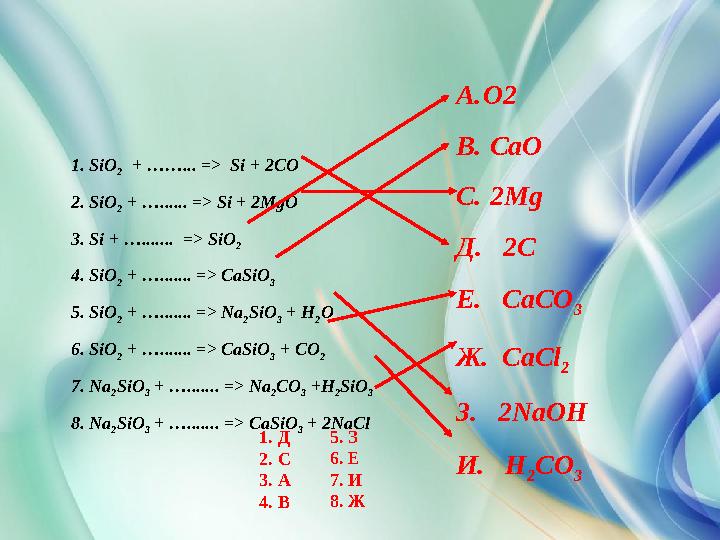
1. SiO
2 + …… ... => Si + 2CO
2. SiO
2 + …. ..... => Si + 2MgO
3. Si + …. ...... => SiO
2
4. SiO
2 + …. ...... => CaSiO
3
5. SiO
2 + …. ...... => Na
2 SiO
3 + H
2 O
6. SiO
2 + …. ...... => CaSiO
3 + CO
2
7. Na
2 SiO
3 + …. ...... => Na
2 CO
3 +H
2 SiO
3
8. Na
2 SiO
3 + …. ...... => CaSiO
3 + 2NaCl A. O2
B. CaO
C. 2Mg
Д. 2C
Е. CaCO
3
Ж. CaCl
2
З. 2NaOH
И. H
2 CO
3
27 слайд
1. SiO 2 + …… ... => Si + 2CO 2. SiO 2 + …. ..... => Si + 2MgO 3. Si + …. ...... => SiO 2 4. SiO 2 + …. ...... => CaSiO 3 5. SiO 2 + …. ...... => Na 2 SiO 3 + H 2 O 6. SiO 2 + …. ...... => CaSiO 3 + CO 2 7. Na 2 SiO 3 + …. ...... => Na 2 CO 3 +H 2 SiO 3 8. Na 2 SiO 3 + …. ...... => CaSiO 3 + 2NaCl A. O2 B. CaO C. 2Mg Д. 2C Е. CaCO 3 Ж. CaCl 2 З. 2NaOH И. H 2 CO 3
28 слайд
1. SiO
2 + …… ... => Si + 2CO
2. SiO
2 + …. ..... => Si + 2MgO
3. Si + …. ...... => SiO
2
4. SiO
2 + …. ...... => CaSiO
3
5. SiO
2 + …. ...... => Na
2 SiO
3 + H
2 O
6. SiO
2 + …. ...... => CaSiO
3 + CO
2
7. Na
2 SiO
3 + …. ...... => Na
2 CO
3 +H
2 SiO
3
8. Na
2 SiO
3 + …. ...... => CaSiO
3 + 2NaCl A. O2
B. CaO
C. 2Mg
Д. 2C
Е. CaCO
3
Ж. CaCl
2
З. 2NaOH
И. H
2 CO
31 . Д
2. С
3. А
4. В 5. З
6. Е
7. И
8. Ж
28 слайд
1. SiO 2 + …… ... => Si + 2CO 2. SiO 2 + …. ..... => Si + 2MgO 3. Si + …. ...... => SiO 2 4. SiO 2 + …. ...... => CaSiO 3 5. SiO 2 + …. ...... => Na 2 SiO 3 + H 2 O 6. SiO 2 + …. ...... => CaSiO 3 + CO 2 7. Na 2 SiO 3 + …. ...... => Na 2 CO 3 +H 2 SiO 3 8. Na 2 SiO 3 + …. ...... => CaSiO 3 + 2NaCl A. O2 B. CaO C. 2Mg Д. 2C Е. CaCO 3 Ж. CaCl 2 З. 2NaOH И. H 2 CO 31 . Д 2. С 3. А 4. В 5. З 6. Е 7. И 8. Ж

29 слайд
29 слайд

30 слайд
Есеп
I топ. Масасы 18,25 г тұз қышқылы мен натрий
силикатының артық мөлшері әрекеттескенде тұнбаға
түсетін кремний қышқылының массасын және мөлшерін
есепте.
II топ. Массасы 30%-тік 140г кремний қышқылына
массасы 32 г калий гидроксидін қосқанда түзілетін тұздың
массасын табыңдар
ІІІ топ. Кремний оксидінің артық мөлшері массасы 10 кг
натрий гидроксидімен әрекеттескенде 11,2 кг натрий
силикаты алынды. Натрий силикатының теориялық
мүмкіндікпен салыстырғандағы шығымын анықтаңдар.
30 слайд
Есеп I топ. Масасы 18,25 г тұз қышқылы мен натрий силикатының артық мөлшері әрекеттескенде тұнбаға түсетін кремний қышқылының массасын және мөлшерін есепте. II топ. Массасы 30%-тік 140г кремний қышқылына массасы 32 г калий гидроксидін қосқанда түзілетін тұздың массасын табыңдар ІІІ топ. Кремний оксидінің артық мөлшері массасы 10 кг натрий гидроксидімен әрекеттескенде 11,2 кг натрий силикаты алынды. Натрий силикатының теориялық мүмкіндікпен салыстырғандағы шығымын анықтаңдар.

31 слайд
31 слайд



