Ашық сабақ тақырыбы Сілтілік металдар. 10класс
Ашық сабақ тақырыбы Сілтілік металдар. 10класс


#1 слайд
Тақырыбы:
«Сілтілік металлдар»
Пән мұғалімі: Джумалиева Қ.Т
2018/2019ж
1 слайд
Тақырыбы: «Сілтілік металлдар» Пән мұғалімі: Джумалиева Қ.Т 2018/2019ж
#2 слайд
!!!
2 слайд
!!!

#3 слайд
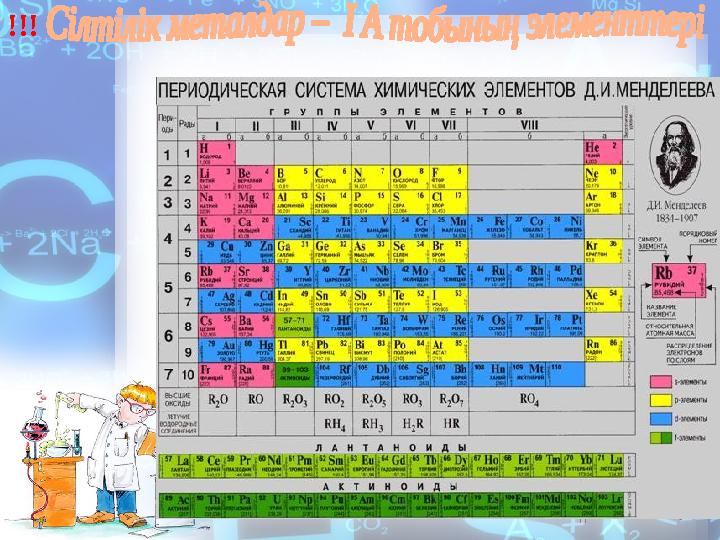
•Сілтілік металдар ІА топшада
орналаскан:
литий
Li, натрий
Na,
калий
К
, рубидий
Rb, цезий
Cs, франций
Fr.
Франций
-
радиобелсенді
элемент. Олардың валенттілік электрондарының
жалпы
формуласы
ns
1
(n
= 2-7).
Олардың
топтық атауы - сілтілік
металдар
— сумен әрекеттескенде күшті негіз - сілті түзуіне
байланысты
қойылған .
•Сілтілік
металдарда валенттілік электрондары
s-деңгейшесінді
орналасқан,
сондықтан оларды
s-элементтері
деп те атайды.
S
элементтері
қалыпты жағдайда кристалдық күйде болады,
басқа
металдарға қарағанда тығыздықтары төмен (27-кесте).
Литий,
калий және натрий судан жеңіл (0,53 - 0,86 г/см3),
сондықтан
су бетінде қалқып жүреді. Олардың балқу және
қайнау
температуралары төмен, бұл олардың кристалдық
торларындағы
металдық байланыстың әлсіз болуынан. Бұл
металдар
және олардың қосылыстары жалын түсін
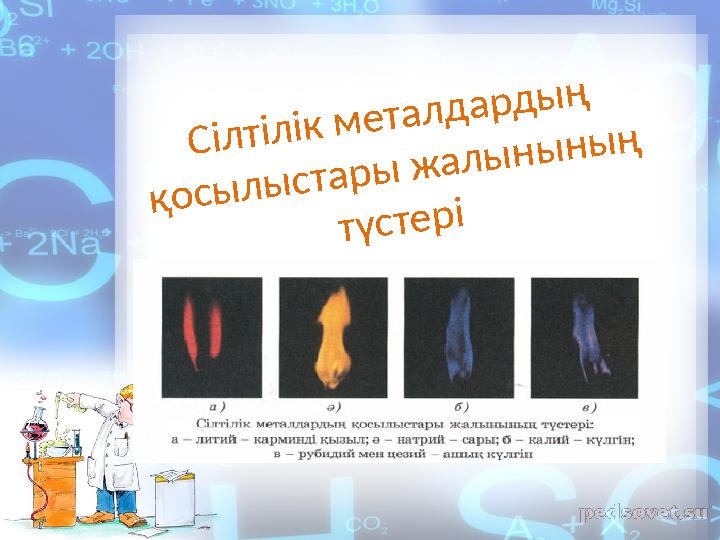
төмендегідей
өзгертеді: литий — карминс қызыл, натрий - сары,
калий
- күлгін түске бояйды.
3 слайд
•Сілтілік металдар ІА топшада орналаскан: литий Li, натрий Na, калий К , рубидий Rb, цезий Cs, франций Fr. Франций - радиобелсенді элемент. Олардың валенттілік электрондарының жалпы формуласы ns 1 (n = 2-7). Олардың топтық атауы - сілтілік металдар — сумен әрекеттескенде күшті негіз - сілті түзуіне байланысты қойылған . •Сілтілік металдарда валенттілік электрондары s-деңгейшесінді орналасқан, сондықтан оларды s-элементтері деп те атайды. S элементтері қалыпты жағдайда кристалдық күйде болады, басқа металдарға қарағанда тығыздықтары төмен (27-кесте). Литий, калий және натрий судан жеңіл (0,53 - 0,86 г/см3), сондықтан су бетінде қалқып жүреді. Олардың балқу және қайнау температуралары төмен, бұл олардың кристалдық торларындағы металдық байланыстың әлсіз болуынан. Бұл металдар және олардың қосылыстары жалын түсін төмендегідей өзгертеді: литий — карминс қызыл, натрий - сары, калий - күлгін түске бояйды.
#4 слайд
Сілтілік металдардың
қосылыстары жалынының
түстері
4 слайд
Сілтілік металдардың қосылыстары жалынының түстері

#5 слайд
•1807 г. Гемфри Дэви натрий мен калийді ашты
•1817 г. Август Арфведсон литийді ашты
•1860-1861 г.г. Роберт Бунзен және Густав Кирхгоф
Германияда рубидийді ашты
•1939 г. Маргарита Перей радиоактивті элемент
францийді ашты, оның атауын өзінің елі Францияның
құрметіне байланысты қойды
Сілтілік металдардың ашылу тарихы
5 слайд
•1807 г. Гемфри Дэви натрий мен калийді ашты •1817 г. Август Арфведсон литийді ашты •1860-1861 г.г. Роберт Бунзен және Густав Кирхгоф Германияда рубидийді ашты •1939 г. Маргарита Перей радиоактивті элемент францийді ашты, оның атауын өзінің елі Францияның құрметіне байланысты қойды Сілтілік металдардың ашылу тарихы

#6 слайд
Na - үшінші периодта, бірінші топтың негізгі топшасында
орналасқан.
23
11
Na ядросында 11 протон бар, яғни ядро заряды +11,
электрондарының жалпы саны да 11, нейтрондарының саны 12-ге тең.
Натрий атомының электрондық формуласы;ls
2
2s
2
2p
6
3s
1
, валенттілік
электроны -
3s
1
. Натрий үнемі I валентті, тотығу дәрежесі 0, +1.
Рубидий
(
Rubіdіum),
Rb —
элементтердің
периодтық жүйесінің І
тобындағыхимиялық элемент,
атомдық
нөмірі 37,
атомдық
массасы
85,47, сілтілік металдарға жатады
6 слайд
Na - үшінші периодта, бірінші топтың негізгі топшасында орналасқан. 23 11 Na ядросында 11 протон бар, яғни ядро заряды +11, электрондарының жалпы саны да 11, нейтрондарының саны 12-ге тең. Натрий атомының электрондық формуласы;ls 2 2s 2 2p 6 3s 1 , валенттілік электроны - 3s 1 . Натрий үнемі I валентті, тотығу дәрежесі 0, +1. Рубидий ( Rubіdіum), Rb — элементтердің периодтық жүйесінің І тобындағыхимиялық элемент, атомдық нөмірі 37, атомдық массасы 85,47, сілтілік металдарға жатады

#7 слайд
•Калий, К –
элементтердің периодтық жүйесінің I тобындағы
химиялық элемент. Атомдық нөмірі 19; атомдық массасы39,102;
•Франций
(
Francіum), Fr — элементтердің периодтық жүйесінің X
тобындағы хим. элемент, атомдық нөмірі 87, атомдық массасы 212;
• Цезий(лат.
Caesіum), Cs — элементтердің периодтық жүйесінің Қ
тобындағы хим. элемент, атомдық нөмірі 55, атомдық
массасы132,91;
7 слайд
•Калий, К – элементтердің периодтық жүйесінің I тобындағы химиялық элемент. Атомдық нөмірі 19; атомдық массасы39,102; •Франций ( Francіum), Fr — элементтердің периодтық жүйесінің X тобындағы хим. элемент, атомдық нөмірі 87, атомдық массасы 212; • Цезий(лат. Caesіum), Cs — элементтердің периодтық жүйесінің Қ тобындағы хим. элемент, атомдық нөмірі 55, атомдық массасы132,91;
#8 слайд
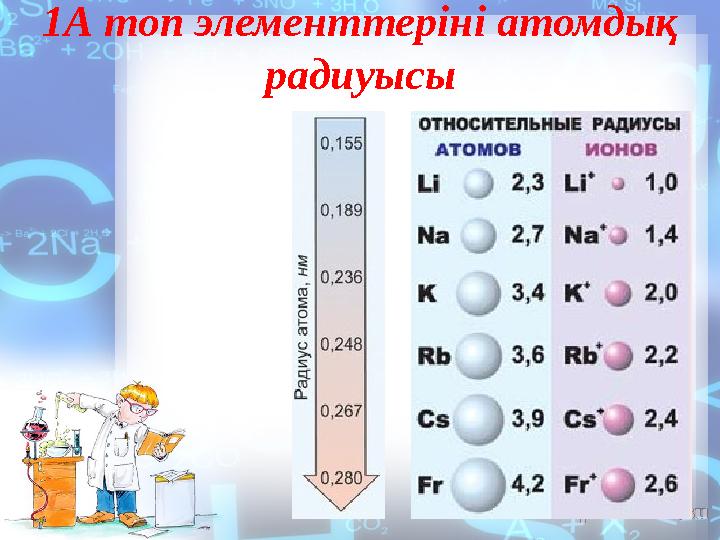
1А топ элементтеріні атомдық
радиуысы
8 слайд
1А топ элементтеріні атомдық радиуысы
#9 слайд
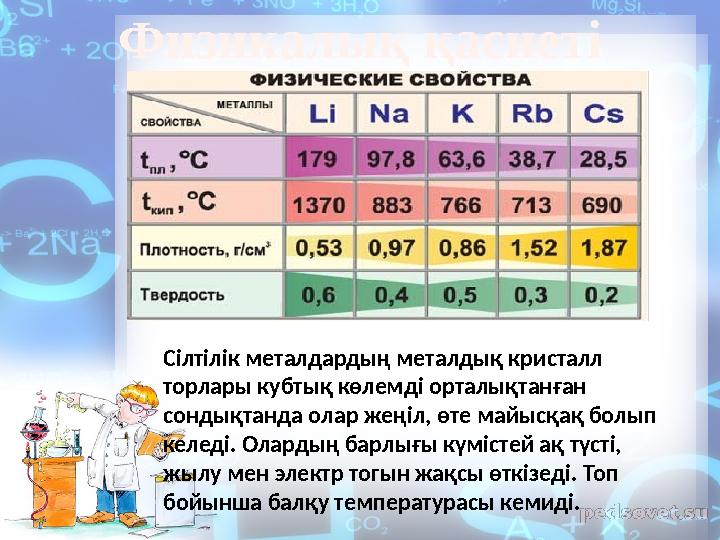
Физикалық қасиеті
Сілтілік металдардың металдық кристалл
торлары кубтық көлемді орталықтанған
сондықтанда олар жеңіл, өте майысқақ болып
келеді. Олардың барлығы күмістей ақ түсті,
жылу мен электр тогын жақсы өткізеді. Топ
бойынша балқу температурасы кемиді.
9 слайд
Физикалық қасиеті Сілтілік металдардың металдық кристалл торлары кубтық көлемді орталықтанған сондықтанда олар жеңіл, өте майысқақ болып келеді. Олардың барлығы күмістей ақ түсті, жылу мен электр тогын жақсы өткізеді. Топ бойынша балқу температурасы кемиді.
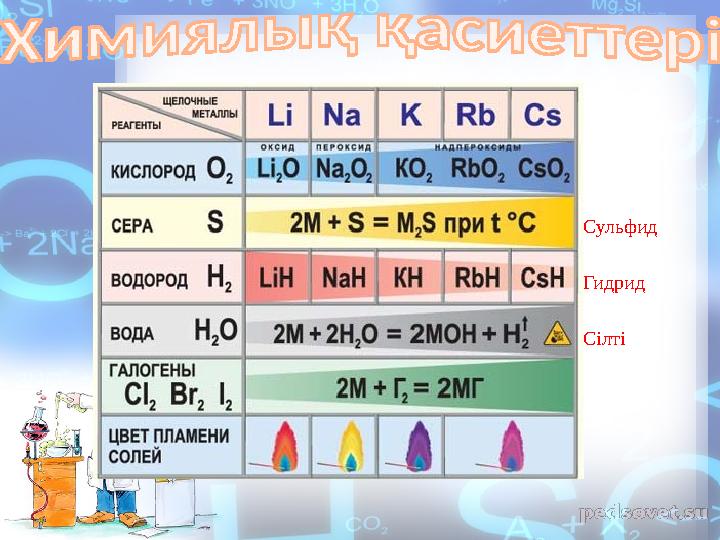
#10 слайд
Сульфид
Гидрид
Сілті
10 слайд
Сульфид Гидрид Сілті

#11 слайд
11 слайд

#12 слайд
12 слайд

#13 слайд
13 слайд

#14 слайд
Сыртқы электрондық қабаттарында тек бір ғана электрондары
бар, оларды оңай беріп жіберіп, өзінің алдында тұрған бекзат
газдардың аяқталған электрондық құрылысын қабылдайды.
Қосылыстарында үнемі бір валентті, тотығу дәрежелері -0, + 1,
күшті тотықсыздандырғыштар. Тотықсыздандырғыштық
қасиеттері топ бойынша жоғарыдан төмен қарай артады, себебі
атом радиустары осы бағытта өседі. Литий сумен енжарлау, ал
натрий белсендірек, калий шабытты әрекеттессе, рубидий
қопарылыс бере реакцияласады.
. Бұл элементтердің оксидтері – негіздік оксидтер, ал
гидроксидтері суда жақсы еритін сілтілер, олардың қасиеттері
жоғарыдан төмен қарай артады.
14 слайд
Сыртқы электрондық қабаттарында тек бір ғана электрондары бар, оларды оңай беріп жіберіп, өзінің алдында тұрған бекзат газдардың аяқталған электрондық құрылысын қабылдайды. Қосылыстарында үнемі бір валентті, тотығу дәрежелері -0, + 1, күшті тотықсыздандырғыштар. Тотықсыздандырғыштық қасиеттері топ бойынша жоғарыдан төмен қарай артады, себебі атом радиустары осы бағытта өседі. Литий сумен енжарлау, ал натрий белсендірек, калий шабытты әрекеттессе, рубидий қопарылыс бере реакцияласады. . Бұл элементтердің оксидтері – негіздік оксидтер, ал гидроксидтері суда жақсы еритін сілтілер, олардың қасиеттері жоғарыдан төмен қарай артады.

#15 слайд
Назар қойып
тамашалағандарыңызға
рахмет
15 слайд
Назар қойып тамашалағандарыңызға рахмет

шағым қалдыра аласыз
















