Элементтердің қасиеттерінің олардың атомдарының құрылысына тәуелділігі. Периодтық жүйе және периодтық заңның маңызы.
Дипломдар мен сертификаттарды алып үлгеріңіз!



1 слайд
Элементтердің қасиеттерінің олардың атомдарының
құрылысына тәуелділігі. Д. И. Менделеев атындағы
элементтердің периодтық жүйесі және периодтық
заңның маңызы.
1 слайд
Элементтердің қасиеттерінің олардың атомдарының құрылысына тәуелділігі. Д. И. Менделеев атындағы элементтердің периодтық жүйесі және периодтық заңның маңызы.

2 слайд
( П Е Р И О Д Т Ы Қ Ж Ү Й Е ) Дмитрий Иванович
Менделеев (1834-1907ж.) –
орыс ғалымы, химик.
Периодтық жүйені жасап
шығарды және химиядағы
Периодтық заңды ашты.
2 слайд
( П Е Р И О Д Т Ы Қ Ж Ү Й Е ) Дмитрий Иванович Менделеев (1834-1907ж.) – орыс ғалымы, химик. Периодтық жүйені жасап шығарды және химиядағы Периодтық заңды ашты.

3 слайд
3 слайд

4 слайд
Литияйден фторға ауысқанда элементтердің металдық
қасиеті кемиді және бейметалдық қасиеті өседі.
Na кейін Mg , оның қасиеті Ве ұқсас- олар металдық қасиет
көрсетеді. А1 , және одан кейінгі Mg , В-ға ұқсас . Келесі
элементтер бір-біріне ұқсас: Si және С; Р және N ; S және О; С1
және F . Не байқалды?
4 слайд
Литияйден фторға ауысқанда элементтердің металдық қасиеті кемиді және бейметалдық қасиеті өседі. Na кейін Mg , оның қасиеті Ве ұқсас- олар металдық қасиет көрсетеді. А1 , және одан кейінгі Mg , В-ға ұқсас . Келесі элементтер бір-біріне ұқсас: Si және С; Р және N ; S және О; С1 және F . Не байқалды?

5 слайд
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
Осы орналастыру қатарында астындағы элементтер
үстінде орналасқан элементтің қасиетін қайталадйды. Д.И. Менделеевтің
периодтық заңы
5 слайд
Li Be B C N O F Ne Na Mg Al Si P S Cl Ar Осы орналастыру қатарында астындағы элементтер үстінде орналасқан элементтің қасиетін қайталадйды. Д.И. Менделеевтің периодтық заңы

6 слайд
Периодтық кестенің бірінші
нұсқасы
6 слайд
Периодтық кестенің бірінші нұсқасы
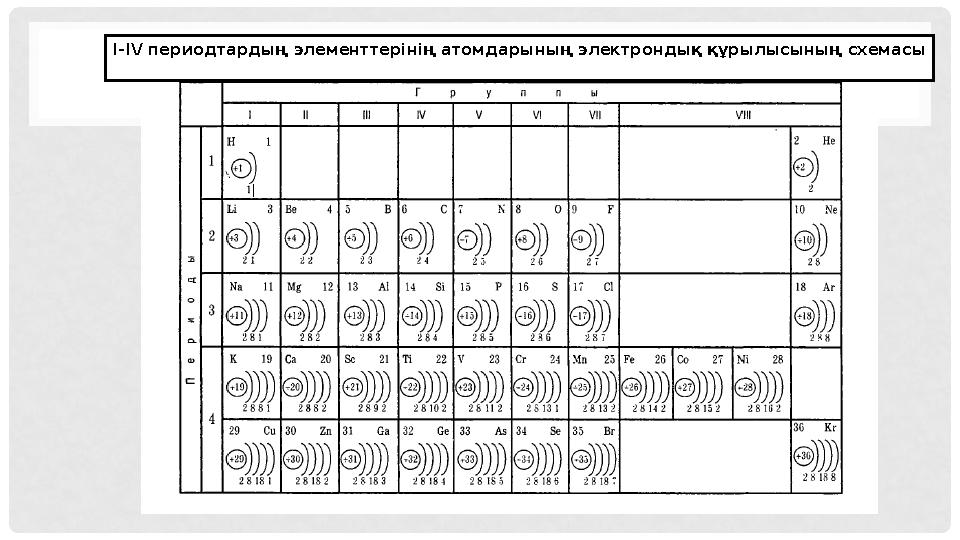
7 слайд
I-IV периодтарды ң элементтерінің атомдарының электрондық құрылысының схемасы
7 слайд
I-IV периодтарды ң элементтерінің атомдарының электрондық құрылысының схемасы
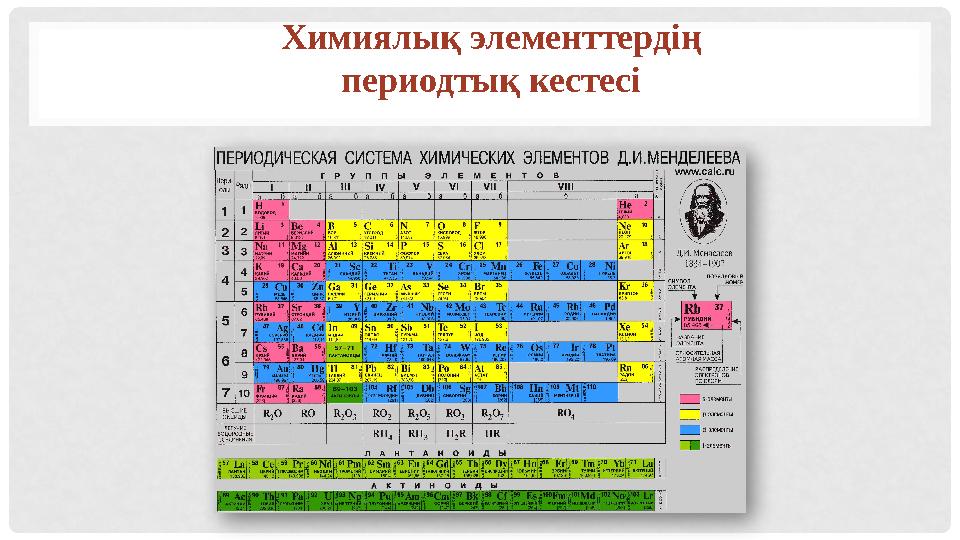
8 слайд
Химиялық элементтердің
периодтық кестесі
8 слайд
Химиялық элементтердің периодтық кестесі
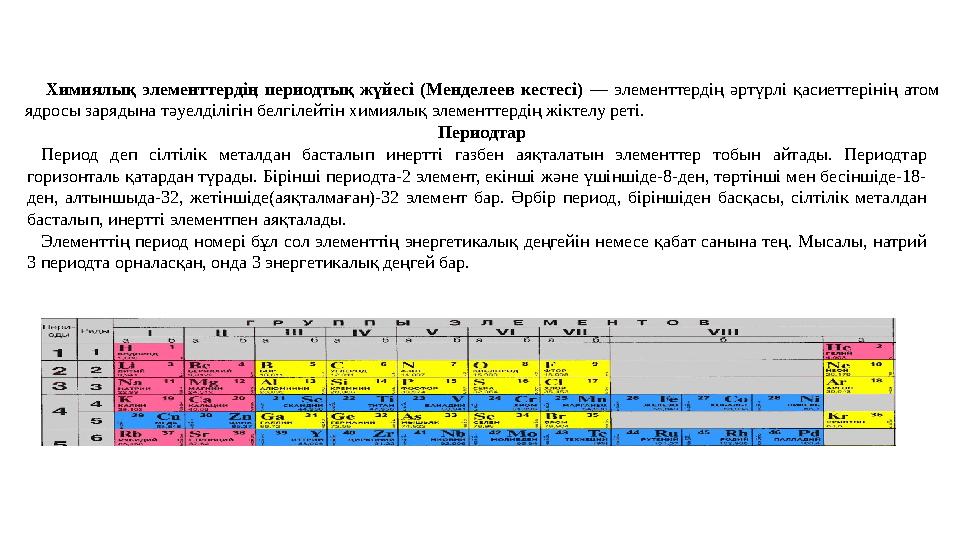
9 слайд
Химиялық элементтердің периодтық жүйесі (Менделеев кестесі) — элементтердің әртүрлі қасиеттерінің атом
ядросы зарядына тәуелділігін белгілейтін химиялық элементтердің жіктелу реті.
Периодтар
Период деп сілтілік металдан басталып инертті газбен аяқталатын элементтер тобын айтады. Периодтар
горизонталь қатардан түрады. Бірінші периодта-2 элемент, екінші және үшіншіде-8-ден, төртінші мен бесіншіде-18-
ден, алтыншыда-32, жетіншіде(аяқталмаған)-32 элемент бар. Әрбір период, біріншіден басқасы, сілтілік металдан
басталып, инертті элементпен аяқталады.
Элементтің период номері бұл сол элементтің энергетикалық деңгейін немесе қабат санына тең. Мысалы, натрий
3 периодта орналасқан, онда 3 энергетикалық деңгей бар.
9 слайд
Химиялық элементтердің периодтық жүйесі (Менделеев кестесі) — элементтердің әртүрлі қасиеттерінің атом ядросы зарядына тәуелділігін белгілейтін химиялық элементтердің жіктелу реті. Периодтар Период деп сілтілік металдан басталып инертті газбен аяқталатын элементтер тобын айтады. Периодтар горизонталь қатардан түрады. Бірінші периодта-2 элемент, екінші және үшіншіде-8-ден, төртінші мен бесіншіде-18- ден, алтыншыда-32, жетіншіде(аяқталмаған)-32 элемент бар. Әрбір период, біріншіден басқасы, сілтілік металдан басталып, инертті элементпен аяқталады. Элементтің период номері бұл сол элементтің энергетикалық деңгейін немесе қабат санына тең. Мысалы, натрий 3 периодта орналасқан, онда 3 энергетикалық деңгей бар.
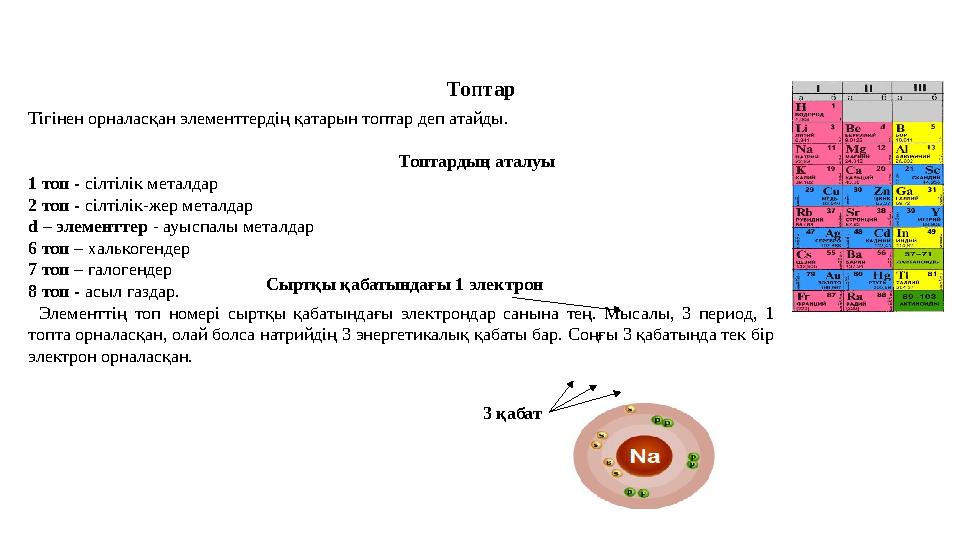
10 слайд
Тігінен орналасқан элементтердің қатарын топтар деп атайды.
Топтардың аталуы
1 топ - сілтілік металдар
2 топ - сілтілік-жер металдар
d – элементтер - ауыспалы металдар
6 топ – халькогендер
7 топ – галогендер
8 топ - асыл газдар.
Элементтің топ номері сыртқы қабатындағы электрондар санына тең. Мысалы, 3 период, 1
топта орналасқан, олай болса натрийдің 3 энергетикалық қабаты бар. Соңғы 3 қабатында тек бір
электрон орналасқан. Топтар
3 қабатСыртқы қабатындағы 1 электрон
10 слайд
Тігінен орналасқан элементтердің қатарын топтар деп атайды. Топтардың аталуы 1 топ - сілтілік металдар 2 топ - сілтілік-жер металдар d – элементтер - ауыспалы металдар 6 топ – халькогендер 7 топ – галогендер 8 топ - асыл газдар. Элементтің топ номері сыртқы қабатындағы электрондар санына тең. Мысалы, 3 период, 1 топта орналасқан, олай болса натрийдің 3 энергетикалық қабаты бар. Соңғы 3 қабатында тек бір электрон орналасқан. Топтар 3 қабатСыртқы қабатындағы 1 электрон

11 слайд
Металдылық — бұл элемент атомдарының электрондарды беру
қабілеті. Металдылықтың сандық сипаттамасы болып иондану
энергиясы (I) табылады.
Атомның иондану энергиясы — элемент (Э) атомынан электронды
жұлып алуға қажетті энергия мөлшері, яғни атомды оң зарядталған
ионға айналдыру үшін қажет:
Э° + I = Э+ + ё
Бейметалдылық — бұл элемент атомдарының өзіне электрондарды қосып
алу қабілеті.
Электронға жақындылық — бұл электронның бейтарап атомға қосылу кезінде бөлінетін
энергия, яғни атом теріс заряталған ионға айналады:
Э° + е = Э" + Еср
11 слайд
Металдылық — бұл элемент атомдарының электрондарды беру қабілеті. Металдылықтың сандық сипаттамасы болып иондану энергиясы (I) табылады. Атомның иондану энергиясы — элемент (Э) атомынан электронды жұлып алуға қажетті энергия мөлшері, яғни атомды оң зарядталған ионға айналдыру үшін қажет: Э° + I = Э+ + ё Бейметалдылық — бұл элемент атомдарының өзіне электрондарды қосып алу қабілеті. Электронға жақындылық — бұл электронның бейтарап атомға қосылу кезінде бөлінетін энергия, яғни атом теріс заряталған ионға айналады: Э° + е = Э" + Еср
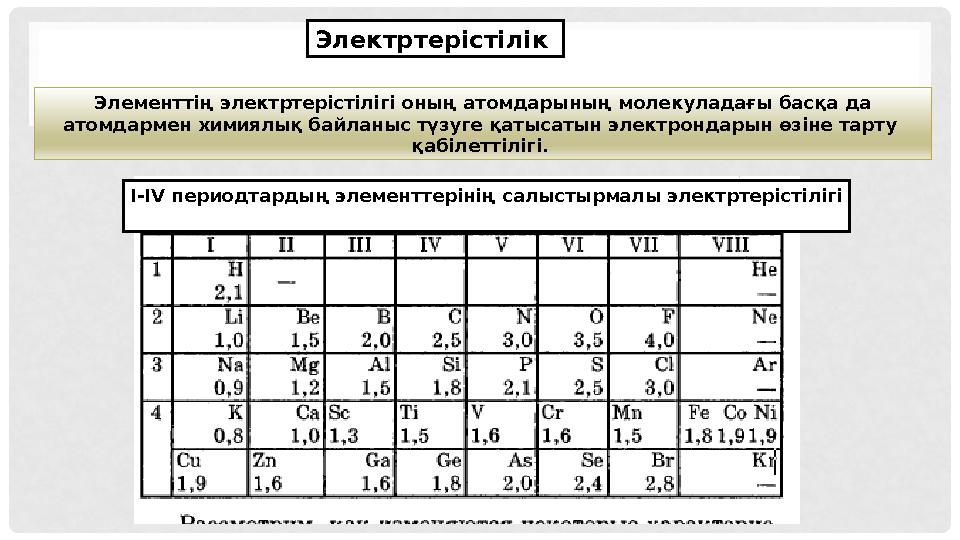
12 слайд
Элементтің электртерістілігі оның атомдарының молекуладағы басқа да
атомдармен химиялық байланыс түзуге қатысатын электрондарын өзіне тарту
қабілеттілігі. Электртерістілік
I-IV периодтарды ң элементтерінің салыстырмалы электртерістілігі
12 слайд
Элементтің электртерістілігі оның атомдарының молекуладағы басқа да атомдармен химиялық байланыс түзуге қатысатын электрондарын өзіне тарту қабілеттілігі. Электртерістілік I-IV периодтарды ң элементтерінің салыстырмалы электртерістілігі

13 слайд
— Атомдардың ядрозаряды өседі
— Атомдардың электрондық қабаттарының саны
өзгермейді
— Атомдардың сыртқы қабатындағы
электрондар саны 1-ден 8-ге дейін өседі
— Атомдардың радиусы кемиді
— Сыртқы қабат электрондарының ядромен
байланыс беріктігі өседі
— Иондану энергиясы өседі
— Электронға жақындығы өседі
— Электртерістілігі өседі
— Элементтердің металдық қасиеті кемиді
— Элементтердің бейметалдық қасиеті өседіКіші периодКіші периодтардағы элементтердің кейбір қасиеттерінің
өзгерісі
13 слайд
— Атомдардың ядрозаряды өседі — Атомдардың электрондық қабаттарының саны өзгермейді — Атомдардың сыртқы қабатындағы электрондар саны 1-ден 8-ге дейін өседі — Атомдардың радиусы кемиді — Сыртқы қабат электрондарының ядромен байланыс беріктігі өседі — Иондану энергиясы өседі — Электронға жақындығы өседі — Электртерістілігі өседі — Элементтердің металдық қасиеті кемиді — Элементтердің бейметалдық қасиеті өседіКіші периодКіші периодтардағы элементтердің кейбір қасиеттерінің өзгерісі

14 слайд
Негізгі топшадағы элементтердің кейбір қасиеттерінің
өзгерісі
— Атомдардың электрондық қабаттарының саны өседі
— Атомдардың сыртқы қабатындағы электрондар саны
бірдей
— Атомдардың радиусы өседі
— Сыртқы қабат электрондарының ядромен байланыс
беріктігі кемиді
— Иондану энергиясы кемиді
— Электронға жақындығы кемиді
— Электртерістілігі кемиді
— Элементтердің металдық қасиеті өседі
— Элементтердің бейметалдық қасиеті кемидіН
е
г
із
г
і т
о
п
ш
а
14 слайд
Негізгі топшадағы элементтердің кейбір қасиеттерінің өзгерісі — Атомдардың электрондық қабаттарының саны өседі — Атомдардың сыртқы қабатындағы электрондар саны бірдей — Атомдардың радиусы өседі — Сыртқы қабат электрондарының ядромен байланыс беріктігі кемиді — Иондану энергиясы кемиді — Электронға жақындығы кемиді — Электртерістілігі кемиді — Элементтердің металдық қасиеті өседі — Элементтердің бейметалдық қасиеті кемидіН е г із г і т о п ш а

15 слайд
Атомның тотықсыздандырғыш қасиеті (химиялық
байланыс түзу кезінде электрондарды жоғалту қабілеті)
негізгі топшаларда өседі, ал период бойынша кемиді.
Атомның тотықтырғыш қасиеті (электрондарды қабылдау
қабілеті ), керісінше, - негізгі топшаларда кемиді, ал период
бойынша өседі. Тотығу-тотықсыздану қасиеттеріэлектртерістілік
тотықтырғыш және бейметалдық қасиеттері тотықсыздандырғыш және металдық қасиеттері
15 слайд
Атомның тотықсыздандырғыш қасиеті (химиялық байланыс түзу кезінде электрондарды жоғалту қабілеті) негізгі топшаларда өседі, ал период бойынша кемиді. Атомның тотықтырғыш қасиеті (электрондарды қабылдау қабілеті ), керісінше, - негізгі топшаларда кемиді, ал период бойынша өседі. Тотығу-тотықсыздану қасиеттеріэлектртерістілік тотықтырғыш және бейметалдық қасиеттері тотықсыздандырғыш және металдық қасиеттері


