Химиялық реакция жылдамдығы
Химиялық реакция жылдамдығы


#1 слайд
Сабақтың тақырыбы:
Химиялық кинетика. Химиялы қ реакция
жылдамдығы
Мақсаты:
• Білімділік: Химиялық реакция жылдамдығына әсер ететін
факторларды қарастыру және оларды соқтығысу
энергиясы тұрғысынан түсіндіру, ол бойынша есеп
шығаруға дағдыландыру.
• Дамытушылық: Химиялық реакция жылдамдығына
концентрация, температура, өршіткі, әрекеттесуші
заттардың табиғатының әсерін меңгеру. Формуланы
қолданып есептер шығаруда логикалық белсенділіктерін
кеңейту, білімдерін тереңдету. Білімгерлердің бойына
химия ғылымына деген қызығушылықты арттыру.
• Тәрбиелік: Пәнге деген ынтасын арттыру, өз бетімен
жұмыс істей білуге, топта өзін, өзгені сыйлау сезімін
қалыптастыру.
1 слайд
Сабақтың тақырыбы: Химиялық кинетика. Химиялы қ реакция жылдамдығы Мақсаты: • Білімділік: Химиялық реакция жылдамдығына әсер ететін факторларды қарастыру және оларды соқтығысу энергиясы тұрғысынан түсіндіру, ол бойынша есеп шығаруға дағдыландыру. • Дамытушылық: Химиялық реакция жылдамдығына концентрация, температура, өршіткі, әрекеттесуші заттардың табиғатының әсерін меңгеру. Формуланы қолданып есептер шығаруда логикалық белсенділіктерін кеңейту, білімдерін тереңдету. Білімгерлердің бойына химия ғылымына деген қызығушылықты арттыру. • Тәрбиелік: Пәнге деген ынтасын арттыру, өз бетімен жұмыс істей білуге, топта өзін, өзгені сыйлау сезімін қалыптастыру.

#2 слайд
«Ой шақыру»
Күнделікті тұрмыста сүтті тоңазтқышқа салып
қоямыз, егер жылы үй температурасында қалып
кетсе не болады?
Қандай факторлар реакция жылдамдығына әсер
етеді?
• Әрекеттесуші заттар табиғаты
• Температураны жоғарылату
• Еритін реагенттердің концентрациясын жоғарылату
• Газ тәріздес реагенттердің қысымын жоғарылату
• Қатты реагенттердің беттік ауданын жоғарылату
• Катализаторларды қолдану
2 слайд
«Ой шақыру» Күнделікті тұрмыста сүтті тоңазтқышқа салып қоямыз, егер жылы үй температурасында қалып кетсе не болады? Қандай факторлар реакция жылдамдығына әсер етеді? • Әрекеттесуші заттар табиғаты • Температураны жоғарылату • Еритін реагенттердің концентрациясын жоғарылату • Газ тәріздес реагенттердің қысымын жоғарылату • Қатты реагенттердің беттік ауданын жоғарылату • Катализаторларды қолдану

#3 слайд
Химиялық реакция жылдамдығы нені білдіреді?
Әртүрлі химиялық реакциялардың жылдамдығы бір-
бірінен күрт ерекшеленеді. Кейбір реакциялар өте тез
және кейбіреулері өте баяу болады.
Реакциялар, бөлшектер және соқтығысу
Энергияның белгілі бір мөлшері бар бөлшектер
соқтығысқан кезде реакциялар жүзеге асады.
Бөлшектер реакцияға түсу үшін қажетті энергияның
минималды мөлшері активтелу энергиясы деп аталады
және әр реакция үшін әртүрлі болады .
3 слайд
Химиялық реакция жылдамдығы нені білдіреді? Әртүрлі химиялық реакциялардың жылдамдығы бір- бірінен күрт ерекшеленеді. Кейбір реакциялар өте тез және кейбіреулері өте баяу болады. Реакциялар, бөлшектер және соқтығысу Энергияның белгілі бір мөлшері бар бөлшектер соқтығысқан кезде реакциялар жүзеге асады. Бөлшектер реакцияға түсу үшін қажетті энергияның минималды мөлшері активтелу энергиясы деп аталады және әр реакция үшін әртүрлі болады .

#4 слайд
Химиялық реакция жылдамдығы екі нәрсеге:
• бөлшектер арасындағы соқтығысудың жиілігіне
• бөлшектер соқтығысу үшін қажетті энергияға тәуелді болады.
Егер бөлшектер активтелу энергиясынан төмен энергиямен
соқтығысса, олар әрекеттеспейді. Бөлшектер тек бір-бірінен
серпілетін болады.
Химиялық реакция жылдамдығын өзгерту
Әрекеттесетін бөлшектер арасындағы сәтті соқтығысу
санын арттыратынның бәрі реакция жылдамдығын
жоғарылатады.
• Реакциялар бірдей жылдамдықпен өтпейді. Олар
бастапқыда белгілі бір жылдамдықпен бастайды, одан
кейін реакция тоқтағанға дейін біртіндеп жылдамдығы
қосылады.
• Реакция өткен сайын реакцияға түсетін заттардың
концентрациясы азаяды.
4 слайд
Химиялық реакция жылдамдығы екі нәрсеге: • бөлшектер арасындағы соқтығысудың жиілігіне • бөлшектер соқтығысу үшін қажетті энергияға тәуелді болады. Егер бөлшектер активтелу энергиясынан төмен энергиямен соқтығысса, олар әрекеттеспейді. Бөлшектер тек бір-бірінен серпілетін болады. Химиялық реакция жылдамдығын өзгерту Әрекеттесетін бөлшектер арасындағы сәтті соқтығысу санын арттыратынның бәрі реакция жылдамдығын жоғарылатады. • Реакциялар бірдей жылдамдықпен өтпейді. Олар бастапқыда белгілі бір жылдамдықпен бастайды, одан кейін реакция тоқтағанға дейін біртіндеп жылдамдығы қосылады. • Реакция өткен сайын реакцияға түсетін заттардың концентрациясы азаяды.
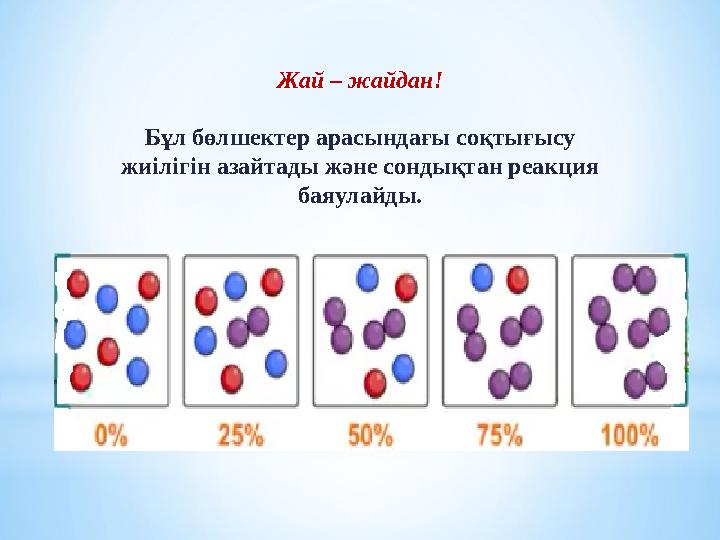
#5 слайд
Жай – жайдан!
Бұл бөлшектер арасындағы соқтығысу
жиілігін азайтады және сондықтан реакция
баяулайды.
5 слайд
Жай – жайдан! Бұл бөлшектер арасындағы соқтығысу жиілігін азайтады және сондықтан реакция баяулайды.

#6 слайд
Заттардың табиғатына әсері
Оттектің сутекпен әрекеттесуі тез өтеді, оттек
молекуласындағы байланысын бұзу үшін 494 кДж/моль
қажет.
азоттың сутекпен әрекеттесуі өте баяу жүреді. Азот
молекуласындағы байланысты бұзу үшін 942 кДж/моль
энергия. Беріктеу азот молекуласы реакцияға қиын түседі,
мұндай реакцияның жылдамдығы төмендеу болады.
Әрекеттесуші заттар табиғатының химиялық реакция
жылдамдығына әсері
Мырыш + күкірт қышқылы → мырыш сульфаты + сутек
Zn + H
2 SO
4 →ZnSO
4 + H
2
Мыс + күкірт қышқылы → реакция жүрмейді
Cu + H
2 SO
4 →
6 слайд
Заттардың табиғатына әсері Оттектің сутекпен әрекеттесуі тез өтеді, оттек молекуласындағы байланысын бұзу үшін 494 кДж/моль қажет. азоттың сутекпен әрекеттесуі өте баяу жүреді. Азот молекуласындағы байланысты бұзу үшін 942 кДж/моль энергия. Беріктеу азот молекуласы реакцияға қиын түседі, мұндай реакцияның жылдамдығы төмендеу болады. Әрекеттесуші заттар табиғатының химиялық реакция жылдамдығына әсері Мырыш + күкірт қышқылы → мырыш сульфаты + сутек Zn + H 2 SO 4 →ZnSO 4 + H 2 Мыс + күкірт қышқылы → реакция жүрмейді Cu + H 2 SO 4 →

#7 слайд
Температураның әсері
Температура жоғарылаған сайын реакция жылдамдығы өседі
Вант-Гофф ережесі: Температура әрбір 10 0
С-қа артқанда, реакция
жылдамдығы 2-4 есе өседі.
Неге температураны арттырғанда реакцияның жылдамдығы
артады?
Температура жоғары болғанда, бөлшектер көбірек энергияға
ие болады. Олар жылдамырақ қозғалады және басқа
бөлшектермен соқтығысу мүмкіндігі көп болады дегенді
білдіреді.
Бөлшектер көбірек энергиямен соқтығысады, сондықтан
сәтті соқтығысулар саны артады.
7 слайд
Температураның әсері Температура жоғарылаған сайын реакция жылдамдығы өседі Вант-Гофф ережесі: Температура әрбір 10 0 С-қа артқанда, реакция жылдамдығы 2-4 есе өседі. Неге температураны арттырғанда реакцияның жылдамдығы артады? Температура жоғары болғанда, бөлшектер көбірек энергияға ие болады. Олар жылдамырақ қозғалады және басқа бөлшектермен соқтығысу мүмкіндігі көп болады дегенді білдіреді. Бөлшектер көбірек энергиямен соқтығысады, сондықтан сәтті соқтығысулар саны артады.

#8 слайд
Температураның химиялық реакция жылдамдығына әсері
Тәжірибе жүргізіп көрейік:
Екі сынауыққа мыс (ІІ) оксид ұнтағын салып, екеуіне күкірт
қышқылының бірдей көлемін құямыз және бір сынауықты
қыздырамыз. Қай сынауықта реакция жылдамдығы көп болғанын
анықтаймыз?
Екі сынауықта да өтетін химиялық реакция теңдеуі:
Cu O + H
2 SO
4 Cu SO
4 + H
2 O
Химиялық реакция жылдамдығына концентрацияның
әсері
Ерітілген реагенттердің концентрациясы жоғары болған
сайын, химиялық реакция жылдамдығы артады.
8 слайд
Температураның химиялық реакция жылдамдығына әсері Тәжірибе жүргізіп көрейік: Екі сынауыққа мыс (ІІ) оксид ұнтағын салып, екеуіне күкірт қышқылының бірдей көлемін құямыз және бір сынауықты қыздырамыз. Қай сынауықта реакция жылдамдығы көп болғанын анықтаймыз? Екі сынауықта да өтетін химиялық реакция теңдеуі: Cu O + H 2 SO 4 Cu SO 4 + H 2 O Химиялық реакция жылдамдығына концентрацияның әсері Ерітілген реагенттердің концентрациясы жоғары болған сайын, химиялық реакция жылдамдығы артады.

#9 слайд
Заттардың концентрациясы
Әрекеттесуші заттардың концентрациясы неғұрлым
жоғары болса соқтығысуы соғұрлым көп болады. =>
Әсерлеуші массалар заңы: химиялық реакцияның
жылдамдығы әрекеттесуші заттардың
концентрацияларының көбейтіндісіне пропорционал.
A + B = C => = k*C
A *C
B немесе = k[A][B]
Неге концентрацияны арттырғанда химиялық реакция
жылдамдығы артады?
Концентрация жоғары болғанда, кеңістіктің сол
аймағында бөлшектер саны көп болады. Бұл бөлшектер
көбірек соқтығысады және көбірек реакция түседі
дегенді білдіреді.
9 слайд
Заттардың концентрациясы Әрекеттесуші заттардың концентрациясы неғұрлым жоғары болса соқтығысуы соғұрлым көп болады. => Әсерлеуші массалар заңы: химиялық реакцияның жылдамдығы әрекеттесуші заттардың концентрацияларының көбейтіндісіне пропорционал. A + B = C => = k*C A *C B немесе = k[A][B] Неге концентрацияны арттырғанда химиялық реакция жылдамдығы артады? Концентрация жоғары болғанда, кеңістіктің сол аймағында бөлшектер саны көп болады. Бұл бөлшектер көбірек соқтығысады және көбірек реакция түседі дегенді білдіреді.

#10 слайд
Катализатор (өршіткі)
Катализаторлар – химиялық реакцияның жылдамдығын
арттыратын зат. Реакцияға қатысып, процесті тиімді жолмен
жүргізеді, бірақ реакция соңында бастапқы қалпын сақтап қалады.
Катализаторға қойылған негізгі талап – оның бірлік бетіне (1 м 2
)
немесе салмақ бірлігіне (1 г) есептегендегі жоғары катализдік
активтілігі.
Мысалы :
Nickel (никель) – маргаринді өндіру кезінде катализатор
ретінде қолданылады. (сұйық өсімдік майын гидрлеу).
Iron (темір) – азот пен сутектен аммиакты алу кезінде
катализатор ретінде қолданылады (Габер үрдісі)
Platinum (платина) көліктердің газ шығаратын
түтіктерінде түрлендіру үшін катализатор ретінде
қолданылады. Көміртек монооксиді мен азот оксидін ауаны
аз ластайтын көмірқышқыл газы мен азотқа түрлендіріп
катализдейді.
10 слайд
Катализатор (өршіткі) Катализаторлар – химиялық реакцияның жылдамдығын арттыратын зат. Реакцияға қатысып, процесті тиімді жолмен жүргізеді, бірақ реакция соңында бастапқы қалпын сақтап қалады. Катализаторға қойылған негізгі талап – оның бірлік бетіне (1 м 2 ) немесе салмақ бірлігіне (1 г) есептегендегі жоғары катализдік активтілігі. Мысалы : Nickel (никель) – маргаринді өндіру кезінде катализатор ретінде қолданылады. (сұйық өсімдік майын гидрлеу). Iron (темір) – азот пен сутектен аммиакты алу кезінде катализатор ретінде қолданылады (Габер үрдісі) Platinum (платина) көліктердің газ шығаратын түтіктерінде түрлендіру үшін катализатор ретінде қолданылады. Көміртек монооксиді мен азот оксидін ауаны аз ластайтын көмірқышқыл газы мен азотқа түрлендіріп катализдейді.
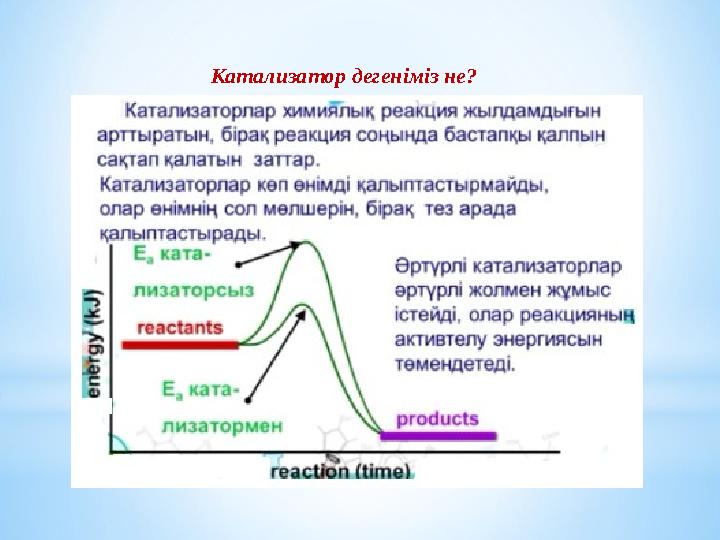
#11 слайд
Катализатор дегеніміз не?
11 слайд
Катализатор дегеніміз не?

#12 слайд
Өндірістегі катализаторлар
Неге катализаторлар өндіріс үшін аса маңызды?
Өнімдер тез жасалады, сол арқылы уақыт және қаражат
үнемделеді
Катализаторлар жоғары температураның қажеттілігін
төмендетеді, сол арқылы отынды және қаражатты
үнемдейді.
Сонымен қатар катализаторлар тірі ұяшықтар үшін табиғи
болып саналады. Биологиялық катализаторлар протеиннің
арнайы түрлері энзимдер деп аталады.
12 слайд
Өндірістегі катализаторлар Неге катализаторлар өндіріс үшін аса маңызды? Өнімдер тез жасалады, сол арқылы уақыт және қаражат үнемделеді Катализаторлар жоғары температураның қажеттілігін төмендетеді, сол арқылы отынды және қаражатты үнемдейді. Сонымен қатар катализаторлар тірі ұяшықтар үшін табиғи болып саналады. Биологиялық катализаторлар протеиннің арнайы түрлері энзимдер деп аталады.

#13 слайд
«Жедел жауап» әдісі
А деңгейі сұрағы:
1. Химиялық реакция
жылдамдығын
зерттейтін ғылым?
2. Химиялық реакция
жылдамдығы дегеніміз
не?
3. Орташа және лездік
жылдамдық дегеніміз не?
Формуласын өрнектеп
бер?
4. Массалардың әсер ету
заңы нені анықтайды?
5. Осы заңның жеке
анықтамасын кім берді? В деңгейі сұрағы:
1. Химиялық
реакциялардың
жылдамдығын зерттеу
не үшін қажет?
2.Гомогенді реакция
дегеніміз не?
3.Гетерогенді реакция
дегеніміз не? Мысалдар
келтіріңдер.
4. Жылдамдық
тұрақтысы неге тәуелді? С деңгейі сұрағы:
1.Гомогенді, гетерогенді
химиялық реакция
жылдамдықтарына
анықтама бер.
2.Гомогенді, гетерогенді
реакциялардың
жылдамдығының
айырмашылықтары,
математикалық
өрнектерін жаз.
3. Вант-Гоффтың
жуықталған ережесін
айтып бер.
13 слайд
«Жедел жауап» әдісі А деңгейі сұрағы: 1. Химиялық реакция жылдамдығын зерттейтін ғылым? 2. Химиялық реакция жылдамдығы дегеніміз не? 3. Орташа және лездік жылдамдық дегеніміз не? Формуласын өрнектеп бер? 4. Массалардың әсер ету заңы нені анықтайды? 5. Осы заңның жеке анықтамасын кім берді? В деңгейі сұрағы: 1. Химиялық реакциялардың жылдамдығын зерттеу не үшін қажет? 2.Гомогенді реакция дегеніміз не? 3.Гетерогенді реакция дегеніміз не? Мысалдар келтіріңдер. 4. Жылдамдық тұрақтысы неге тәуелді? С деңгейі сұрағы: 1.Гомогенді, гетерогенді химиялық реакция жылдамдықтарына анықтама бер. 2.Гомогенді, гетерогенді реакциялардың жылдамдығының айырмашылықтары, математикалық өрнектерін жаз. 3. Вант-Гоффтың жуықталған ережесін айтып бер.

#14 слайд
Химиялық диктант
А) Химиялық реакциялар ..............................
жылдамдықпен жүреді.
Б) Химиялық реакцияның жылдамдығы
деп ................... немесе реакция өнімінің біреуінің
....................... уақыт бірлігінде өзгеруін айтады.
В) Реакцияның жүру .................. анықтайтын
саты ............................. деп аталады.
14 слайд
Химиялық диктант А) Химиялық реакциялар .............................. жылдамдықпен жүреді. Б) Химиялық реакцияның жылдамдығы деп ................... немесе реакция өнімінің біреуінің ....................... уақыт бірлігінде өзгеруін айтады. В) Реакцияның жүру .................. анықтайтын саты ............................. деп аталады.

#15 слайд
Тест тапсырмалары:
1. Химиялық процесс нәтижесінде түзілетін және
ары қарай өзгерістерге түспейтін заттар
А) реакция өнімдері
Б) бастапқы
В) аралас
2. Химиялық реакцияның жылдамдығын,
жылдамдыққа әсер ететін параметрлерді және
химиялық реакцияның механизмін зерттейтін
физикалық химияның үлкен бір тарауы
А) химиялық кинетика
Б) термодинамика
В) ерітінді
3. Гетерогенді реакцияға мысал келтір:
А) Н
2 (г) + J
2 (г)→2НJ(г)
В) 2NО(г) + О
2 (г) ↔ 2NО
2 (г)
С) 4Fe(қ) + 3О
2 (г)→2Fe
2 O
3
4. Келтірілген формулалардың қайсысы масса
әрекеттесу заңының математикалық өрнегі:
А) V=1/C.
В) V=∆C/t
С) V=k[A] n
·[B] n
5. Орташа жылдамдықтың формуласы?
A) V=1/C.
B) C=1/V
C) V=∆C/t 6. Лездік жылдамдықтың формуласы?
А) V=k[A]m·[B]n
В) V=+-dC/dt
С) V=1/C
7. Әр түрлі фазадан тұратын жүйе:
А) гетерогенді
В) жанасу беті
С) гомогенді
8 . Гомогенді реакцияға мысал келтір:
А) С(қ) + О
2 (г) ↔ СО
2 (г)
В) 2NО(г) + О
2 (г) ↔ 2NО
2 (г)
С) 4Fe(қ) + 3О
2 (г)→2Fe
2 O
3
9. Әрекеттесуші және түзілетін заттар бірдей
агрегаттық күйде болатын реакция:
А) гетерогенді
В) қайтымды
С) гомогенді
10. Әрекеттесуші және үзілетін заттар әртүрлі
агрегаттық күйде болатын реакция:
А) гетерогенді
В) қайтымды
С) гомогенді
15 слайд
Тест тапсырмалары: 1. Химиялық процесс нәтижесінде түзілетін және ары қарай өзгерістерге түспейтін заттар А) реакция өнімдері Б) бастапқы В) аралас 2. Химиялық реакцияның жылдамдығын, жылдамдыққа әсер ететін параметрлерді және химиялық реакцияның механизмін зерттейтін физикалық химияның үлкен бір тарауы А) химиялық кинетика Б) термодинамика В) ерітінді 3. Гетерогенді реакцияға мысал келтір: А) Н 2 (г) + J 2 (г)→2НJ(г) В) 2NО(г) + О 2 (г) ↔ 2NО 2 (г) С) 4Fe(қ) + 3О 2 (г)→2Fe 2 O 3 4. Келтірілген формулалардың қайсысы масса әрекеттесу заңының математикалық өрнегі: А) V=1/C. В) V=∆C/t С) V=k[A] n ·[B] n 5. Орташа жылдамдықтың формуласы? A) V=1/C. B) C=1/V C) V=∆C/t 6. Лездік жылдамдықтың формуласы? А) V=k[A]m·[B]n В) V=+-dC/dt С) V=1/C 7. Әр түрлі фазадан тұратын жүйе: А) гетерогенді В) жанасу беті С) гомогенді 8 . Гомогенді реакцияға мысал келтір: А) С(қ) + О 2 (г) ↔ СО 2 (г) В) 2NО(г) + О 2 (г) ↔ 2NО 2 (г) С) 4Fe(қ) + 3О 2 (г)→2Fe 2 O 3 9. Әрекеттесуші және түзілетін заттар бірдей агрегаттық күйде болатын реакция: А) гетерогенді В) қайтымды С) гомогенді 10. Әрекеттесуші және үзілетін заттар әртүрлі агрегаттық күйде болатын реакция: А) гетерогенді В) қайтымды С) гомогенді

#16 слайд
Тест жауаптары:
1. Химиялық процесс нәтижесінде түзілетін және
ары қарай өзгерістерге түспейтін заттар
А) реакция өнімдері
Б) бастапқы
В) аралас
2. Химиялық реакцияның жылдамдығын,
жылдамдыққа әсер ететін параметрлерді және
химиялық реакцияның механизмін зерттейтін
физикалық химияның үлкен бір тарауы
А) химиялық кинетика
Б) термодинамика
В) ерітінді
3. Гетерогенді реакцияға мысал келтір:
А) Н
2 (г) + J
2 (г)→2НJ(г)
В) 2NО(г) + О
2 (г) ↔ 2NО
2 (г)
С) 4Fe(қ) + 3О
2 (г)→2Fe
2 O
3
4. Келтірілген формулалардың қайсысы масса
әрекеттесу заңының математикалық өрнегі:
А) V=1/C.
В) V=∆C/t
С) V=k[A] n
·[B] n
5. Орташа жылдамдықтың формуласы?
A) V=1/C.
B) C=1/V
C) V=∆C/t 6. Лездік жылдамдықтың формуласы?
А) V=k[A]m·[B]n
В) V=+-dC/dt
С) V=1/C
7. Әр түрлі фазадан тұратын жүйе:
А) гетерогенді
В) жанасу беті
С) гомогенді
8 . Гомогенді реакцияға мысал келтір:
А) С(қ) + О
2 (г) ↔ СО
2 (г)
В) 2NО(г) + О
2 (г) ↔ 2NО
2 (г )
С) 4Fe(қ) + 3О
2 (г)→2Fe
2 O
3
9. Әрекеттесуші және түзілетін заттар бірдей
агрегаттық күйде болатын реакция:
А) гетерогенді
В) қайтымды
С) гомогенді
10. Әрекеттесуші және үзілетін заттар әртүрлі
агрегаттық күйде болатын реакция:
А) гетерогенді
В) қайтымды
С) гомогенді
16 слайд
Тест жауаптары: 1. Химиялық процесс нәтижесінде түзілетін және ары қарай өзгерістерге түспейтін заттар А) реакция өнімдері Б) бастапқы В) аралас 2. Химиялық реакцияның жылдамдығын, жылдамдыққа әсер ететін параметрлерді және химиялық реакцияның механизмін зерттейтін физикалық химияның үлкен бір тарауы А) химиялық кинетика Б) термодинамика В) ерітінді 3. Гетерогенді реакцияға мысал келтір: А) Н 2 (г) + J 2 (г)→2НJ(г) В) 2NО(г) + О 2 (г) ↔ 2NО 2 (г) С) 4Fe(қ) + 3О 2 (г)→2Fe 2 O 3 4. Келтірілген формулалардың қайсысы масса әрекеттесу заңының математикалық өрнегі: А) V=1/C. В) V=∆C/t С) V=k[A] n ·[B] n 5. Орташа жылдамдықтың формуласы? A) V=1/C. B) C=1/V C) V=∆C/t 6. Лездік жылдамдықтың формуласы? А) V=k[A]m·[B]n В) V=+-dC/dt С) V=1/C 7. Әр түрлі фазадан тұратын жүйе: А) гетерогенді В) жанасу беті С) гомогенді 8 . Гомогенді реакцияға мысал келтір: А) С(қ) + О 2 (г) ↔ СО 2 (г) В) 2NО(г) + О 2 (г) ↔ 2NО 2 (г ) С) 4Fe(қ) + 3О 2 (г)→2Fe 2 O 3 9. Әрекеттесуші және түзілетін заттар бірдей агрегаттық күйде болатын реакция: А) гетерогенді В) қайтымды С) гомогенді 10. Әрекеттесуші және үзілетін заттар әртүрлі агрегаттық күйде болатын реакция: А) гетерогенді В) қайтымды С) гомогенді
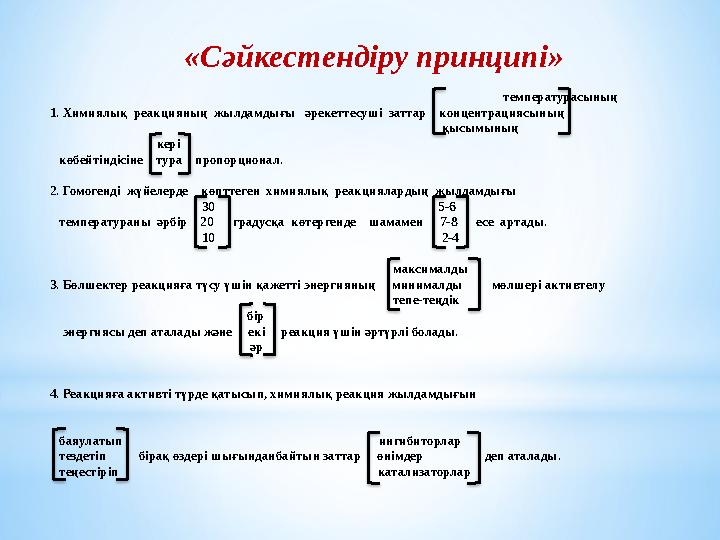
#17 слайд
«Сәйкестендіру принципі»
температурасының
1. Химиялық реакцияның жылдамдығы әрекеттесуші заттар концентрациясының
қысымының
кері
көбейтіндісіне тура пропорционал.
2. Гомогенді жүйелерде көпттеген химиялық реакциялардың жылдамдығы
30 5-6
температураны әрбір 20 градусқа көтергенде шамамен 7-8 есе артады.
10 2-4
максималды
3. Бөлшектер реакцияға түсу үшін қажетті энергияның минималды мөлшері активтелу
тепе-теңдік
бір
энергиясы деп аталады және екі реакция үшін әртүрлі болады.
әр
4. Реакцияға активті түрде қатысып, химиялық реакция жылдамдығын
баяулатып ингибиторлар
тездетіп бірақ өздері шығынданбайтын заттар өнімдер деп аталады.
теңестіріп катализаторлар
17 слайд
«Сәйкестендіру принципі» температурасының 1. Химиялық реакцияның жылдамдығы әрекеттесуші заттар концентрациясының қысымының кері көбейтіндісіне тура пропорционал. 2. Гомогенді жүйелерде көпттеген химиялық реакциялардың жылдамдығы 30 5-6 температураны әрбір 20 градусқа көтергенде шамамен 7-8 есе артады. 10 2-4 максималды 3. Бөлшектер реакцияға түсу үшін қажетті энергияның минималды мөлшері активтелу тепе-теңдік бір энергиясы деп аталады және екі реакция үшін әртүрлі болады. әр 4. Реакцияға активті түрде қатысып, химиялық реакция жылдамдығын баяулатып ингибиторлар тездетіп бірақ өздері шығынданбайтын заттар өнімдер деп аталады. теңестіріп катализаторлар

#18 слайд
Есептер шығару
1. 2SO
2 +O
2 →2SO
3 реакциясындағы күкірт (IV) оксидінің
концентрациясын 3 есе көбейткенде реакция
жылдамдығы қалай өзгереді?
2. C
2 H
4 +3O
2 =2CO
2 +2H
2 O реакциядағы оттек
концентрациясын 3 есе азайтқанда реакция жылдамдығы
қалай өзгереді?
3. Температуралық коэффициенті 2 - ге тең болған
жағдайда температураны 20 0
C – ден 80 0
C - ге дейін
көтергенде химиялық реакцияның жылдамдығы неше есе
артады.
18 слайд
Есептер шығару 1. 2SO 2 +O 2 →2SO 3 реакциясындағы күкірт (IV) оксидінің концентрациясын 3 есе көбейткенде реакция жылдамдығы қалай өзгереді? 2. C 2 H 4 +3O 2 =2CO 2 +2H 2 O реакциядағы оттек концентрациясын 3 есе азайтқанда реакция жылдамдығы қалай өзгереді? 3. Температуралық коэффициенті 2 - ге тең болған жағдайда температураны 20 0 C – ден 80 0 C - ге дейін көтергенде химиялық реакцияның жылдамдығы неше есе артады.

#19 слайд
Glossary
• activation energy – активтелу энергиясы - Реакция басталу
үшін энергия мөлшері
• catalyst – катализатор – Химиялық реакция жылдамдығын
арттыратын, бірақ өзі реакцияда өзгеріссіз қалатын зат.
• concentration – концентрация – Берілген көлемде заттың
молекула саны.
• enzyme – энзим – Биологиялық катализатор.
• rate of reaction – химиялық реакция жылдамдығы –
Концентрацияның белгілі бір уақыт аралығындағы
өзгерісі.
19 слайд
Glossary • activation energy – активтелу энергиясы - Реакция басталу үшін энергия мөлшері • catalyst – катализатор – Химиялық реакция жылдамдығын арттыратын, бірақ өзі реакцияда өзгеріссіз қалатын зат. • concentration – концентрация – Берілген көлемде заттың молекула саны. • enzyme – энзим – Биологиялық катализатор. • rate of reaction – химиялық реакция жылдамдығы – Концентрацияның белгілі бір уақыт аралығындағы өзгерісі.

#20 слайд
Үйге тапсырма
•
Температура, концентрацияның жоғарылауы
мен төмендеуіне байланысты әрқайсысына 3
есептен шығарып келу.
•
Химиялық реакциялардың жылдамдығына
катализатордың әсері жайлы химиялық
диктант дайындап келу.
20 слайд
Үйге тапсырма • Температура, концентрацияның жоғарылауы мен төмендеуіне байланысты әрқайсысына 3 есептен шығарып келу. • Химиялық реакциялардың жылдамдығына катализатордың әсері жайлы химиялық диктант дайындап келу.

шағым қалдыра аласыз
















