

презентация
Дипломдар мен сертификаттарды алып үлгеріңіз!



1 слайд
Сабақтың тақырыбы:
Энтропия өзгерісі
1 слайд
Сабақтың тақырыбы: Энтропия өзгерісі

2 слайд
?Суреттерді не байланыстырады
2 слайд
?Суреттерді не байланыстырады

3 слайд
Оқу мақсаты
еркін энергия (∆G) мен энтропия өзгерісі (∆S)
түсініктерін түсіну және қолдана білу
Павлодар қ., ХББ НЗМ
3 слайд
Оқу мақсаты еркін энергия (∆G) мен энтропия өзгерісі (∆S) түсініктерін түсіну және қолдана білу Павлодар қ., ХББ НЗМ

4 слайд
Проблемалық сұрақтар
Өздігінен жүретін (спонтанды), өздігінен жүрмейтін
(спонтанды емес) процесстерді қалай анықтауға
болады?
Энтропия деген не?
Химиялық реакциялардың, қоршаған ортаның және жалпы
энтропияның өзгерісін қалай есептейді? Ол не үшін
керек?
Павлодар қ., ХББ НЗМ
4 слайд
Проблемалық сұрақтар Өздігінен жүретін (спонтанды), өздігінен жүрмейтін (спонтанды емес) процесстерді қалай анықтауға болады? Энтропия деген не? Химиялық реакциялардың, қоршаған ортаның және жалпы энтропияның өзгерісін қалай есептейді? Ол не үшін керек? Павлодар қ., ХББ НЗМ

5 слайд
Бүгін мен...
Өздігінен жүретін ( ) спонтанды және өздігінен
жүрмейтін ( ) спонтанды емес процесстер ге мысалдар
,
келтіріп оларды анықтаймын ;
Энтропия
ұғымымен және кейбір заттардың
стандартты энтропия мәндерімен танысамын ;
Энтропия өзгерісін физикалық және химиялық
үрдістердің мысалдарын қарастыру арқылы
болжаймын ;
* ( )
Жүйе химиялық реакция мен қоршаған орта
энтропияларының өзгерісін есептеуді үйренемін ;
** ,
Жалпы энтропияның өзгерісін есептеп реакцияның
спонтанды жүруін анықтаймын .
Павлодар қ., ХББ НЗМ
5 слайд
Бүгін мен... Өздігінен жүретін ( ) спонтанды және өздігінен жүрмейтін ( ) спонтанды емес процесстер ге мысалдар , келтіріп оларды анықтаймын ; Энтропия ұғымымен және кейбір заттардың стандартты энтропия мәндерімен танысамын ; Энтропия өзгерісін физикалық және химиялық үрдістердің мысалдарын қарастыру арқылы болжаймын ; * ( ) Жүйе химиялық реакция мен қоршаған орта энтропияларының өзгерісін есептеуді үйренемін ; ** , Жалпы энтропияның өзгерісін есептеп реакцияның спонтанды жүруін анықтаймын . Павлодар қ., ХББ НЗМ

6 слайд
Энтропия
1865 жылы Рудольф Клаузиус алғашқы
рет осы түсінікті енгізген.
Реттілігі жоғары күйден реттілігі төмен
күйге ауыса жүретін физикалық
немесе химиялық өзгерістер спонтанды
түрде жүреді. Бұл бақылау жүйедегі
және оның айналасындағы
жалпы өзгеріске қатысты.
Жүйедегі ретсіздік деңгейінің өлшемі
энтропия деп аталады, белгіленуі «S»
Энтропия – оқшауланған жүйелер үшін
процестің жүру мүмкіндігін, бағытын
көрсететін негізгі белгі Clausius, Rudolf Julius Emanuel
1822-1888
6 слайд
Энтропия 1865 жылы Рудольф Клаузиус алғашқы рет осы түсінікті енгізген. Реттілігі жоғары күйден реттілігі төмен күйге ауыса жүретін физикалық немесе химиялық өзгерістер спонтанды түрде жүреді. Бұл бақылау жүйедегі және оның айналасындағы жалпы өзгеріске қатысты. Жүйедегі ретсіздік деңгейінің өлшемі энтропия деп аталады, белгіленуі «S» Энтропия – оқшауланған жүйелер үшін процестің жүру мүмкіндігін, бағытын көрсететін негізгі белгі Clausius, Rudolf Julius Emanuel 1822-1888

7 слайд
Өздігінен жүретін және өздігінен жүре алмайтын
құбылыстар бар (мысалдар келтіріңіздер).
Өздігінен жүретін процесстер ( спонтанды ) – сыртқы
күштің әсерінсіз жүретін үрдістер.
Өздігінен жүрмейтін процесстер ( спонтанды емес ) –
қандай да бір сыртқы күштің әсерінен, яғни сыртқы
энергияның жұмсалуымен жүретін үрдістер. Өздігінен жүретін және өздігінен
жүрмейтін процесстер (спонтанды,
спонтанды емес)
7 слайд
Өздігінен жүретін және өздігінен жүре алмайтын құбылыстар бар (мысалдар келтіріңіздер). Өздігінен жүретін процесстер ( спонтанды ) – сыртқы күштің әсерінсіз жүретін үрдістер. Өздігінен жүрмейтін процесстер ( спонтанды емес ) – қандай да бір сыртқы күштің әсерінен, яғни сыртқы энергияның жұмсалуымен жүретін үрдістер. Өздігінен жүретін және өздігінен жүрмейтін процесстер (спонтанды, спонтанды емес)
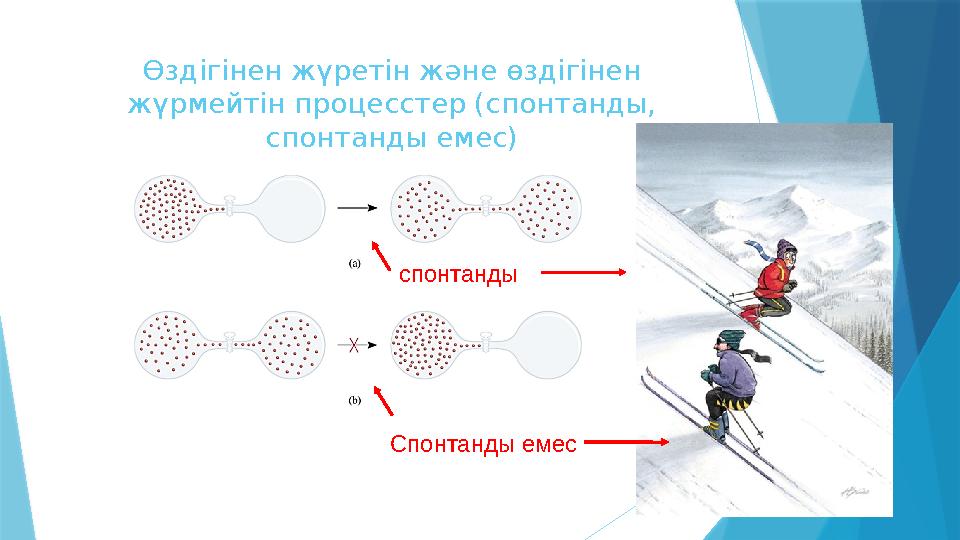
8 слайд
Өздігінен жүретін және өздігінен
жүрмейтін процесстер (спонтанды,
спонтанды емес)
спонтанды
Спонтанды емес
8 слайд
Өздігінен жүретін және өздігінен жүрмейтін процесстер (спонтанды, спонтанды емес) спонтанды Спонтанды емес

9 слайд
Спонтанды (өздігінен
жүретін) процесстер Спонтанды емес (өздігінен
жүрмейтін) процесстер
5. Электролиттердің сулы ерітіндіде
иондарға ыдырауы: 4. Газдар мен
сұйықтықтардағы
диффузия3. Судың
айналымы 2. Терімдің таттануы1. Тастың таудан құлауы 1. Газдың сығылуы
2. Тоңазытқыштың жұмысы р
а
б
о
т
3. Судың электролизі
4. Доңғалақты
насоспен үрлеуӨздігінен жүретін және өздігінен
жүрмейтін процесстер (спонтанды,
спонтанды емес)
9 слайд
Спонтанды (өздігінен жүретін) процесстер Спонтанды емес (өздігінен жүрмейтін) процесстер 5. Электролиттердің сулы ерітіндіде иондарға ыдырауы: 4. Газдар мен сұйықтықтардағы диффузия3. Судың айналымы 2. Терімдің таттануы1. Тастың таудан құлауы 1. Газдың сығылуы 2. Тоңазытқыштың жұмысы р а б о т 3. Судың электролизі 4. Доңғалақты насоспен үрлеуӨздігінен жүретін және өздігінен жүрмейтін процесстер (спонтанды, спонтанды емес)

10 слайд
Процесстің спонтанды болатын/болмайтындығын
қалай анықтауға болады? Ол тек энтальпиялық
факторға тәуелді ме ?
Бертло -Томсен принципі (19 ғасырдың ортасы) бойынша өздігінен тек экзотермиялық
реакциялар жүреді:
А + В → АВ ΔΗ <0 (мысалы, сутек пен оттектен судың түзілуі; метанның жануы )
А + В → С+ D ΔΗ <0 (мысалы, бейтараптану реакциясы , т.с.с )
Иә, 95% барлық қайтымсыз процесстер үшін бұл принцип сақталады, алайда 5% реакцияларда
керісінше тәуелдідік байқалады, мысалы:
NH
4 NO
3 → NH
4 +
aq + NO
3 _
aq ΔΗ >0
N
2 O
4 → 2NO
2 ΔΗ >0
Мұздың еруі ΔΗ >0
Яғни, егер жүйе ретсіздік күйге келсе, эндотермиялық процесстер де спонтанды жүре алады.
Сонымен, жүйенің тек жылуды сіңіру немесе бөле алатындығы жайлы ақпараты
( энтальпиялық фактор ) арқылы ғана кез келген процесстің жүре алу мүмкіндігі туралы айта
алмаймыз.
Энтропиялық факторды да ескеру керек
10 слайд
Процесстің спонтанды болатын/болмайтындығын қалай анықтауға болады? Ол тек энтальпиялық факторға тәуелді ме ? Бертло -Томсен принципі (19 ғасырдың ортасы) бойынша өздігінен тек экзотермиялық реакциялар жүреді: А + В → АВ ΔΗ <0 (мысалы, сутек пен оттектен судың түзілуі; метанның жануы ) А + В → С+ D ΔΗ <0 (мысалы, бейтараптану реакциясы , т.с.с ) Иә, 95% барлық қайтымсыз процесстер үшін бұл принцип сақталады, алайда 5% реакцияларда керісінше тәуелдідік байқалады, мысалы: NH 4 NO 3 → NH 4 + aq + NO 3 _ aq ΔΗ >0 N 2 O 4 → 2NO 2 ΔΗ >0 Мұздың еруі ΔΗ >0 Яғни, егер жүйе ретсіздік күйге келсе, эндотермиялық процесстер де спонтанды жүре алады. Сонымен, жүйенің тек жылуды сіңіру немесе бөле алатындығы жайлы ақпараты ( энтальпиялық фактор ) арқылы ғана кез келген процесстің жүре алу мүмкіндігі туралы айта алмаймыз. Энтропиялық факторды да ескеру керек
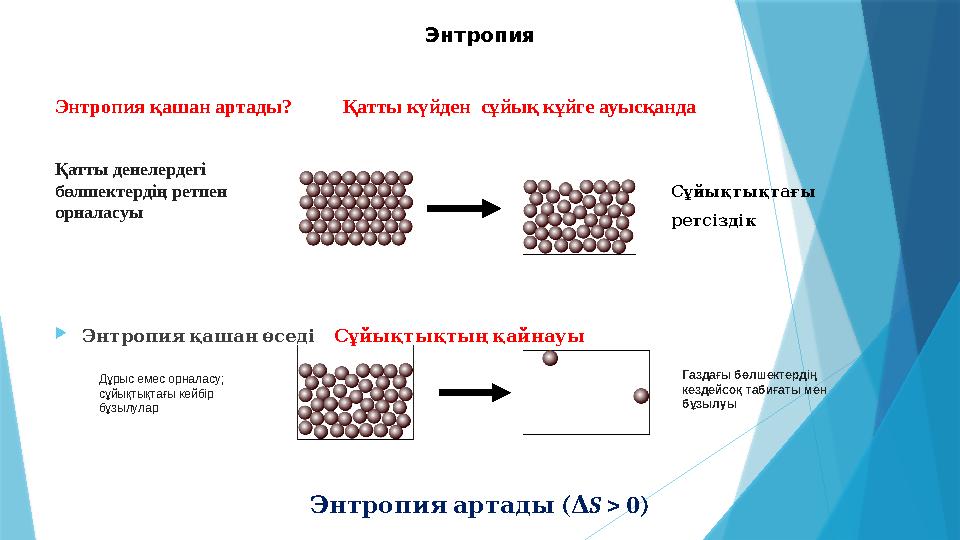
11 слайд
Энтропия қашан артады? Қатты күйден сұйық кұйге ауысқанда
Энтропия қашан өседі Сұйықтықтың қайнауы
Энтропия артады ( Δ S > 0)Энтропия
Қатты денелердегі
бөлшектердің ретпен
орналасуы
Сұйықтықтағы
ретсіздік
Дұрыс емес орналасу;
сұйықтықтағы кейбір
бұзылулар Газдағы бөлшектердің
кездейсоқ табиғаты мен
бұзылуы
11 слайд
Энтропия қашан артады? Қатты күйден сұйық кұйге ауысқанда Энтропия қашан өседі Сұйықтықтың қайнауы Энтропия артады ( Δ S > 0)Энтропия Қатты денелердегі бөлшектердің ретпен орналасуы Сұйықтықтағы ретсіздік Дұрыс емес орналасу; сұйықтықтағы кейбір бұзылулар Газдағы бөлшектердің кездейсоқ табиғаты мен бұзылуы

12 слайд
Химиялық реакцияның стандартты
энтропия өзгерісін есептеу
ΔS 0
реак – реакцияның стандартты энтропия өзгерісі
ΣΔS 0
(өнімдер) − барлық өнімдердің стандартты энтропияларының қосындысы
ΣΔS 0
(реагенттер) − барлық реагенттердің стандартты энтропияларының
қосындысы Физикалық және химиялық процестердегі стандартты энтропия
өзгерісін өнімдер мен реагенттердің жалпы энтропияларының
айырмасы ретінде есептеуге болады
12 слайд
Химиялық реакцияның стандартты энтропия өзгерісін есептеу ΔS 0 реак – реакцияның стандартты энтропия өзгерісі ΣΔS 0 (өнімдер) − барлық өнімдердің стандартты энтропияларының қосындысы ΣΔS 0 (реагенттер) − барлық реагенттердің стандартты энтропияларының қосындысы Физикалық және химиялық процестердегі стандартты энтропия өзгерісін өнімдер мен реагенттердің жалпы энтропияларының айырмасы ретінде есептеуге болады

13 слайд
Мысалы:
2CO(g) + O
2 (g) ⟶ 2CO
2 (g)
Жоғарыда берілген формулаға сәйкес және реакцияға қатысқан заттар мен түзілген өнімдердің
әрқайсысының стандартты энтропия мәндерін кестеден тауып, олардың алдында тұрған
коэффициенттерді ескере отырып есептеу керек.
S 0
(CO) = 197.9 J/K•mol
S 0
(O
2 ) = 205.0 J/K•mol
S 0
(CO
2 ) = 213.6 J/K•mol
ΔS 0
реакц.
= 2 х S 0
(CO
2 ) – [2хS 0
(CO) + S 0
(O
2 )]
Δ S 0
реакц.
= 427.2 – [395.8 + 205.0] = -173.6 J/K•mol
Жауабы: Δ S 0
реакц.
= -173.6 Дж/К•моль
13 слайд
Мысалы: 2CO(g) + O 2 (g) ⟶ 2CO 2 (g) Жоғарыда берілген формулаға сәйкес және реакцияға қатысқан заттар мен түзілген өнімдердің әрқайсысының стандартты энтропия мәндерін кестеден тауып, олардың алдында тұрған коэффициенттерді ескере отырып есептеу керек. S 0 (CO) = 197.9 J/K•mol S 0 (O 2 ) = 205.0 J/K•mol S 0 (CO 2 ) = 213.6 J/K•mol ΔS 0 реакц. = 2 х S 0 (CO 2 ) – [2хS 0 (CO) + S 0 (O 2 )] Δ S 0 реакц. = 427.2 – [395.8 + 205.0] = -173.6 J/K•mol Жауабы: Δ S 0 реакц. = -173.6 Дж/К•моль

14 слайд
Fe
2 O
3 (к) + 3H
2 = 2Fe
(к) + 3H
2 O
(г)
Жоғарыда берілген формулаға сәйкес және реакцияға қатысқан заттар мен
түзілген өнімдердің әрқайсысының стандартты энтропия мәндерін кестеден
тауып, олардың алдында тұрған коэффициенттерді ескере отырып есептеу
керек.
Шешуі.
ΔS
р-ции =ΣS 0
кон – ΣS 0
исх Дж/(моль·K)
Используя справочные данные стандартных энтропий веществ, находим:
ΔS
р-ции = 2· ΔS 0
Fe + 3· ΔS 0
H2O — ΔS 0
Fe2O3 — 3· ΔS 0
H2 = 2·27,15 + 3·188,7 – 89,96 — 3·131 =
137,44 Дж/(моль·K)
14 слайд
Fe 2 O 3 (к) + 3H 2 = 2Fe (к) + 3H 2 O (г) Жоғарыда берілген формулаға сәйкес және реакцияға қатысқан заттар мен түзілген өнімдердің әрқайсысының стандартты энтропия мәндерін кестеден тауып, олардың алдында тұрған коэффициенттерді ескере отырып есептеу керек. Шешуі. ΔS р-ции =ΣS 0 кон – ΣS 0 исх Дж/(моль·K) Используя справочные данные стандартных энтропий веществ, находим: ΔS р-ции = 2· ΔS 0 Fe + 3· ΔS 0 H2O — ΔS 0 Fe2O3 — 3· ΔS 0 H2 = 2·27,15 + 3·188,7 – 89,96 — 3·131 = 137,44 Дж/(моль·K)

15 слайд
a) CaCO
3 (s) —> CaO(s) + CO
2 (g) +
b) NH
3 (g) + HC l (g) —> NH
4 C l (s) -
c) Na(s) —> Na(g) +
d) C
6 H
12 (l) + 9O
2 (g) —> 6CO
2 (g) + 6H
2 O(g ) +
e) C(s) + O
2 (g) —> CO
2 (g) 0 Өнімдегі газ
молекулалары көп
газ молекулалары аз
қатты күйден газға
ауысады
Газ молекулалары көп
Бірдей ,газ
молекулалары тең2 -тапсырма
Төменде берілген реакциялардың жанына
.
энтропияның өзгеру белгісін қойыңыз Жауапты
түсіндіріңіз
15 слайд
a) CaCO 3 (s) —> CaO(s) + CO 2 (g) + b) NH 3 (g) + HC l (g) —> NH 4 C l (s) - c) Na(s) —> Na(g) + d) C 6 H 12 (l) + 9O 2 (g) —> 6CO 2 (g) + 6H 2 O(g ) + e) C(s) + O 2 (g) —> CO 2 (g) 0 Өнімдегі газ молекулалары көп газ молекулалары аз қатты күйден газға ауысады Газ молекулалары көп Бірдей ,газ молекулалары тең2 -тапсырма Төменде берілген реакциялардың жанына . энтропияның өзгеру белгісін қойыңыз Жауапты түсіндіріңіз
16 слайд
Қоршаған ортаның энтропия өзгерісі.
Жалпы энтропия өзгерісі.
Павлодар қ., ХББ НЗМΔ S 0
жалпы= Δ S 0
жүйе +
Δ S 0
қорш.орта
Егер жүйе мен қоршаған ортаның
жалпы энтропия өзгерісі оң , мәнге ие болса
онда химиялық немесе физикалық өзгеріс
спонтанды жүреді
16 слайд
Қоршаған ортаның энтропия өзгерісі. Жалпы энтропия өзгерісі. Павлодар қ., ХББ НЗМΔ S 0 жалпы= Δ S 0 жүйе + Δ S 0 қорш.орта Егер жүйе мен қоршаған ортаның жалпы энтропия өзгерісі оң , мәнге ие болса онда химиялық немесе физикалық өзгеріс спонтанды жүреді

17 слайд
Энтропия
Термодинамикалық жабық жүйеде
энтропия өздігінен жүретін процесстердің
жүру бағытын сипаттайды.
Клаузиус теңсіздігі
Қайтымды үрдістер үшін энтропия
тұрақты болып қалады
Қайтымсыз үрдістер үшін энтропия
өзгерісі әрдайым оң мәнді қабылдайды
Павлодар қ., ХББ НЗМ
17 слайд
Энтропия Термодинамикалық жабық жүйеде энтропия өздігінен жүретін процесстердің жүру бағытын сипаттайды. Клаузиус теңсіздігі Қайтымды үрдістер үшін энтропия тұрақты болып қалады Қайтымсыз үрдістер үшін энтропия өзгерісі әрдайым оң мәнді қабылдайды Павлодар қ., ХББ НЗМ
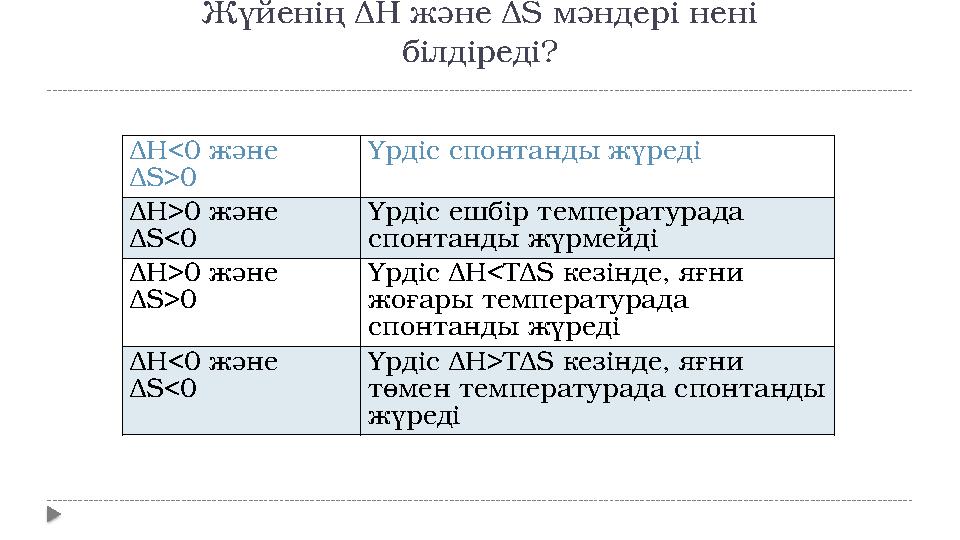
18 слайд
Δ H<0 және
Δ S>0 Үрдіс спонтанды жүреді
Δ H>0 және
Δ S<0 Үрдіс ешбір температурада
спонтанды жүрмейді
Δ H>0 және
Δ S>0 Үрдіс Δ H<T Δ S кезінде, яғни
жоғары температурада
спонтанды жүреді
Δ H<0 және
Δ S<0 Үрдіс Δ H>T Δ S кезінде, яғни
төмен температурада спонтанды
жүредіЖүйенің Δ H және Δ S мәндері нені
білдіреді?
18 слайд
Δ H<0 және Δ S>0 Үрдіс спонтанды жүреді Δ H>0 және Δ S<0 Үрдіс ешбір температурада спонтанды жүрмейді Δ H>0 және Δ S>0 Үрдіс Δ H<T Δ S кезінде, яғни жоғары температурада спонтанды жүреді Δ H<0 және Δ S<0 Үрдіс Δ H>T Δ S кезінде, яғни төмен температурада спонтанды жүредіЖүйенің Δ H және Δ S мәндері нені білдіреді?

19 слайд
Қолданылған ресурстар
1. Химиялық термодинамика. Энтропия. - Білімлэнд
http://bilimland.kz/kk/content/structure/977-zhalpy_ximiya#lesson=11
306
2. Химическая термодинамика . Физическая химия. Лекция 5.
3. Cengage Learning. Entropy
4. Entropy, Free Energy and Equilibrium - PowerPoint Lecture Presentation
by J. David Robertson University of Missouri. The McGraw-Hill
Companies, Inc.
5. https://www.saddleback.edu/faculty/cabel/Saddleback/Chapter17_fil
es/chem1b-ws14-s-g.pdf
6. https://www.saddleback.edu/faculty/cabel/Saddleback/Chapter17_fil
es/chem1b-ws14-s-g.pdf
7. http://ellischemistry.wikispaces.com/file/view/Entropyworksheet.pd
f
19 слайд
Қолданылған ресурстар 1. Химиялық термодинамика. Энтропия. - Білімлэнд http://bilimland.kz/kk/content/structure/977-zhalpy_ximiya#lesson=11 306 2. Химическая термодинамика . Физическая химия. Лекция 5. 3. Cengage Learning. Entropy 4. Entropy, Free Energy and Equilibrium - PowerPoint Lecture Presentation by J. David Robertson University of Missouri. The McGraw-Hill Companies, Inc. 5. https://www.saddleback.edu/faculty/cabel/Saddleback/Chapter17_fil es/chem1b-ws14-s-g.pdf 6. https://www.saddleback.edu/faculty/cabel/Saddleback/Chapter17_fil es/chem1b-ws14-s-g.pdf 7. http://ellischemistry.wikispaces.com/file/view/Entropyworksheet.pd f



