Презентация Химиялық реакциялар,жылу эфектісі химиялық реакциялардың жылдамдығы
Презентация Химиялық реакциялар,жылу эфектісі химиялық реакциялардың жылдамдығы


#1 слайд
ХИМИЯЛЫҚ РЕАКЦИЯЛАР,ЖЫЛУ ЭФЕКТІСІ
ХИМИЯЛЫҚ РЕАКЦИЯЛАРДЫҢ ЖЫЛДАМДЫҒЫ
1 слайд
ХИМИЯЛЫҚ РЕАКЦИЯЛАР,ЖЫЛУ ЭФЕКТІСІ ХИМИЯЛЫҚ РЕАКЦИЯЛАРДЫҢ ЖЫЛДАМДЫҒЫ

#2 слайд
ХИМИЯЛЫҚ РЕАКЦИЯЛАРДЫҢ ЖЫЛУ
ЭФФЕКТІСІ. ХИМИЯЛЫҚ РЕАКЦИЯЛАРДЫҢ
ЖЫЛДАМДЫҒЫ
•
Химиялық реакциялардың жылдамдығын оқытатын бөлім химиялық
кинетика деп аталады. Реакция жылдамдығы бұл әрекеттесуші
заттардың белгілі уақыт бірлігінде біреуінің концентрациясының
өзгеруі. 4. 1. Химиялық реакцияның жылдамдығы
Химиялық реакцияның жылдамдығын зерттейтін химияның бөлімін
— химиялық кинетика деп атайды. Химиялық реакцияның
жылдамдығы деп уақыт бірлігінде әрекеттесетін заттардың немесе
реакция өнімдерінің біреуінің концентрацияларының өзгеруін
айтады. Бұл кезде реакцияға қатысатын зат қандай болса да
бәрібір: олардың барлығы өзара реакция теңдеуімен байланысқан,
сондықтан олардың біреуінің концентрациясының өзгеруі бойынша
қалғандарының концентрациясының өзгеруі туралы айтуға болады.
Әдетте концентрация моль/л, ал уақыт секундпен немесе минутпен
өрнектеледі.
2 слайд
ХИМИЯЛЫҚ РЕАКЦИЯЛАРДЫҢ ЖЫЛУ ЭФФЕКТІСІ. ХИМИЯЛЫҚ РЕАКЦИЯЛАРДЫҢ ЖЫЛДАМДЫҒЫ • Химиялық реакциялардың жылдамдығын оқытатын бөлім химиялық кинетика деп аталады. Реакция жылдамдығы бұл әрекеттесуші заттардың белгілі уақыт бірлігінде біреуінің концентрациясының өзгеруі. 4. 1. Химиялық реакцияның жылдамдығы Химиялық реакцияның жылдамдығын зерттейтін химияның бөлімін — химиялық кинетика деп атайды. Химиялық реакцияның жылдамдығы деп уақыт бірлігінде әрекеттесетін заттардың немесе реакция өнімдерінің біреуінің концентрацияларының өзгеруін айтады. Бұл кезде реакцияға қатысатын зат қандай болса да бәрібір: олардың барлығы өзара реакция теңдеуімен байланысқан, сондықтан олардың біреуінің концентрациясының өзгеруі бойынша қалғандарының концентрациясының өзгеруі туралы айтуға болады. Әдетте концентрация моль/л, ал уақыт секундпен немесе минутпен өрнектеледі.

#3 слайд
ХИМИЯЛЫҚ РЕАКЦИЯЛАР
•
Химиялық реакциялар масса сақталу заңы мен эквивалент заңына
негізделген. Химиялық реакциялардың ядролық реакциялардан
айырмашылығы — реакция кезінде әрекеттесетін заттар
құрамындағы химиялық элементтер мен олардың атомдарының
жалпы санының өзгермейтіндігінде. Химиялық реакциялар
химиялық теңдеулер арқылы өрнектеледі. Химиялық процесте тура
реакциямен қатар бастапқы заттар қайта түзілетін кері реакция
жүреді. Қайтымды реакцияда тура реакция мен кері реакцияның
жылдамдықтары теңескенде жүйеде химиялық тепе-теңдік
орнайды, бірақ кері процесс баяу жүретіндіктен көптеген химиялық
реакциялар қайтымсыз, яғни аяғына дейін жүреді. Реакция кезінде
заттар санының өзгеруіне қарай химиялық реакциялар
3 слайд
ХИМИЯЛЫҚ РЕАКЦИЯЛАР • Химиялық реакциялар масса сақталу заңы мен эквивалент заңына негізделген. Химиялық реакциялардың ядролық реакциялардан айырмашылығы — реакция кезінде әрекеттесетін заттар құрамындағы химиялық элементтер мен олардың атомдарының жалпы санының өзгермейтіндігінде. Химиялық реакциялар химиялық теңдеулер арқылы өрнектеледі. Химиялық процесте тура реакциямен қатар бастапқы заттар қайта түзілетін кері реакция жүреді. Қайтымды реакцияда тура реакция мен кері реакцияның жылдамдықтары теңескенде жүйеде химиялық тепе-теңдік орнайды, бірақ кері процесс баяу жүретіндіктен көптеген химиялық реакциялар қайтымсыз, яғни аяғына дейін жүреді. Реакция кезінде заттар санының өзгеруіне қарай химиялық реакциялар

#4 слайд
ЗАТТАРДЫҢ ҚҰРАМЫ МЕН САНЫ ӨЗГЕРЕ
ЖҮРЕТІН РЕАКЦИЯЛАР
•
Бұған бұрыннан таныс қосылу, айырылу, орынбасу, алмасу
реакциялары жатады.
•
Егер бірнеше реагент бірігіп бір ғана өнім түзсе, ол — қосылу, ал
керісінше, бір күрделі зат ыдырап, одан бірнеше жаңа заттар
түзілсе, айырылу реакциясына жатады. Органикалық химиядағы аса
маңызды гидрлену , гидраттану, полимерлену реакциялары қосылу
реакциясына мысал бола алады:
4 слайд
ЗАТТАРДЫҢ ҚҰРАМЫ МЕН САНЫ ӨЗГЕРЕ ЖҮРЕТІН РЕАКЦИЯЛАР • Бұған бұрыннан таныс қосылу, айырылу, орынбасу, алмасу реакциялары жатады. • Егер бірнеше реагент бірігіп бір ғана өнім түзсе, ол — қосылу, ал керісінше, бір күрделі зат ыдырап, одан бірнеше жаңа заттар түзілсе, айырылу реакциясына жатады. Органикалық химиядағы аса маңызды гидрлену , гидраттану, полимерлену реакциялары қосылу реакциясына мысал бола алады:

#5 слайд
АТОМДАРДЫҢ ТОТЫҒУ ДӘРЕЖЕСІ ӨЗГЕРЕ
ЖҮРЕТІН РЕАКЦИЯЛАР.
•
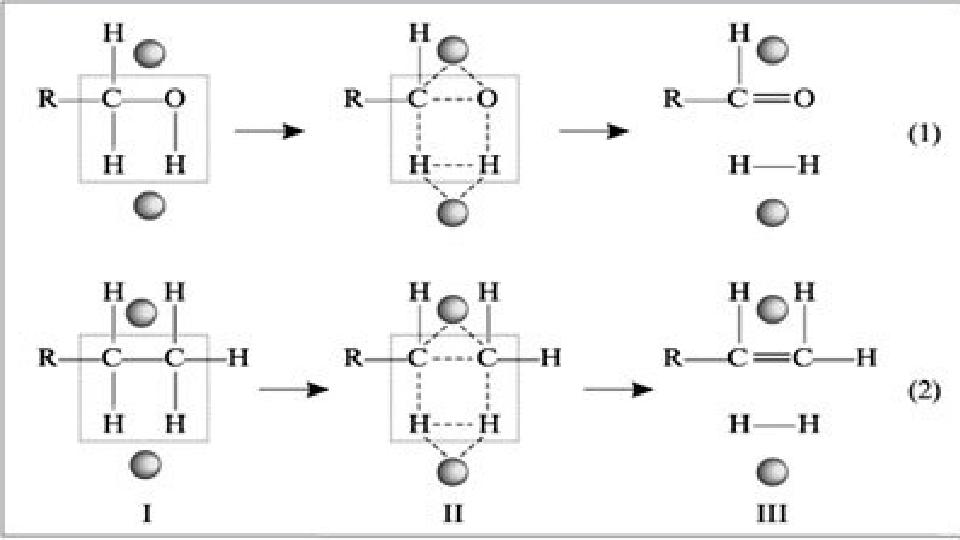
Мұндай реакцияларды тотығу-тотықсыздану реакциялары деп
атайтыны белгілі. Реакция кезінде тотықсыздандырғыш атом
электронын тотықтырғыш атомға беріп, біріншісі тотығып, екіншісі
тотықсызданады. Электрондық баланс әдісі арқылы тотығу
дәрежесіне сүйеніп, шартты түрде берген және алған электрондар
санын есептеу арқылы теңдеуді оңай теңестіруге болады. Мысалы,
альдегидтерді сутекпен тотықсыздандыру.
•
Өздерің көріп отырғандай, органикалық заттар құрамындағы
тотығу-тотықсыздануға қатысқан атомды молекуланың
функционалдық тобына жататын бөлігінен іздеу орынды. Сонда
сірке альдегидіндегі альдегидтік топтың спиртке айналуы үшін
ондағы көміртек атомы 2 электрон қосып алады.
5 слайд
АТОМДАРДЫҢ ТОТЫҒУ ДӘРЕЖЕСІ ӨЗГЕРЕ ЖҮРЕТІН РЕАКЦИЯЛАР. • Мұндай реакцияларды тотығу-тотықсыздану реакциялары деп атайтыны белгілі. Реакция кезінде тотықсыздандырғыш атом электронын тотықтырғыш атомға беріп, біріншісі тотығып, екіншісі тотықсызданады. Электрондық баланс әдісі арқылы тотығу дәрежесіне сүйеніп, шартты түрде берген және алған электрондар санын есептеу арқылы теңдеуді оңай теңестіруге болады. Мысалы, альдегидтерді сутекпен тотықсыздандыру. • Өздерің көріп отырғандай, органикалық заттар құрамындағы тотығу-тотықсыздануға қатысқан атомды молекуланың функционалдық тобына жататын бөлігінен іздеу орынды. Сонда сірке альдегидіндегі альдегидтік топтың спиртке айналуы үшін ондағы көміртек атомы 2 электрон қосып алады.

#6 слайд
ЖЫЛУ ЭФФЕКТІСІМЕН СИПАТТАЛАТЫН
РЕАКЦИЯЛАР
•
Кез келген химиялық құбылысты , яғни химиялық айналуларды
сипаттайтын реакциялар реагенттердің өнімдерге айналуын
көрсетумен қатар олардың жылу эффектісін белгілеуге міндетті .
Осыған бола жылу беле жүретін реакцияларды экзотермиялық, ал
жылу сіңіре жүретіндерді эндотермиялық деп саралайтынын
білесіңдер. Оларды арнайы термохимиялық теңдеулермен
өрнектейді. Термохимиялық теңдеудің ерекшелігі — берілген
реакцияның жылу эффектісі таңбасымен қоса энтальпия түрінде Δ Н
(дельта аш) жеке көрсетіледі.
6 слайд
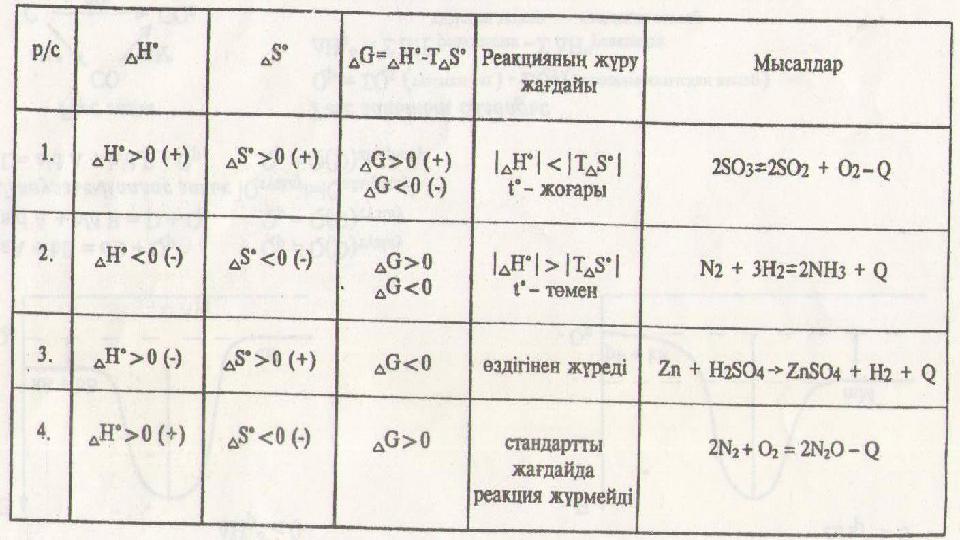
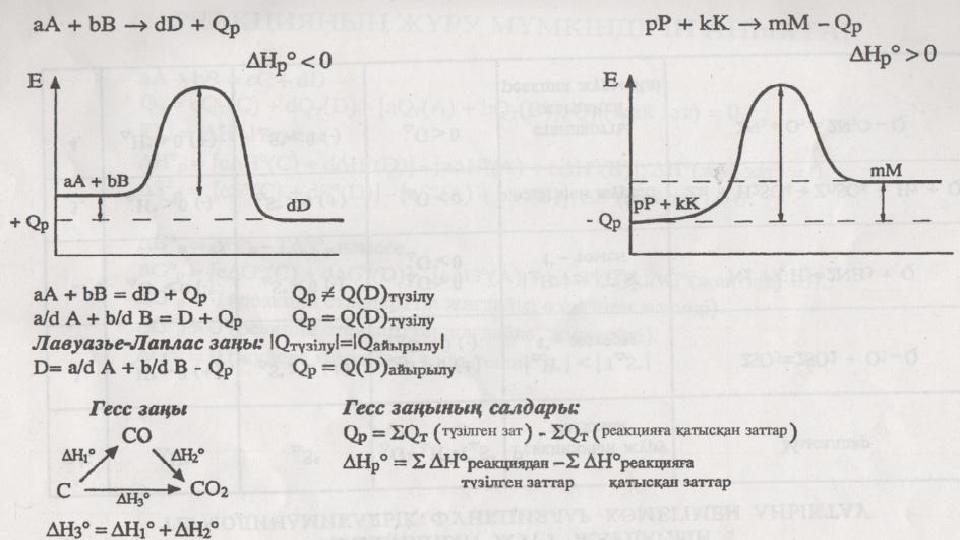
ЖЫЛУ ЭФФЕКТІСІМЕН СИПАТТАЛАТЫН РЕАКЦИЯЛАР • Кез келген химиялық құбылысты , яғни химиялық айналуларды сипаттайтын реакциялар реагенттердің өнімдерге айналуын көрсетумен қатар олардың жылу эффектісін белгілеуге міндетті . Осыған бола жылу беле жүретін реакцияларды экзотермиялық, ал жылу сіңіре жүретіндерді эндотермиялық деп саралайтынын білесіңдер. Оларды арнайы термохимиялық теңдеулермен өрнектейді. Термохимиялық теңдеудің ерекшелігі — берілген реакцияның жылу эффектісі таңбасымен қоса энтальпия түрінде Δ Н (дельта аш) жеке көрсетіледі.

#7 слайд
ҚАЙТЫМДЫЛЫҒЫМЕН СИПАТТАЛАТЫН
РЕАКЦИЯЛАР
•
Бір бағытта жүретін қайтымсыз және қарама-қарсы бағытта жүретін
қайтымды реакцияларды бұрыннан білесіңдер.
•
Қайтымсыз реакция кезінде реагенттер өзара түгелдей әрекеттесіп,
өнімдерге айналады, оған ацетиленнің жануы мысал бола алады:
7 слайд
ҚАЙТЫМДЫЛЫҒЫМЕН СИПАТТАЛАТЫН РЕАКЦИЯЛАР • Бір бағытта жүретін қайтымсыз және қарама-қарсы бағытта жүретін қайтымды реакцияларды бұрыннан білесіңдер. • Қайтымсыз реакция кезінде реагенттер өзара түгелдей әрекеттесіп, өнімдерге айналады, оған ацетиленнің жануы мысал бола алады:

#8 слайд
•
Химиялық реакциялардың жылдамдығын оқытатын бөлім химия лық
кинетика деп аталады. Реакция жыл -дамдығы бұл әрекеттесуші
заттардың белілі уақыт бірлігінде біреуінің концентрациясының
өзгеруі . 4.1. X имиялық реакцияның жылдамдығы
•
Химиялық реакцияның жылдамдығын зерттейтін химияның бөлі- мін-
химиялық кинетика деп атайды. Химиялық реакцияның жыл-
дамдығы деп уақыт бірлігінде әрекеттесетін заттардың немесе
ре акция өнімдерінің біреуінің концентрацияларының өзгеруін ай
тады .Бұл кезде реакцияға қатысатын зат қандай болса да бәрібір:
олардың барлығы өзара реакция тендеуімен байланысқан, сондықтан
олардың біреуінің концентрациясының өзгеруі бойынша қалғандары
ның концентрациясының өзгеруі туралы айтуға болады.Әдетте кон
центрация моль/л,ал уақыт секундпен немесе минутпен өрнектеледі.
8 слайд
• Химиялық реакциялардың жылдамдығын оқытатын бөлім химия лық кинетика деп аталады. Реакция жыл -дамдығы бұл әрекеттесуші заттардың белілі уақыт бірлігінде біреуінің концентрациясының өзгеруі . 4.1. X имиялық реакцияның жылдамдығы • Химиялық реакцияның жылдамдығын зерттейтін химияның бөлі- мін- химиялық кинетика деп атайды. Химиялық реакцияның жыл- дамдығы деп уақыт бірлігінде әрекеттесетін заттардың немесе ре акция өнімдерінің біреуінің концентрацияларының өзгеруін ай тады .Бұл кезде реакцияға қатысатын зат қандай болса да бәрібір: олардың барлығы өзара реакция тендеуімен байланысқан, сондықтан олардың біреуінің концентрациясының өзгеруі бойынша қалғандары ның концентрациясының өзгеруі туралы айтуға болады.Әдетте кон центрация моль/л,ал уақыт секундпен немесе минутпен өрнектеледі.
#9 слайд
9 слайд
#10 слайд
10 слайд

#11 слайд
11 слайд
#12 слайд
12 слайд
#13 слайд
13 слайд
#14 слайд
14 слайд
#15 слайд
15 слайд
#16 слайд
16 слайд
#17 слайд
17 слайд

#18 слайд
ХИМИЯЛЫҚ РЕАКЦИЯНЫҢ
ЖЫЛДАМДЫҒЫ
•
Химиялық реакцияның жылдамдығын және оған әсер ететін факторларды (температура,
концентрация, қысым, жанасу бетінің аумағы, катализатор) зерттейтін химияның саласы химиялық
кинетика деп аталады.
•
Химиялық реакциялардың жүру заңдылықтарымен танысу үшін мынадай түсініктерге және
заңдарға анықтама берейік:
•
фаза
•
гомогенді және гетерогенді жүйелер мен реакциялар
•
химиялық реакциялардың жылдамдығы
•
әрекеттесуші массалар заңы
•
Вант-Гофф ережесі
•
катализ
•
катализатор.
•
Фаза – гетерогенді (әртүрлі) жүйенің біртекті бөлігі. Мысалы, О˚С су үш агрегаттық күйде болып:
мұз, су мен бу – үш фазадан тұратын гетерогенді жүйе түзеді: қатты фаза – мұз, сұйық – су және
газтекті фаза – бу.
18 слайд
ХИМИЯЛЫҚ РЕАКЦИЯНЫҢ ЖЫЛДАМДЫҒЫ • Химиялық реакцияның жылдамдығын және оған әсер ететін факторларды (температура, концентрация, қысым, жанасу бетінің аумағы, катализатор) зерттейтін химияның саласы химиялық кинетика деп аталады. • Химиялық реакциялардың жүру заңдылықтарымен танысу үшін мынадай түсініктерге және заңдарға анықтама берейік: • фаза • гомогенді және гетерогенді жүйелер мен реакциялар • химиялық реакциялардың жылдамдығы • әрекеттесуші массалар заңы • Вант-Гофф ережесі • катализ • катализатор. • Фаза – гетерогенді (әртүрлі) жүйенің біртекті бөлігі. Мысалы, О˚С су үш агрегаттық күйде болып: мұз, су мен бу – үш фазадан тұратын гетерогенді жүйе түзеді: қатты фаза – мұз, сұйық – су және газтекті фаза – бу.

#19 слайд
ӘРЕКЕТТЕСУШІ МАССАЛАР ЗАҢЫ :
•
химиялық реакцияның жылдамдығы әрекеттесуші заттардың
концентрацияларының көбейтіндісіне тура пропорционал.
•
Мұнда А, В, С, D – газ және сұйық күйдегі заттар, ал а, в, с, d –
реакция теңдеудегі стехиометриялық коэффициенттер.
19 слайд
ӘРЕКЕТТЕСУШІ МАССАЛАР ЗАҢЫ : • химиялық реакцияның жылдамдығы әрекеттесуші заттардың концентрацияларының көбейтіндісіне тура пропорционал. • Мұнда А, В, С, D – газ және сұйық күйдегі заттар, ал а, в, с, d – реакция теңдеудегі стехиометриялық коэффициенттер.

#20 слайд
ОРЫНДАҒАН: Санжар Чаик
ТЕКСЕРГЕН: Кудайбергенова . З . М
20 слайд
ОРЫНДАҒАН: Санжар Чаик ТЕКСЕРГЕН: Кудайбергенова . З . М

шағым қалдыра аласыз
















