Назар аударыңыз. Бұл материалды сайт қолданушысы жариялаған. Егер материал сіздің авторлық құқығыңызды бұзса, осында жазыңыз. Біз ең жылдам уақытта материалды сайттан өшіреміз
Жақын арада сайт әкімшілігі сізбен хабарласады

Бонусты жинап картаңызға (kaspi Gold, Halyk bank) шығарып аласыз


Открытый урок. Кислород, получение, свойства, применение. 8-класс
Дипломдар мен сертификаттарды алып үлгеріңіз!


Материалдың толық нұсқасын
жүктеп алып көруге болады
|
1.Урок: Кислород, получение, свойства, применение. Практическая работа №3 «Получение кислорода и изучение его свойств» |
2.Акжарская средняя школа |
|||||||||||||||
|
3.Дата: |
4.ФИО учителя: Бегимкулова А.А. |
|||||||||||||||
|
5.Класс: 8б |
6.Количество присутствующих: |
отсутствующих: |
||||||||||||||
|
Цели обучения, которые достигаются на данном уроке |
8.4.2.3 -уметь получать кислород и изучать его свойства и применение |
|||||||||||||||
|
Цели урока каторым способствует данный урок |
- Продолжить формирование представления о кислороде как химическом элементе и простом веществе. - Рассмотреть получение, физические и химические свойства кислорода. - Познакомить с применением и круговоротом кислорода в природе. - Продолжить формирование научно-материалистического мировоззрения на основе изучения свойств кислорода. - Воспитывать интерес к предмету на основе связи с жизнью. - Развивать умения анализировать, делать выводы |
|||||||||||||||
|
Языковая цель/яхзык предмета |
Языковые цели Учащиеся могут: используя специальную лексику сформулировать вопросы и ответить на них касательно процентное содержание ксилорода в составе воздуха. Предметная лексика и терминология Элементы, газы, земная кора, кислород, атмосфера, процентное соотношение, компонент |
|||||||||||||||
|
Критерии оценивания |
|
|||||||||||||||
|
Привитие ценностей
|
Открытость. Все обсууждения и деятельность реализуются открыто, учащиеся делятся своими знаниями и открытиями с соклассниками Уважение. Деятельность на уроке реализуется в условиях самоуважения, учащеися выслушивают друг-друга, смело высказывают свое мнение Сотрудничество. Учащиеся выполняют практическую, групповые работы в тесном сотрудничестве, совместно . Обучение на протяжении всей жизни. Учащиеся знают как применять имеющиеся знания и навыки, понимают актуальность приобретения новых знаний. |
|||||||||||||||
|
|
|
|||||||||||||||
|
Межпредметные связи |
Физика, биология |
|||||||||||||||
|
Предварительные знания |
7.2В Воздух. Реакция горения 8.2С Знакомство с энергией химических реакций 8.1В Формулы веществ и уравнения химических реакций |
|||||||||||||||
|
|
||||||||||||||||
|
Запланированные этапы урока |
Ход урока |
Ресурсы |
||||||||||||||
|
Начало урока Вводно-мотивационный этап (5 минут) |
Вездесущий, всемогущий и невидимый — это все о нем. Еще он не имеет ни вкуса, ни запаха. Создается впечатление, что разговор идет о том, чего вообще не существует. Однако это вещество есть, мало того: без него человечество попросту задохнулось бы. Поэтому, наверное, Лавуазье с ходу назвал этот газ «жизненным газом». Вопрос: О каком веществе идет речь и почему ученый так назвал его? (Учащиеся определяют тему урока).
Рассказ учителя: Знаете ли вы: Все растения Земли в течение года создают около 3 триллионов тонн кислорода. Люди вдыхают более 6 млрд. тонн кислорода в год.Около 2/3 человеческого тела содержит кислород, и клетки тела не могут существовать без него.За сутки здоровый человек в спокойном состоянии прокачивает через легкие 7200л воздуха, безвозвратно забирая из атмосферы около 1500 л кислорода Стратегия «ЗХУ»
Что бы вы хотели узнать про кислород? (положение в ПСХЭ, аллотропия, нахождение в природе, применение, получение, свойствафизические и химические) Как видите, у вас получились разные ответы. Исходя из данных утверждений, определите цель урока. (Изучить кислород как элемент и простое вещество) 1.4 Актуализация прежних знаний Что называется химическим элементом? Найдите элемент кислорода в ПСХЭ и запишите его. Что такое простое вещество? Чем оно отличается от сложного? Запишите формулу вещества кислорода. Простое оно или сложное? 1.5 Распределение на микрогруппы (на перемене)
|
слайд |
||||||||||||||
|
Середина урока Информационно-операциональный (30 минут)
|
Каждой группе выдается задание, с которым они работают в течение 15 минут. По истечении времени каждая группа защищает (20 минут) оформленный постер (4 минуты на группу).
1 группа. 1. История открытия. Общая характеристика химического элемента кислорода на основе его положения в ПСХЭ. Прочитайте текст и выполните задания.
Стратегия «PISA-партнер» Прочитайте текст и ответьте на вопросы. Кислород - самый распространенный элемент на Земле. Он входит в состав всех окружающих нас веществ. Так, например, вода, песок, многие горные породы и минералы, составляющие зеленую кору, содержат кислород. Кислород является важной частью многих органических соединений, например, белков, жиров и углеводов, имеющих исключительно большое значение в жизни человека. В 1772 году шведский химик Шееле установил, что воздух состоит из кислорода и азота. В 1774 году английский химик Д. Пристли разложением оксида ртути получил кислород и изучил его свойства. В 1777 году француз А. Лавуазье объяснил процессы дыхания и горения, как взаимодействие веществ с окислителем кислородом. Название элемента – оксигениум (рождающий кислоты) – дал Лавуазье. Кислород – бесцветный газ, без вкуса, запаха, мало растворим в воде, тяжелее воздуха. Кислород энергично реагирует со многими веществами, при этом выделяется теплота и свет. Такие реакции называются горением. Для того, чтобы горение началось, необходимы два условия: 1) нагревание горючего вещества до температуры воспламенения; 2) доступ кислорода. Для прекращения горения необходимо исключить хотя бы одно из условий. Применение кислорода основано на его химических свойствах. В больших количествах кислород используют в разных отраслях химической промышленности, в металлургии, в ракетных двигателях, в медицине и т. д. Пополняют запас кислорода в атмосфере зеленые растения.
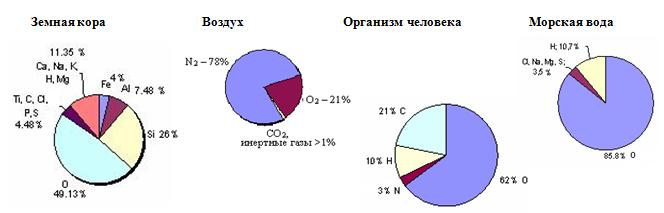
Кислород в природе
Сравните диаграммы, показывающие содержание кислорода в природе. Объясните и аргументируйте на основе критического анализа, как вы распределите содержание кислорода по оболочкам Земли в порядке убывания его массы. Стратегия «Иерархия бриллиантов»: Перечислите области применения кислорода, начиная с самой важнейшей по мере убывания значимости.
3 группа Физические свойства кислорода. Охрана атмосферы. Прочитайте текст и ответьте на вопросы. Задание 1 Впервые состав воздуха был установлен французским ученым Лавуазье. Он нагрел ртуть в определенном объеме воздуха. Объем воздуха сократился, а ртуть покрылась налетом оранжевого света, оставшийся газ не поддерживал ни горения, ни дыхания. Тогда Лавуазье собрал с поверхности ртути оранжевые чешуйки, поместил их в пробирку, сильно нагрел и собрал выделившийся газ. Смешав собранный газ с остатками газа из первого опыта, он получил смесь газов, ничем не отличающуюся от воздуха. Разъясните опыт Лавуазье. Приведите уравнение тех реакций, которые он воспользовался для определения состава воздуха. Ответ: 2Hg + O2 = 2HgO Объем воздуха сократился, т.к. кислород взаимодействует с ртутью при нагревании. Налет оранжевого цвета – оксид ртути II. Оставшийся газ, который не поддерживает ни горение, ни дыхание – азот. 2HgO = 2Hg + O2 При разложении оксида ртути образуется кислород, вот почему при смешивании собранного газа с остатками газа из первого опыта, он получил смесь газов, ничем не отличающуюся от воздуха. Задание 2 «Доктор Окс (повесть Ж.Верна «Опыт доктора Окса») … не пользовался марганцовокислым натрием по методу Тессье дю Мотэ, а попросту разлагал слегка подкисленную воду с помощью изобретенной им батареи… Электрический ток проходил сквозь большие чаны, наполненные водой, которая разлагалась на составные элементы, кислород и водород». Запишите уравнение реакций получения кислорода, о которых упоминается в данном отрывке из повести. Ответ: 2NaMnO4 = Na 2MnO4 + MnO4 + O2 марганцевокислый марганат оксид кислород натрий натрия марганца (перманганат натрия) Способ Тессье дю Мотэ - разложение перманганата натрия при нагревании. 2H 2O = 2H2 + O2 вода водород кислород
Воду подкисляют для активизации процесса гидролиза Задание 3 Используя диаграмму, определите массу кислорода в своем организме. Ответ:Организм человека содержит в своем составе хим. элемента кислорода – 62%. Необходимо массу своего тела умножить на массовую долу элемента кислорода в организме человека. m(O) = m тела чел * 0.62 m(O) = (m тела чел. * 0,62%)/ 100% Задание 4 Жизненная емкость легких человека составляет 3 500 см3. Определите объем кислорода, содержащегося в том объеме воздуха, который человек вдыхает за 1 час, если совершает 16 вдохов в минуту. Ответ: Дано: Решение: Vлегких = 3500см3 Vвоздуха = 3500см2 * 16 вдох./мин.* 60 мин. = = 3360*103 см3 N = 16 вдох./мин (объем воздуха за 1 час дыхания) Vкислорода в воздухе 21% V(O2) - ? V (O2) = (3360*103 cм3 * 21%) / 100% = 705600 см3 Ответ: за час человек вдыхает 705600 см3 кислорода Задание 5 В своем произведении «Унесенные ветром» Митчелл М. описывает сцену тушения пожара: «… сухой, как трут, осиновый пол мгновенно занялся, заглатывая огонь, как воду… Она (Скарлет) сунула ковер в бадью и, набрав побольше воздуха в легкие, ринулась в темную от дыма кухню, плотно захлопнув за собою дверь. Целую, как ей показалось, вечность она, кашляя, задыхаясь, кружилась по кухне, била и била мокрым ковром по струйкам огня, змеившимся вокруг нее». Правильно ли поступила героиня? Объясните ее действия. Ответ: Скарлет поступила правильно, смочив ковер в воде. Для того чтобы прекратить горение, необходимо либо охладить вещество ниже температуры воспламенения, либо перекрыть к нему доступ кислорода. Она выполнила оба условия. Плотно закрыла дверь, вода охлаждает горячие предметы, ее пары затрудняют к ним доступ кислорода воздуха. Кроме того, температура снизилась за счет того, что часть теплоты расходовалось на нагревание ковра, что довольно быстро понижало температуру в помещении в целом.
3. ЛО № 4: «Получение кислорода разложением пероксида водорода в присутствии катализатора» При комнатной температуре пероксид водорода разлагается медленно (признаков протекания реакции мы не видим), но этот процесс можно ускорить, если добавить в раствор несколько крупинок оксида марганца(IV). Вещества, которые ускоряют реакцию, но не расходуются в реакции, называют катализаторами. Используя химическую посуду у вас на столах, получите кислород, соберите и докажите его наличие.
|
Материал ұнаса әріптестеріңізбен бөлісіңіз
Ашық сабақ, ҚМЖ, көрнекілік, презентация
жариялап табыс табыңыз!
Материалдарыңызды сатып, ақша табыңыз.
(kaspi Gold, Halyk bank)
Ресми байқаулар тізімі
Республикалық байқауларға қатысып жарамды дипломдар алып санатыңызды көтеріңіз!
Материал іздеу Сіз үшін 400 000 ұстаздардың еңбегі мен тәжірибесін біріктіріп, ең үлкен материалдар базасын жасадық. Төменде пәніңізді белгілеп, керек материалды алып сабағыңызға қолдана аласыз Барлығы 663 959 материал жиналған
Ұқсас материалдар  Дайын ҚМЖ. Барлық пәндерден 2024-2025 оқу жылына, жаңа бұйрыққа сай жасалған Дайын ҚМЖ. Барлық пәндерден 2024-2025 оқу жылына, жаңа бұйрыққа сай жасалғанСертификатталған тренер жасаған
ҚР Білім және Ғылым министірлігінің стандарты бойынша жасалған.
Барлық пәндер Барлық материалдар Барлық сыныптар
Аттестацияда (ПББ) 100% келетін тақырыптармен дайындаймыз Аттестацияда (ПББ) келетін тақырыптар бойынша жасалған тесттермен дайындалып, бізбен бірге тестілеуден оңай өтесіз Өткен жылы бізбен дайындалған ұстаздар 50/50 жинап рекорд жасады Толығырақ | ||||||||||||||


 Масса земной коры оценивается в 2,8·1019
тонн. Суммарная масса всего населения мира составляет 287 миллионов
тонн.
Масса земной коры оценивается в 2,8·1019
тонн. Суммарная масса всего населения мира составляет 287 миллионов
тонн.