

Аммиак және оның қосылыстары
Дипломдар мен сертификаттарды алып үлгеріңіз!



1 слайд
Аммиак Аммиак
және оның және оның
қосылыстарықосылыстары
1 слайд
Аммиак Аммиак және оның және оның қосылыстарықосылыстары
2 слайд
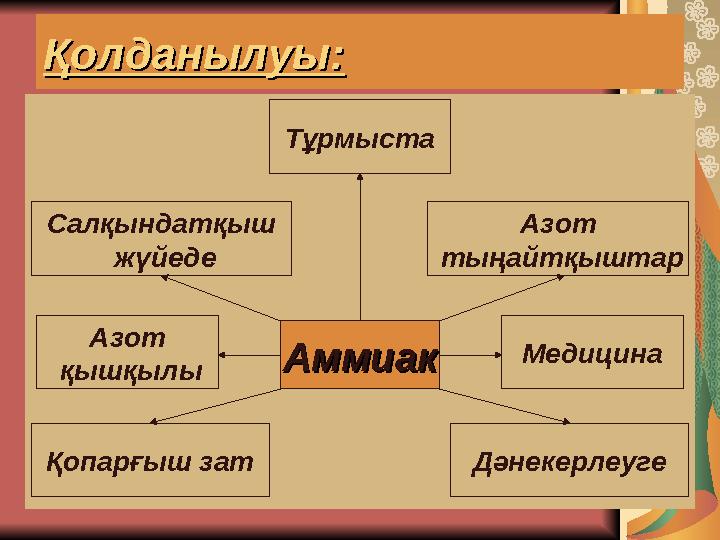
Қолданылуы:Қолданылуы:
АммиакАммиак
Салқындатқыш
жүйеде
Азот
қышқылы
Медицина
Азот
тыңайтқыштар
ДәнекерлеугеҚопарғыш зат
Тұрмыста
2 слайд
Қолданылуы:Қолданылуы: АммиакАммиак Салқындатқыш жүйеде Азот қышқылы Медицина Азот тыңайтқыштар ДәнекерлеугеҚопарғыш зат Тұрмыста
3 слайд
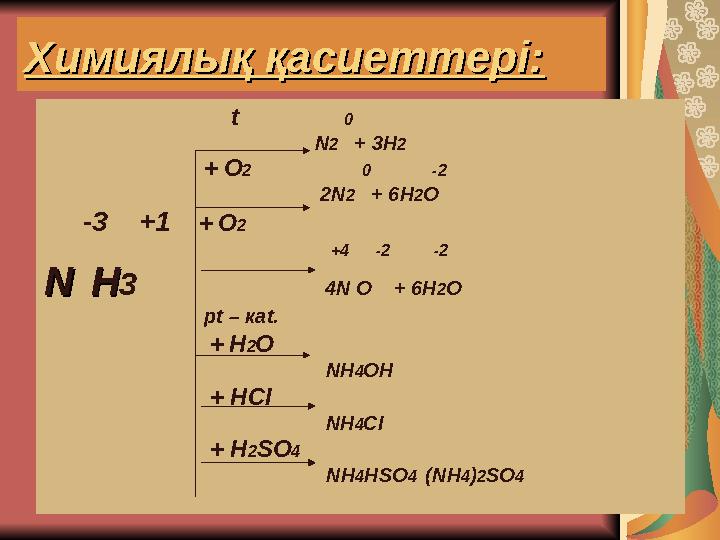
Химиялық қасиеттері:Химиялық қасиеттері:
t 0
N2 + 3Н2
+ О2 0 -2
2N2 + 6Н2О
-3 +1 + О2
+4 -2 -2
NN НН3 4N О + 6Н2О
рt – каt.
+ Н2О
NН4ОН
+ НСІ
NН4СІ
+ Н2SО4
NН4НSО4 (NН4)2SО4
3 слайд
Химиялық қасиеттері:Химиялық қасиеттері: t 0 N2 + 3Н2 + О2 0 -2 2N2 + 6Н2О -3 +1 + О2 +4 -2 -2 NN НН3 4N О + 6Н2О рt – каt. + Н2О NН4ОН + НСІ NН4СІ + Н2SО4 NН4НSО4 (NН4)2SО4

4 слайд
Физикалық қасиеттері:Физикалық қасиеттері:
Г Т NН3
А И Мl = 17
З У ДАУА = 0,59
+ 1 v Н2О → 700 V NН3
р>
NН3 (газ) → NН3 (сұйық)
4 слайд
Физикалық қасиеттері:Физикалық қасиеттері: Г Т NН3 А И Мl = 17 З У ДАУА = 0,59 + 1 v Н2О → 700 V NН3 р> NН3 (газ) → NН3 (сұйық)

5 слайд
Алынуы:Алынуы:
1. Өндірісте: N2 + 3Н2 → 2NН3 + Q
0
t = 400 – 500 С
р = 30 + 100 мПа
КАТАЛИЗАТОР: Алюминий және калий
оксиді қосылған темір ұнтағы.
2. ЗЕРТХАНАДА:
t
2NН4СІ + Са(ОН)2 → СаСІ2 + 2Н2О + 2NН3↑
5 слайд
Алынуы:Алынуы: 1. Өндірісте: N2 + 3Н2 → 2NН3 + Q 0 t = 400 – 500 С р = 30 + 100 мПа КАТАЛИЗАТОР: Алюминий және калий оксиді қосылған темір ұнтағы. 2. ЗЕРТХАНАДА: t 2NН4СІ + Са(ОН)2 → СаСІ2 + 2Н2О + 2NН3↑
6 слайд
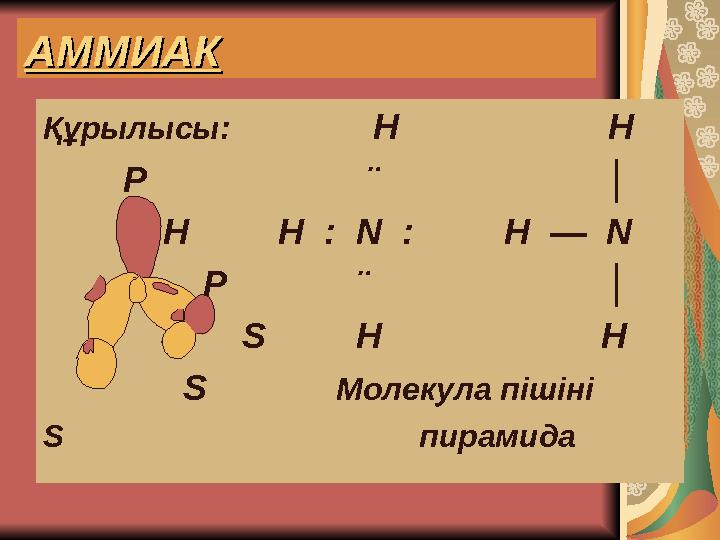
АММИАКАММИАК
Құрылысы: Н Н
Р ¨ │
Н Н : N : Н — N
Р ¨ │
S Н Н
S Молекула пішіні
S пирамида
6 слайд
АММИАКАММИАК Құрылысы: Н Н Р ¨ │ Н Н : N : Н — N Р ¨ │ S Н Н S Молекула пішіні S пирамида



