Ашық сабаққа презентация "Күкірт және оның қосылыстары. Галогендер"
Ашық сабаққа презентация "Күкірт және оның қосылыстары. Галогендер"


#1 слайд
Сабақтың тақырыбы:
“Күкірт және оның
қосылыстары.
Галогендер”
1 слайд
Сабақтың тақырыбы: “Күкірт және оның қосылыстары. Галогендер”
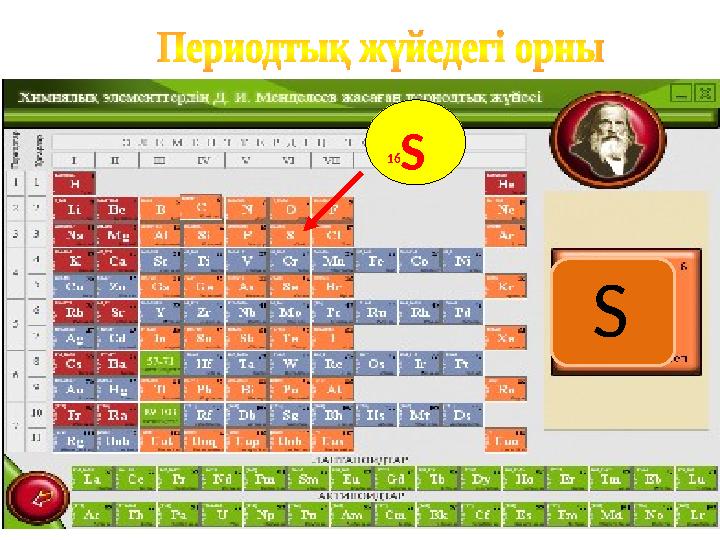
#2 слайд
16S
S
2 слайд
16S S

#3 слайд
Физикалық қасиеттері
Күкірт оңай ұнтақталады және суда
ерімейді.Бірақ органикалық еріткіштерде
(бензин,спирт ) аздап ериді.Сары түсті
күкіртті суға салсақ,оның бетіне қалқып
шығады.Күкіртті одан әрі қыздырса,қоңыр
түсті буға айналады.
3 слайд
Физикалық қасиеттері Күкірт оңай ұнтақталады және суда ерімейді.Бірақ органикалық еріткіштерде (бензин,спирт ) аздап ериді.Сары түсті күкіртті суға салсақ,оның бетіне қалқып шығады.Күкіртті одан әрі қыздырса,қоңыр түсті буға айналады.

#4 слайд
Химиялық қасиеттері
Cu + S =
H
2
+ S =
S + O
2
=
S + O
2
=
P + S =
S + C =
S + HNO
3
=
S + KOH =
4 слайд
Химиялық қасиеттері Cu + S = H 2 + S = S + O 2 = S + O 2 = P + S = S + C = S + HNO 3 = S + KOH =

#5 слайд
Кү
кір
т –
м а
кр
о
эле
м е
нт,
а қ
у ы
зд
ың
не
гіз
гі
ко
м п
о н
е н
ті.
К
ү
кі
рт
ке
ш
а
ш
,
ке
ра
т
и
н,
в
и
та
м
и
н
В
1
б
а
й.
Та
з а р
ты
лға
н
кү
кір
тті
–
те
р і
ау
ру
ла
р ы
на
м а
й
тү
р ін
д е
ж а
ға
д ы
,
а с
қа з
а н
т а ғ
а м
д ы
Қо
р ы
тп
а ға
нд
а
іш
ед і
.
Кү
кір
т
б а
р
а м
ин
қы
шқ
ыл
д а
р ы
(ц
ис
те
ин,
)
а ғз
а н
ы
р а
д и
а ц
ия
д а
н
қо
р ғ
а й
д ы
,
а ғз
а д
а
су т
е к
ио
нд
а р
ын
т а
с ы
м а
лд
а й
д ы
.
5 слайд
Кү кір т – м а кр о эле м е нт, а қ у ы зд ың не гіз гі ко м п о н е н ті. К ү кі рт ке ш а ш , ке ра т и н, в и та м и н В 1 б а й. Та з а р ты лға н кү кір тті – те р і ау ру ла р ы на м а й тү р ін д е ж а ға д ы , а с қа з а н т а ғ а м д ы Қо р ы тп а ға нд а іш ед і . Кү кір т б а р а м ин қы шқ ыл д а р ы (ц ис те ин, ) а ғз а н ы р а д и а ц ия д а н қо р ғ а й д ы , а ғз а д а су т е к ио нд а р ын т а с ы м а лд а й д ы .

#6 слайд
Қолданылуы
6 слайд
Қолданылуы
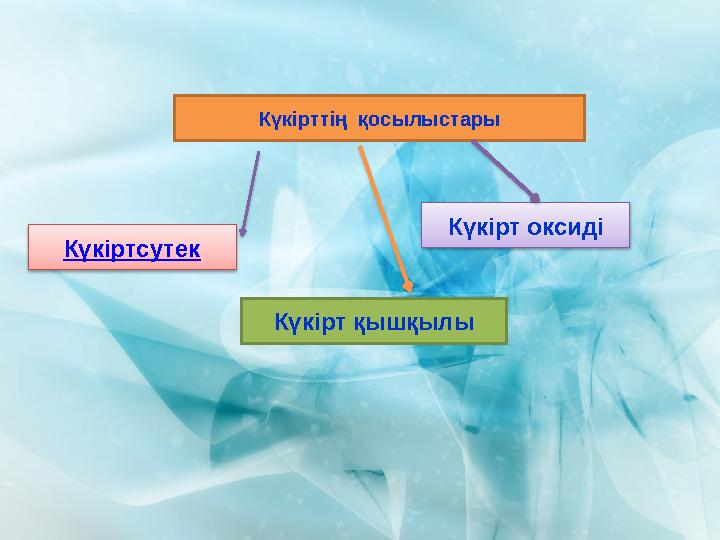
#7 слайд
Күкірттің қосылыстары
Күкіртсутек
Күкірт қышқылы
Күкірт оксиді
7 слайд
Күкірттің қосылыстары Күкіртсутек Күкірт қышқылы Күкірт оксиді

#8 слайд
Күкіртсутек H
2S
шіріген жұмыртқа йісті,түссіз газ.
-60°с-та сұйық күйге ауысады, ал -86° с-та қатады.
Күкіртсутек табиғатта жанартау атқылағандағы
газдардың құрамында,емдік қасиеті бар минерал
суларда кездеседі
Мұнай және табиғи газдармен жиі бірге жүреді
Күкіртсутек тыныс алғанда гемоглобинмен
байланысып,сал ауруын туғызады.
Күкіртсутекпен уланған адамды тез арада таза
ауаға шығару керек.
8 слайд
Күкіртсутек H 2S шіріген жұмыртқа йісті,түссіз газ. -60°с-та сұйық күйге ауысады, ал -86° с-та қатады. Күкіртсутек табиғатта жанартау атқылағандағы газдардың құрамында,емдік қасиеті бар минерал суларда кездеседі Мұнай және табиғи газдармен жиі бірге жүреді Күкіртсутек тыныс алғанда гемоглобинмен байланысып,сал ауруын туғызады. Күкіртсутекпен уланған адамды тез арада таза ауаға шығару керек.

#9 слайд
КҮКІРТ ҚЫШҚЫЛЫ Н2SO4
•Күкірт қышқылы-түссіз, майлы сұйықтық
•Кейде оны “купорос майы” деп атайды (ертеде темір
купоросын FeSO
4
•7H
2
O қыздыру арқылы алған)
•Күкірт қышқылы суда жақсы ериді. Еру кезінде көп
мөлшерде жылу бөлінеді
•Ауадан және басқа газдардан су буын жақсы тартады
Күкірт қышқылы жан-жақты қолданылуы бойынша бірінші
орында тұр. Оны химия өнеркәсібінің “наны” деп санайды,
себебі басқа қышқылдарды алуда, мұнай өнімдерін
тазалауда, қант өндірісінде, өсімдік майын тазалауда,
газдарды құрғатуда, сода, бояу өндірісінде қолданылады.
Негізгі химиялық өнеркәсіпте күкірт қышқылы
тыңайтқыштар алуда қолданылады
9 слайд
КҮКІРТ ҚЫШҚЫЛЫ Н2SO4 •Күкірт қышқылы-түссіз, майлы сұйықтық •Кейде оны “купорос майы” деп атайды (ертеде темір купоросын FeSO 4 •7H 2 O қыздыру арқылы алған) •Күкірт қышқылы суда жақсы ериді. Еру кезінде көп мөлшерде жылу бөлінеді •Ауадан және басқа газдардан су буын жақсы тартады Күкірт қышқылы жан-жақты қолданылуы бойынша бірінші орында тұр. Оны химия өнеркәсібінің “наны” деп санайды, себебі басқа қышқылдарды алуда, мұнай өнімдерін тазалауда, қант өндірісінде, өсімдік майын тазалауда, газдарды құрғатуда, сода, бояу өндірісінде қолданылады. Негізгі химиялық өнеркәсіпте күкірт қышқылы тыңайтқыштар алуда қолданылады

#10 слайд
Заттарды
ағарту
Тағамдарды
сақтау
Тұз,қышқыл алу
Көкөніс
қоймасын
ыстау
SO
2
Ыстау — сақтау мерзімін
ұлғайту үшін
10 слайд
Заттарды ағарту Тағамдарды сақтау Тұз,қышқыл алу Көкөніс қоймасын ыстау SO 2 Ыстау — сақтау мерзімін ұлғайту үшін
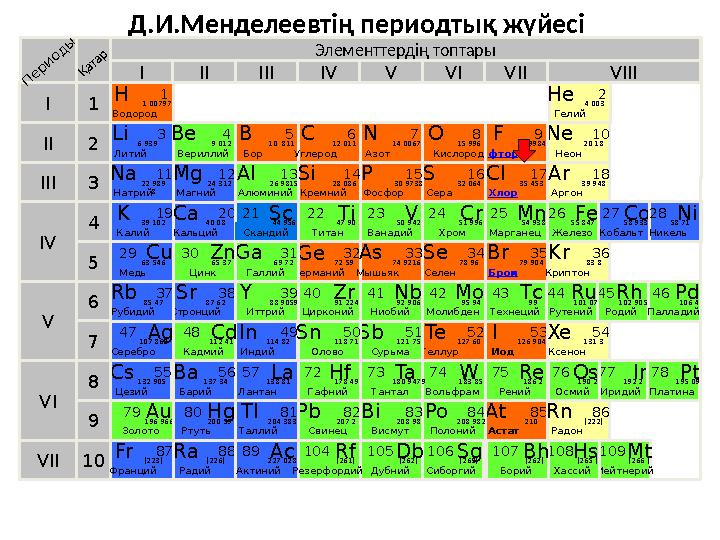
#11 слайд
Д.И.Менделеевтің периодтық жүйесі
Элементтердің топтары
I IIIII VIIIIV V VI VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
10
Li
Литий
3
6,939
П
е
р
и
о
д
ы
Қ
а т а р
K
Калий
19
39.102
Na
Натрий
11
22,989
8
Cu
Медь
29
63.546
В
Бор
5
10 .811
Ne
Неон
10
20,18
Be
Вериллий
4
9,012
Ca
Кальций
20
40,08
Ag
Серебро
47
107.868
Ra
Радий
88
[226]
La
Лантан
57
138.81
Al
Алюминий
13
26,9815
O
Кислород
8
15.996
N
Азот
7
14.0067
Ge
Германий
32
72.59
C
Углерод
6
12,011
F
фтор
9
18.9984
Br
Бром
35
79.904
H
Водород
1
1.00797
Se
Селен
34
78.96
I
Иод
53
126.904
Cl
Хлор
17
35,453
As
Мышьяк
33
74.9216
He
Гелий
2
4,003
Ar
Аргон
18
39,948
Xe
Ксенон
54
131,3
Kr
Криптон
36
83,8
Te
Теллур
52
127.60
Fe
Железо
26
55.847
Mg
Магний
12
24,312
S
Сера
16
32,064
P
Фосфор
15
30,9738
Si
Кремний
14
28,086
Ti
Титан
22
47.90
Mo
Молибден
42
95.94
Tс
Технеций
43
99
V
Ванадий
23
50.942
Cr
Хром
24
51.996
Mn
Марганец
25
54.938
Sс
Скандий
21
44.956
Ga
Галлий
31
69.72
Re
Рений
75
186.2
Rh
Родий
45
102.905
Ir
Иридий
77
192.2
Ru
Рутений
44
101.07
Os
Осмий
76
190.2
Pt
Платина
78
195.09
Pd
Палладий
46
106.4
At
Астат
85
210
Rn
Радон
86
[222]
Mt
Мейтнерий
109
[266 ]
Hs
Хассий
108
[265 ]
Ba
Барий
56
137.34
Sr
Стронций
38
87.62
Rb
Рубидий
37
85.47
In
Индий
49
114.82
Cs
Цезий
55
132.905
Fr
Франций
87
[223]
9
8
Zn
Цинк
30
65.37
W
Вольфрам
74
183.85
Po
Полоний
84
208.982
Zr
Цирконий
40
91.224
Nb
Ниобий
41
92.906
Ta
Тантал
73
180.9479
Cd
Кадмий
48
112.41
Sb
Сурьма
51
121.75
Hf
Гафний
72
178.49
Sn
Олово
50
118.71
Pb
Свинец
82
207.2
Bi
Висмут
83
208.98
Co
Кобальт
27
58.933
Ni
Никель
28
58.71
Y
Иттрий
39
88.9059
Au
Золото
79
196.966
Tl
Таллий
81
204.383
Hg
Ртуть
80
200.59
Ac
Актиний
89
227.028
Bh
Борий
107
[262]
Sg
Сиборгий
106
[263]
Db
Дубний
105
[262]
Rf
Резерфордий
104
[261]
11 слайд
Д.И.Менделеевтің периодтық жүйесі Элементтердің топтары I IIIII VIIIIV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 10 Li Литий 3 6,939 П е р и о д ы Қ а т а р K Калий 19 39.102 Na Натрий 11 22,989 8 Cu Медь 29 63.546 В Бор 5 10 .811 Ne Неон 10 20,18 Be Вериллий 4 9,012 Ca Кальций 20 40,08 Ag Серебро 47 107.868 Ra Радий 88 [226] La Лантан 57 138.81 Al Алюминий 13 26,9815 O Кислород 8 15.996 N Азот 7 14.0067 Ge Германий 32 72.59 C Углерод 6 12,011 F фтор 9 18.9984 Br Бром 35 79.904 H Водород 1 1.00797 Se Селен 34 78.96 I Иод 53 126.904 Cl Хлор 17 35,453 As Мышьяк 33 74.9216 He Гелий 2 4,003 Ar Аргон 18 39,948 Xe Ксенон 54 131,3 Kr Криптон 36 83,8 Te Теллур 52 127.60 Fe Железо 26 55.847 Mg Магний 12 24,312 S Сера 16 32,064 P Фосфор 15 30,9738 Si Кремний 14 28,086 Ti Титан 22 47.90 Mo Молибден 42 95.94 Tс Технеций 43 99 V Ванадий 23 50.942 Cr Хром 24 51.996 Mn Марганец 25 54.938 Sс Скандий 21 44.956 Ga Галлий 31 69.72 Re Рений 75 186.2 Rh Родий 45 102.905 Ir Иридий 77 192.2 Ru Рутений 44 101.07 Os Осмий 76 190.2 Pt Платина 78 195.09 Pd Палладий 46 106.4 At Астат 85 210 Rn Радон 86 [222] Mt Мейтнерий 109 [266 ] Hs Хассий 108 [265 ] Ba Барий 56 137.34 Sr Стронций 38 87.62 Rb Рубидий 37 85.47 In Индий 49 114.82 Cs Цезий 55 132.905 Fr Франций 87 [223] 9 8 Zn Цинк 30 65.37 W Вольфрам 74 183.85 Po Полоний 84 208.982 Zr Цирконий 40 91.224 Nb Ниобий 41 92.906 Ta Тантал 73 180.9479 Cd Кадмий 48 112.41 Sb Сурьма 51 121.75 Hf Гафний 72 178.49 Sn Олово 50 118.71 Pb Свинец 82 207.2 Bi Висмут 83 208.98 Co Кобальт 27 58.933 Ni Никель 28 58.71 Y Иттрий 39 88.9059 Au Золото 79 196.966 Tl Таллий 81 204.383 Hg Ртуть 80 200.59 Ac Актиний 89 227.028 Bh Борий 107 [262] Sg Сиборгий 106 [263] Db Дубний 105 [262] Rf Резерфордий 104 [261]

#12 слайд
F Cl Br I
Фтор Хлор Бром Йод
Газ Газ Сұйық Қатты
12 слайд
F Cl Br I Фтор Хлор Бром Йод Газ Газ Сұйық Қатты
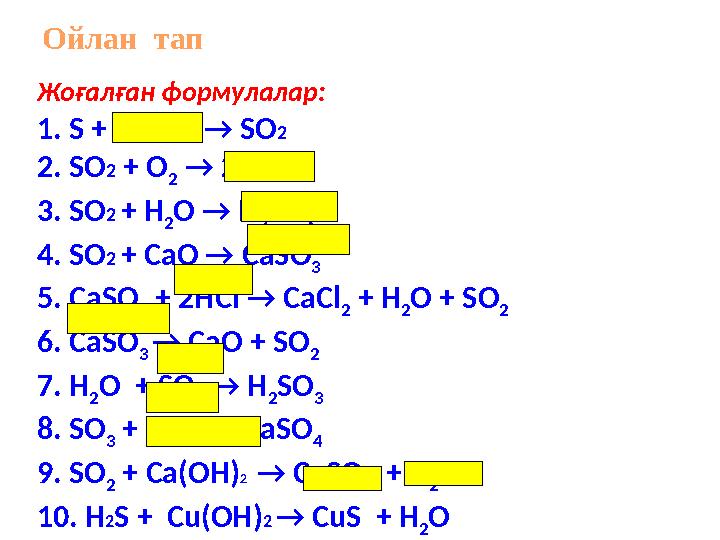
#13 слайд
Жоғалған формулалар:
1. S + O2 → SO2
2. SO2 + О
2 → 2 SO3
3. SO2 + Н
2О → Н
2SО
3
4. SO2 + СaО → СаSО
3
5. СаSО
3 + 2НСІ → СаСl
2 + Н
2О + SО
2
6. СаSО
3 → СаО + SО
2
7. Н
2О + SО
2 → Н
2SО
3
8. SО
3 + СaО → СаSО
4
9. SО
2 + Cа(OH)2 → СаSО
3 + Н
2О
10. H2S + Cu(OH)2 → СuS + Н
2О
Ойлан тап
13 слайд
Жоғалған формулалар: 1. S + O2 → SO2 2. SO2 + О 2 → 2 SO3 3. SO2 + Н 2О → Н 2SО 3 4. SO2 + СaО → СаSО 3 5. СаSО 3 + 2НСІ → СаСl 2 + Н 2О + SО 2 6. СаSО 3 → СаО + SО 2 7. Н 2О + SО 2 → Н 2SО 3 8. SО 3 + СaО → СаSО 4 9. SО 2 + Cа(OH)2 → СаSО 3 + Н 2О 10. H2S + Cu(OH)2 → СuS + Н 2О Ойлан тап

шағым қалдыра аласыз
















