Азот
Азот


#1 слайд
1 слайд
#2 слайд
Сабақтың мақсаты:
Білімділігі: Периодтық жүйедегі
азоттың орнына байланысты
оны V топ элементі ретінде
сипаттау; оқушыларды оның
физикалық – химиялық
қасиеттерімен таныстыру.
Тәрбиелігі: Дәстүрлі емес
оқыту әдісін қолдана
отырып,оқушылардың
химияға танымдық
қызығушылығын арттыру.
Дамытушылығы:
Оқушыларды өзіндік жұмысқа
дағдыландыру және
сараптау,салыстыру
қабілеттерін дамыту.Өзін-өзі
бақылау мен талдауды іске
асыру.
2 слайд
Сабақтың мақсаты: Білімділігі: Периодтық жүйедегі азоттың орнына байланысты оны V топ элементі ретінде сипаттау; оқушыларды оның физикалық – химиялық қасиеттерімен таныстыру. Тәрбиелігі: Дәстүрлі емес оқыту әдісін қолдана отырып,оқушылардың химияға танымдық қызығушылығын арттыру. Дамытушылығы: Оқушыларды өзіндік жұмысқа дағдыландыру және сараптау,салыстыру қабілеттерін дамыту.Өзін-өзі бақылау мен талдауды іске асыру.

#3 слайд
Сабақтың түрі:
Жаңа білімді меңгерту
Сабақтың өту әдісі:
Сын тұрғысынан ойлауды
дамыту технологиясы.
3 слайд
Сабақтың түрі: Жаңа білімді меңгерту Сабақтың өту әдісі: Сын тұрғысынан ойлауды дамыту технологиясы.

#4 слайд
Д.И.Менделеевтің периодтық жүйесі
Элементтердің топтары
I IIIII VIIIIV V VI VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
10
Li
Литий
3
6,939
П
е
р
и
о
д
ы
Қ
а т а
р
K
Калий
19
39.102
Na
Натрий
11
22,989
8
Cu
Медь
29
63.546
В
Бор
5
10 .811
Ne
Неон
10
20,18
Be
Вериллий
4
9,012
Ca
Кальций
20
40,08
Ag
Серебро
47
107.868
Ra
Радий
88
[226]
La
Лантан
57
138.81
Al
Алюминий
13
26,9815
O
Кислород
8
15.996
N
Азот
7
14.0067
Ge
Германий
32
72.59
C
Углерод
6
12,011
F
фтор
9
18.9984
Br
Бром
35
79.904
H
Водород
1
1.00797
Se
Селен
34
78.96
I
Иод
53
126.904
Cl
Хлор
17
35,453
As
Мышьяк
33
74.9216
He
Гелий
2
4,003
Ar
Аргон
18
39,948
Xe
Ксенон
54
131,3
Kr
Криптон
36
83,8
Te
Теллур
52
127.60
Fe
Железо
26
55.847
Mg
Магний
12
24,312
S
Сера
16
32,064
P
Фосфор
15
30,9738
Si
Кремний
14
28,086
Ti
Титан
22
47.90
Mo
Молибден
42
95.94
Tс
Технеций
43
99
V
Ванадий
23
50.942
Cr
Хром
24
51.996
Mn
Марганец
25
54.938
Sс
Скандий
21
44.956
Ga
Галлий
31
69.72
Re
Рений
75
186.2
Rh
Родий
45
102.905
Ir
Иридий
77
192.2
Ru
Рутений
44
101.07
Os
Осмий
76
190.2
Pt
Платина
78
195.09
Pd
Палладий
46
106.4
At
Астат
85
210
Rn
Радон
86
[222]
Mt
Мейтнерий
109
[266 ]
Hs
Хассий
108
[265 ]
Ba
Барий
56
137.34
Sr
Стронций
38
87.62
Rb
Рубидий
37
85.47
In
Индий
49
114.82
Cs
Цезий
55
132.905
Fr
Франций
87
[223]
9
8
Zn
Цинк
30
65.37
W
Вольфрам
74
183.85
Po
Полоний
84
208.982
Zr
Цирконий
40
91.224
Nb
Ниобий
41
92.906
Ta
Тантал
73
180.9479
Cd
Кадмий
48
112.41
Sb
Сурьма
51
121.75
Hf
Гафний
72
178.49
Sn
Олово
50
118.71
Pb
Свинец
82
207.2
Bi
Висмут
83
208.98
Co
Кобальт
27
58.933
Ni
Никель
28
58.71
Y
Иттрий
39
88.9059
Au
Золото
79
196.966
Tl
Таллий
81
204.383
Hg
Ртуть
80
200.59
Ac
Актиний
89
227.028
Bh
Борий
107
[262]
Sg
Сиборгий
106
[263]
Db
Дубний
105
[262]
Rf
Резерфордий
104
[261]
4 слайд
Д.И.Менделеевтің периодтық жүйесі Элементтердің топтары I IIIII VIIIIV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 10 Li Литий 3 6,939 П е р и о д ы Қ а т а р K Калий 19 39.102 Na Натрий 11 22,989 8 Cu Медь 29 63.546 В Бор 5 10 .811 Ne Неон 10 20,18 Be Вериллий 4 9,012 Ca Кальций 20 40,08 Ag Серебро 47 107.868 Ra Радий 88 [226] La Лантан 57 138.81 Al Алюминий 13 26,9815 O Кислород 8 15.996 N Азот 7 14.0067 Ge Германий 32 72.59 C Углерод 6 12,011 F фтор 9 18.9984 Br Бром 35 79.904 H Водород 1 1.00797 Se Селен 34 78.96 I Иод 53 126.904 Cl Хлор 17 35,453 As Мышьяк 33 74.9216 He Гелий 2 4,003 Ar Аргон 18 39,948 Xe Ксенон 54 131,3 Kr Криптон 36 83,8 Te Теллур 52 127.60 Fe Железо 26 55.847 Mg Магний 12 24,312 S Сера 16 32,064 P Фосфор 15 30,9738 Si Кремний 14 28,086 Ti Титан 22 47.90 Mo Молибден 42 95.94 Tс Технеций 43 99 V Ванадий 23 50.942 Cr Хром 24 51.996 Mn Марганец 25 54.938 Sс Скандий 21 44.956 Ga Галлий 31 69.72 Re Рений 75 186.2 Rh Родий 45 102.905 Ir Иридий 77 192.2 Ru Рутений 44 101.07 Os Осмий 76 190.2 Pt Платина 78 195.09 Pd Палладий 46 106.4 At Астат 85 210 Rn Радон 86 [222] Mt Мейтнерий 109 [266 ] Hs Хассий 108 [265 ] Ba Барий 56 137.34 Sr Стронций 38 87.62 Rb Рубидий 37 85.47 In Индий 49 114.82 Cs Цезий 55 132.905 Fr Франций 87 [223] 9 8 Zn Цинк 30 65.37 W Вольфрам 74 183.85 Po Полоний 84 208.982 Zr Цирконий 40 91.224 Nb Ниобий 41 92.906 Ta Тантал 73 180.9479 Cd Кадмий 48 112.41 Sb Сурьма 51 121.75 Hf Гафний 72 178.49 Sn Олово 50 118.71 Pb Свинец 82 207.2 Bi Висмут 83 208.98 Co Кобальт 27 58.933 Ni Никель 28 58.71 Y Иттрий 39 88.9059 Au Золото 79 196.966 Tl Таллий 81 204.383 Hg Ртуть 80 200.59 Ac Актиний 89 227.028 Bh Борий 107 [262] Sg Сиборгий 106 [263] Db Дубний 105 [262] Rf Резерфордий 104 [261]

#5 слайд
Азот
Азотты 1772 жылы ағылшын ғалымы Даниэль
Резерфорд ашқан. Жер қыртысындағы азоттың мөлшері 0.03%.
Табиғатта азот дербес және қосылыстар күйінде кездеседі және
негізгі қоры екі атомнан тұратын молекула түрінде ауа
құрамында болады. Азоттың ауадағы салмақ үлесі 75.6% ,
көлем үлесі 78.1%. Жер қыртысының 1 т массасына 1 кг
азоттан келеді, әрі ол бейорганикалық және органикалық
қосылыстар күйінде кездеседі. Оның бейорганикалық
қосылыстарының негізгілеріне натрий нитраты (чили селитрі),
калий нитраты (үнді селитрі) жатады. Органикалық
қосылыстар күйіндегі азоттың негізгі қоры барлық тірі
ағзалардың ақуыздарында құрамына кіреді. Кезінде жанбайтын
қасиетіне байланысты “тіршіліксіз” деп аталып кеткенімен азот
тіршілікке өте керек элемент. Қалыпты температурада азот
түссіз, иіссіз газ.Қайнау температурасы – 196 °C, қату
температурасы– 210 °C. Су бір өлшем көлемінде (20 °C-та)
0.0154 көлем азот ериді, яғни азоттың суда ерігіштігі оттектің
ерігігтігінен төмен. Ауадан аздап жеңіл болады.
5 слайд
Азот Азотты 1772 жылы ағылшын ғалымы Даниэль Резерфорд ашқан. Жер қыртысындағы азоттың мөлшері 0.03%. Табиғатта азот дербес және қосылыстар күйінде кездеседі және негізгі қоры екі атомнан тұратын молекула түрінде ауа құрамында болады. Азоттың ауадағы салмақ үлесі 75.6% , көлем үлесі 78.1%. Жер қыртысының 1 т массасына 1 кг азоттан келеді, әрі ол бейорганикалық және органикалық қосылыстар күйінде кездеседі. Оның бейорганикалық қосылыстарының негізгілеріне натрий нитраты (чили селитрі), калий нитраты (үнді селитрі) жатады. Органикалық қосылыстар күйіндегі азоттың негізгі қоры барлық тірі ағзалардың ақуыздарында құрамына кіреді. Кезінде жанбайтын қасиетіне байланысты “тіршіліксіз” деп аталып кеткенімен азот тіршілікке өте керек элемент. Қалыпты температурада азот түссіз, иіссіз газ.Қайнау температурасы – 196 °C, қату температурасы– 210 °C. Су бір өлшем көлемінде (20 °C-та) 0.0154 көлем азот ериді, яғни азоттың суда ерігіштігі оттектің ерігігтігінен төмен. Ауадан аздап жеңіл болады.

#6 слайд
1
2 3
4
5
6
7
Next
6 слайд
1 2 3 4 5 6 7 Next

#7 слайд
Азот атомының
электрондық
конфигурациясын
жаз.
Back
7 слайд
Азот атомының электрондық конфигурациясын жаз. Back

#8 слайд
Азот топшасына
кіретін
элементтер
саны?
Back
8 слайд
Азот топшасына кіретін элементтер саны? Back

#9 слайд
Азот қандай тотығу
дәрежелерін көрсетеді?
Back
9 слайд
Азот қандай тотығу дәрежелерін көрсетеді? Back

#10 слайд
Азоттың бес валентті
оксидіндегі көрсететін
тотығу дәрежесі?
Back
10 слайд
Азоттың бес валентті оксидіндегі көрсететін тотығу дәрежесі? Back

#11 слайд
Азот топшасы
орналасқан
топ нөмірі.
Back
11 слайд
Азот топшасы орналасқан топ нөмірі. Back

#12 слайд
Азоттың сутекті
қосылысының
атауы?
Back
12 слайд
Азоттың сутекті қосылысының атауы? Back

#13 слайд
Азот элементінің
атомдық массасы
қанша?
Back
13 слайд
Азот элементінің атомдық массасы қанша? Back

#14 слайд
14 слайд

#15 слайд
Табиғатта
таралуы
Ауада – 78,09%
Адам ағзасында – 3,1 %
(ақуыз, дәрумен, гармон)
Өсімдіктер (ион түрінде)
Топырақта – 0,01 – 0,04 %
Азот - өмір элементі
15 слайд
Табиғатта таралуы Ауада – 78,09% Адам ағзасында – 3,1 % (ақуыз, дәрумен, гармон) Өсімдіктер (ион түрінде) Топырақта – 0,01 – 0,04 % Азот - өмір элементі

#16 слайд
16 слайд
#17 слайд
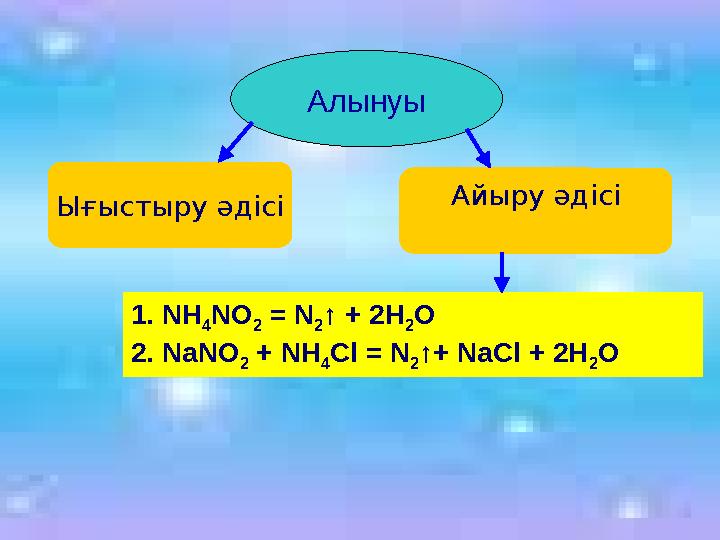
Алынуы
Ығыстыру әдісі
Айыру әдісі
1. NH
4
NO
2
= N
2
↑ + 2H
2
O
2. NaNO
2 + NH
4Cl = N
2↑+ NaCl + 2H
2O
17 слайд
Алынуы Ығыстыру әдісі Айыру әдісі 1. NH 4 NO 2 = N 2 ↑ + 2H 2 O 2. NaNO 2 + NH 4Cl = N 2↑+ NaCl + 2H 2O

#18 слайд
Физикалық
қасиеттері
Инертті газ
g = 1,25 г/л(қ.ж)
tб = -210
0
С
tқ = -195,8
0
С
Mr = 28
18 слайд
Физикалық қасиеттері Инертті газ g = 1,25 г/л(қ.ж) tб = -210 0 С tқ = -195,8 0 С Mr = 28
#19 слайд
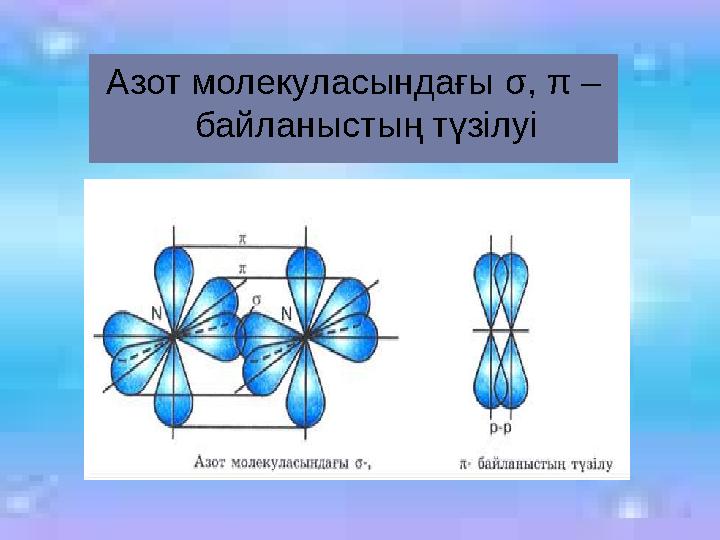
Азот молекуласындағы σ, π –
байланыстың түзілуі
19 слайд
Азот молекуласындағы σ, π – байланыстың түзілуі

#20 слайд
6Li = 2Li3N
2Al = 2AlN
N2 +
O2 = 2NO
3H2 =2NH3
20 слайд
6Li = 2Li3N 2Al = 2AlN N2 + O2 = 2NO 3H2 =2NH3
#21 слайд
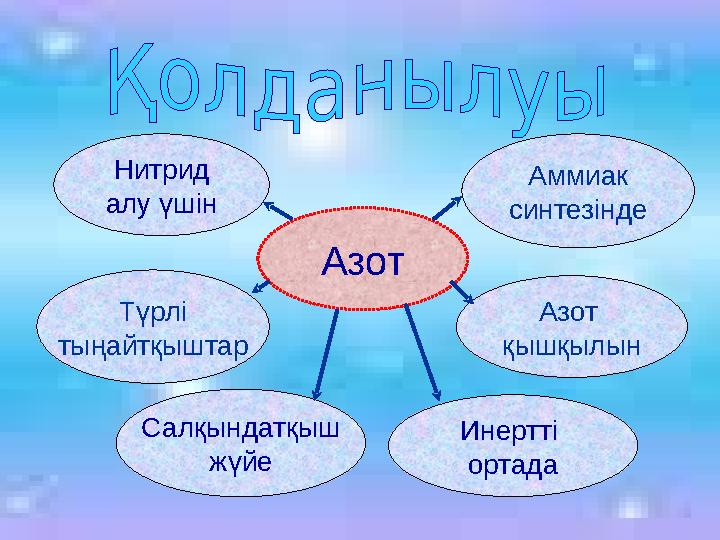
Азот
Нитрид
алу үшін
Түрлі
тыңайтқыштар
Аммиак
синтезінде
Азот
қышқылын
Салқындатқыш
жүйе
Инертті
ортада
21 слайд
Азот Нитрид алу үшін Түрлі тыңайтқыштар Аммиак синтезінде Азот қышқылын Салқындатқыш жүйе Инертті ортада

#22 слайд
Азоттың табиғаттағы айналымы
22 слайд
Азоттың табиғаттағы айналымы

#23 слайд
23 слайд
#24 слайд
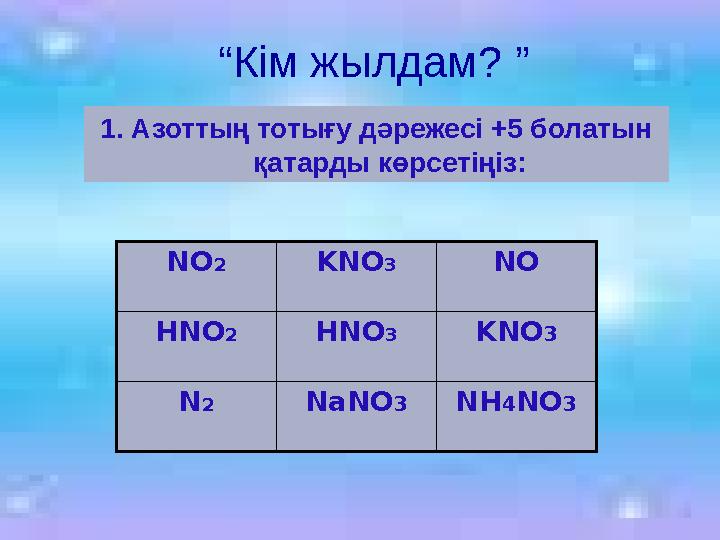
“Кім жылдам? ”
1. Азоттың тотығу дәрежесі +5 болатын
қатарды көрсетіңіз:
NO2 KNO3 NO
HNO2 HNO3 KNO3
N2 NaNO3NH4NO3
24 слайд
“Кім жылдам? ” 1. Азоттың тотығу дәрежесі +5 болатын қатарды көрсетіңіз: NO2 KNO3 NO HNO2 HNO3 KNO3 N2 NaNO3NH4NO3
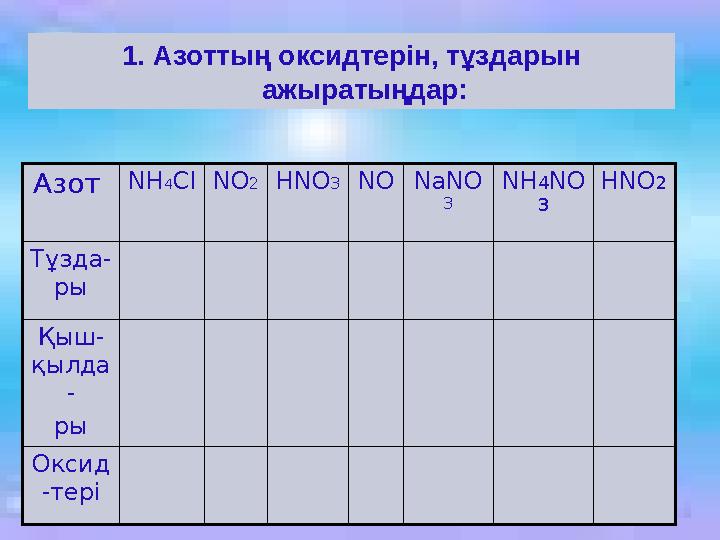
#25 слайд
1. Азоттың оксидтерін, тұздарын
ажыратыңдар:
Азот NH4ClNO2HNO3NONaNO
3
NH4NO
3
HNO2
Тұзда-
ры
Қыш-
қылда
-
ры
Оксид
-тері
25 слайд
1. Азоттың оксидтерін, тұздарын ажыратыңдар: Азот NH4ClNO2HNO3NONaNO 3 NH4NO 3 HNO2 Тұзда- ры Қыш- қылда - ры Оксид -тері

#26 слайд
Сергіту
сәті
26 слайд
Сергіту сәті

#27 слайд
27 слайд
#28 слайд
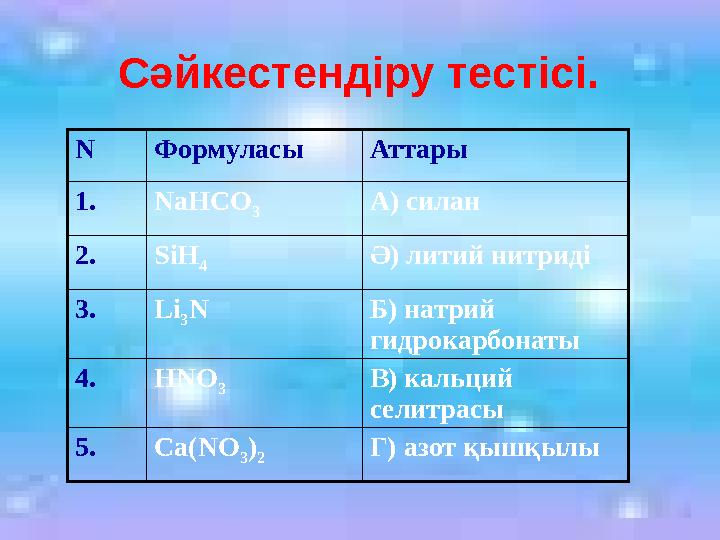
Сәйкестендіру тестісі.
N Формуласы Аттары
1.NaHСO
3
А) силан
2.SiH
4
Ә) литий нитриді
3.Li
3
N Б) натрий
гидрокарбонаты
4.HNO
3
В) кальций
селитрасы
5.Ca(NO
3)
2 Г) азот қышқылы
28 слайд
Сәйкестендіру тестісі. N Формуласы Аттары 1.NaHСO 3 А) силан 2.SiH 4 Ә) литий нитриді 3.Li 3 N Б) натрий гидрокарбонаты 4.HNO 3 В) кальций селитрасы 5.Ca(NO 3) 2 Г) азот қышқылы

#29 слайд
Үйге тапсырма:
§8.9. №7
29 слайд
Үйге тапсырма: §8.9. №7

шағым қалдыра аласыз
















