Химиялық байланыс және валенттілік
Химиялық байланыс және валенттілік


#1 слайд
Шахтинск қаласы Әлихан Бөкейханов атындағы мектеп-лицейі
Орындаған: химия пәні мұғалімі Тургунов Э.Т.
Химиялық байланыс және валенттілік
1 слайд
Шахтинск қаласы Әлихан Бөкейханов атындағы мектеп-лицейі Орындаған: химия пәні мұғалімі Тургунов Э.Т. Химиялық байланыс және валенттілік

#2 слайд
Мазмұны:
Кіріспе
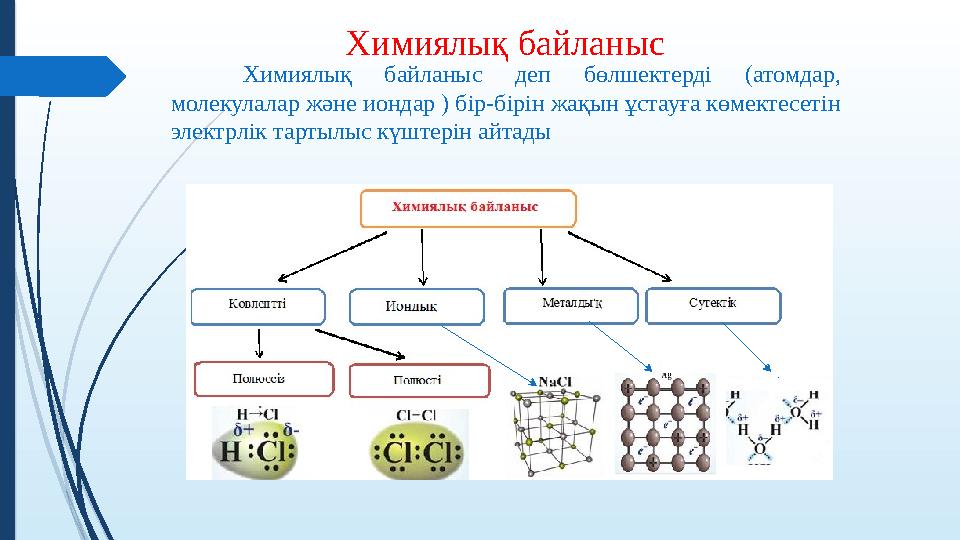
Химиялық байланыс
•а) Ковалентті байланыс
•ə) Иондық байланыс
•б) Донорлы – акцепторлы байланыс
•в) Металдық байланыс
•г) Сутектік байланыс
Заттың құрылысы
Валенттілік
Тотығу дəрежесі
Қорытынды
2 слайд
Мазмұны: Кіріспе Химиялық байланыс •а) Ковалентті байланыс •ə) Иондық байланыс •б) Донорлы – акцепторлы байланыс •в) Металдық байланыс •г) Сутектік байланыс Заттың құрылысы Валенттілік Тотығу дəрежесі Қорытынды

#3 слайд
Кіріспе
Химиялық байланысты оқып-үйренудің екі методикалық тəсілі кездеседі. Бірінші тəсіл –
химиялық байланыстың барлық түрлерін полюсті, полюссіз жəне донор-акцепторлы ковалентті,
иондық, металдық, сутектік байланыстарды бір тарауда оқытуды көздейді. Мұның кемшілігі
оқушылардың тірек білімі жеткіліксіз, кейбір байланысты (донор- акцепторлы ковалентті,
металдық, сутектік) саналы түсінетін деректі материалдар оқушыларға əлі белгісіз, оның үстіне
түсіндірілгеннен кейін ұзақ уақыт пайдаланылмай ұмыт болады.
Екінші тəсіл бойынша 8-сыныптағы арнайы тақырыпта тек ковалентті жəне иондық
байланыстарды қарастыру ұсынылады. Донор- акцепторлы байланыс 9- кластағы азот
тақырыбын, металдық байланыс металдардың құрылымы мен жалпы қасиеттерін өткенде
беріледі. Сутектік байланыс органикалық химияда талданады.
3 слайд
Кіріспе Химиялық байланысты оқып-үйренудің екі методикалық тəсілі кездеседі. Бірінші тəсіл – химиялық байланыстың барлық түрлерін полюсті, полюссіз жəне донор-акцепторлы ковалентті, иондық, металдық, сутектік байланыстарды бір тарауда оқытуды көздейді. Мұның кемшілігі оқушылардың тірек білімі жеткіліксіз, кейбір байланысты (донор- акцепторлы ковалентті, металдық, сутектік) саналы түсінетін деректі материалдар оқушыларға əлі белгісіз, оның үстіне түсіндірілгеннен кейін ұзақ уақыт пайдаланылмай ұмыт болады. Екінші тəсіл бойынша 8-сыныптағы арнайы тақырыпта тек ковалентті жəне иондық байланыстарды қарастыру ұсынылады. Донор- акцепторлы байланыс 9- кластағы азот тақырыбын, металдық байланыс металдардың құрылымы мен жалпы қасиеттерін өткенде беріледі. Сутектік байланыс органикалық химияда талданады.
#4 слайд
Химиялық байланыс
Химиялық байланыс деп бөлшектерді (атомдар,
молекулалар және иондар ) бір-бірін жақын ұстауға көмектесетін
электрлік тартылыс күштерін айтады
4 слайд
Химиялық байланыс Химиялық байланыс деп бөлшектерді (атомдар, молекулалар және иондар ) бір-бірін жақын ұстауға көмектесетін электрлік тартылыс күштерін айтады
#5 слайд
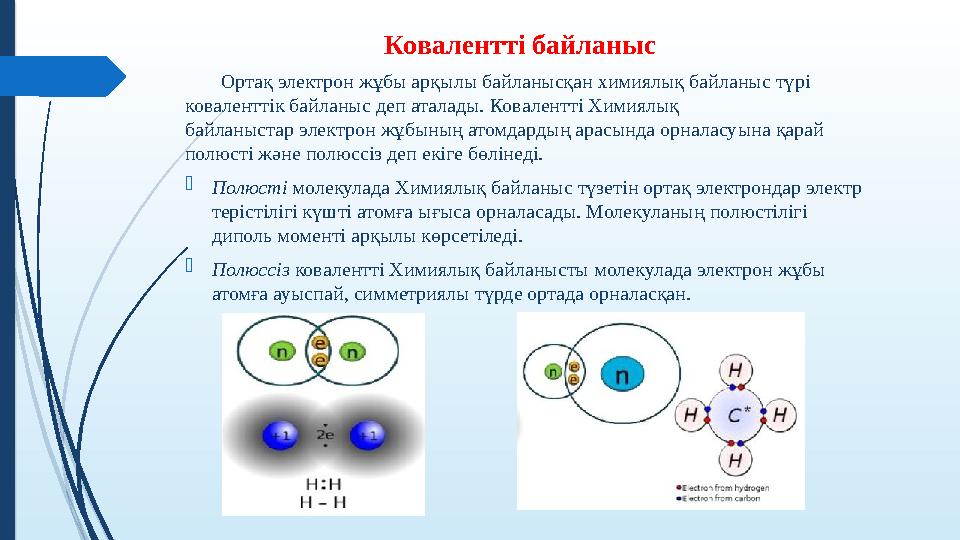
Ковалентті байланыс
Ортақ электрон жұбы арқылы байланысқан химиялық байланыс түрі
коваленттік байланыс деп аталады. Ковалентті Химиялық
байланыстар электрон жұбының атомдардың арасында орналасуына қарай
полюсті және полюссіз деп екіге бөлінеді.
Полюсті молекулада Химиялық байланыс түзетін ортақ электрондар электр
терістілігі күшті атомға ығыса орналасады. Молекуланың полюстілігі
диполь моменті арқылы көрсетіледі.
Полюссіз ковалентті Химиялық байланысты молекулада электрон жұбы
атомға ауыспай, симметриялы түрде ортада орналасқан.
5 слайд
Ковалентті байланыс Ортақ электрон жұбы арқылы байланысқан химиялық байланыс түрі коваленттік байланыс деп аталады. Ковалентті Химиялық байланыстар электрон жұбының атомдардың арасында орналасуына қарай полюсті және полюссіз деп екіге бөлінеді. Полюсті молекулада Химиялық байланыс түзетін ортақ электрондар электр терістілігі күшті атомға ығыса орналасады. Молекуланың полюстілігі диполь моменті арқылы көрсетіледі. Полюссіз ковалентті Химиялық байланысты молекулада электрон жұбы атомға ауыспай, симметриялы түрде ортада орналасқан.
#6 слайд
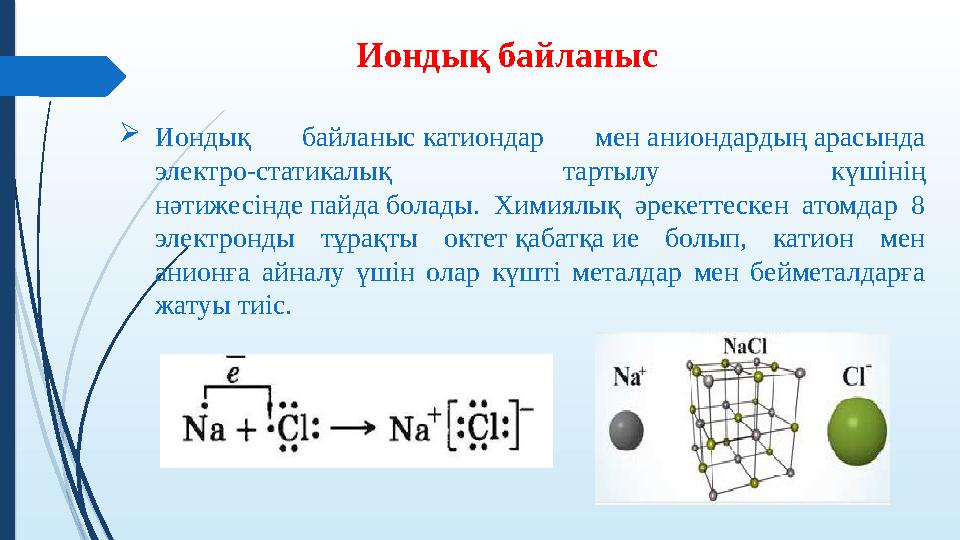
Иондық байланыс катиондар мен аниондардың арасында
электро-статикалық тартылу күшінің
нәтижесінде пайда болады. Химиялық әрекеттескен атомдар 8
электронды тұрақты октет қабатқа ие болып, катион мен
анионға айналу үшін олар күшті металдар мен бейметалдарға
жатуы тиіс.
Иондық байланыс
6 слайд
Иондық байланыс катиондар мен аниондардың арасында электро-статикалық тартылу күшінің нәтижесінде пайда болады. Химиялық әрекеттескен атомдар 8 электронды тұрақты октет қабатқа ие болып, катион мен анионға айналу үшін олар күшті металдар мен бейметалдарға жатуы тиіс. Иондық байланыс
#7 слайд
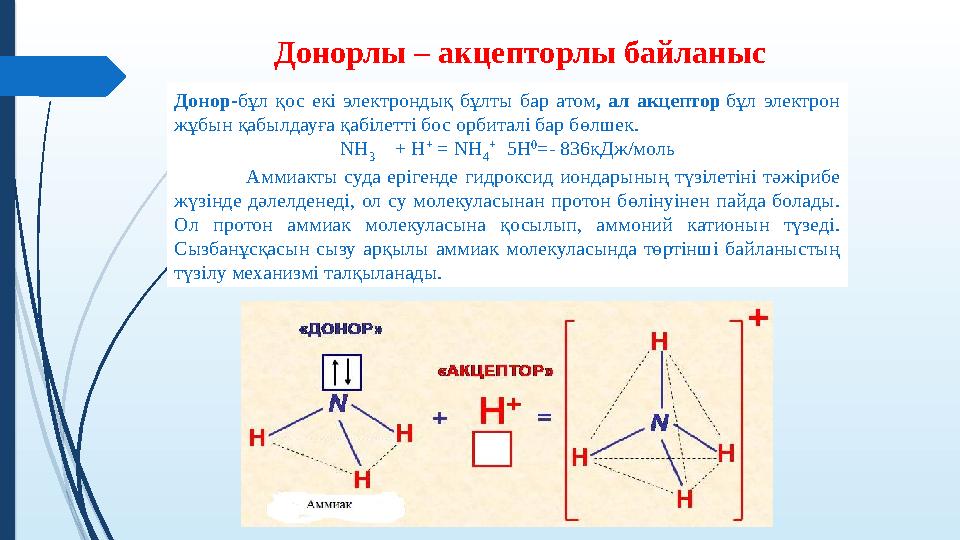
Донорлы – акцепторлы байланыс
Донор-бұл қос екі электрондық бұлты бар атом, ал акцептор бұл электрон
жұбын қабылдауға қабілетті бос орбиталі бар бөлшек.
NH
3
+ Н
+
= NH
4
+
5Н
0
=- 836кДж/моль
Аммиакты суда ерігенде гидроксид иондарының түзілетіні тəжірибе
жүзінде дəлелденеді, ол су молекуласынан протон бөлінуінен пайда болады.
Ол протон аммиак молекуласына қосылып, аммоний катионын түзеді.
Сызбанұсқасын сызу арқылы аммиак молекуласында төртінші байланыстың
түзілу механизмі талқыланады.
7 слайд
Донорлы – акцепторлы байланыс Донор-бұл қос екі электрондық бұлты бар атом, ал акцептор бұл электрон жұбын қабылдауға қабілетті бос орбиталі бар бөлшек. NH 3 + Н + = NH 4 + 5Н 0 =- 836кДж/моль Аммиакты суда ерігенде гидроксид иондарының түзілетіні тəжірибе жүзінде дəлелденеді, ол су молекуласынан протон бөлінуінен пайда болады. Ол протон аммиак молекуласына қосылып, аммоний катионын түзеді. Сызбанұсқасын сызу арқылы аммиак молекуласында төртінші байланыстың түзілу механизмі талқыланады.

#8 слайд
Металдық байланыс
Металдық байланыс та ортақ электрондар арқылы жүзеге асады,
бірақ олар белгілі бір атомдар арасында тұрақтанбаған. Металдық
байланыс кезінде электрондар босауынан оң зарядталған иондар
түзіледі, бірақ теріс иондар болмайды.
Металдық Химиялық байланыс —
металл атомдарының сыртқы қабатындағы
бос электрондар қатысуымен түзілетін
байланыс. Химиялық байланыс валенттік
электрондар арқылы жүзеге асады.
8 слайд
Металдық байланыс Металдық байланыс та ортақ электрондар арқылы жүзеге асады, бірақ олар белгілі бір атомдар арасында тұрақтанбаған. Металдық байланыс кезінде электрондар босауынан оң зарядталған иондар түзіледі, бірақ теріс иондар болмайды. Металдық Химиялық байланыс — металл атомдарының сыртқы қабатындағы бос электрондар қатысуымен түзілетін байланыс. Химиялық байланыс валенттік электрондар арқылы жүзеге асады.
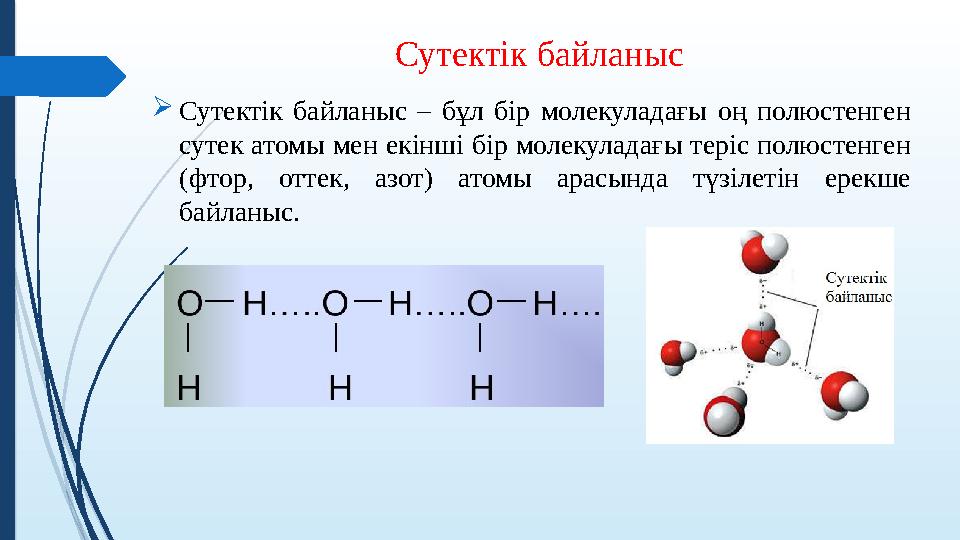
#9 слайд
Сутектік байланыс
Сутектік байланыс – бұл бір молекуладағы оң полюстенген
сутек атомы мен екінші бір молекуладағы теріс полюстенген
(фтор, оттек, азот) атомы арасында түзілетін ерекше
байланыс.
9 слайд
Сутектік байланыс Сутектік байланыс – бұл бір молекуладағы оң полюстенген сутек атомы мен екінші бір молекуладағы теріс полюстенген (фтор, оттек, азот) атомы арасында түзілетін ерекше байланыс.

#10 слайд
Валенттілік
Валенттілік – химиялық элемент атомының басқа химиялық
элементатомдарының белгілі бір санын қосып алу қабілеті.
Атомдар арасында химиялық байланыс түзуге қатысатын
электрондар валенттік электрондар деп атайды.
Валенттік электрондар сыртқы аяқталмаған деңгейдегі
электрондар жатады.
R
2O, RO, R
2O
3, RO
2, R
2O
5, RO
3, R
2O
7
RH
4, RH
3 , RH
2, RH
10 слайд
Валенттілік Валенттілік – химиялық элемент атомының басқа химиялық элементатомдарының белгілі бір санын қосып алу қабілеті. Атомдар арасында химиялық байланыс түзуге қатысатын электрондар валенттік электрондар деп атайды. Валенттік электрондар сыртқы аяқталмаған деңгейдегі электрондар жатады. R 2O, RO, R 2O 3, RO 2, R 2O 5, RO 3, R 2O 7 RH 4, RH 3 , RH 2, RH

#11 слайд
Тотығу дəрежесі
Тотығу дәрежесі – химиялық қосылысты тек иондардан тұрады деп
қарастырғанда әр атомда болатын шартты зарядтың сан шамасы. Кез
келген қосылысты ионды қосылыс деп қарастыруға болмайтындықтан,
Тотығу дәрежесу шартты түрде алынады. Тотығу дәрежесінің оң мәні (+)
берген электрон санын, ал теріс мәні (-) қосып алған электрон санын
көрсетеді.
Атомдардың терісэлектрлігіне жəне тотығу дəрежесіне сүеніп химиялық
формула құрудың алгоритмі түсіндіріледі:
терісэлектрлігінің өсуіне қарай элементтер таңбаларын жазу;
теріс тотығу дəрежесінің мəнін табу;
оң тотығу дəрежесін анықтау;
табылған тотығу дəрежелерінің ең кіші еселіктері бойынша индекстерді
есептеп шығару.
11 слайд
Тотығу дəрежесі Тотығу дәрежесі – химиялық қосылысты тек иондардан тұрады деп қарастырғанда әр атомда болатын шартты зарядтың сан шамасы. Кез келген қосылысты ионды қосылыс деп қарастыруға болмайтындықтан, Тотығу дәрежесу шартты түрде алынады. Тотығу дәрежесінің оң мәні (+) берген электрон санын, ал теріс мәні (-) қосып алған электрон санын көрсетеді. Атомдардың терісэлектрлігіне жəне тотығу дəрежесіне сүеніп химиялық формула құрудың алгоритмі түсіндіріледі: терісэлектрлігінің өсуіне қарай элементтер таңбаларын жазу; теріс тотығу дəрежесінің мəнін табу; оң тотығу дəрежесін анықтау; табылған тотығу дəрежелерінің ең кіші еселіктері бойынша индекстерді есептеп шығару.

#12 слайд
Қорытынды
Орта мектептің химия курсында химиялық байланыс,
валенттілік жəне тотығу дəрежелері арасындағы тəуелділік
нақтылы ашылмайды.
Методикалық əдебиеттерде валенттіліктің бүтін санмен рим
цифрлары арқылы белгіленетіні, таңбасы болмайтыны
айтылады.
Тотығу дəрежесінің оң, теріс жəне нөл , бөлшек сан түрінде
болып, араб цифрларымен көрсетілетініне назар аударылады.
Тағы бір ескертілетіні валенттілік пен тотығу дəрежесінің сан
мəндері сəйкес келуі де келмеуі де мүмкін
Валенттілік пен тотығу дəрежелерінің сан мəндеріндегі
үйлеспеушілікті түсіну үшін мұғалім үш түрлі валенттілік
болатынын есте ұстаған жөн.
12 слайд
Қорытынды Орта мектептің химия курсында химиялық байланыс, валенттілік жəне тотығу дəрежелері арасындағы тəуелділік нақтылы ашылмайды. Методикалық əдебиеттерде валенттіліктің бүтін санмен рим цифрлары арқылы белгіленетіні, таңбасы болмайтыны айтылады. Тотығу дəрежесінің оң, теріс жəне нөл , бөлшек сан түрінде болып, араб цифрларымен көрсетілетініне назар аударылады. Тағы бір ескертілетіні валенттілік пен тотығу дəрежесінің сан мəндері сəйкес келуі де келмеуі де мүмкін Валенттілік пен тотығу дəрежелерінің сан мəндеріндегі үйлеспеушілікті түсіну үшін мұғалім үш түрлі валенттілік болатынын есте ұстаған жөн.

шағым қалдыра аласыз
















