
Автор: Сарсенғали Перизат
Тақырыбы: Амин қышқылдары
Сынып: 11
Мақсаты: аминқышқылдарының жіктелуімен танысу, таңбалануы және классификациясын ажырату
Амин қышқылдары – түссіз кристалды заттар, суда жақсы ериді. Бір негізді амин қышқылдары бейтарап орта көрсетеді. Екі немесе бірнеше амин қышқылдарынан су бөлінгенде, түзілетін заттарды пептидтер деп атайды. Бұл жағдайда амин қышқылдарының арасында пептидтік байланыс пайда болады.
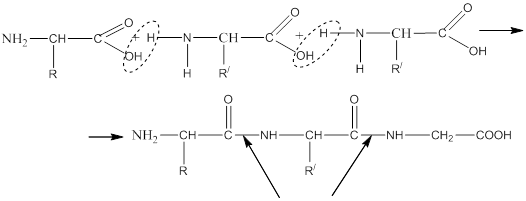
пептидтік байланыс
Егер пептидтер екі амин қышқылынан түзілсе дипептид, үшеуден түзілсе − трипептид, ол көп амин қышқылдарынан түзілсе – полипептид деп аталады. Пептидтердің аталуы қатысқан амин қышқылдарының атымен аталады және бірінші амин қышқылының атына «ил» жалғауы қосылады. Полипептидтердің құрылысы тізбекті болады, кез келген амин қышқылдары бір-бірімен әр түрлі қосыла алады.
Ақуыздар (белоктар) деп молекуласы бір-бірімен пептидтік байланыспен қосылған α- амин қышқылдарының 20-ға жуық түрінің қалдықтарынан құралған жоғары молекулалы қосылыстарды атайды. Ақуыздар организм құрамының ең маңыздысы, олар өсімдіктер мен жануарлардың клеткаларының протоплазмасында және ядросында болады. Ақуыз жоқ жерде тіршілік жоқ, ол – тіршіліктің негізгі нышаны.
Табиғатта ақуыздардың көптеген түрлері кездеседі. Олардың атқаратын функцияларына және қасиеттеріне байланысты молекулалық массалары бірнеше мыңнан бірнеше миллионға дейін барады. 1839 жылы Голландия ғалымы Мульдер ақуыздарды «протеин» деп атауды ұсынған.
Ақуыздар бұлшық еттердің, қанның, сүттін, жұмыртқаның, өсімдіктердің, жүннің, жібектің және шаштың құрамына кіреді. Барлық ақуыздардың химиялық құрамы шамамен мынадай:
|
С- 50- 55 % |
S- 0,2- 2,4 % |
Н- 6,5- 7,3 % |
|
О- 21,5- 23,5 % |
N- 15- 35 % |
Р- 0,8 % |
|
Ғе- 0,4 % |
|
|
Соңғы кезде ақуыздың құрамында басқа да элементтер (магний, кобальт, сынап, күміс, қорғасын, йод, мыс, т.б.) болатыны анықталған.
Кестеде аминқышқылдарының әрқайсысы үшін келесі сипаттамалар келтірілген:
- классификация (жеті класс);
- аты және қабылданған аббревиатура (алғашқы үш әріп үшін) (мысалы, гистидин үшін - His);
- ақуыздар тізбегін жазуға ыңғайлы бір әріптен тұратын белгі (гистидин үшін - H);
- бүйір тізбектің полярлығы (гистидин үшін +10,3) бұл мән неғұрлым жоғары болса, аминқышқылдарының молекуласы соғұрлым көп болады.
Диаграммада полярлық жоғарылаған сайын аминқышқылының атауы бар өрістің түсі сары тондардан жасыл түске көк түске өзгереді. Иондық бүйірлік тізбек топтары үшін pKa берілген (қызыл сандар).
Алифатты аминқышқылдарына глицин, аланин, валин, лейцин және изолейцин жатады. Бұл аминқышқылдары гетероатомдардың (N, O немесе S), циклдік топтардың бүйір тізбегінде жүрмейді және төмен полярлықпен сипатталады.
Құрамында күкірт бар аминқышқылдары – метионин және цистеин, сонымен қатар цистеин тек бөлінбеген күйде болады. Дисульфидті көпірлердің пайда болуына байланысты цистеин ақуыздардың кеңістіктік құрылымын тұрақтандырудың маңызды функциясын орындайды. Амин қышқылы цистин дисульфид көпірімен байланысқан екі цистеин қалдықтарынан тұрады.
Ароматты аминқышқылдарының құрамында мезомерлі (резонансты тұрақтандырылған) циклдер бар. Бұл топта тек фенилаланин төмен полярлықты көрсетеді. Тирозин мен триптофан айқын, ал гистидин тіпті жоғары полярлықпен сипатталады. Гистидиннің имидазол сақинасы рН-ның сәл қышқыл мәндерінде айтарлықтай протондалады. Сондықтан, тек протон түрінде ароматты қасиеттері бар гистидинді негізгі аминқышқылдарына жатқызуға болады. Тирозин мен триптофан 250 және 300 нм арасындағы спектрдің ультрафиолет аймақтарына қатты сіңеді.
Бейтарап аминқышқылдарының құрамында гидроксил (серин, треонин) немесе карбоксамид топтары (аспарагин, глутамин) бар. Амидтік топтар иондық емес болғанымен, аспарагин мен глутамин молекулалары жоғары полярлы.
Қышқылдық аминқышқылдарының бүйір тізбектерінің карбоксил топтары бар аспарагин және глутамин рН физиологиялық мәндерінің барлық диапазонында толығымен иондалған. Сол сияқты негізгі аминқышқылдарының – лизин мен аргининнің бүйір тізбектері рН бейтарап аймағында толығымен протондалған. Өте негізгі, сондықтан өте полярлы амин қышқылы-гуанидинді топтастыратын аргинин.
Пролин ерекше орын алады. Пролиннің бүйір тізбегі α-көміртегі атомы мен α-амин тобын қамтитын бес мүшелі циклден тұрады. Сондықтан, пролин, қатаң айтқанда, амин қышқылы емес имин қышқылы. Азот пен сақина атомы әлсіз негіз болып табылады және рН физиологиялық мәндерінде протондалмайды. Циклдік құрылымға байланысты пролин полипептидтік тізбектің иілуін тудырады, бұл коллаген құрылымы үшін өте маңызды.
Аталған аминқышқылдарының кейбіреуі адам ағзасында синтезделмейді және тамақпен бірге келуі керек.
|
Алифатты |
Глицин |
-2,4 |
Gly, G |
|
Аланин |
-1,9 |
Ala, A |
|
|
Валин |
-2,0 |
Val, V |
|
|
Лейцин |
-2,3 |
Leu, L |
|
|
Изолейцин |
-2,2 |
Ile, I |
|
|
Күкіртті |
Цистеин |
-1,2 |
Cys, C |
|
Метионин |
-1,5 |
Met, M |
|
|
Ароматты |
Фенилаланин |
+0,8 |
Phe, F |
|
Тирозин |
+6,1 |
Tyr, Y |
|
|
Триптофан |
+5,9 |
Trp, W |
|
|
Имин қышқылды |
Пролин |
+6,0 |
Pro, P |
|
Бейтарап |
Серин |
+5,1 |
Ser, S |
|
Треонин |
+4,9 |
Thr, T |
|
|
Аспарагин |
+9,7 |
Asn, N |
|
|
Глутамин |
+9,4 |
Gln, Q |
|
|
Қышқылдық |
Аспарагин қышқылы |
+11,0 |
Asp, D |
|
|
Глутамин қышқылы |
+10,2 |
Glu, E |
|
Негіздік |
Гистидин |
+10,3 |
His, H |
|
Лизин |
+15,0 |
Lys, K |
|
|
Аргинин |
+20,0 |
Arg, R |
Аминқышқылдарының биологиялық классификациясы
-
-
Алмастырылатын
Алмастырылмайтын
Глицин
Валин
Аланин
Лейцин
Цистеин
Изолейцин
Аспарагин қышқылы
Треонин
Глутамин қышқылы
Метионин
Тирозин
Фенилаланин
Пролин
Триптофан
Серин
Лизин
Аспарагин
Гистидин
Шартты түрде алмастырылмайтын
Глутамин
Аргинин
-
Өзін-өзі тексеру сұрақтары
1. Аминдердің номенклатурасы және структурасы.
2. Аминдердің физикалық қасиеттері.
3. Аминдердің химиялық қасиеттері. Аминдерді алу және қолданылуы.
4. Мына аминдердің формулаларын жазу керек: а) метилэтил амин; ә) диметил амин; б) анилин; в) 1,4-диаминобутан; г) метанитроанилин.
5. Амин құрамында 53,33% С, 31,11% N және 15,56% H болса, амин формуласы қандай болады?
6. Пара- нитротолуолға сутегімен (катализатор қатысында) әсер еткенде түзілетін заттың атын атап, формуласын жазу керек.
7. Амин қышқылдарын алу, қасиеттері. Ақуыз, қасиеттері.
жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
Аминқышқылдары. Атауы мен жіктелуі
Аминқышқылдары. Атауы мен жіктелуі
Автор: Сарсенғали Перизат
Тақырыбы: Амин қышқылдары
Сынып: 11
Мақсаты: аминқышқылдарының жіктелуімен танысу, таңбалануы және классификациясын ажырату
Амин қышқылдары – түссіз кристалды заттар, суда жақсы ериді. Бір негізді амин қышқылдары бейтарап орта көрсетеді. Екі немесе бірнеше амин қышқылдарынан су бөлінгенде, түзілетін заттарды пептидтер деп атайды. Бұл жағдайда амин қышқылдарының арасында пептидтік байланыс пайда болады.

пептидтік байланыс
Егер пептидтер екі амин қышқылынан түзілсе дипептид, үшеуден түзілсе − трипептид, ол көп амин қышқылдарынан түзілсе – полипептид деп аталады. Пептидтердің аталуы қатысқан амин қышқылдарының атымен аталады және бірінші амин қышқылының атына «ил» жалғауы қосылады. Полипептидтердің құрылысы тізбекті болады, кез келген амин қышқылдары бір-бірімен әр түрлі қосыла алады.
Ақуыздар (белоктар) деп молекуласы бір-бірімен пептидтік байланыспен қосылған α- амин қышқылдарының 20-ға жуық түрінің қалдықтарынан құралған жоғары молекулалы қосылыстарды атайды. Ақуыздар организм құрамының ең маңыздысы, олар өсімдіктер мен жануарлардың клеткаларының протоплазмасында және ядросында болады. Ақуыз жоқ жерде тіршілік жоқ, ол – тіршіліктің негізгі нышаны.
Табиғатта ақуыздардың көптеген түрлері кездеседі. Олардың атқаратын функцияларына және қасиеттеріне байланысты молекулалық массалары бірнеше мыңнан бірнеше миллионға дейін барады. 1839 жылы Голландия ғалымы Мульдер ақуыздарды «протеин» деп атауды ұсынған.
Ақуыздар бұлшық еттердің, қанның, сүттін, жұмыртқаның, өсімдіктердің, жүннің, жібектің және шаштың құрамына кіреді. Барлық ақуыздардың химиялық құрамы шамамен мынадай:
|
С- 50- 55 % |
S- 0,2- 2,4 % |
Н- 6,5- 7,3 % |
|
О- 21,5- 23,5 % |
N- 15- 35 % |
Р- 0,8 % |
|
Ғе- 0,4 % |
|
|
Соңғы кезде ақуыздың құрамында басқа да элементтер (магний, кобальт, сынап, күміс, қорғасын, йод, мыс, т.б.) болатыны анықталған.
Кестеде аминқышқылдарының әрқайсысы үшін келесі сипаттамалар келтірілген:
- классификация (жеті класс);
- аты және қабылданған аббревиатура (алғашқы үш әріп үшін) (мысалы, гистидин үшін - His);
- ақуыздар тізбегін жазуға ыңғайлы бір әріптен тұратын белгі (гистидин үшін - H);
- бүйір тізбектің полярлығы (гистидин үшін +10,3) бұл мән неғұрлым жоғары болса, аминқышқылдарының молекуласы соғұрлым көп болады.
Диаграммада полярлық жоғарылаған сайын аминқышқылының атауы бар өрістің түсі сары тондардан жасыл түске көк түске өзгереді. Иондық бүйірлік тізбек топтары үшін pKa берілген (қызыл сандар).
Алифатты аминқышқылдарына глицин, аланин, валин, лейцин және изолейцин жатады. Бұл аминқышқылдары гетероатомдардың (N, O немесе S), циклдік топтардың бүйір тізбегінде жүрмейді және төмен полярлықпен сипатталады.
Құрамында күкірт бар аминқышқылдары – метионин және цистеин, сонымен қатар цистеин тек бөлінбеген күйде болады. Дисульфидті көпірлердің пайда болуына байланысты цистеин ақуыздардың кеңістіктік құрылымын тұрақтандырудың маңызды функциясын орындайды. Амин қышқылы цистин дисульфид көпірімен байланысқан екі цистеин қалдықтарынан тұрады.
Ароматты аминқышқылдарының құрамында мезомерлі (резонансты тұрақтандырылған) циклдер бар. Бұл топта тек фенилаланин төмен полярлықты көрсетеді. Тирозин мен триптофан айқын, ал гистидин тіпті жоғары полярлықпен сипатталады. Гистидиннің имидазол сақинасы рН-ның сәл қышқыл мәндерінде айтарлықтай протондалады. Сондықтан, тек протон түрінде ароматты қасиеттері бар гистидинді негізгі аминқышқылдарына жатқызуға болады. Тирозин мен триптофан 250 және 300 нм арасындағы спектрдің ультрафиолет аймақтарына қатты сіңеді.
Бейтарап аминқышқылдарының құрамында гидроксил (серин, треонин) немесе карбоксамид топтары (аспарагин, глутамин) бар. Амидтік топтар иондық емес болғанымен, аспарагин мен глутамин молекулалары жоғары полярлы.
Қышқылдық аминқышқылдарының бүйір тізбектерінің карбоксил топтары бар аспарагин және глутамин рН физиологиялық мәндерінің барлық диапазонында толығымен иондалған. Сол сияқты негізгі аминқышқылдарының – лизин мен аргининнің бүйір тізбектері рН бейтарап аймағында толығымен протондалған. Өте негізгі, сондықтан өте полярлы амин қышқылы-гуанидинді топтастыратын аргинин.
Пролин ерекше орын алады. Пролиннің бүйір тізбегі α-көміртегі атомы мен α-амин тобын қамтитын бес мүшелі циклден тұрады. Сондықтан, пролин, қатаң айтқанда, амин қышқылы емес имин қышқылы. Азот пен сақина атомы әлсіз негіз болып табылады және рН физиологиялық мәндерінде протондалмайды. Циклдік құрылымға байланысты пролин полипептидтік тізбектің иілуін тудырады, бұл коллаген құрылымы үшін өте маңызды.
Аталған аминқышқылдарының кейбіреуі адам ағзасында синтезделмейді және тамақпен бірге келуі керек.
|
Алифатты |
Глицин |
-2,4 |
Gly, G |
|
Аланин |
-1,9 |
Ala, A |
|
|
Валин |
-2,0 |
Val, V |
|
|
Лейцин |
-2,3 |
Leu, L |
|
|
Изолейцин |
-2,2 |
Ile, I |
|
|
Күкіртті |
Цистеин |
-1,2 |
Cys, C |
|
Метионин |
-1,5 |
Met, M |
|
|
Ароматты |
Фенилаланин |
+0,8 |
Phe, F |
|
Тирозин |
+6,1 |
Tyr, Y |
|
|
Триптофан |
+5,9 |
Trp, W |
|
|
Имин қышқылды |
Пролин |
+6,0 |
Pro, P |
|
Бейтарап |
Серин |
+5,1 |
Ser, S |
|
Треонин |
+4,9 |
Thr, T |
|
|
Аспарагин |
+9,7 |
Asn, N |
|
|
Глутамин |
+9,4 |
Gln, Q |
|
|
Қышқылдық |
Аспарагин қышқылы |
+11,0 |
Asp, D |
|
|
Глутамин қышқылы |
+10,2 |
Glu, E |
|
Негіздік |
Гистидин |
+10,3 |
His, H |
|
Лизин |
+15,0 |
Lys, K |
|
|
Аргинин |
+20,0 |
Arg, R |
Аминқышқылдарының биологиялық классификациясы
-
-
Алмастырылатын
Алмастырылмайтын
Глицин
Валин
Аланин
Лейцин
Цистеин
Изолейцин
Аспарагин қышқылы
Треонин
Глутамин қышқылы
Метионин
Тирозин
Фенилаланин
Пролин
Триптофан
Серин
Лизин
Аспарагин
Гистидин
Шартты түрде алмастырылмайтын
Глутамин
Аргинин
-
Өзін-өзі тексеру сұрақтары
1. Аминдердің номенклатурасы және структурасы.
2. Аминдердің физикалық қасиеттері.
3. Аминдердің химиялық қасиеттері. Аминдерді алу және қолданылуы.
4. Мына аминдердің формулаларын жазу керек: а) метилэтил амин; ә) диметил амин; б) анилин; в) 1,4-диаминобутан; г) метанитроанилин.
5. Амин құрамында 53,33% С, 31,11% N және 15,56% H болса, амин формуласы қандай болады?
6. Пара- нитротолуолға сутегімен (катализатор қатысында) әсер еткенде түзілетін заттың атын атап, формуласын жазу керек.
7. Амин қышқылдарын алу, қасиеттері. Ақуыз, қасиеттері.

шағым қалдыра аласыз















