Дата _________
Класс: 9
Тема: Гидролиз
солей
Цель урока: научиться составлять химические реакции для определения
среды солей.
Задачи:
-
Образовательная: изучить химические реакции, характеризующие свойства
простых и сложных веществ.
-
Развивающая: развитие познавательных и мыслительных
процессов;
-
Воспитательная: формирование научной картины мира.
Тип урока: изучение нового материала
Оборудование: учебник, доска, мел, видеоролик: гидролиз.
Ход урока
I Организационно – мотивационный
этап.
-
Приветствие «Здравствуйте»
Учащиеся поочередно касаются одноименных пальцев рук своего соседа,
начиная с больших пальцев и говорят:
-
Психологический настрой учащихся. Повернитесь лицом к соседу, улыбнитесь и скажите
ему:
Я желаю тебе добра;
Если тебе будет трудно, я помогу.
-
Актуализация знаний.
Электролиз раствора нитрата меди(II):
Cu(NO3)2 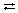 Cu2+ +
Cu2+ +
Н2O 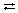 H+ + OH–;
H+ + OH–;
катод (–) (Cu2+;
Н+): Cu2+ +
2е =
Cu0,
анод (+) ( OН–):
OH– – е =
OH0,
4H0 = O2 + 2H2O;
2Cu(NO3)2 + 2H2O = 2Cu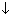 + O2
+ O2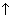 + 4HNO3.
+ 4HNO3.
4)Постановка проблемы:
Учащийся зачитывает стихотворение о воде, одновременно
просматривается учащимся видеоролик. Учитель задаёт вопрос: почему
было прочитано данное стихотворение? (примерный ответ учащихся: мы
сегодня, наверное, будем говорить о воде)
Стихотворение (читает ученица полностью наизусть, здесь
приводится только отрывок)
Безбрежная ширь океана
И
тихая заводь пруда
Струи
водопада
И
брызги фонтана
А в
сущности только вода…
II Операционно – исполнительный
этап.
-
Изучение нового материала.
Гидролиз – это
реакция обмена между некоторыми солями и водой приводящая к
образованию слабого электролита.
Проведение лабораторной работы № 2 Получение
гидроксидов и изучение их свойств и № 3 «Экспериментальное
подтверждение качественного состава кислот , оснований и солей»
(приложение 2,3).
2.Валеологическая пауза.
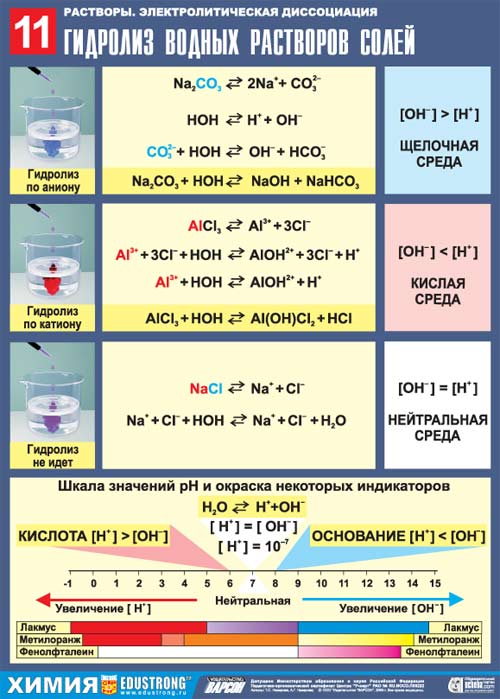
По
химической природе соли подразделяются на:
1.
сильное основание + сильная кислота
Гидролизу не подвергаются, реакция среды нейтральная
2.
сильное основание + слабая кислота
Гидролиз идет по аниону, реакция среды щелочная
3.
слабое основание + сильная кислота
Гидролиз идет по катиону, реакция среды кислая
4.
слабое основание + слабая кислота
Гидролизуется полностью, реакция среды нейтральная
Реакция
нейтрализации называется реакция взаимодействия сильных кислот с
сильными основаниями
III Рефлексивно –оценочный
этап.
1.Рефлексия ( устно 3 мин)
|
Что я знаю
|
Что я
узнал
|
Что я хочу узнать
|
|
|
|
|
2.Выставление оценок
3.Домашнее задание:












