

“Бейметалдар және олардың маңызды қосылыстары” тақырыбы бойынша есептер шығару
Дипломдар мен сертификаттарды алып үлгеріңіз!





1 слайд
“ Бейметалдар және олардың маңызды қосылыстары” тақырыбы
бойынша есептер шығару
9сынып Химия
П ән мұғалімі: М.Р.Макиева
1 слайд
“ Бейметалдар және олардың маңызды қосылыстары” тақырыбы бойынша есептер шығару 9сынып Химия П ән мұғалімі: М.Р.Макиева

2 слайд
Көміртек,ФОСФОР
күкірт
Периодтық жүйедегі орны және оның
қасиеттері
2 слайд
Көміртек,ФОСФОР күкірт Периодтық жүйедегі орны және оның қасиеттері

3 слайд
Сабақтың мақсаты:
Білімділік: Оқушыларға көміртек, фосфор,күкірттің
периодты жүйедегі орнына сипаттама берумен қатар
химиялық қасиеттерін сипаттайтын реакция теңдеулерін
жаздыру, ашылу тарихы жөніндегі мағлұматттармен
таныстыру және олардың химия өнеркәсібіндегі маңызына
түсінік беру.
Дамытушылық: Оқушылардың химиялық білімін одан әрі
дамыту, тез ойлауға, шапшаңдыққа , өз бетімен ізденуге
үйрету. Ой-өрісін, шығармашылық мүмкіндігін, ғылымы
көзқарасын қалыптастыру.
Тәрбиелік: Өздігінен талпынып, жауапкершілікті сезінетін
саналы, өнегелі ұрпақ тәрбиелеу .
3 слайд
Сабақтың мақсаты: Білімділік: Оқушыларға көміртек, фосфор,күкірттің периодты жүйедегі орнына сипаттама берумен қатар химиялық қасиеттерін сипаттайтын реакция теңдеулерін жаздыру, ашылу тарихы жөніндегі мағлұматттармен таныстыру және олардың химия өнеркәсібіндегі маңызына түсінік беру. Дамытушылық: Оқушылардың химиялық білімін одан әрі дамыту, тез ойлауға, шапшаңдыққа , өз бетімен ізденуге үйрету. Ой-өрісін, шығармашылық мүмкіндігін, ғылымы көзқарасын қалыптастыру. Тәрбиелік: Өздігінен талпынып, жауапкершілікті сезінетін саналы, өнегелі ұрпақ тәрбиелеу .

4 слайд
Көміртек, фосфор,күкірттің ашылу тарихы
Қазақстандағы көміртек, фосфор,күкірт өндіру
саласы
Көміртек, фосфор,күкірттің периодтық
жүйедегі орны
Табиғата таралуы,физикалық және химиялық
қасиеттері
Оларды алу және қолдану әдістері Үй тапсырмасы.
4 слайд
Көміртек, фосфор,күкірттің ашылу тарихы Қазақстандағы көміртек, фосфор,күкірт өндіру саласы Көміртек, фосфор,күкірттің периодтық жүйедегі орны Табиғата таралуы,физикалық және химиялық қасиеттері Оларды алу және қолдану әдістері Үй тапсырмасы.
5 слайд
Бейметалдар
С P S
5 слайд
Бейметалдар С P S

6 слайд
ФОСФОР –ЖАРЫҚ
ШЫҒАРҒЫШ
ЭЛЕМЕНТ
6 слайд
ФОСФОР –ЖАРЫҚ ШЫҒАРҒЫШ ЭЛЕМЕНТ
7 слайд
ФОСФОР атом
құрылысы
қолданылуы табиғатта
кездесуі
химиялық
қасиеттері алынуы
физикалық
қасиеттері
7 слайд
ФОСФОР атом құрылысы қолданылуы табиғатта кездесуі химиялық қасиеттері алынуы физикалық қасиеттері
8 слайд
Фосфор
кездеседіСүт тағам-
дарында
Асбұр-
шақта
ІрімшіктеБалықта Нанда Қырық-
қабат
Қара нан
ЕтЛобияҚара
құмық
8 слайд
Фосфор кездеседіСүт тағам- дарында Асбұр- шақта ІрімшіктеБалықта Нанда Қырық- қабат Қара нан ЕтЛобияҚара құмық

9 слайд
Атом құрылысы
Фосфордың сыртқы энергетикалық
деңгейінде 5 электрон бар.
Атомындағы электрондардың
орналасуы:
Электрондық құрылысы: +15 Р )2е )8е )5
е
1 s 2
2s 2
2p 6
3s 2
3p 3
9 слайд
Атом құрылысы Фосфордың сыртқы энергетикалық деңгейінде 5 электрон бар. Атомындағы электрондардың орналасуы: Электрондық құрылысы: +15 Р )2е )8е )5 е 1 s 2 2s 2 2p 6 3s 2 3p 3

10 слайд
№ 1-есеп. Массасы
7,1г фосфор ( V ) оксиді
судың артық мөлшері-
мен әрекеттескенде
түзілген фосфор қышқы-
лының массасын есепте.
10 слайд
№ 1-есеп. Массасы 7,1г фосфор ( V ) оксиді судың артық мөлшері- мен әрекеттескенде түзілген фосфор қышқы- лының массасын есепте.

11 слайд
№ 2-есеп. 15,5г
Са
3 (РО4)
2 ыды-
рағанда түзілетін
фосфор ( V ) оксидінің
массасын есепте.
11 слайд
№ 2-есеп. 15,5г Са 3 (РО4) 2 ыды- рағанда түзілетін фосфор ( V ) оксидінің массасын есепте.

12 слайд
Химиялық қасиеттері
1. Фосфор оттекте жанып, пентаоксид түзеді:
4Р+5О
2 = 2Р
2 О
5
2. Фосфор хлормен ерекеттесіп, фосфор үш хлоридін және
300 0
С-та фосфор пентахлоридін түзеді:
2Р+3 Cl
2 = 2Р Cl
3
2Р+ 5Cl
2 = 2Р Cl
5
3 . Фосфор сутекпен тікелей әрекеттесіп, фосфин түзеді:
2Р+3Н
2 = 2РН
3
12 слайд
Химиялық қасиеттері 1. Фосфор оттекте жанып, пентаоксид түзеді: 4Р+5О 2 = 2Р 2 О 5 2. Фосфор хлормен ерекеттесіп, фосфор үш хлоридін және 300 0 С-та фосфор пентахлоридін түзеді: 2Р+3 Cl 2 = 2Р Cl 3 2Р+ 5Cl 2 = 2Р Cl 5 3 . Фосфор сутекпен тікелей әрекеттесіп, фосфин түзеді: 2Р+3Н 2 = 2РН 3

13 слайд
4. Фосфор металдармен фосфидтер түзе
әрекеттеседі:
3Са+2Р = Са
3 Р
2 кальций фосфиді
3 N а+Р = Na
3 Р
натрий фосфиді
5. Күрделі заттармен әрекеттеседі:
5 КС l
3 +6P=3P
2 O
5 +5KCl
13 слайд
4. Фосфор металдармен фосфидтер түзе әрекеттеседі: 3Са+2Р = Са 3 Р 2 кальций фосфиді 3 N а+Р = Na 3 Р натрий фосфиді 5. Күрделі заттармен әрекеттеседі: 5 КС l 3 +6P=3P 2 O 5 +5KCl

14 слайд
Білімділік Тест тапсырмалары
1. Мына элементтердің арасынан S-элементтерді көрсетіңіздер.
2. Д.И.Менделеевтің периодтық жүйесінде қанша бейметалл
орналасқан?
3. Мына бейметалдардың арасындағы сұйық затты
табыңыздар?
4 . Мына қосылыстардың қайсысында азот + 4 тотығу дәрежесін
көрсетеді?
5. Мына қосылыстардың арасынан қатты затты көрсетіңіз? 2 ұ
А) Si Б) P С) C Д) H
А) 87 Б) 22 С) 56 Д) 35
А) Ar Б) CI С) Br Д) S
А) HNO
3 Б) NO
2 С) NO Д) NaNO
3
А) C
Б) Xe С) F Д) N
14 слайд
Білімділік Тест тапсырмалары 1. Мына элементтердің арасынан S-элементтерді көрсетіңіздер. 2. Д.И.Менделеевтің периодтық жүйесінде қанша бейметалл орналасқан? 3. Мына бейметалдардың арасындағы сұйық затты табыңыздар? 4 . Мына қосылыстардың қайсысында азот + 4 тотығу дәрежесін көрсетеді? 5. Мына қосылыстардың арасынан қатты затты көрсетіңіз? 2 ұ А) Si Б) P С) C Д) H А) 87 Б) 22 С) 56 Д) 35 А) Ar Б) CI С) Br Д) S А) HNO 3 Б) NO 2 С) NO Д) NaNO 3 А) C Б) Xe С) F Д) N

15 слайд
Физикалық қасиеттері
Ақ фосфор Қызыл фосфор
1.Ақ түсті кристалл зат, тығыздығы
1,83г/см 3
2.Қараңғыда жарқырайды
3.Кәдімгі жағдайда 30-40 0
С
температурада ауадағы оттекпен
тотығады
4.От алғыш қауіптілігіне
байланысты су астында сақтайды
5.Суда ерімейді,
(С S
2 ) күкірткөміртекте ериді
6 .Өте қауіпті, улы!
7.44 0
С-та балқиды, 280 0
С-та
қайнайды 1.Аморфты зат, кристалды емес,
тығыздығы 2,20 г/см 3
2.Қараңғыда жарқырамайды
3.Ауадағы оттекпен 260 0
С –та
тотығады
4.Отқа қауіпті емес. Қыздырғанда
оталады.
5.Суда да, (С S
2 ) күкірткөміртекте
де ерімейді
6 .Улы емес
7.400 0
С-та балқиды
15 слайд
Физикалық қасиеттері Ақ фосфор Қызыл фосфор 1.Ақ түсті кристалл зат, тығыздығы 1,83г/см 3 2.Қараңғыда жарқырайды 3.Кәдімгі жағдайда 30-40 0 С температурада ауадағы оттекпен тотығады 4.От алғыш қауіптілігіне байланысты су астында сақтайды 5.Суда ерімейді, (С S 2 ) күкірткөміртекте ериді 6 .Өте қауіпті, улы! 7.44 0 С-та балқиды, 280 0 С-та қайнайды 1.Аморфты зат, кристалды емес, тығыздығы 2,20 г/см 3 2.Қараңғыда жарқырамайды 3.Ауадағы оттекпен 260 0 С –та тотығады 4.Отқа қауіпті емес. Қыздырғанда оталады. 5.Суда да, (С S 2 ) күкірткөміртекте де ерімейді 6 .Улы емес 7.400 0 С-та балқиды

16 слайд
Периодтық жүйедегі орны
?
16 слайд
Периодтық жүйедегі орны ?
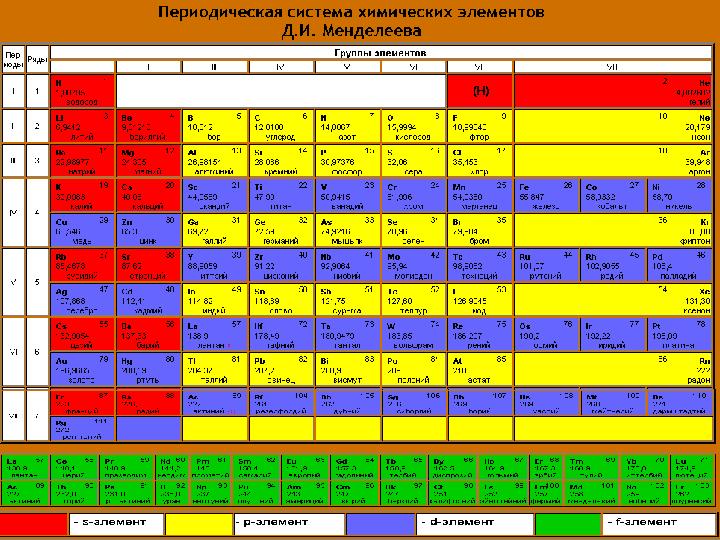
17 слайд
17 слайд

18 слайд
Элементтің
сипаттамасы ФОСФОР
Периодтық
жүйедегі орны
Атом құрылысы
Тотығу дәрежесі 3 период
V топ
Негізгі топ
топшасы (А)
Р +15 )
2 )
8 )
5
+3, +5 , -3
18 слайд
Элементтің сипаттамасы ФОСФОР Периодтық жүйедегі орны Атом құрылысы Тотығу дәрежесі 3 период V топ Негізгі топ топшасы (А) Р +15 ) 2 ) 8 ) 5 +3, +5 , -3
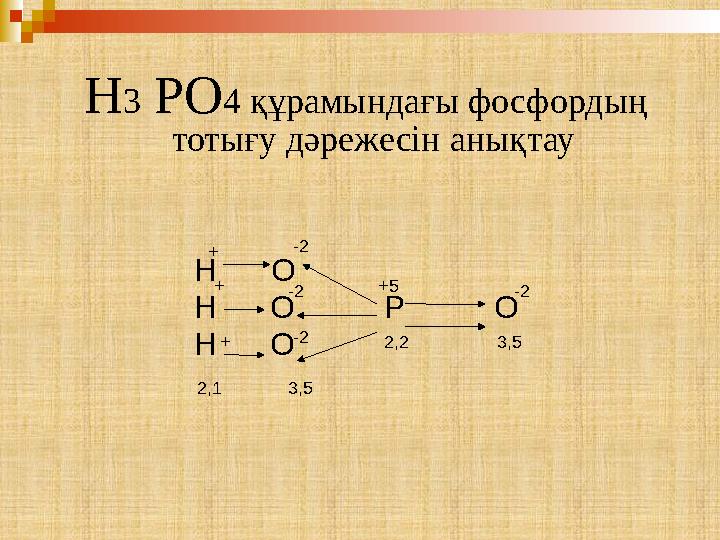
19 слайд
H 3 PO 4 құрамындағы фосфордың
тотығу дәрежесін анықтау
Н О
Н О Р О
Н О
-2
3,52,2+5+
+
+
2,1 -2
-2
-2
3,5
19 слайд
H 3 PO 4 құрамындағы фосфордың тотығу дәрежесін анықтау Н О Н О Р О Н О -2 3,52,2+5+ + + 2,1 -2 -2 -2 3,5

20 слайд
Р
АҒЗАДА
МИНЕРАЛДАР
ФОСФОЛИПИДТЕР,
ФЕРМЕНТТЕР,
КАЛЬЦИЙ
ФОСФАТы
ЭФИРЛЕР
ОРТОФОСФОР
ҚЫШҚЫЛЫ
ТІС пен СҮЙЕКТЕ АПАТИТ
ФОСФОРИТ
БИРЮЗАТабиғатта таралуыР АҒЗАДА МИНЕРАЛДАР ФОСФОЛИПИДТЕР,
ФЕРМЕНТТЕР,
КАЛЬЦИЙ
ФОСФАТы
ЭФИРЛЕР
ОРТОФОСФОР
ҚЫШҚЫЛЫ ТІС пен СҮЙЕКТЕ АПАТИТ
ФОСФОРИТ
БИРЮЗА
20 слайд
Р АҒЗАДА МИНЕРАЛДАР ФОСФОЛИПИДТЕР, ФЕРМЕНТТЕР, КАЛЬЦИЙ ФОСФАТы ЭФИРЛЕР ОРТОФОСФОР ҚЫШҚЫЛЫ ТІС пен СҮЙЕКТЕ АПАТИТ ФОСФОРИТ БИРЮЗАТабиғатта таралуыР АҒЗАДА МИНЕРАЛДАР ФОСФОЛИПИДТЕР, ФЕРМЕНТТЕР, КАЛЬЦИЙ ФОСФАТы ЭФИРЛЕР ОРТОФОСФОР ҚЫШҚЫЛЫ ТІС пен СҮЙЕКТЕ АПАТИТ ФОСФОРИТ БИРЮЗА
21 слайд
21 слайд
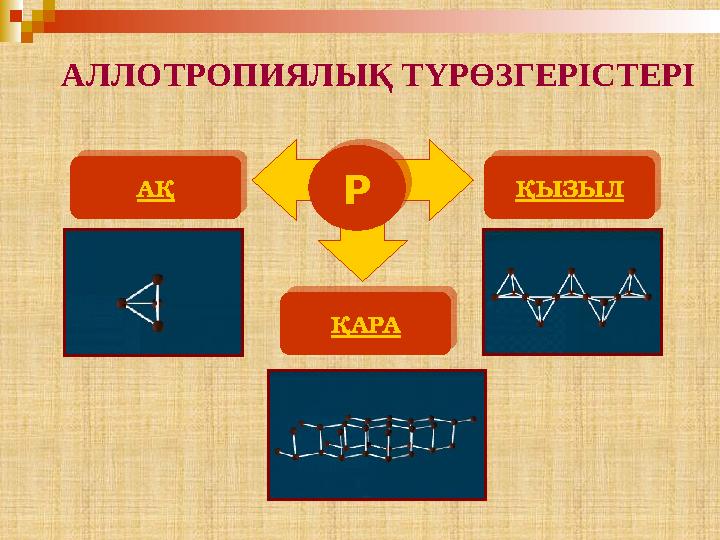
22 слайд
АЛЛОТРОПИЯЛЫҚ ТҮРӨЗГЕРІСТЕРІ
РАҚ ҚЫЗЫЛ
ҚАРАР АҚ ҚЫЗЫЛ ҚАРА
22 слайд
АЛЛОТРОПИЯЛЫҚ ТҮРӨЗГЕРІСТЕРІ РАҚ ҚЫЗЫЛ ҚАРАР АҚ ҚЫЗЫЛ ҚАРА

23 слайд
Фосфор түрөзгерісі:
Р (ақ) <=> Р (қызыл) <=> Р (қара)
23 слайд
Фосфор түрөзгерісі: Р (ақ) <=> Р (қызыл) <=> Р (қара)

24 слайд
P
4 молекуласы тетраэдр пішінді. Оңай балқиды
t (б)=44,1 о
С, t (қайн)=275 о
С, жұмсақ, түссіз
аморфты зат. Тек күкірткөміртекте ғана ериді.
Улы, ауада тез тұтанады, қаранғыда жарық
шығарады. Су астында сақтайды. АҚ ФОСФОР
Ақ фосфор тұрақсыз түрі .
24 слайд
P 4 молекуласы тетраэдр пішінді. Оңай балқиды t (б)=44,1 о С, t (қайн)=275 о С, жұмсақ, түссіз аморфты зат. Тек күкірткөміртекте ғана ериді. Улы, ауада тез тұтанады, қаранғыда жарық шығарады. Су астында сақтайды. АҚ ФОСФОР Ақ фосфор тұрақсыз түрі .

25 слайд
Қызыл фосфордың бірнеше түрі белгілі. Олардың
құрылымы дұрыс дәлелденбеген. Кристал торлары
полимерлі атомдық заттар. Балқу температурасы
585-600 о
С, түсі қара қоңырдан қызыл болады. Улы
емес . ҚЫЗЫЛ ФОСФОР
25 слайд
Қызыл фосфордың бірнеше түрі белгілі. Олардың құрылымы дұрыс дәлелденбеген. Кристал торлары полимерлі атомдық заттар. Балқу температурасы 585-600 о С, түсі қара қоңырдан қызыл болады. Улы емес . ҚЫЗЫЛ ФОСФОР

26 слайд
Қара фосфордың кристалдық торы
атомдық. Графитке ұқсас, жартылай
өткізгіш болып табылады. Улы емес. Қара фосфор
Қара фосфор өте сирек кездеседі.
26 слайд
Қара фосфордың кристалдық торы атомдық. Графитке ұқсас, жартылай өткізгіш болып табылады. Улы емес. Қара фосфор Қара фосфор өте сирек кездеседі.

27 слайд
Металдармен:
3 Ca+ 2P =
Бейметалдармен :
4 P + 5O 2
2P + 3S = P 2 S 3 =2P +5
2 O -2
5 Ca +2
3 P -3
2ХИМИЯЛЫҚ ҚАСИЕТТЕРІ:
27 слайд
Металдармен: 3 Ca+ 2P = Бейметалдармен : 4 P + 5O 2 2P + 3S = P 2 S 3 =2P +5 2 O -2 5 Ca +2 3 P -3 2ХИМИЯЛЫҚ ҚАСИЕТТЕРІ:

28 слайд
Фосфордың азот қышқылымен әрекеттесуі:
P (қ.) + 5 HNO 3 ( конц.) = 2 H 3 PO 4 + 5NO 2 ↑ + H 2 O Фосформен жұмыс
істегенде қауіпсіздік
ережелерін қатаң сақтау
керек. Ф осфор улы
28 слайд
Фосфордың азот қышқылымен әрекеттесуі: P (қ.) + 5 HNO 3 ( конц.) = 2 H 3 PO 4 + 5NO 2 ↑ + H 2 O Фосформен жұмыс істегенде қауіпсіздік ережелерін қатаң сақтау керек. Ф осфор улы

29 слайд
Сірінке басын қорап сыртына үйкелеу
кезінде сірінке тұтанады :
Қалыпты жағдайда қызыл фосфор тұрақты .
6 P + 5 KCIO 3 = 5 KCI + 3 P 2 O 5
29 слайд
Сірінке басын қорап сыртына үйкелеу кезінде сірінке тұтанады : Қалыпты жағдайда қызыл фосфор тұрақты . 6 P + 5 KCIO 3 = 5 KCI + 3 P 2 O 5
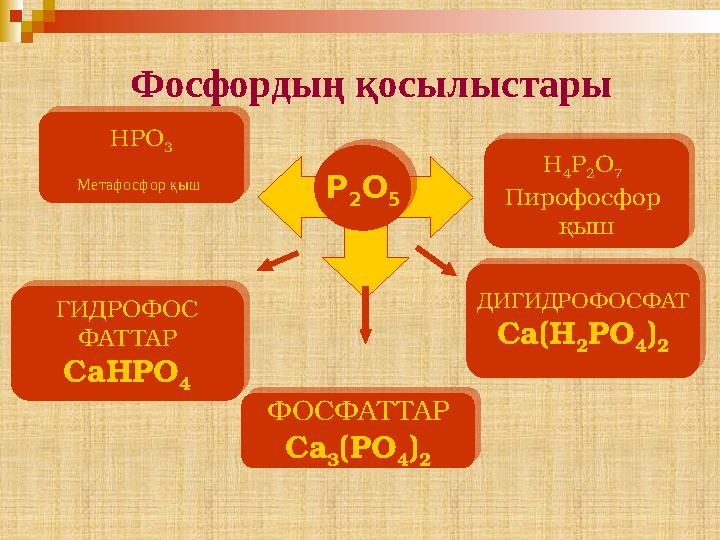
30 слайд
Фосфордың қосылыстары
Р
2 O
5HPO
3
Метафосфор қыш H
4 P
2 O
7
Пирофосфор
қыш
ФОСФАТ ТАР
Ca
3 (PO
4 )
2ГИДРОФОС
ФАТ ТАР
Ca Н PO
4 ДИГИДРОФОСФАТ
Ca (Н
2 PO
4 )
2Р
2 O
5 HPO
3
Метафосфор қыш H
4 P
2 O
7
Пирофосфор
қыш ФОСФАТ ТАР
Ca
3 (PO
4 )
2 ГИДРОФОС
ФАТ ТАР
Ca Н PO
4 ДИГИДРОФОСФАТ
Ca (Н
2 PO
4 )
2
30 слайд
Фосфордың қосылыстары Р 2 O 5HPO 3 Метафосфор қыш H 4 P 2 O 7 Пирофосфор қыш ФОСФАТ ТАР Ca 3 (PO 4 ) 2ГИДРОФОС ФАТ ТАР Ca Н PO 4 ДИГИДРОФОСФАТ Ca (Н 2 PO 4 ) 2Р 2 O 5 HPO 3 Метафосфор қыш H 4 P 2 O 7 Пирофосфор қыш ФОСФАТ ТАР Ca 3 (PO 4 ) 2 ГИДРОФОС ФАТ ТАР Ca Н PO 4 ДИГИДРОФОСФАТ Ca (Н 2 PO 4 ) 2

31 слайд
Фосфор оксидінің сумен әрекеттесуі:
Р
2 О
5 +
3H
2 O = 2 H
3 PO
4
31 слайд
Фосфор оксидінің сумен әрекеттесуі: Р 2 О 5 + 3H 2 O = 2 H 3 PO 4

32 слайд
Фосфорды алу :
Ca 3 (PO 4 ) 2 + 5C + 3SiO 2 =
3CaSiO 3 + 2P + 5CO ↑
32 слайд
Фосфорды алу : Ca 3 (PO 4 ) 2 + 5C + 3SiO 2 = 3CaSiO 3 + 2P + 5CO ↑
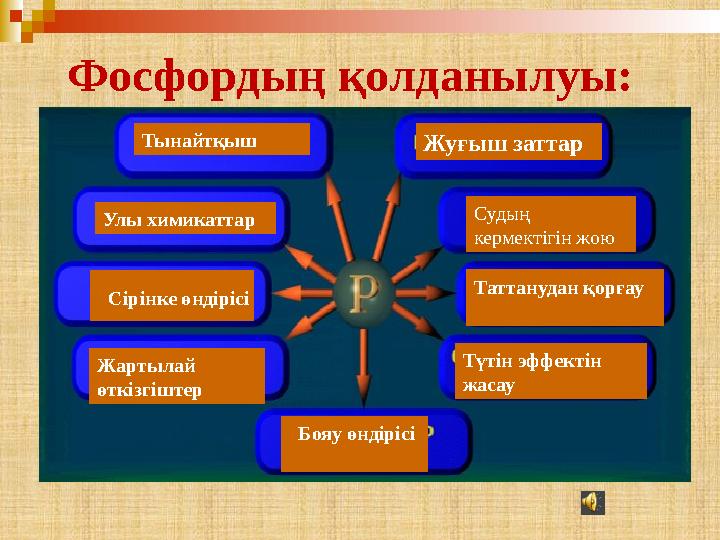
33 слайд
Тынайтқыш
Улы химикаттар
Сірінке өндірісі
Жартылай
өткізгіштер Жуғыш заттар
Судың
кермектігін жою
Таттанудан қорғау
Түтін эффектін
жасау
Бояу өндірісі Фосфордың қолданылуы:
33 слайд
Тынайтқыш Улы химикаттар Сірінке өндірісі Жартылай өткізгіштер Жуғыш заттар Судың кермектігін жою Таттанудан қорғау Түтін эффектін жасау Бояу өндірісі Фосфордың қолданылуы:
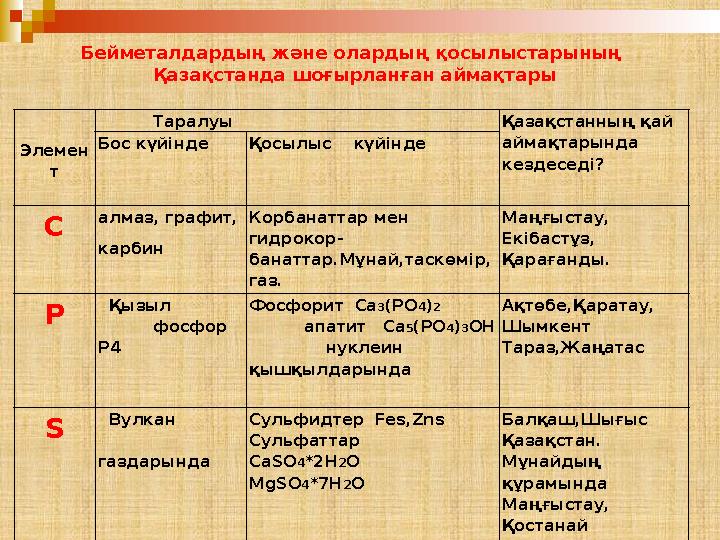
34 слайд
Элемен
т Таралуы Қазақстанның қай
аймақтарында
кездеседі ?Бос күйінде Қосылыс күйінде
C алмаз, графит,
карбин Корбанаттар мен
гидрокор -
банаттар.Мұнай,таскөмір,
газ. Маңғыстау,
Екібастұз,
Қарағанды.
P Қызыл
фосфор
Р4 Фосфорит Ca 3 (PO 4 ) 2
апатит Ca 5 (PO 4 ) 3 OH
нуклеин
қышқылдарында Ақтөбе,Қаратау,
Шымкент
Тараз,Жаңатас
S Вулкан
газдарында Сульфидтер Fes,Zns
Сульфаттар
CaSO 4 *2H 2 O
MgSO 4 *7H 2 O Балқаш,Шығыс
Қазақстан.
Мұнайдың
құрамында
Маңғыстау,
ҚостанайБейметалдардың және олардың қосылыстарының
Қазақстанда шоғырланған аймақтары
34 слайд
Элемен т Таралуы Қазақстанның қай аймақтарында кездеседі ?Бос күйінде Қосылыс күйінде C алмаз, графит, карбин Корбанаттар мен гидрокор - банаттар.Мұнай,таскөмір, газ. Маңғыстау, Екібастұз, Қарағанды. P Қызыл фосфор Р4 Фосфорит Ca 3 (PO 4 ) 2 апатит Ca 5 (PO 4 ) 3 OH нуклеин қышқылдарында Ақтөбе,Қаратау, Шымкент Тараз,Жаңатас S Вулкан газдарында Сульфидтер Fes,Zns Сульфаттар CaSO 4 *2H 2 O MgSO 4 *7H 2 O Балқаш,Шығыс Қазақстан. Мұнайдың құрамында Маңғыстау, ҚостанайБейметалдардың және олардың қосылыстарының Қазақстанда шоғырланған аймақтары

35 слайд
1 .Фосфордың электронды конфигурациясы
A) 1s 2
2s 2
2p 6
3s 2
3p 1
B) 1s 2
2s 2
2p 6
3s 2
3p 2
C). 1s 2
2s 2
2p 6
3s 2
3p 3
D) 1s 2
2s 2
2p 6
3s 2
3p 4
2 .Фосфордың табиғаттағы қоры ...түрінде болады
A) CaSiO
3
B) . 3Ca
3 (PO
4 )
2 * CaF
2
C) Ba
3 (PO
4 )
2
D) H
3 PO
4
3 .Фосформен әрекеттесетін заттар
A) KCl, H
2 , BaO
B) NaCl, Al, Li
2 O
C) . O
2 , S, Ca, Cl
2
D) MgO, N
2 O
5 , Cl
2 O
7
35 слайд
1 .Фосфордың электронды конфигурациясы A) 1s 2 2s 2 2p 6 3s 2 3p 1 B) 1s 2 2s 2 2p 6 3s 2 3p 2 C). 1s 2 2s 2 2p 6 3s 2 3p 3 D) 1s 2 2s 2 2p 6 3s 2 3p 4 2 .Фосфордың табиғаттағы қоры ...түрінде болады A) CaSiO 3 B) . 3Ca 3 (PO 4 ) 2 * CaF 2 C) Ba 3 (PO 4 ) 2 D) H 3 PO 4 3 .Фосформен әрекеттесетін заттар A) KCl, H 2 , BaO B) NaCl, Al, Li 2 O C) . O 2 , S, Ca, Cl 2 D) MgO, N 2 O 5 , Cl 2 O 7

36 слайд
4 .Фосфордың болуы мүмкін тотығу дәрежелері?
A) – 2, + 4
B). – 3, + 5
C) – 1, + 7
D) + 2, + 4
5.Фосфиннің формуласы:
A) .PH
3
B) NH
3
C) AsH
3
D) PCl
3
6.Натрий дигидрофосфаты формуласы :
A) Na
3 PO
4
B) Na
2 HPO
4
C) .NaH
2 PO
4
D) NaHCO
3
7. Фосфорды қай жерлерде алады?
А.Өскемен; В.Семей; С.Көкшетау; Д.Қаратау
8.Суперфосфат өндіру заводы қайда орналасқан?
А.Таразда; В.Тлдықорғанда; С.Алматы; С.Қостанай
9 Фосфордың ірі кен орындары:
А.Құмкөл-Теңіз; В.Ембі-Мақат; С.Қаратау-Шолақтау; Д.Лепсі-Қаратал.
10. Қазақстандағы ірі фосфор заводтары:
А.Тараз, Алға; В .Шымкент, Қызылорда; С. Талдықорған, Шымкент; Д.Семей, Атырау
36 слайд
4 .Фосфордың болуы мүмкін тотығу дәрежелері? A) – 2, + 4 B). – 3, + 5 C) – 1, + 7 D) + 2, + 4 5.Фосфиннің формуласы: A) .PH 3 B) NH 3 C) AsH 3 D) PCl 3 6.Натрий дигидрофосфаты формуласы : A) Na 3 PO 4 B) Na 2 HPO 4 C) .NaH 2 PO 4 D) NaHCO 3 7. Фосфорды қай жерлерде алады? А.Өскемен; В.Семей; С.Көкшетау; Д.Қаратау 8.Суперфосфат өндіру заводы қайда орналасқан? А.Таразда; В.Тлдықорғанда; С.Алматы; С.Қостанай 9 Фосфордың ірі кен орындары: А.Құмкөл-Теңіз; В.Ембі-Мақат; С.Қаратау-Шолақтау; Д.Лепсі-Қаратал. 10. Қазақстандағы ірі фосфор заводтары: А.Тараз, Алға; В .Шымкент, Қызылорда; С. Талдықорған, Шымкент; Д.Семей, Атырау

37 слайд
Жауаптары:
1.С 6.с
2.В 7.д
3. c 8.В
4.в 9. А
5.а 10.а
37 слайд
Жауаптары: 1.С 6.с 2.В 7.д 3. c 8.В 4.в 9. А 5.а 10.а

38 слайд
Есептер шығарайық
1. Күкірттің табиғатта кездесетін қосылыстарының:
а) қорғасын жылтыры РbS;
ә) мыс жылтыры Cu
2 S;
б) темір колчеданы FeS
2 қайсысының құрамында
күкірттің массалық үлесі үлкен?
2. Темір (ІІ) сульфиді мен массасы 146 г тұз қышқылы
әрекеттескенде күкіртсутектің қандай көлемін (қ.ж.)
алуға болады?
3. Мына айналымдарды жүзеге асыруға болатын
реакция теңдеулерін жазыңдар ?
а) S →H 2 S → K 2 S→ Fe S → SO 2
Ә) FeS 2 → SO 2 → SO 3 → Na 2 SO 4 → BaSO 4
38 слайд
Есептер шығарайық 1. Күкірттің табиғатта кездесетін қосылыстарының: а) қорғасын жылтыры РbS; ә) мыс жылтыры Cu 2 S; б) темір колчеданы FeS 2 қайсысының құрамында күкірттің массалық үлесі үлкен? 2. Темір (ІІ) сульфиді мен массасы 146 г тұз қышқылы әрекеттескенде күкіртсутектің қандай көлемін (қ.ж.) алуға болады? 3. Мына айналымдарды жүзеге асыруға болатын реакция теңдеулерін жазыңдар ? а) S →H 2 S → K 2 S→ Fe S → SO 2 Ә) FeS 2 → SO 2 → SO 3 → Na 2 SO 4 → BaSO 4

39 слайд
Бекіту тапсырмалары
1. Мына қосылыстардың ішінен күкіртті қосылыстарының
формуласын тауып, атын ата: СаО, Н
2 S, NaOH, SO
2 , H
2 O,
HNO
3 , MgCI
2 , Fe
2 (SO
4 )
3
2. Күкірттің (І V ) оксиді ......... оксид деп аталады.
3. Күкірттің ( V І) оксиді сумен әрекеттесіп, .......... түзеді.
4. Күкірт қышқылының формуласы және салыстырмалы
молекулалық массасы?
5. Күкірт қышқылына және оның тұздарына қай зат сапалық
реактив болып табылады ?
6. Реакция теңдеулерін аяқта:
а)Mg+H
2 SO
4 → ә)ZnO+H
2 SO
4 → б)NaOН+H
2 SO
4 →
7. Айналымды жүзеге асыр:
S → SO
2 → SO
3 → H
2 SO
4 → K
2 SO
4
39 слайд
Бекіту тапсырмалары 1. Мына қосылыстардың ішінен күкіртті қосылыстарының формуласын тауып, атын ата: СаО, Н 2 S, NaOH, SO 2 , H 2 O, HNO 3 , MgCI 2 , Fe 2 (SO 4 ) 3 2. Күкірттің (І V ) оксиді ......... оксид деп аталады. 3. Күкірттің ( V І) оксиді сумен әрекеттесіп, .......... түзеді. 4. Күкірт қышқылының формуласы және салыстырмалы молекулалық массасы? 5. Күкірт қышқылына және оның тұздарына қай зат сапалық реактив болып табылады ? 6. Реакция теңдеулерін аяқта: а)Mg+H 2 SO 4 → ә)ZnO+H 2 SO 4 → б)NaOН+H 2 SO 4 → 7. Айналымды жүзеге асыр: S → SO 2 → SO 3 → H 2 SO 4 → K 2 SO 4
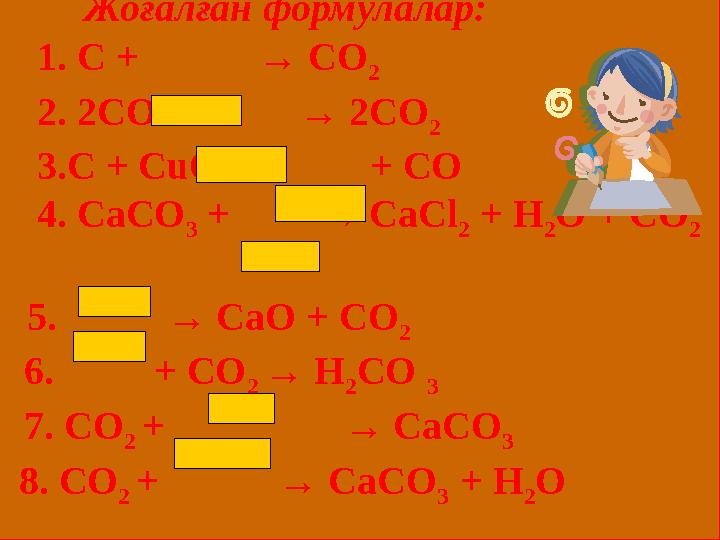
40 слайд
Жоғалған формулалар:
1. С + → СО
2
2 . 2СО + → 2СО
2
3 .С + С u О → + СО
4 . СаСО
3 + → СаС l
2 + Н
2 О + СО
2
5 . → СаО + СО
2
6 . + СО
2 → Н
2 СО
3
7 . СО
2 + → СаСО
3
8 . СО
2 + → СаСО
3 + Н
2 О
40 слайд
Жоғалған формулалар: 1. С + → СО 2 2 . 2СО + → 2СО 2 3 .С + С u О → + СО 4 . СаСО 3 + → СаС l 2 + Н 2 О + СО 2 5 . → СаО + СО 2 6 . + СО 2 → Н 2 СО 3 7 . СО 2 + → СаСО 3 8 . СО 2 + → СаСО 3 + Н 2 О

41 слайд
2 3 3 2 2
CaCl CaCO CO Na СО СО С 3. Мына айналымдарды жүзеге асыруға болатын реакция
теңдеулерін жазыңдар ?
41 слайд
2 3 3 2 2 CaCl CaCO CO Na СО СО С 3. Мына айналымдарды жүзеге асыруға болатын реакция теңдеулерін жазыңдар ?
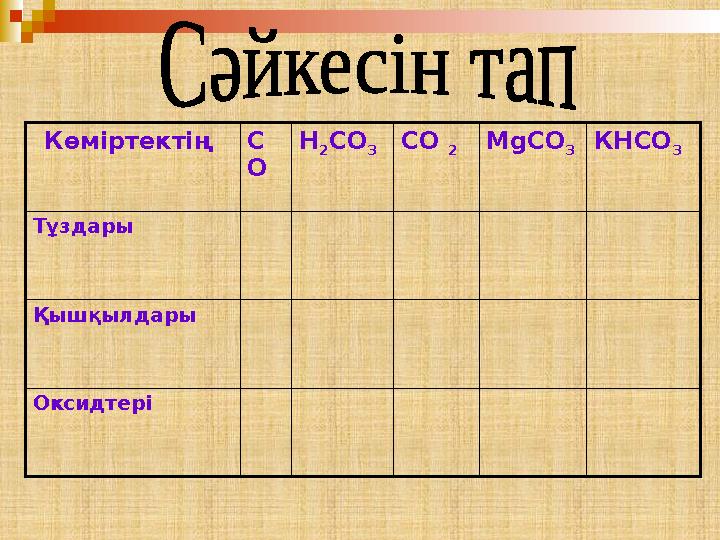
42 слайд
Көміртектің С
О Н
2 СО
3 СО
2 М g СО
3 КНСО
3
Тұздары
Қышқылдары
Оксидтері
42 слайд
Көміртектің С О Н 2 СО 3 СО 2 М g СО 3 КНСО 3 Тұздары Қышқылдары Оксидтері

43 слайд
Үйге тапсырма:
§ . Бейметалдар тарауын қайталау
43 слайд
Үйге тапсырма: § . Бейметалдар тарауын қайталау

44 слайд
44 слайд




