
ОҚО Мақтарал ауданы «Көктөбе ауылы»
№ 19 М.Мақатаев атындағы жалпы орта мектебі
коммуналдық мемлекеттік мекемесі

Әдістемелік құрал
Битабарова Хадиша Исабековна
химия пәні мұғалімі
-
Мұғалімнің аты –жөні: Битабарова Хадиша Исабековна .
-
Жұмыс орны:«№ 19 М.Мақатаев атындағы жалпы орта мектебі»
коммуналдық мемлекеттік мекемесі».
-
Қызметі: Мұғалім
-
Оқытатын пәні: Химия
-
Білімі: Жоғары
-
Санаты: Бірінші
-
Курстан өтілуі: Үшініші (базалық) деңгей
-
Мекен –жайы: Онтүстік Қазақстан облысы Мақтарал. ауданы, Ж.Ералиев. ауыл ,
-
Ұялы телефон :8 775 240 62 67, 8775 705 49 62,
-
Электрондық почта E-mail :bitabarova66@mail.ru.
Шығармашылық
тақырыбы:«Жаңа педагогикалық
технология негізінде, оқушылардың өзіндік ізденісін, ойлау және
шығармашылық қабілетін
дамыту,ақпараттық технологиялардың мүмкіндігін қолдана
отырып оқушылардың химия пәніне деген
қызығушылықтарын
арттыру. »
Мазмұны.
І-Кіріспе-------------------------------------------------------------------------------- 3-5
ІІ-Негізгі-------------------------------------------------------------------------------6-206
Органикалық реакциялардың түрлері---------------------------------------6-8
Алкандардың химиялық қасиеттері-------------------------------------------9-12
Алкендердің химиялық қасиеттері--------------------------------------------13-15
Алкиндердің химиялық қасиеттері-------------------------------------------16-18
Алкадиендердің химиялық қасиеттері---------------------------------------19-20
Ароматты көмірсутектердің химиялық қасиеттері. Бензол.----------21-22
Оттекті органикалық қосылыстар. Спирттер. Қаныққан біратомды спирттердің химиялық қасиеттері---------------------------------------------23-26
Фенолдың химиялық реакциясы-----------------------------------------------27-29
Альдегидтер мен кетондардың химиялық қасиеттері--------------------30-33
Күрделі эфирлердің химиялық қасиеттері.-----------------------------------34-35
Аминдердің химиялық қасиеттері----------------------------------------------36-37
Көмірсулардың химиялық қасиеттері-----------------------------------------38-39
І.«Сызбанұсқа бойынша өзгерістерді жүзеге асыру»---------------------40-117
ІІ. Жабық тізбектерге арналған қиындатылған тапсырмалар.-----118-206
ІІІ-Қорытынды------------------------------------------------------------------- 207-208
ІҮ-ПӘН БОЙЫНША ГЛОССАРИЙ----------------------------------------209-217
Ү-Әдебиеттер ------------------------------------------------------------------------218
V- Қосымшалар--------------------------------------------------------------------219-229
І-Кіріспе
Елбасымыз Н.Ә.Назарбаевтың «Қазақстан - 2030» стратегиясы жолдауында, 1999 жылдың маусымында қабылданған Қазақстан Республикасы «Білім туралы» Заңында, 2000 жылдың 30 қыркүйегінде қабылданған «Білім» мемлекеттік бағдарламасында көрсетілгендей қоғамның экономикалық және әлеуметтік жағынан ілгерілеуінің маңызды факторы ретінде білім берудің ұлттық моделін дамыту, шығармашыл тұлға қалыптастыруға дағды алу, ақыл –ой қорын жинау сияқты мақсаттарды кµздейді. Ол Қазақстан республикасы жарияланған білім беру басымдылығына, «жалпыға білім беру» моделін «әр адамға таңдау бойынша білім беру» моделіне көшуге негізделген.
ХХІ ғасыр – ғылым мен техниканың дамыған кезеңі. Заман талабына сай қазіргі білім жүйесіндегі игі өзгерістер мен жаңалықтар соның нәтижесі. Бүгінгі білім беру үрдісінде жаңа ақпараттық технологияны пайдалану және оны мақсатты түрде жүзеге асыру – ақпараттық қоғам дәуірінің негізгі көзі.
Қазіргі заман мұғалімнен тек өз пәнінің терең білгірі болуы емес, тарихи танымдық, педагогикалық –психологиялық сауаттылық, саяси экономикалық білімділік және ақпараттық сауаттылық талап етілуде. Ол заман ағымына сәйкес білім беруде жаңалыққа жаны құмар, шығармашылықпен жұмыс істеп, оқу мен тәрбие ісіне еніп, оқытудың жаңа технологиясын шебер меңгерген жан болғанда ғана білігі мен білімі жоғары жетекші тұлға ретінде ұлағатты саналады.
Қазақстанның тәуелсіз мемлекет ретінде қалыптасуы орта білім беру жүйесінің дамуымен тығыз байланысты. Қай халықтың, қай ұлттың болсын толығып өсуіне, рухани әрі мәдени дамуына басты ықпал жасайтын тірегі де, түп қазығы да – мектеп. Мектептердің білім деңгейін көтеру және онда интерактивті құралдарды пайдалану арқылы оқу – тәрбие процесін тиісті деңгейге көтеру, мектеп ұстаздарының, басшыларының, педагогикалық ұжымның жүйелі басшылыққа алған бағыты деп есептейміз.
Педагогикалық, ғылыми және шығармашылық еңбектеріңіздің жолында мол табысқа кенеліңіздер, жаңадан бастаған істеріңізге үлкен сәттіліктер тілеймін! Саналы ұрпаққа сапалы білім мен тәрбие беруден жалықпайық!
Қызығушылық деп оқушының бір нəрсеге зейін қоюға, кейбір заттар мен құбылысты танып-білуге ұмтылуын айтамыз. Химияда оқушыларды қызықтырып, өзіне тартатын құбылыстар аз емес, тек соларды таба, тани білу керек.
Қызығулар адамның рухани жəне дене күші дамуының аса маңызды шарттары болып табылады жəне ой - өрісін кеңейтіп, білім алуға итермелейді. Бұл оның іс - əрекетін жеңілдетеді, бір нəрсеге қызығатын болса, ол кез келген іспен шұғылдану үшін зор қиындықтарды жеңуге дайын тұрады. Оқушы қызықты сабақты зор ынтамен қабылдайды да, əдетте оны жақсы оқитын болады.
Іс-əрекет үрдісінде қызығулар бейімділікке ұласады. Пəнге қызығу не болмаса сабаққа бейімділігі тікелей немесе жанама түрде болады. Адамның қызығуы олардың іс-əрекеті тəрізді алуан түрлі. Қызығудың таным, білім алу, еңбек ету, шығармашылық жəне басқа да түрлері көп
Материалистік диалектика негізінде химияны оқытуға қойылатын негізгі талаптардың бірі заттар мен құбылыстарды жеке күйінде емес, маңызды байланыстары жəне негізгі қарым – қатынастары тұрғысынан үйрену болып табылады. Дүниенің бірлігі туралы ұғым қалыптастыру үшін заттар арсындағы генетикалық байланысты: бос күйдегі элемент пен құрамына осы элемент кіретін күрделі заттар арсындағы, əсіресе химиялық элементтер арасындағы байланысты ашудың маңызы зор. Əсіресе, заттардың құрылысы мен қасиеттерінің арасындағы байланыстарды ашу керек. Заттар жəне химиялық құбылысты бір-бірімен байланысты оқып үйрену химия заңдарын(жалпы жəне жеке) анықтауға мүмкіндік береді.Дегенмен, химия заңдарының көзқарастық мəні оларды оқып-үйренудің тереңдігіне байланысты.
Бейорганикалық жəне органикалық дүниедегі даму туралы ілім химиядан сабақ беруде көрініс табуы тиіс, ол заттар мен құбылыстардың өзара байланысы жəне тəуелділігі жөніндегі ілім тəрізді мектептегі химия курсының өн бойы қамтуы керек. Химияны оқыту əдістемесінің міндеті – біріншіден, химияны заңдарға сəйкес оқыту, екіншіден, қоғамтану сабақтарында бұл заңдарды саналы игеруге оқушыларды дайындау.
Органикалық реакциялардың түрлері.
Органикалық қосылыстардың химиялық өзгерістері бағыттылығымен, жылдамдығымен және механизмімен сипатталады.Органикалық қосылыстардың реакциялары көбінесе екі бағытпен жүреді. Реакция бағыты заттың құрамына, құрылысына, сонымен бірге сыртқы жағдайларға тәуелді. Реакция бағыты химиялық реакциялардың жалпы теориясы негізінде шешіледі.
Екі заттың арасында реакция жүру үшін олар соқтығысулары қажет, бірақ реакция жүруі үшін олардың энергиялары реакция жүруіне қажет энергиядан (реакцияның активациялық энергиясынан) жоғары болуы керек.
Органикалық өзгерістер көміртегі тізбегі өзгеріп не өзгермей жүреді. Көптеген реакцияларда көміртегі тізбегі (қаңқасы) өзгермейді, бұл жағдайға мына реакциялар жатады: орынбасу, қосылу, элиминирлеу (бөліп алу), изомерлену.
Көміртегі қаңқасы өзгере жүретін реакцияларға: тізбектің ұзаруы (орын басу және қосылу реакциялары арқылы), тізбектің қысқаруы (крекинг және изомерлену), тізбектің изомерленуі, циклдену, циклдің ашылуы, циклдің сығылуы және кеңеюі жатады.
Органикалық реакциялардың типтері:
1.Орынбасу реакциясы – органикалық заттың құрамындағы атом реагенттің молекуласындағы атомға немесе атомдар тобына орын алмасады:
СН4 +
СІ2  CH3Cl+
НСІ
CH3Cl+
НСІ
хлорметан
2.Қосылу реакциясы – еселікбайланысы бар қанықпаған қосылыстар үшін тән..
CH2=CH2 + СІ2 → CH2СІ -CH2СІ,
1,2- дихлорметан
3. Бөліп алу реакциясы (элиминирлеу) -органикалық заттың құрамындағы атом атом немесе атомдар тобы көмірсутек радикалынан үзілгенде қанықпаған қосылыстың түзілуі
С2Н5ОН
 СН2=
СН2 +
Н2О
СН2=
СН2 +
Н2О
4. Айырылу реакциясы –бір органикалық заттың айырылуы нәтижесінде екі жаңа органикалық заттар түзіледі.
СН3-
СН2
–СН2
–СН3
 СН3
–СН3
+
СН2
=
СН2
СН3
–СН3
+
СН2
=
СН2
этан этен
5.Изомеризация реакциясы – берілген заттың өзінің изомеріне айналу реакциясы.
СН3-
СН2
–СН2
–СН3
 СН3-
СН(СН2)
–СН2
–СН3
СН3-
СН(СН2)
–СН2
–СН3
2-метилбутан
6. Тотығу реакциясы - органикалық заттың құрамына кіретін көміртектің тотығу дәрежесі артады.
а) толық тотығу
СН4
+
2О2
 СО2
+
2Н2О
СО2
+
2Н2О
б) шала тотығу
СН4
+
2О2
 НСОН +
2Н2О
НСОН +
2Н2О
метаналь
Именные реакции:
Вюрц С2Н5CІ +2Na
+C3H7CІ →
C5H12+2NaCІ
2CH3
–CH2
–CH(CH3)Br-CH3+2Na→CH3-CH2-
C(CH3)2
-C(CH3)2
-CH2-
CH3
+
2NaCl
Вагнер3CH2
=CH2+
2KMnO4
+4H2O→CH2(OH)-CH2(OH)+2KOH+2MnO2
Марковников СН2=СН-СН3+НCІ
→CH3-
CH(CІ)-CH3
ЗайцевСН3-СН(Вr)CH2
–CH3+NaOH(спирт) →СH3-CH=CH-CH3+NaBr+
H2O
КучеровC2H2+H2O→CH3-CОН
Зинин C6H5
–NO2
+6H→
C6H5–NH2
+2H2O
Густавсон CІCH2–CH2–
CH2-CH2- CІ +Zn→
C4H8
+ZnCІ2
ДюмаCH3-COONa+NaOH →
CH4+Na2CO3
Кольбе 2CH3-COONa+2H2O→
C2H6 +
2CO2↑+H2↑+
2NaOН
Изменение длины углеродной
цепи:
Реактив
Гриньяра
СН3
-Mg
–Cl+C2H5
-Cl→
C3H8
+MgCl2
CO2
+
CH3-Mg-Cl→
CH3-COOMgCl→
CH3
–COOH
+MgCl2
алкил
реакциясы
С6H6
+СН3
–Сl→
C6Н5
–СН3
+HCl
декарбоксилдеу
реакциясы
С6
H5
-COOH→
C6H6
+CO2
↑
CH3
–CH2
-COONa +NaOH→
C2H6
+
Na2CO3
Димерлену
2
С2Н2
→
винилацетилен
Полимерлену
СН2
=СН- СОО
–СН3
→
Поливинилацетаты
Сапалық
реакция
1. С2Н2 +
2[Ag(NH3)2]OH→
C2Ag2↓+4NH3↑ +
2Н2О
2. СH3COH+2[Ag(NH3)2]OH →
CH3COOH+2Ag ↓
+4NH3↑+H2O
3. CH3COH+ 2
[Ag(NH3)2]OH →
CH3CООNH4 +2Ag↓+3NH3↑+ H2O
4. CH3COH +Ag2O +NH3 → CH3COONH4+2Ag↓
5. CH3COH+
2Cu(OH)2→ CH3COOH +Cu2O↓+ 2H2O
6. C6H12O6+ 2Сu(OH)2 → CH2OH-(CHOH)4-COOH
+Cu2O↓+ 2H2O
7. C6H12O6+2[Ag(NH3)2]OH → CH2OH
–(CHOH)4-COOH+2Ag↓ +
2H2O
8. 2C3HO3 + Cu(OH)2→ Глицератмеди II+ 2H2O
9. HCOOH+ 2[Ag(NH3)2]OH → CO2+2Ag+
4NH3 + 2H2O
Алкандардың химиялық қасиеттері
Алкандар орынбасу, айырылу изомерлену және тотығу реакцияларына түседі. Алкандардың басқа көмірсутектермен салыстырғандағы бір ерекшелігі — олардың құрамындағы көміртек атомдарының валенттіктері толығымен сутек атомдарымен қаныққан. Сондықтан алкандар қосылу реакцияларына түспейді.
Алкандар құрамындағы тағы бір ерекшелік — оларда едәуір берік коваленттік σ-байланыстың болуы. Бұл байланыстың полюстігі төмен, сондықтан алкандар, негізінен, SRмеханизмі бойынша реакцияларға түседі. С—С байланыс едәуір қатаң жағдайда үзіліп, реакцияға қиын түседі. Алкандардың парафиндер деп аталу себебі осы.
Алкандар химиялық реакцияларға энергия берген (қыздыру немесе ультракүлгін сәулелердің әсерінен) жағдайда ғана түседі. Реакция барысында көміртек пен сутек С—Н арасындағы байланыс үзіліп, сутек атомы басқа атомдар мен атом топтарына алмасады немесе көміртек атомдарының С—С араларындағы байланыстар үзіледі. Алкандар полюссіз қосылыстар болғандықтан, байланыстардың үзілуі негізінен радикалдар түзе, гомолиттік механизм бойынша жүреді.
.
 СnН2n +
1CI
СnН2n +
1CI
 құрылымдық
изомер
құрылымдық
изомер
 СО2
+
Н2О
СО2
+
Н2О
![]() СnН2n +2
СnН2n +2
 СnН2n +
1NО2
СnН2n +
1NО2
 СnН2n +
1SО3Н
СnН2n +
1SО3Н
 СnН2n
немесе
СnН2n
-2
СnН2n
немесе
СnН2n
-2
 СnН2n +
2/2
СnН2n +
2/2

![]()
Қаныққан көмірсутектерге тән реакциялар
Галогендену реакциялары қаныққан көмірсутектердің маңызды реакцияларының бірі.
Жарықтың әсерінен жүретін реакциялар фотохимиялық реакциялар деп аталады.Бұл реакция хлорметан түзілген сатыда тоқтап қалмайды. Тізбекті реакциялар нәтижесіндеСН3СІ, СН2СІ2, СНСІ3 және ССІ4 тәрізді орынбасу реакциясының өнімдері түзіледі. Жалпы түрде бұл реакция былай жазылады:
СН4 СН3СІ
СН3СІ
 СН2СІ2
СН2СІ2 СНСІ3
СНСІ3 ССІ4
ССІ4
Алкандардың галогендермен орынбасу реакциялары хлормен жеңіл, броммен қиындау, йодпен қиын жүреді. Ал фтормен қопарылыс түзе жүретін болғандықтан, реакцияны инертті газ қатысында сұйылтып жүргізеді. Сутектердің орнын галогендерге алмастырғанда, алкандардың галогентуындылары түзіледі. F2 > Cl2> Br2> I2.
CH3-CH2-CH2-CH3 + CІ2 → CH3-CHCІ-CH2-CH3 + HCІ,
CH3-CHCІ-CH2-CH3+ CІ2 → CH3-CCІ2-CH2-CH3 + HCІ.
Сумен әрекеттесуі.Метанды су буымен никель өршіткісі үстінен 800 — 850°С-та өткізгенде, көміртек (II) оксиді мен сутек түзіледі. Өршіткі ретінде Сг2О3 алуға да болады:
CH4+
H2O
 CO +
3H2.
CO +
3H2.
Термиялық айырылады. Алкандардың термиялық айырылуы молекула құрамын анықтаудың дәлелі. Метанды С қыздырғанда дегидрлеу (сутектің бөлінуі) реакциясы жүреді де ацетилен түзеледі. Бұл реакцияның өнеркәсіпте көксағыз, пластмасса, күйе, бояу алуда маңызы зор.
Сутек бөліне жүретін ыдырау реакциялары дегидрлену реакциясы деп аталады.
Алкандардың дегидрлену реакцияларының басқа қанықпаған көмірсутектер алу үшін өнеркәсіптік маңызы зор. Алкандарды өршіткі қатысында қыздырғанда (Ni, 500°С), дегидрленіп, сутек бөлінеді және канықпаған көмірсутектер түзіледі:
2CH4 H2C=CH2+
2H2
H2C=CH2+
2H2
Қыздырғанда алкандар термиялық айырылады. Метанды жоғары температурада (1000°С шамасында) ауа қатыстырмай қыздырғанда жай заттарға айырылады:
CH4 C +
2H2,
C +
2H2,
Метанды бұдан да жоғарырақ температурада қыздырғанда (15000С), реакция қанықпаған көмірсутек - ацетилен түзе және сутек бөле жүреді:
2CH4 HC≡CH +
3H2.
HC≡CH +
3H2.
Тотығу реакциялары
Қаныққан көмірсутектер катализатор қатысында жоғары температурада және жоғары қысымда тотығу реакциясына түсіп альдегидтер, кетондар, спирттер, карбон қышқылдарын түзеді.
2CH3-CH2-CH2-CH3 + 5O2 → 4CH3COOH + 2H2O,
2CH3-CH2-CH2-CH3 + 13O2 → 8CO2 + 10H2O.
Жану реакция —алкандар түсетін ең маңызды реакциялардың бірі болып табылады. Көмірсутектердің қолданылуының негізгі бір саласы жану реакциясының нәтижесінде энергия бөлінуіне байланысты. Ауада қыздырғанда, алкандар тұтанып жанады. Оттек жеткілікті болса, реакция нәтижесінде көміртек (IV) оксиді мен су түзіледі және жылу бөлінеді:
СН4 + 2O2 → СO2 + 2Н2O ΔН =-890 кДж/моль
Метанның конверсиялануы— оттекпен, су буымен және көміртек (IV) оксидімен тотығуы оның негізгі қолданылу салаларының бірі:
2СН4 + O2 → 2СО + 4Н2
СН4 + Н2O → СО + ЗН2
СН4 + СO2 → 2СО + 2Н2
Бұл реакциялардың нәтижелерінде түзілген синтез-газ (су газы) көмірсутектер, метанол, метаналь, т.б. органикалық қосылыстар алынатын бағалы шикізат болып табылады.
Алкандардың ыдырау температурасы, олардың молекулалық массасына және құрылысына тәуелді. Сутек бөліне жүретін ыдырау реакциялары дегидрлену реакциясы деп аталады.
![]() CH2
=CH
–CH2
–CH3
CH2
=CH
–CH2
–CH3
CH3
–CH2
–CH2
–CH3

![]() CH3–CH= CH
–CH3
,
CH3–CH= CH
–CH3
,
CH3
–CH
2–CH2
–CH3 CH2
= CH—CH =
CH2
+
2H2.
CH2
= CH—CH =
CH2
+
2H2.
Изомерлену реакциялары барысында С—С байланыстары үзіліп, түзу көміртек тізбегі тармақталғанға айналады. Изомерлену процесі өршіткі (АІСІ3) қатысында және қыздырғанда (-400 °С) жүреді.
CH3
–CH2
–CH2–CH3
 CH3
–CH(CH3)
–CH3.
CH3
–CH(CH3)
–CH3.
Крекинг:
C4H10 → CH3—CH3 + CH2=CH2
Риформинг реакциялары нәтижесінде алкандар ароматты көмірсутектерге, мысалы, гексан бензолға айналады:
C6H14 → С6Н12 + H2 ,
C7H16 → С6Н5 -CH3 + 4H2
Нитрлеу реакциясы. Бұл реакцияны орыс ғалымы М.И.Коновалов (1888ж.) ашқандықтан, Коновалов реакциясы деп аталады. Қысым мен температураны аздап жоғарылатқанда, алкандар сұйылтылған азот қышқылы мен орынбасу реакциясына түседі:
CH4 + HNO3 → CH3NO2 + H2O,
CH3-CH2-CH3 + HNO3 → CH3-CH(NO2)-CH3 + H2O.
Алкендердің химиялық қасиеттері
Алкендер химиялық белсенді болғандықтан табиғатта өте сирек кездеседі. Оларға қосылу реакциялары тән. Еселі- қанықпаған (қос) байланысы бойынша алкендер қосылу реакцияларына жеңіл түседі. Себебі σ –байланысқа қарағанда әлсіз π-байланысы оңай үзіліп, көміртек атомының босаған валенттіктеріне әрекеттесуші реагент молекуласының атомдары мен атом топтары қосылады. Реакция нәтижесіне көмірсутек молекуласындағы қос байланыстың біреуі –дара (σ-) байланыс қалып, алкандар немесе олардың туындылары түзіледі. Қосылу реакцияларының жылдамдығы, галогенсутек қышқылының күші өсуіне байланысты артады:HF < HCl < НВг < HI. Галогенсутектердің симметриялы емес алкендерге қосылу реакциялары В. В. Марковников ережесі бойынша жүреді
СnН2n
![]()
СnН2n +
2  СnН2n +
2
СnН2n +
2
СnН2n -
2 
(-СnН2n-)n
 СО2
+
Н2О
СО2
+
Н2О
Этилен мен оның гомологтары қосылу, полимерлену және тотығу реакцияларына түседі.
Этен:
Гидрлеу реакциясы.Алкендер сутекті қосып алып, сәйкес алкандарға айналады. Реакция металл катализаторлар Ni, Pt, Pd қатысында жүреді. Мысалы этенге сутек косылғанда, этан түзіледі:
CH2=CH2 + H2 → CH3 -CH3,
Немесе осы реакцияны ықшамдап жазсақ:
C2H4 + H2 → C2H6
Сутек қосыла журетін реакцияларды гидрлену реакциясы деп атайды.
Гидрлену реакциясын зерттеуде Д. В. Сокольскийдің еңбегі зор.
Галогендеу реакциясы.Галогенденуі (галогендердің қосылуы). Алкендер галогендермен әрекеттескенде, реакция қос байланыс бойынша жүріп, нәтижесінде, алкандардың дигалогентуындылары түзіледі. Реакция алкенді галогеннің ерітіндісімен кәдімгі температурада әрекеттестіргенде жүреді. Алкендерді бромды сумен (бромның судағы ерітіндісі) әрекеттестіргенде, ерітіндідегі бромның қызыл қоңыр түсі жойылып, түссіз дибромалкандар (СnН2nВг2) түзіледі:
Н2С = СН2 + Вг2 → ВгН2С - СН2Вr
этилен 1,2-дихлорбром
Бромдау реакциясы алкендердің сапалық реакциясы болып табылады, бромның түссізденуі бойынша алкендерді сапалық анықтауға болады.
Алкендердің фтормен әрекеттесуі шабытты жүреді, ал йодпен әрекеттесуі баяу жүреді.
Этиленге хлор қосып, дихлорэтан С2Н4СІ2 алуға да болады.
Н2С = СН2 + СІ2 → СІН2С - СН2СІ
этилен 1,2-дихлорэтан
Галогенсутектерді қосып алу. Галогенсутектердің алкендердің қосып алу реакциясына түсуі ионды механизм арқылы іске асады. Симметриясыз алкендерге галогенсутектер қосылғанда екі түрлі өнім түзілетінін, реакция Марковников ережесі бойынша жүреді.
H2C=CH2 + HBr → CH3 -CH2Br,
Гидратация реакциясы. Суды қосып алу. Мұнда өршіткі ретіде күкірт Н2SО4 немесе Н3РО4 фосфор қышқылдары пайдаланылады. Алкендердің қышқылдық ортадағы гидратациясы иондық механизммен жүреді
CH2=CH2 + H2O → CH3-CH2OH.
Бұл реакцияның өнеркәсіптік маңызы зор.
Пропен молекуласына судың қосылуы Марковников ережесі бойынша жүріп, пропанол-1 емес, пропанол-2 түзіледі:
СH3—СH =CH2 + H - OH →H3C - CHOH-CH3
Галоген сутектер мен судың симметриялы емес алкендерге қосылу реакциялары В.В. Марковников ережесіне сәйкес жүреді. Ол былай тұжырымдалады: Гидрогалогендеу және гидраттау реакцияларында сутегі атомы субстрат құрамындағы сутегі атомы көп, яғни көп гидрогенденген, көміртегі атомына қосылады:
СН3-СН=СН2 + НСІ→ Н3С-СНСІ –СН3
Тотығу реакциясы. Этиленді көмірсутектер толық тотыққанда (жанғанда) жарқыраған жалын шығара жанады:
H2C=CH2 + 3O2 → 2CO2 + 2H2O,
Алкендер ауадағы оттектің және басқа тотықтырғыштардың әсерінен тотығады.Тотығудың бағыты реакция жағдайына және тотықтырғыштың табиғатына тәуелді. Күміс өршіткінің қатысуында ауадағы оттектің әсерінен алкенгдер органикалық оксидтерге яғни эпоксидтерге дейін тотығады.
CH2
=
CH2
+
O2 H2C -О
-CH2,
H2C -О
-CH2,
2H2C=CH2
+
O2 2CH3C(O)H,
2CH3C(O)H,
Жұмсақ тотығу кезінде бөлме температурасында сілтілік орта жағдайында КМnО4-тің судағы ерітіндісі этилен газын түссіздендіреді. Алкендердің қалыпты жағдайда тотығуы (Вангер реакциясы)
3CH2 = CH2 + 2KMnO4 + 4H2O → 3HO -CH2 -CH2 -OH + 2MnO2 + 2KOH,
С6Н6
+
CH2
=CH2 С6Н5
-CH2CH3,
С6Н5
-CH2CH3,
Полимерленуі реакциясы. Қысымның немесе өршіткінің әсерінен этилен қатты күйдегі үлкен молекулалы қосылыс полиэтиленге айналады.
CH2 = CH2 → (-CH2-CH2-)n.
CH2 = CH2 → HC≡CH + H2,
Пропен:
H2C=CH -CH3 + H2 → CH3 -CH2 -CH3,
H2C=CH -CH3 + Br2 → BrCH2 -CHBr -CH3,
H2C=CH -CH3 + HCІ → CH3 -CHCІ -CH3,
H2C=CH -CH3 + H2O → CH3 -CH(OH) -CH3,
H2C =CH -CH3 + С6Н6 → С6Н5- H3C–CH-CH3,
CH2
=
CH2
+
O2 H2C -О -СН
-CH3,
H2C -О -СН
-CH3,
3H2C = CH -CH3 + 2KMnO4 + 4H2O → 3HO -CH2 -CH(OH) -CH3 + 2MnO2 + 2KOH,
H2C = CH -CH3 → (-CH2 -C(CH3)H-)n.
Катализаторлар қатысында алкандар мен алкендер арасында алкилдеу реакциясы жүреді:
CH3 -CH(CH3) -CH3 + CH2 = C(CH3) -CH3 → CH3 -C(CH3)2 -CH2 -CH(CH3) -CH3.
CH2=CH-CH3
+
CІ2
 CH2=CH-CH2CІ +
HCІ,
CH2=CH-CH2CІ +
HCІ,
H2C=CH -CH3 → HC ≡ C -CH3 + H2.
Алкиндердің химиялық қасиеттері
Алкиндерге де алкендер тәрізді көміртек қаңқасына, еселі байланыс орнына сәйкес изомерлер тән. Сонымен қатар алкиндердің де көмірсутектердің басқа кластарынан изомері болады. Алкиндер мен жалпы формулалары бірдей (СnН2n-2) алкадиендер арасында класаралық изомерлер бар.
 СnН2n
+2
СnН2n
+2
![]() СnН2n -2
СnН2n -2
 СnН2n –
2Вr4
СnН2n –
2Вr4
 СО2
+Н2О
СО2
+Н2О
 СН2
=СН -
С≡СН
СН2
=СН -
С≡СН

![]()
Алкиндерге:
а) қосылу (гидрленуі,
галогенденуі, галогенсутектерді қосып алуы, гидратация реакциялары)
Марковников ережесі бойынша сутек атомы сутек атомы көбірек
көміртек атомына, ал галоген атомы сутек атомы азырақ көміртек
атомына қарай тартылады.
В.В. Марковников – орыс органик-химигі. Ол еңбектерін мұнай
химиясына, органикалық синтезге арнады. Нафтендерді зерттеді.
Гидратация реакциясы сынап (II) сульфатының қатысында жүреді. Оны
1881 жылы М.Г.Кучеров ашқан. Өнеркәсіпте осы жолмен алынады. Аралық
тұрақсыз өнім – винил спирті түзіліп, ол изомерленіп,
ацетальдегидке айналады:
Ацетилен:
Гидрогендеу реакциясы. Катализатор Nі, Рt, Рd қатысында ацетилен сутекті қосып алады, ол процесс сатылап жүреді:
HC≡CH
 CH2=CH2
CH2=CH2 CH3
-СH3,
CH3
-СH3,
Галогендеу реакциясы. Алкиндердің галогенденуі алкендерге қарағанда баяу жүреді және реакция барысында дигалогеналкендер түзілуі мүмкін. Оларды бөліп алу жеңіл. Ал галогенденудің 1,1,2,2- тетрабромэтан түзу сатысы қиындау жүреді. Ацетиленнің бром суымен әрекеттесуі еселі байланысы бар заттарға сапалық реакция болып табылады.
HC ≡CH +
Br2
→
BrCH=CHBr  Br2CH
-CHBr2,
Br2CH
-CHBr2,
Реакция соңында бром суы түссізденеді.
Гидрогалогендеу реакциясы. Галогенсутекті қосып алу. Алкиндердің галогенсутекті қосып алуы баяу жүреді, бірақ сынап (ІІ) хлориді НgСІ2 , т.б. катализаторлар қатысумен реакция жүруі тездейді:
HC ≡CH + HCІ →
CH2=CHCІ
 CH3
-CHCІ2.
CH3
-CHCІ2.
Кучеров реакциясы:
C2H2+
H2O
 [CH2
=CHOH] →
CH3COH
[CH2
=CHOH] →
CH3COH
Винил реакциясы:
CH ≡CH + C2H5OH → CH2 =CH -O -C2H5,
винилэтиловый эфир
CH ≡CH + HCN → CH2 = CH -CN,
синильная к-та акрилонитрил
CH ≡CH + H3C -COOH → CH3COO- CH=CH2
винилацетат
ди- мен тримерлену реакциясы:
2СH≡CН
 CH≡C
-CH=CH2,
CH≡C
-CH=CH2,
винилацетилен
3СH≡CН

![]()
Орынбасу реакциясы:
CH≡CH + 2Na → Na -С≡C -Na + H2,
CH≡CH + 2AgNO3 + 2NH3 → Ag -С≡C -Ag + 2NH4NO3,
CH≡CH + 2CuCІ +2NH3 → Cu-С≡C-Cu + 2NH4Cl.
Тотығу реакциясы:
3HC≡CH + 8KMnO4 → 3KO(O)C-C(O)OK + 8MnO2+ 2KOH + 2H2O,
2C2H2 + 5O2 → 4CO2 + 2H2O.
Пропин:
HC≡C-CH3
 CH2=CH—CH3
CH2=CH—CH3
 C3H8
C3H8
H3C–C≡CH +
Br2
→
H3C−CBr =
CHBr  H3C−CBr2−
CHBr2
H3C−CBr2−
CHBr2
HC≡C—CH3 + HBr → H2C=CBr—CH3 → H3C—CBr2—CH3,
С![]() Н3-С ≡СН +
Н2О
Н3-С ≡СН +
Н2О

тримерлену:
3CH ≡C -CH3 → С6Н3 –(СН3)3.
2CH3 -C≡CH + 2Na → 2CH3 -С≡C -Na + H2
CH3 -C≡CH + [Cu(NH3)2]OH → H3C -C≡CСu + 2NH3 + H2O
Алкадиендердің химиялық қасиеттері
Алкадиендер — қанықпаған көмірсутектердің маңызды түрлерінің бірі.
Алкадиендер — құрамында екі қос байланысы бар, жалпы формуласы СnН2n-2 болатын қанықпаған көмірсутектер.
Алкадиендерді кысқартып диен көмірсутектері деп те атайды. Диен көмірсутектерінің бірінші мүшесі пропадиен (аллен) СН2 = С = СН2. Диендерде қос байланыстардың өзара орналасуы әр түрлі болуы мүмкін. алкадиендердің номенклатурасы алкендерге ұқсас екенін, бар айырмашылығы — қос байланыстың саны екеу болғандықтан, -ен жұрнағының алдына оның саны көрсетіліп, -диен деп аталатындығын және бір кос байланыстан кейін үтірден соң екінші қос байланыстың орны көрсетілетінді.
Молекулаларында қос байланыстары болғандықтан, диендердің химиялық қасиеттері алкендерге ұқсас, бұлар да қосылу және полимерлену реакцияларына оңай түседі. Алкадиендер галогендерді, сутекті, галогенсутекті қосып алады. Молекулаларындағы қос байланыстары дара байланыспен бөлінген диендер қасиеттерінің ерекшеліктері бар. Бұл диендер реагенттерді бір немесе екі қос байланыстары бойынша (1,2 және 3,4 қосылу) да, молекуланың екі шетіне де (1,4 қосылу) қосып алады.
Косылу реакциясы. Галогендерді қосып алуы галогеннің табиғатына және реакция жағдайына тәуелді болады.Температура жоғарылағанда және хлордан йодқа қарай ауысқанда 1,4- реакция өнімінің мөлшері артады. Сондықтан да алкендердегі секілді қосып лау реакциясы әрі иондық, әрі радикалдық механизммен жүреді.
![]() BrCH2
–CHBr - CH
=CH2
BrCH2
–CHBr - CH
=CH2
H2C =CH -CH =CH2 + 2Br2
![]() Br
-CH2
–CH =CH
-=CH2Br
Br
-CH2
–CH =CH
-=CH2Br
Диен көмірсутектерінде электрондар тығыздығы атомдар арасына бірдей таралған. Қосылу реакциясы бір қос байланыс арқылы жүрсе, онда 1,2- қосылу деп, ал косарланған жүйе бұзылу арқылы жүрсе, онда 1,4 қосылу деп аталады.
Гидрленуі реакциясы.
Сутекті косып алуы (гидрленуі) сатылап жүреді:
Жартылай гидлену
H2C=CH -CH=CH2 + 2H2 → CH3 -CH =CH -CH3.
бутадиен – 1,3 бутен-2
толық гидрлену
CH3 -CH =CH -CH3+ 2H2 → CH3 -CH2 -CH2 -CH3.
бутен-2 бутан
Полимерленуі:
nH2C=CH -CH=CH2 → (-CH2 –CH = CH -CH2-)n.
Ароматты көмірсутектердің химиялық қасиеттері. Бензол.
Арендер — молекулаларының құрамында бензол сақинасы (бензол ядросы) бар жалпы формуласы СnН2n -6 болатын көмірсутектер. Арендердің ең қарапайым мүшесі — бензол С6Н6.
Бензол өте қанықпаған қосылыс бола тұра, кәдімгі жағдайда қанықпаған көмірсутектерге тән реакцияларға қатыспайды: бром суы мен калий перманганаты ерітіндісін түссіздендірмейді. Оның себебін бензолдың электрондық формуласы түсіндіреді: әр көміртектің р-электрондарының (6р)тұтасуынан түзілген
π-байланыс сақинаға орынбасуды, қосып алуды қиындатады. Сондықтан ароматты көмірсутектер қасиеттері жөнінен қаныққан және қанықпаған көмірсутектердің аралығында деуге болады.
Бензолдардың химиялық қасиеттері:
 С6Н6CI6
С6Н6CI6
 С6Н5-СН3
С6Н5-СН3
 СО2
+
Н2О
СО2
+
Н2О
![]() С6Н6
С6Н6
 С6Н5Вr
С6Н5Вr
 С6Н5
-SО3Н
С6Н5
-SО3Н
 С6Н12
С6Н12
 С6Н5
-NО2
С6Н5
-NО2
Бензол гомологтарының химиялық қасиеттері:
 С6Н5
-СН2CI
С6Н5
-СН2CI
 С6Н5-СН3СІ
С6Н5-СН3СІ
 СО2
+
Н2О
СО2
+
Н2О
![]() С7Н8
С7Н8
 С6Н5СООН
С6Н5СООН
 С6Н5
-СН3-SО3Н
С6Н5
-СН3-SО3Н
 С6Н5
–(NО2)3СН3
С6Н5
–(NО2)3СН3
C6H6
+
Cl2 C6H5CІ + HCІ
(галогендеу)
C6H5CІ + HCІ
(галогендеу)
C6H6
+
HNO3 C6H5-NO2
+
H2O
(нитлеу)
C6H5-NO2
+
H2O
(нитлеу)
С6Н6 С6Н5-SO3H +
H2O
(сульфендеу)
С6Н5-SO3H +
H2O
(сульфендеу)
С6Н6 +
RCІ
 С6Н5-R +
HCІ
(алкилдеу)
С6Н5-R +
HCІ
(алкилдеу)
С6Н6 + СН3СОCІ
 С6Н5-СОСН3
+ HCІ
(алкилдеу)
С6Н5-СОСН3
+ HCІ
(алкилдеу)
С6Н6 +
ЗН2 С6Н12 циклогексан (сутекті қосып
алуы)
С6Н12 циклогексан (сутекті қосып
алуы)
(1,2,3,4,5,6-гексахлороциклогексан, хлордй қосып алуы)
C6H6+
3СІ2 C6H6CІ6
C6H6CІ6
Толуол С6Н5 — СН3 судан жеңіл, суда ерімейтін, түссіз сұйықтық. Дәрі-дәрмектер, бояулар және қопарылғыш заттар (тротил, тол), синтетикалық жуғыш заттар, капролактам алу үшін қолданылады. Полимерлердің жаксы еріткіші болып табылады. Антидетонаторлық қасиетін өсіретін болғандықтан, бензинге қоспа ретінде қолданылады.
КMnO4- тің қызғылт түсті ерітіндісін түссіз толуолға құйып, қоспаны аздап қыздырғанның өзінде ерітінді біртіндеп түссізденеді. Оның себебі бензол сақинасының әсерінен метил тобындағы атомдарда белсенділік байқалып, ол тез тотығады да карбоксил –СООН тобына айналады:
C6H5-CH3 + 3О → C6H5-CООН + H2O
С6Н5-CH3 + [О] → С6Н5-COOH кипячение с раствором КMnO4 (окисление алкилбензолов)
Толуолдағы метил СН3–тобының бензол сақинасына әсерін оның азот қышқылымен әрекеттесуінің оңай жүреді. Нәтижесінде бензол сақинасындағы 2,4,6- орындарында электрон тығыздықтары өседі де үш сутек атомдары орынбасу реакциясына оңай түседі.
C6H5-CH3 + НОNО2 → C6H2(NО2)3-CH3 + 3Н2О
Метил тобының –СН3 электрон тығыздығы бензол сақинасына қарай ығысуы нәтижесінде сақинадағы электрон тығыздығының біркелкі бөлінуі бұзылады.
C6H5-CH3
+
СІ2
 C6H5-CH2СІ +
НСІ
C6H5-CH2СІ +
НСІ
C6H5-CH2СІ +
СІ2
 C6H5-CHСІ2
+ НСІ
C6H5-CHСІ2
+ НСІ
C6H5-CHСІ2
+
СІ2
 C6H5-CСІ3
+ НСІ
C6H5-CСІ3
+ НСІ
C6H5-CH3 + 2KMnO4 → C6H5COOK + 2MnO2 + KOH + H2O,
5C6H5-CH3 + 6KMnO4 + 9H2SO4→ 5C6H5COOH + 6MnSO4+ 3K2SO4+ 14H2O.
Оттекті органикалық қосылыстар. Спирттер.
Қаныққан біратомды спирттердің химиялық қасиеттері.
 R
-ОNа
R
-ОNа
 R
–Гал.
R
–Гал.

![]() R-ОН
R-ОН СnН2n
СnН2n
 R-О-R
R-О-R
 СО2
+
Н2О
СО2
+
Н2О

Спирттердің химиялық қасиеттерін анықтайтын гидроксил тобы және ол байланысқан радикалдардыц құрылысы. Гидроксил тобы қатысында өтетін реакциялар О—Н немесе С—ОН байланыстарын үзу арқылы жүреді. Спирттер (алканолдар) полюсті косылыстар, көміртек пен оттек және оттек пен сутек атомдарының арасында екі полюсті байланысы бар: С → О жәнө О ← Н . О ← Н байланысының полюстігі С → О байланысының полюстігіне қарағанда жоғары. Оттектің жұп электрондары спирттерге электрондонорлық қасиет береді.
Қаныққан біратомды спирттердің жалпы формуласы СН- ОН . Олар сутектің бір атомы гидроксил тобына алмасқан алкандардың туындылары. Ең қарапайым спирт метанол СНОН. Спирттер молекуалаларының арасындағы сутектік байланыс олардың қасиеттеріне әсер етеді
Спирттердің химиялық қасиеттері
Спирттің гидроксил тобындағы сутек атомының орнын белсенді металдар баса алады:
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2.
Спирттер галогенсутектермен әрекеттеседі, бұл гидроксил тобының орнын галоген басу арқылы өтетін қайтымды реакция:
C![]()
![]() 2H5OH + НBr
C2H5Br +
H2O,
2H5OH + НBr
C2H5Br +
H2O,
Гидроксил тобының алмасуы:
CH3CH2CH2-OH + PCl5 → CH3CH2CH2CІ + POCІ3 + HCІ,
CH3CH2CH2-OH + SOCІ2 → CH3CH2CH2CІ + HCІ + SO2.
Дегидратация реакциялары.
Жоғарырақ температурада t0 > 1400С дегидратациялағанда, реакция молекула ішінде өтеді, нәтижесінде алкен түзіледі:
CH3CH2CH2OH → СH3CH=CH2 + H2O,
CH3CH2CH(OH)CH3 → СH3CH=CHCH3 + Н2О.
Егер дегидратациян төменірек температурада жүргізсе, онда реакция молекулааралық өтеді де, жай эфир түзіледі:
2CH3
-CH2
–OH
 CH3
-CH2
–O
-CH2
-CH3
+
Н2О.
CH3
-CH2
–O
-CH2
-CH3
+
Н2О.
Мыс (ІІ) оксидімен тотығып, альдегид түзуі біріншілік спирттердің сапалық реакциясы:
C2H5OH + CuO → CH3C(O)H + Cu + H2O,
Тотығу реакциялары.
Тотықтырғыштардың әсерінен (хромды қоспа K2Cr2O7+ H2SO4), біріншілік спирттер альдегидке дейін, ал екіншілік спирттер кетонға дейін тотығады:
3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3COH + Cr2(SO4)3 + K2SO4 + 7H2O,
3C2H5OH + 2K2Cr2O7 + 8H2SO4 → 3CH3COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O.

Көпатомды спирттер.
Молекуласында екі гидроксил тобы бар спирттерді екі атомды спирттер немесе гликольдер деп атайды. СnH2n(OH)2.
HOCH2 -CH2OH.
Химиялқ қасиеттері:
Көпатомды спирттердің құрамында гидроксил топтары болғандықтан, химиялық қасиеттері біратомды спирттерге ұқсас. Олармен белсенді металдар әрекеттесіп, гидроксил тобында сутекті ығыстырады, галогенсутектермен орынбасу реакциясына түседі, спирттермен әрекеттесіп жай эфирлер, карбон қышқылдарымен әрекеттесіп күрделі эфирлер түзіледі. Реакцияға бір гидроксил тобы түсуі мүмкін:
HOCH2 -CH2OH + 2Na → NaOCH2 -CH2ONa + H2↑,
HOCH2 -CH2OH + CH3OH → HOCH2 -CH2 -O-CH3 + H2O,
HOCH2 -CH2OH + 2CH3OH → СH3OCH2 -CH2OCH3 +2H2O,
HOCH2 -CH2OH + HCІ → HOCH2 -CH2CІ,
4HOCH2 -CH2OH + 2PCІ5 → CІCH2 -CH2CІ + 2P(O)CІ3 + 2HCІ,

![]()
Көпатомды спирттердің құрамында бірнеше гидроксотоптардың болуынан сутек атомдары қозғалғыш келеді де, олар ауыр металдардың гидроксидтермен де әрекеттеседі. Бұл реакция –көпатомды спирттерге сапалық рекция.

![]()
![]()
![]()
![]()
Үш атомды спирттер
Бұлардың ең қарапайым өкілі - глицерин
HOCH2-CH(OH)-CH2OH.
2HOCH2-CH(OH)-CH2OH + 6Na → 2NaOCH2-CH(ONa)-CH2ONa + 3H2,


немесе реакция теңдеуін ықшамдап былай жазуға болады:
HOCH2-CH(OH)-CH2OH
 →
СІCH2-CH(OH)-CH2OH
→
СІCH2-CH(OH)-CH2OH
 →
→
→ СІCH2-CH(СІ)-CH2OH
 →
СІCH2-CH(СІ)-CH2СІ
→
СІCH2-CH(СІ)-CH2СІ
Этерификация реакциясы:

![]()

![]()
Фенолдың химиялық реакциясы
 С6Н5
-ОNа
С6Н5
-ОNа
 С6Н5
–СІ
С6Н5
–СІ
 С6Н2Вr3ОН
С6Н2Вr3ОН
![]() С6Н5-ОН
С6Н5-ОН С6Н2(NО2)3ОН
С6Н2(NО2)3ОН
 С6Н4SО3НОН
С6Н4SО3НОН
 С6Н5
–О-СН2-СН3
С6Н5
–О-СН2-СН3
 (-C6H3OH-CH2-)n
(-C6H3OH-CH2-)n
 С6Н5ОССН3О
С6Н5ОССН3О
Фенол молекуласындағы –ОН тобының бензол сақинасының орта-және пара- орындарына әсері едәуір болғандықтан оттек атомы сутек атомынан электрондық тығыздықты өзіне қатты тартады. О ← Н арасындағы ковалентті байланыс полярлы болғандықтан сутек атомы қозғалғыш күйге түседі. Бұл жағдайда фенол сілтімен оңай әрекеттесіп фенолят түзіледі.Бензол сақинасыына электрон-акцепторлы орынбасушылар нитротоп пен галогендер енгізсе, фенолдың қышқылдық қасиеті жоғарылайды.
Гидроксил тобының реакциялары. Қышқылдығы. Фенолдың қышқылдық қасиеті спирттерден басым болғанмен, ол әлсіз қышқыл. Тіпті көмір қышқылы мен сірке қышқылынан да әлсіз, лакмустың түсін өзгерте алмайды.
Спирттен өзгешелігі-фенол қышқылдармен әрекеттеспейді.
1. Фенолдың балқу температурасына дейін қыздырып, оған металл натрий салса, реакция сутек бөліне жүреді:
2C6H5OH + 2Na → 2C6H5ONa + H2.
Фенолдың бұл қасиеті спирттерге ұқсас
2. Спирттерден ерекшелігі- фенол қышқылдық қасиет көрсететіндіктен, сілтілердің судағы ерітіндісімен әрекеттесіп, реакция нәтижесінде тұздар (фенолят) түзіледі:
C6H5OH + NaOH → C6H5ONa + H2O,
Фенолдың қышқылдығы төмен болғандықтан , фенолят әлсіз қышқылдың әсерінен-ақ ыдырап кетеді:
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
Бензол сақинасының реакциялары. Электрофильді орынбасу реакциясы. Фенолдың гидроксил тобы бензолдың (орто- және пара-орындарына үлкен әсерін тигізеді.Бұл орындарда (электрофильді) орынбасу реакциялары оңай өтеді.
3. Фенол бромды сумен оңай әрекеттесіп, ақ түсті 2,4,6-трибромфенол тұнбаға түседі. Бұл-фенолдың сапалық реакциясы:
![]()
![]()


![]()
![]()
![]()
4. Концентрациялы азот қышқылымен әрекеттескенде ,2,4,6-тринитрофенол алынады, Бұл қосылысты пикрин қышқылы деп те атайды:

![]()

![]()
![]()
С6Н5ОН + (СН3СО)2О → СН3СООС6Н5 + СН3СООН ( о-ацилирование)
С6Н5ОН + СН3СОСІ → СН3СООС6Н5 + НСІ
6. Фенол формальдегидпен оңай әрекеттеседі. Реакция қышқыл немесе негіз қатысында жүреді. Бұл реакция нәтижесінде, жоғары молекулалы қосылыс фенолформальдегид шайыры алынады.
7. Фенол темір (ІІІ) хлоридімен күлгін түсті кешенді қосылыс түзеді, бұл реакция фенол үшін сапалық реакция ретінде пайдалануға болады.
Фенолдар спирттерге қарағанда қышқылдық қасиеттері күштірек. Бұл қасиет Фенолдарда теріс электрлігі жоғары топ қосылған сайын күшейе береді, мысалы, нитротоп, галоген, күкірт. Фенолдар сілтілерде еріп феноляттар, сілтілік ортада оңай ацилденіп алифатты және хош иісті қышқылдардың күрделі эфирлерін, алкилденіп жай эфирлер түзеді.
Фенолдың альдегидтермен поликонденсациялануы.
Фенол формальдегидпен поликонденсация реакциясына қатысады, нәтижесінде, фенолформальдегид шайыры түзіледі:
n C6H5OH + n CH2O → n H2O + (-C6H3OH-CH2-)n
Альдегидтер мен кетондардың химиялық қасиеттері
 R
-СН2
–ОН
R
-СН2
–ОН
![]() R-СОН
R-СОН  R–НСОН-SО3Nа
R–НСОН-SО3Nа
 R
-СООН
R
-СООН
Альдегидтер мен кетондар кұрамында >С=Окарбонил тобы болады. Оларды кейде оксоқосылыстар деп атайды, ал карбонил тобын оксотоп дейді. Альдегидтерде карбонил тобы бір радикалмен және сутек атомымен байланыскан, ал кетонда карбонил тобы екі радикалмен байланысқан.
Құрамында еселі байланыс болғандықтан, карбонилді қосылыстарға қосылу реакциясы тән. Қосылатынреагенттің теріс зарядталған бөлігі көміртек атомына, ал оң зарядталған бөлігі оттек атомына қосылады. Басқа органикалық қосылыстарменсалыстырғанда, альдегидтерде карбонилді топпен байланысқан С-Н байланысының белсенділігі жоғары және реакцияға жеңіл түседі.Альдегидтер мен кетондар көптеген химиялық реакцияға белсенді қатысады. Бұл карбонил тобындағы қос байланыстың біреуі σ- байланыс, ал екінші π- байланыс болғандықтан, электрон тығыздығы көміртек атомынан оттегі атомына қарай ығысып, поляризациялануынан болады. Сондықтан химиялық реакция кезінде карбонил тобы жоғарғы белсенділік көрсетеді. Олар қосып алу, алмасу, тотығу, полимерлену, конденсация реакцияларына қатысады.
Альдегидтердің химиялық қасиеттері:
Қосылу реакциялары.
а)Қос байланысқа сутектің қосылуы. Альдегидтер мен кетондар карбонил тобының қос байланысы бойынша металл катализаторлар (Nі, Рt) қатысында сутекті қосып алып, тотықсызданады. Реакция нәтижесінде альдегидтер біріншілік спиртке, ал кетондар екіншілік спиртке айналады.
CH3 -COH + H2 → CH3 -CH2OH,
б) Көгерткіш қышқылды (НСN) қосып алу. Оксинитрилдер түзіледі.
CH3 –COH + HCN → CH3OHCH -C≡N
циангидрин.
в) Альдегидтер спирттерді қосып алып, жартылайацетальдар түзіледі.Егер реакцияны хлорлы сутек қатысында қыздыру арқылы жүргізсе, толық ацеталь түзіледі.

![]()
![]()

![]()
![]()
![]()
CH3
-COH
 CH3
-CH2OH,
CH3
-CH2OH,

5CH3-COH + 2KMnO4 + 3H2SO4 → 5CH3-COOH + + 2MnSO4 + K2SO4+ 3H2O,
CH3-CH2-COH + 2[Ag(NH3)2]OH → CH3-CH2-COONH4 + 2Ag + 3NH3 + H2O
(«Күміс-айна» реакциясы),
Альдегидтерге сапалық реакция ретінде мыс (II) гидроксидімен жүретіп реакцияны да қолдануға болады. Алғаш сары тұнба — мыс (I) гидроксиді түіледі. Содан кейін ол қызыл түсті мыс (I) оксидіне айырылады:
CH3-(CH2)2-COH +
2Cu(OH)2 CH3-
(CH2)2-COOH +
Cu2O +
2H2O.
CH3-
(CH2)2-COOH +
Cu2O +
2H2O.
Дигалогеналкандардың алынуы
CH3-(CH2)2-C(O)H + PCl5 → CH3-(CH2)2-CHCІ2 + POCІ3.
Орынбасу реакциясы:
CH3 -CH2 -CH2 -COH + CІ2 → CH3-CH2 -CHCІ -COH + HCl.
Полимеризация реакциясы:
nH-COH → [-O-CH2-]nn= 10—100.
Кетондардың химиялық қасиеттері:
CH3-CH2-C(O)-CH3 + H2 → CH3-CH2-CH(OH)-CH3,
CH3-CH2-C(O)-CH3 + PCІ5 → CH3-CH2-CCІ2-CH3 + POCІ3,
CH3-C(O)-CH3 + Br2 → BrCH2-C(O)-CH3 + HBr,
C6H5-C(O)-CH3 + CІ2 → C6H5-C(O)-CH2CІ + HCІ.
Карбон қышқылдарының химиялық қасиеттері.
![]() R-СООМе
R-СООМе
 R-СООМе
R-СООМе
 R-СООМе
R-СООМе
 R-СООNа +
СО2↑
R-СООNа +
СО2↑
![]()
![]() R-СООН
R-СООН R-СООR1
R-СООR1
 R-ОС-О-СО-
R
R-ОС-О-СО-
R
 R
–СО-СІ
R
–СО-СІ
R-СІСН-СООН
Карбон қышқылындағы карбоксил тобы-СООН-тың әсерінен көмірсутек радикалындағы сутектің қозғалғыштығы артып (-СООН жақын болса) ол галогенмен орынбасу реакциясына түседі
Карбон қышқылдарының химиялық қасиеттері:
бірнеше карбоксил тобы -СООН болады.Жалпы формуласы СnH2nO2 не CnH2n+1COOH. Карбон қышқылдары қаныққан, қанықпаған және ароматты болып бөлінеді. Құрамындағы карбоксил тобының санына байланысты бір негізді, екі негізді, көп негізді болып бөлінеді. Бір негізді карбон қышқылы: СН3СООН, СН3 – СН2 – СООН.
Қаныққан бір негізді карбон қышқылдарының изомериясы көміртегі тізбегінің құрылысына байланысты, изомері көміртегі атомдар саны 4-тен жоғары басталады. C3H7COOH – екі изомер; C4H9COOH – төрт изомері болады. HCOOH – құмырсқа (метан) қышқылы; СН3-СООН - сірке (этан) қышқылы; С2Н5-СООН - пропион (пропан) қышқылы; С3Н7-СООН - май (бутан) қышқылы; СН3- СН(СН3) – СООН - изомай (2-метилпропан) қышқылы
Тұз түзу. Карбон қышқылдары металдармен, сілтілермен, карбонаттармен әрекеттесіптұздартүзеді:
Белсенді және орташа белсенді металдармен әрекеттескенде, тұз түзіліп, сутек ығысады:
2CH3-COOH + Ba → (CH3-COO)2Ba + H2↑,
2CH3COOH + Fe → (CH3COO)2Fe + Н2
Металл оксидтерімен және гидроксидтерімен әрекеттескенде, тұз және су түзіледі:
2CH3-COOH + CuO → (CH3-COO)2Cu + H2O,
2CH3COOH + MgO → (CH3COO)2Mg + Н2O
HCOOH + KOH → HCOOK + H2O,
CH3COOH + KOH → CH3COОК + Н2O
Әлсіз қышқылдарды тұздарынан ығыстырады:
CH3COOH + NaHCO3 → CH3COONa + CO2 + Н2O
Аммиакпен әрекеттескенде, аммоеий тұзы түзіледі:
HCOOH + NH3 → HCOONH4
C![]()
![]() H3COONa +
H2O
CH3COOH +
NaOH
H3COONa +
H2O
CH3COOH +
NaOH
2СH3COOH → СH3 -ОC-O-СО-CH3 + H2O,
СH3CH2COOH + SOCІ2 → СH3CH2COCІ + HCІ + SO2,
СH3CH2COOH + PBr5 → СH3CH2COBr + HBr + P(O)Br3,
СH3COOH + PCІ5 → СH3COCІ + HCІ + P(O)CІ3.
Күрделіэфиртүзу.
Карбон қышқылдары спирттермен әрекеттесіп, күрделі эфирлер түзіледі, су тартатын конц. күкірт қышқылы қатысады.
С![]() H3CH2COOH +
CH3OH
H3CH2COOH +
CH3OH
 СH3CH2–COOCH3
+
H2O.
СH3CH2–COOCH3
+
H2O.
СH3CH2COOH + CH≡CH → СH3CH2COO-CH=CH2
Күрделі эфирлердің химиялық қасиеттері.
Гидролиздену реакциясы. Күрделі эфирлердің гидролизі этерификация реакциясына кері реакция, қышқыл немесе сілті қатысында жүреді. Күрделі эфир сумен әрекеттесіп айырылып, реакция нәтижесінде қышқыл және спирт түзіледі:
CH3–COOC2H5 + H2O → CH3COOН + C2H5OН
С![]()
![]() H3CH2COOH +
CH3OH
СH3CH2–COOCH3
+
H2O.
H3CH2COOH +
CH3OH
СH3CH2–COOCH3
+
H2O.
қышқыл спирт күрделі эфир
CH3–COOC2H5 + NаOН → CH3COONа + C2H5OН
Күрделі эфир карбон қышқылының тұзды
Майлардың химиялық қасиеттері.
Глицеридтерді түзуге, негізінен, қаныққан қышқылдардан пальмитин С15Н31СООН мен стеарин С17Н35СООН қышқылдары, қанықпаған қышқылдардан — олеин С17Н33СООН, линол С17Н31СООН, линолен С17Н29СООН қышқылдары қатысады. Кейбір майлардың құрамына төменгі қышқыл қалдықтары кіреді. Мысалы, сары майда май қышқылының (С4Н9СООН) қалдығы болады. Сиырдың сары майы құрамына май қышқылымен қатар пальмитин және олеин қышқылдарының қалдықтары кіреді.
Майлардыц гидролизі. Күрделі эфир болғандықтан, майлар минерал қышқылдар, сілтілер қатысында қыздырғанда, гидролизденеді. Сонымен қатар майлар тірі организмде ферменттердің әсерінен гидролизденеді. Реакция нәтижесінде глицерин мен карбон қышқылы түзіледі:

![]()
![]()
Сілті қатысында гидролизденгенде, глицерин мен карбон қышқылының тұзы (сабын) түзіледі. Бұл реакция майдың сабындану реакциясы деп аталады:

![]()
Гидролиз процесін жүргізу үшін майларды сумен қосып, автоклавта (қысымда) қыздырады. Егер майларды сода немесе сілті қосып қыздырса, сабын түзіледі. Сабынды бөлу үшін натрий хлоридін қосады. Сабын алу үшін қатты майлар қолданылады. Қатты майлар бағалы тамақ өнімдері, сондықтан құрамында қанықпаған қышқылдары бар сұйық майларды қатты майларға айналдырады.
2. Майларды гидрлеу (гидрогендеу). Өсімдік майларының құрамына қанықпаған қышқылдардың күрделі эфирлері кіретін болғандықтан, оларды гидрлеуге болады. Қыздырылған май (150—160°С температурада) және ұнтақталған никель катализаторы қоспасына сутек жібергенде, май құрамындағы еселі байланыстар сутекпен қанығады. Реакция нәтижесінде сұйық май қатты майға айналады. Ол майды саломас немесе құрама май деп атайды:

![]()
Аминдердің химиялық қасиеттері
Аминдер аммиакқа ұқсас негіздік қасиет көрсетеді. Аминдердің негіздік қасиеті — аммиактан жоғары. Себебі аммиакта үш сутек атомының электрон бұлттары азотқа қарай ығысады, ал алкиламиндерде, мысалы, метиламинде екі сутек атомы тікелей жоне үш сутек көміртектің атомы арқылы барлығы бес сутектің электрондары азотқа қарай ығысады. Осының әсерінен метиламинде азот атомындағы теріс зарядтың мөлшері аммиактағы азот атомына қарағанда жоғары болады:
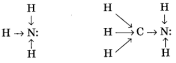
Теріс заряды көп болғандықтан, амин молекуласындағы азот атомы протон қосып алуға бейім болады да, негіздік қасиет көрсетеді.
Аминдердің протон қосып алуы
Аминдер сулы ерітінділерінде аммиак сияқты оң зарядталған сутек ионын (протонды) қосып алып, аммонийлі қосылысқа айналады. Ерітіндіде гидроксил иондары босап, сілтілік орта береді, лакмусты көк түске, фенолфталеинді таңқурай түске бояйды
1. Қышқылдарға протонды бөлу тән болса, негіздерге протонды қосып алу тән болады:
CH3-NH2 + Н2O → [CH3-NH3]+OH-
2. Негіздік қасиет көрсететіндіктен, аминдер аммиак сияқты қышқылдармен әрекеттесіп, тұз түзеді:
(CH3)2NH + HCІ → [(CH3)2NH2]CІ
хлорид диметиламмония
[(CH3)2NH2]CІ + NaOH → (CH3)2NH + NaCІ + H2O
Анилин химиялық реакцияларға амин тобы жәнө бензол ядросы бойынша түседі.
1) Амин тобы бойынша жүретін реакциялар. Анилин қышқылдармен әрекеттесіп, тұз түзеді:
C6H5-NH2 + HCІ → [C6H5-NH3]+CІ-
Аминқышқылдардың химиялық қасиеттері
Аминқышқылдары екідайлы қасиет көрсететіндіктен, қышқылдармен де, негіздермен де әрекеттесетін амфотерлі қосылыстар.
Негіздік қасиет қөрсетіп, қышқылдармен әрекеттеседі:
H2N-CH2-COOH + H+CІ- → [H3N-CH2-COOH]+Cl-
Тұздар түзуі
H2N-CH2-COOH + NaOH → H2N-CH2-COONa+ + H2O
Аминқышқылдарының өзара әрекеттесуі- олардың маңызды қасиеті. Реакцияға бірдей немесе әр түрлі аминқышқылдары түсулері мүмкін. Реакция бір аминқышқылының карбоксил тобы мен екінші қышқылдың амин тобының әрекеттесуі арқылы жүреді.
Аминқышқылдырының қалдықтары өзара –СО-NН- пептид (амид) тобымен жалғасады. Бұл байланыс (-СО-NН-) пептидтік (амидтік) байланыс деп аталады.
Екі аминқышқылының әрекеттесуі нәтижесінде дипептид түзіледі:
H2N-CH2-CO OH + H-NН-CH2-COOH → H2N-CH2-CO-NН-CH2-COOH + H2О
дипептид
Көмірсулардың химиялық қасиеттері
Глюкоза құрамында альдегид тобы бар көпатомды спирт болғандықтан, альдегидтерге және көпатомды спирттерге тән екі жақты қасиет көрсетеді.Альдегид тобына тән реакциялары. Глюкоза жақсы тотықсыздандырғыш, жұмсақ тотықтырғыштардың әсерінен, мысалы, күміс оксидінің аммиактағы ерітіндісімен альдегид тобы ғана тотығып, глюкон қышқылына айналады:
С5Н11O5-CHO +
Ag2O
 CH2OH-(CHOH)4-COOH +
2Ag↓
CH2OH-(CHOH)4-COOH +
2Ag↓
(глюконовая кислота)
Мыс (II) гидроксидімен қыздырғанда, альдегид тобы тотығып, карбоксил тобына айналады және мыс (І) оксидінің қызыл түсті тұнбасы түзіледі:
С5Н11O5-CHO +
Сu(ОН)2
 CH2OH-(CHOH)4-COOH +
Сu2О↓ +
2Н2О
CH2OH-(CHOH)4-COOH +
Сu2О↓ +
2Н2О
С5Н11O5-CHO + Вr2 + Н2O → CH2OH-(CHOH)4-COOH + 2НВr
Никель өршіткісі қатысында сутекпен тотықсызданып, алтыатомды спирт –сорбитті түзеді:
С5Н11O5 -CHO
+ Н2
 CH2OH-(CHOH)4-CH2OH
CH2OH-(CHOH)4-CH2OH
сорбит
Спирттік ашу. Ашытқы ферменті әсерінен ашып, глюкозадан этанол түзіледі. Бұл процестің химизмі өте күрделі. Жүретін өзгерістерді қысқаша былай жазады:
а) С6Н12O6 → 2С2Н5OH + 2CO2
Сүт қышқылды ашу. Глюкоза сүт қышқылды ашығанда, сүт қышқылы түзіледі. Процесс сүт қышқылды бактерия ферменттерінің әсерінен жүреді: Сүт қышқылды ашуы. Глюкоза сүт қышқылды ашығанда, сүт қышқылы түзіледі. Процесс сүт қышқылды бактерия ферменттерінің әсерінен жүреді:
С6Н12O6 → 2CH3-CH(OH)-COOH
Май қышқылы ашу.
С6Н12O6 → С3Н7COOH + 2CO2 + 2Н2O
С6Н12O6+ O2 → HOOC-CH2-С(OH)(COOH)-CH2-COOH + 2Н2O
С6Н12O6 → С4Н9OH + CH3-CO-CH3 + 5CO2 + 4Н2
«Сызбанұсқа бойынша өзгерістерді жүзеге асыру»
Органикалық реакциялар тізбектерін немесе химиялық өзгерістер тізбектерін шешу.
І. Ашық тізбектер
1-жаттығу. Төменде келтірілген өзгерістерді орындауға мүмкіндік беретін реакция теңдеулерін жазып, олардың жүру жағдайларын көрсетіндер:
СН4 → СН3Br → С2Н6 → С2Н5Cl → С2Н5ОН → СН3СОН → СН3СООН → СН3СООС2Н5
Шешуі.
Галогеналкилдерді алкандарды галогендеп алуға болады.Метанның бромдау реакциясы жарықтың немесе температураның әсерінен жүреді:
СН4
+
Br2 CH3Br +
HBr
CH3Br +
HBr
Вюрц реакциясы металл натрий қатысында жүреді, реакция нәтижесінде алкандардың көміртек саны көбірек гомологтарын алуға болады. Көмірсутектердің галогентуындылары металл натриймен әрекеттескенде (Вюрц реакциясы) көміртек қаңқасы ұзарып, галогенид ионы бөлінеді:
CH3Br + 2Na → H3C -CH3 + 2NaBr
C2H6
+
СІ2 CH3CH2СІ
+
HСІ
CH3CH2СІ
+
HСІ
Галогеналкилдердің галоген атомдарын басқа атом топтарына ауыстыруы, олардың маңызды реакциясы болып табылады. Осы реакциялар арқылы органикалық қосылыстардың басқа кластарына өтуге болады. Галогеналкил сілтінің судағы ерітіндісімен әрекеттескенде спирт түзіледі:
С2Н5Cl
+ KOH C2H5OH
+ KCl
C2H5OH
+ KCl
Мыс (ІІ) оксидімен тотығып, альдегид түзуі біріншілік спирттердің сапалық реакциясы. Реакция барысында қара түсті мыс (ІІ) оксиді тотықсызданып, қызғылт түсті мыс түзіледі және альдегидтің өткір иісі сезіледі:
C2H5OH + CuO → CH3-CHO + Cu + H2O
Альдегидтерге сапалық реакция ретінде мыс (ІІ) гидроксидімен жүретін реакцияны да қолдануға болады. Алғаш сары тұнба- мыс (І) гидроксиді түзіледі. Содан кейін ол қызыл түсті мыс (І) оксидіне айырылаы:
CH3-CHO
+2Cu(OН)2 CH3-COOH +
Cu2O+2H2O
CH3-COOH +
Cu2O+2H2O
Карбон қышқылдары сусорғыш заттар қатысында (мысалы, концентрлі Н2SО4) спирттермен әрекеттесіп, күрделі эфир түзеді, бұл –этерификация реакциясы:
CH3-COOH + HO
-CH2
–
CH3 CH3-COO
-CH2
–
CH3
+
H2O
CH3-COO
-CH2
–
CH3
+
H2O
2-жаттығу. Мына айналуларды:
CaC2
 C2Н2
C2Н2 C2Н4
C2Н4 C2Н5Br
C2Н5Br
 C2Н5NH2
C2Н5NH2 [C2Н5NH3]HSO4
[C2Н5NH3]HSO4
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар
Шешуі.
Ацетиленді кальций карбидін сумен әрекеттестіріп алады
CaC2 + 2H2O →Ca(OH)2 ↓ + C2Н2↑
Сутектің қосылуы өршіткі (никель, платина) қатысында қыздыру арқылы жүреді.
C2Н2
+Н2
 C2Н4
C2Н4
Алкендерге галогенсутектердің қосылуы оңай жүріп, нәтижесінде, галогеналкандар түзіледі
C2Н4+ HBr→C2Н5Br
3-жаттығу. Мна айналуларды:
С4Н8О→С4Н8Вr2О→С4Н7Вr3→С4Н10О3.
жүзеге асыруға мүмкіндік беретін реакция теңдеулерін жазыңдар. Реакция теңдеулеріндегі бастапқы затпен өнімнің құрылым формуласын көрсетіндер.
Шешуі.
1) СН2 = СН-СН2-СН2ОН 2) СН3 –СН = СН -СН2ОН

Реакция теңдеулері:



Жауабы. Бастапқы зат- бутен-3-ол-2, соңғы - бутан-3-ол-1,2,3.
4-жаттығу. Мына айналуларды:
С4Н10О→ С4Н8О → C5H9ON → C5H13O3N.
жүзеге асыруға мүмкіндік беретін реакция теңдеулерін жазыңдар.
Шешуі.
C5H9ON -C4H8O = HCN,
СН3СН2СН2-СН=О + HCN→СН3СН2СН2-СН -ОН
CN
С4Н8О C5H9ON
СН3СН2СН2-СН2ОН +
СuО СН3СН2СН2-СН = О + Сu +
Н2О
СН3СН2СН2-СН = О + Сu +
Н2О
С4Н10О С4Н8О
СН3СН2СН2-СН-ОН +
2Н2О СН3СН2СН2-СН-ОН
СН3СН2СН2-СН-ОН
CN COONH4
C5H9ON C5H13O3N
Жауабы. Бастапқы зат-бутанол-1, соңғы зат - 2-гидроксипентан қышқылы аммоний тұзы.
5-жаттығу. Берілген айналуларды орындауға мүмкіндік беретін реакция теңдеулерін жазыңдар:
натрияацетаты → сірке қышқылы → хлорсірке қышқылы
Шешуі.
CH3COONa + HCІ → СН3СООН + NaCІ.
СН3СООН + СІ2→ СН2СІСООН + НСІ
6-жаттығу. Берілген айналуларды орындауға мүмкіндік беретін реакция теңдеулерін жазыңдар:
сахароза→ глюкоза → глюкон қышқылы
Шешуі.
С12Н22О11
+
Н2О С6Н12О6+
С6Н12О6
С6Н12О6+
С6Н12О6
сахароза глюкоза фруктоза
СН2ОН-(СНОН)4
-СНО +
2Сu(ОН)2
 СН2ОН—(СНОН)4-СООН +
Cu2O↓ +
2Н2О.
СН2ОН—(СНОН)4-СООН +
Cu2O↓ +
2Н2О.
7-жаттығу. Берілген айналуларды орындауға мүмкіндік беретін реакция теңдеулерін жазыңдар:.
С6Н6 →С6Н5С2H5→ С6Н5СOOH→ С6Н5СOOСH3→ СН3OH→CH3OCH3
Шешуі.
C6H6 +
C2H5Cl
 C6H5-C2H5 +
HCl
C6H5-C2H5 +
HCl
5C6H5-C2H5 + 12KMnO4 + 18H2SO4 = 5С6Н5СOOH + 5CO2 + 12MnSO4 + 6K2SO4 + 28H2O
С6Н5СOOH + CH3OH С6Н5СOOCH3 + H2O
С6Н5СOOCH3 + H2O
С6Н5СOOCH3 + NaOH → С6Н5СOONa + CH3OH
2CH3OH CH3OCH3 + H2O
CH3OCH3 + H2O
8-жаттығу. Мына айналуларды:
CaCO3
 CaO
CaO  CaC2
CaC2 C2Н2
C2Н2 CH2
= CНСІ
CH2
= CНСІ
 (-
CH2
=
CНСІ-)n
(-
CH2
=
CНСІ-)n
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар
Шешуі.
1)
CaCO3
 CaO+CO2↑
CaO+CO2↑
2) CaO + 3C → CaC2+ CO↑
3) CaC2 + 2H2O →Ca(OH)2 ↓ + C2Н2↑
4) CH≡CH+ HCI→CH2 = CНСІ
5)nCH2
= CНСІ
 (-
CH2
=
CНСІ-)n
(-
CH2
=
CНСІ-)n
9-жаттығу. Мына айналуларды:
CН4
 C2Н2
C2Н2 CН3СОН
CН3СОН
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар
Шешуі.
1) 2CH4 C2H2 + 3Н2
C2H2 + 3Н2
2) CH≡CH
+
Н2О CН3СОН
CН3СОН
10-жаттығу. Мына айналуларды:
CН4
 C2Н2
C2Н2 C6Н6
C6Н6 C6Н5СІ
C6Н5СІ
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар
Шешуі.
1) 2CH4 C2H2 + 3Н2
C2H2 + 3Н2
2) 3C2H2 C6Н6
C6Н6
3) C6Н6
+ CI2 C6Н5СІ
+ НСІ
C6Н5СІ
+ НСІ
11-жаттығу. Мына айналуларды:
CaCO3
 CaO
CaO  CaC2
CaC2 C2Н2
C2Н2 C6Н6
C6Н6 C6Н5NO2
C6Н5NO2
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
CaCO3
 CaO+CO2↑
CaO+CO2↑
2) CaO + 3C → CaC2+ CO↑
3) CaC2 + 2H2O →Ca(OH)2 ↓ + C2Н2↑
4) 3C2H2 C6Н6
C6Н6
5) C6Н6
+ HNO3 C6Н5NO2 + Н2О
C6Н5NO2 + Н2О
12-жаттығу. Мына айналуларды:
C2Н4
 C2Н5ОН
C2Н5ОН
 CН3
-СОН
CН3
-СОН
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар
Шешуі.
1) C2Н4
+Н2О C2Н5ОН
C2Н5ОН
2) C2Н5ОН + СuО
 CН3
-СОН + Сu +
Н2О
CН3
-СОН + Сu +
Н2О
13-жаттығу. Мына айналуларды:
C2Н5ОН C2Н4
C2Н4 CН2OH
- CH2OH
CН2OH
- CH2OH
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар
Шешуі.
1) C2Н5ОН C2Н4↑
+ 3Н2O
C2Н4↑
+ 3Н2O
2) 3C2Н4 + 2KMnO4 + 4H2O → 3CН2OH - CH2OH + 2MnO2↓ + 2KOH
14-жаттығу. Мына айналуларды:
C2H6 C2H4
C2H4 C2Н5ОН
C2Н5ОН
 CН3
-СОН
CН3
-СОН
 CН3
-СОOН
CН3
-СОOН
 CН3
-СОOC2Н5
CН3
-СОOC2Н5
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
C2H6 C2H4+H2↑
C2H4+H2↑
2) C2Н4
+Н2О C2Н5ОН
C2Н5ОН
3) C2Н5ОН + СuО
 CН3
-СОН + Сu↓ +
Н2О
CН3
-СОН + Сu↓ +
Н2О
4) CН3
-СОН +
Ag2О
 CН3
-СОOН +
2Ag↓
CН3
-СОOН +
2Ag↓
5) CН3
-СОOН
+ C2Н5ОН CН3
-СОOC2Н5
+ Н2О
CН3
-СОOC2Н5
+ Н2О
15-жаттығу. Мына
айналуларды: CН3СОOCН3
CН3СОOCН3
CH4
 C2H2
C2H2 CН3CОН
CН3CОН
 CН3СОOН
CН3СОOН
 CН3СОOC3Н7
CН3СОOC3Н7
 CН3СОONН4
CН3СОONН4
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
2CH4 C2H2 +
3Н2
C2H2 +
3Н2
2) CH≡ CH +
Н2О
 CН3СОН
CН3СОН
3)
CН3СОН +
Ag2О
 CН3СОOН +
2Ag↓
CН3СОOН +
2Ag↓
4) CН3СОOН
+ CН3ОН CН3СОOCН3 + Н2О
CН3СОOCН3 + Н2О
5) CН3СОOН
+ C3Н7ОН CН3СОOC3Н7 + Н2О
CН3СОOC3Н7 + Н2О
6) CН3СОOН + NН3 → CН3СОONН4
16-жаттығу. Мына айналуларды:
C6H12O6 C2Н5ОH
C2Н5ОH C2Н4
C2Н4

C3H6O3
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
C6H12O 2C2Н5ОH+2СО2↑
2C2Н5ОH+2СО2↑
2) C2Н5ОН C2Н4
+Н2О
C2Н4
+Н2О
3)
C6H12O
 2
C3H6O3
2
C3H6O3
17-жаттығу. Мына айналуларды:
CaCO3
 CaO
CaO  CaC2
CaC2 C2Н2
C2Н2 C6Н6
C6Н6 C6Н5NO2
C6Н5NO2 C6Н5NН2
C6Н5NН2  C6Н5NН2
· НСІ
C6Н5NН2
· НСІ
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
CaCO3
 CaO+CO2↑
CaO+CO2↑
2)
CaO
+
3C  CaC2+
CO↑
CaC2+
CO↑
3) CaC2 + 2H2O →Ca(OH)2 ↓ + C2Н2↑
4) 3C2H2 C6Н6
C6Н6
5) C6Н6
+ HNO3 C6Н5NO2 + Н2О
C6Н5NO2 + Н2О
6) C6Н5NO2+ 6H C6Н5NН2 +
2Н2О
C6Н5NН2 +
2Н2О
7) C6Н5NН2 + HCI→C6Н5NН2 · НСІ
18-жаттығу. Мына айналуларды:
CН4
 CН3СІ
CН3СІ
 CН3ОН
CН3ОН
 НСОН
НСОН  НСООН
НСООН НСООNа
НСООNа
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
CН4
+
СІ2
 CН3СІ
+
НСІ
CН3СІ
+
НСІ
2)
CН3СІ
+
КОН(водн.) CН3ОН
+
КСІ
CН3ОН
+
КСІ
3) CН3ОН
+ СuO НСОН + Сu +
Н2О
НСОН + Сu +
Н2О
4) НСОН
+ Аg2 НСООН +
2Ag
НСООН +
2Ag
5) НСООН+ NaOH НСООNа
+ Н2О
НСООNа
+ Н2О
19-жаттығу. Мына айналуларды:
CН4
 CO2
CO2 C6H12O6
C6H12O6 C2Н5ОH
C2Н5ОH CН3СОН
CН3СОН CН3СООН
CН3СООН (CН3СОО)2Са
(CН3СОО)2Са CaCO3
CaCO3
 CO2
CO2
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
СН4
+
2O2
 CO2+
2Н2О
CO2+
2Н2О
2) 6CO2 + 6Н2О C6H12O6+ 6O2
C6H12O6+ 6O2
3) C6H12O6
 2C2Н5ОH+ 2CО2↑
2C2Н5ОH+ 2CО2↑
4) C2Н5ОН + СuО
 CН3
-СОН + Сu↓ +
Н2О
CН3
-СОН + Сu↓ +
Н2О
5) CН3
-СОН +
Ag2О
 CН3
-СОOН +
2Ag↓
CН3
-СОOН +
2Ag↓
6) 2CН3СООН+ СаО →(CН3СОО)2Са + Н2О
7) (CН3СОО)2Са + К2СО3 →CaCO3↓ + 2СН3СООК
8)
CaCO3
 CaO+CO2↑
CaO+CO2↑
20-жаттығу. Мына айналуларды:
CaCO3
 CaO
CaO  CaC2
CaC2 C2Н2
C2Н2 C6Н6
C6Н6 C6Н5NO2
C6Н5NO2 C6Н5NН2
C6Н5NН2 
 триброманилин
триброманилин
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
CaCO3
 CaO +
CO2↑
CaO +
CO2↑
2)
CaO
+
3C  CaC2+
CO↑
CaC2+
CO↑
3) CaC2 + 2H2O →Ca(OH)2 ↓ + C2Н2↑
4) 3C2H2 C6Н6
C6Н6
5) C6Н6
+ HNO3 C6Н5NO2 + Н2О
C6Н5NO2 + Н2О
6) C6Н5NO2+ 6H C6Н5NН2 +
2Н2О
C6Н5NН2 +
2Н2О
7) C6Н5NН2 + 3Вr2→C6Н2Вr3NН2↓ + 3НВr
21-жаттығу. Мына айналуларды:
C2Н6
 C2Н4
C2Н4 C2Н5ОH
C2Н5ОH
 CН3СОН
CН3СОН CН3СООН
CН3СООН CICН2СООH
CICН2СООH NH2CН2СООH
NH2CН2СООH
 полипептид
полипептид
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
C2H6 C2H4+H2↑
C2H4+H2↑
2) C2Н4
+Н2О C2Н5ОН
C2Н5ОН
3) C2Н5ОН + СuО
 CН3
-СОН + Сu +
Н2О
CН3
-СОН + Сu +
Н2О
4) CН3
-СОН +
2Cu(OH)2 CН3
-СОOН +
Cu2O+
Н2О
CН3
-СОOН +
Cu2O+
Н2О
5) CН3
-СОOН
+ CI2 CICН2СООH
+ НСІ
CICН2СООH
+ НСІ
6) CICН2СООH+ 2NH3 →NH2CН2СООH + NH4CI
7) nNH2CН2СООH →(-NH-CН2-СОО-)n + (n-1)Н2О
22-жаттығу. Мына айналуларды:
CН4
 C2Н2
C2Н2 CН3СОН
CН3СОН CН3СООН
CН3СООН CICН2СООH
CICН2СООH NH2CН2СООH
NH2CН2СООH
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
2CH4 C2H2+3H2↑
C2H2+3H2↑
2) C2Н2+Н2О CН3CОН
CН3CОН
3) CН3
-СОН +
2Cu(OH)2 CН3СОOН +
Cu2O+
Н2О
CН3СОOН +
Cu2O+
Н2О
4) CН3
-СОOН
+ CI2 CICН2СООH
+ НСІ
CICН2СООH
+ НСІ
5) CICН2СООH+ 2NH3 →NH2CН2СООH + NH4CI
23-жаттығу. Мына айналуларды:
CaC2 C2Н2
C2Н2 C6Н6
C6Н6 C6Н5NO2
C6Н5NO2 C6Н5NН2
C6Н5NН2

C2Н4 C2Н5ОH
C2Н5ОH
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1) CaC2 + 2H2O → Ca(OH)2 ↓ + C2Н2↑
2) 3C2H2 C6Н6
C6Н6
3) C6Н6
+ HNO3 C6Н5NO2 + Н2О
C6Н5NO2 + Н2О
4) C6Н5NO2+ 3H2 C6Н5NН2 + Н2О
C6Н5NН2 + Н2О
5)
C2H2+H2 C2H4
C2H4
6) C2Н4
+Н2О C2Н5ОН
C2Н5ОН
24-жаттығу. Мына айналуларды:
CН4
 C2H2
C2H2 CН3СОН
CН3СОН
 C2Н5ОH
C2Н5ОH C2Н5CI
C2Н5CI C4Н10
C4Н10

CH3COOC2Н5
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
2СН4 C2H2+
3Н2
C2H2+
3Н2
2) C2Н2+Н2О CН3CОН
CН3CОН
3) CН3
СОН
+ Н2 C2Н5ОH
C2Н5ОH
4) C2Н5ОН +
HCI C2Н5CI
+
Н2О
C2Н5CI
+
Н2О
5) 2C2Н5CI
+
2Na C4Н10+
2NaCI
C4Н10+
2NaCI
6) C2Н5ОH+ CH3COOH CH3COOC2Н5+ Н2О
CH3COOC2Н5+ Н2О
25-жаттығу. Мына айналуларды:
C2Н6 C2H5Br
C2H5Br C2Н5ОH
C2Н5ОH
 CН3СОН
CН3СОН CН3СОOН
CН3СОOН

![]()
C2Н4
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
C2Н6
+Br2 C2H5Br
+
HBr
C2H5Br
+
HBr
2) C2H5Br+KOH →C2Н5ОH + KBr
3) C2Н5ОН + СuО
 CН3
-СОН + Сu +
Н2О
CН3
-СОН + Сu +
Н2О
4) CН3
-СОН +
2Cu(OH)2 CН3
-СОOН +
Cu2O+
Н2О
CН3
-СОOН +
Cu2O+
Н2О
4) C2Н5ОН
 C2Н4 +
Н2О
C2Н4 +
Н2О
6) C2Н4+ HBr C2Н5Br
C2Н5Br
26-жаттығу. Мына айналуларды:
CН4
 CH3CI
CH3CI C2Н6
C2Н6  C2Н4
C2Н4 C2Н5OH
C2Н5OH HCOOC2Н5
HCOOC2Н5

CH3COOН
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
CН4
+CI2 CH3CI
+
HCI
CH3CI
+
HCI
2)
2CH3CI
+2Na C2H6
+2NaCI
C2H6
+2NaCI
3)
C2Н6 C2H4+
Н2
C2H4+
Н2
4) C2Н4
+Н2О C2Н5ОН
C2Н5ОН
5) C2Н5ОH + HCOOH → HCOOC2Н5
6) C2Н4 + 2[O] → CH3COOН
27-жаттығу. Мына айналуларды:
CН4
 CH3Br
CH3Br C2Н6
C2Н6  C2Н4
C2Н4 C2Н5CI
C2Н5CI
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
CН4
+Br2 CH3Br
+
HBr
CH3Br
+
HBr
2)
2CH3Br
+2Na C2H6
+2NaBr
C2H6
+2NaBr
3)
C2Н6 C2H4+
Н2
C2H4+
Н2
4) C2Н4+ HCI C2Н5CI
C2Н5CI
28-жаттығу. Мына айналуларды:
C2Н6 C2Н4
C2Н4 C2Н2
C2Н2  C6Н6
C6Н6 C6Н5Br
C6Н5Br
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
C2Н6 C2H4+
Н2
C2H4+
Н2
2) C2Н4
 C2Н2 +Н2
C2Н2 +Н2
3)
3C2Н2 C6H6
C6H6
4) C6Н6
+ Br2 C6Н5Br+НBr
C6Н5Br+НBr
29-жаттығу. Мына айналуларды:
C CН4
CН4 CН3CI
CН3CI CН3OH
CН3OH
 CН3COOCН3
CН3COOCН3
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
C
+2H2 CH4
CH4
2)
CН4
+CI2 CH3CI
+
HCI
CH3CI
+
HCI
3) CH3CI +KOH → CН3OH +KCI
4)
CН3ОH+
CH3COOH CH3COOCН3
+
Н2О
CH3COOCН3
+
Н2О
30-жаттығу. Мына айналуларды:
HCOOH HCOOC2Н5
HCOOC2Н5 C2Н5ОН
C2Н5ОН
 CН3СОН
CН3СОН
 CН3СООН
CН3СООН CН3СООK
CН3СООK
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
HCOOH+
C2Н5ОН HCOOC2Н5 +
Н2О
HCOOC2Н5 +
Н2О
2) HCOOC2Н5 + NaОН → HCOONa+ C2Н5ОН
3) C2Н5ОН
+ СuO CН3СОН
+ Сu +
Н2О
CН3СОН
+ Сu +
Н2О
4) CН3СОН
+ Аg2 CН3СООН
+ 2Ag
CН3СООН
+ 2Ag
5) CН3СООН+ KOH CН3СООK
+ Н2О
CН3СООK
+ Н2О
21
жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
Органикалық химия Өзгерістерді жүзеге асыру Әдістемеліқ құрал
Органикалық химия Өзгерістерді жүзеге асыру Әдістемеліқ құрал
ОҚО Мақтарал ауданы «Көктөбе ауылы»
№ 19 М.Мақатаев атындағы жалпы орта мектебі
коммуналдық мемлекеттік мекемесі

Әдістемелік құрал
Битабарова Хадиша Исабековна
химия пәні мұғалімі
-
Мұғалімнің аты –жөні: Битабарова Хадиша Исабековна .
-
Жұмыс орны:«№ 19 М.Мақатаев атындағы жалпы орта мектебі»
коммуналдық мемлекеттік мекемесі».
-
Қызметі: Мұғалім
-
Оқытатын пәні: Химия
-
Білімі: Жоғары
-
Санаты: Бірінші
-
Курстан өтілуі: Үшініші (базалық) деңгей
-
Мекен –жайы: Онтүстік Қазақстан облысы Мақтарал. ауданы, Ж.Ералиев. ауыл ,
-
Ұялы телефон :8 775 240 62 67, 8775 705 49 62,
-
Электрондық почта E-mail :bitabarova66@mail.ru.
Шығармашылық
тақырыбы:«Жаңа педагогикалық
технология негізінде, оқушылардың өзіндік ізденісін, ойлау және
шығармашылық қабілетін
дамыту,ақпараттық технологиялардың мүмкіндігін қолдана
отырып оқушылардың химия пәніне деген
қызығушылықтарын
арттыру. »
Мазмұны.
І-Кіріспе-------------------------------------------------------------------------------- 3-5
ІІ-Негізгі-------------------------------------------------------------------------------6-206
Органикалық реакциялардың түрлері---------------------------------------6-8
Алкандардың химиялық қасиеттері-------------------------------------------9-12
Алкендердің химиялық қасиеттері--------------------------------------------13-15
Алкиндердің химиялық қасиеттері-------------------------------------------16-18
Алкадиендердің химиялық қасиеттері---------------------------------------19-20
Ароматты көмірсутектердің химиялық қасиеттері. Бензол.----------21-22
Оттекті органикалық қосылыстар. Спирттер. Қаныққан біратомды спирттердің химиялық қасиеттері---------------------------------------------23-26
Фенолдың химиялық реакциясы-----------------------------------------------27-29
Альдегидтер мен кетондардың химиялық қасиеттері--------------------30-33
Күрделі эфирлердің химиялық қасиеттері.-----------------------------------34-35
Аминдердің химиялық қасиеттері----------------------------------------------36-37
Көмірсулардың химиялық қасиеттері-----------------------------------------38-39
І.«Сызбанұсқа бойынша өзгерістерді жүзеге асыру»---------------------40-117
ІІ. Жабық тізбектерге арналған қиындатылған тапсырмалар.-----118-206
ІІІ-Қорытынды------------------------------------------------------------------- 207-208
ІҮ-ПӘН БОЙЫНША ГЛОССАРИЙ----------------------------------------209-217
Ү-Әдебиеттер ------------------------------------------------------------------------218
V- Қосымшалар--------------------------------------------------------------------219-229
І-Кіріспе
Елбасымыз Н.Ә.Назарбаевтың «Қазақстан - 2030» стратегиясы жолдауында, 1999 жылдың маусымында қабылданған Қазақстан Республикасы «Білім туралы» Заңында, 2000 жылдың 30 қыркүйегінде қабылданған «Білім» мемлекеттік бағдарламасында көрсетілгендей қоғамның экономикалық және әлеуметтік жағынан ілгерілеуінің маңызды факторы ретінде білім берудің ұлттық моделін дамыту, шығармашыл тұлға қалыптастыруға дағды алу, ақыл –ой қорын жинау сияқты мақсаттарды кµздейді. Ол Қазақстан республикасы жарияланған білім беру басымдылығына, «жалпыға білім беру» моделін «әр адамға таңдау бойынша білім беру» моделіне көшуге негізделген.
ХХІ ғасыр – ғылым мен техниканың дамыған кезеңі. Заман талабына сай қазіргі білім жүйесіндегі игі өзгерістер мен жаңалықтар соның нәтижесі. Бүгінгі білім беру үрдісінде жаңа ақпараттық технологияны пайдалану және оны мақсатты түрде жүзеге асыру – ақпараттық қоғам дәуірінің негізгі көзі.
Қазіргі заман мұғалімнен тек өз пәнінің терең білгірі болуы емес, тарихи танымдық, педагогикалық –психологиялық сауаттылық, саяси экономикалық білімділік және ақпараттық сауаттылық талап етілуде. Ол заман ағымына сәйкес білім беруде жаңалыққа жаны құмар, шығармашылықпен жұмыс істеп, оқу мен тәрбие ісіне еніп, оқытудың жаңа технологиясын шебер меңгерген жан болғанда ғана білігі мен білімі жоғары жетекші тұлға ретінде ұлағатты саналады.
Қазақстанның тәуелсіз мемлекет ретінде қалыптасуы орта білім беру жүйесінің дамуымен тығыз байланысты. Қай халықтың, қай ұлттың болсын толығып өсуіне, рухани әрі мәдени дамуына басты ықпал жасайтын тірегі де, түп қазығы да – мектеп. Мектептердің білім деңгейін көтеру және онда интерактивті құралдарды пайдалану арқылы оқу – тәрбие процесін тиісті деңгейге көтеру, мектеп ұстаздарының, басшыларының, педагогикалық ұжымның жүйелі басшылыққа алған бағыты деп есептейміз.
Педагогикалық, ғылыми және шығармашылық еңбектеріңіздің жолында мол табысқа кенеліңіздер, жаңадан бастаған істеріңізге үлкен сәттіліктер тілеймін! Саналы ұрпаққа сапалы білім мен тәрбие беруден жалықпайық!
Қызығушылық деп оқушының бір нəрсеге зейін қоюға, кейбір заттар мен құбылысты танып-білуге ұмтылуын айтамыз. Химияда оқушыларды қызықтырып, өзіне тартатын құбылыстар аз емес, тек соларды таба, тани білу керек.
Қызығулар адамның рухани жəне дене күші дамуының аса маңызды шарттары болып табылады жəне ой - өрісін кеңейтіп, білім алуға итермелейді. Бұл оның іс - əрекетін жеңілдетеді, бір нəрсеге қызығатын болса, ол кез келген іспен шұғылдану үшін зор қиындықтарды жеңуге дайын тұрады. Оқушы қызықты сабақты зор ынтамен қабылдайды да, əдетте оны жақсы оқитын болады.
Іс-əрекет үрдісінде қызығулар бейімділікке ұласады. Пəнге қызығу не болмаса сабаққа бейімділігі тікелей немесе жанама түрде болады. Адамның қызығуы олардың іс-əрекеті тəрізді алуан түрлі. Қызығудың таным, білім алу, еңбек ету, шығармашылық жəне басқа да түрлері көп
Материалистік диалектика негізінде химияны оқытуға қойылатын негізгі талаптардың бірі заттар мен құбылыстарды жеке күйінде емес, маңызды байланыстары жəне негізгі қарым – қатынастары тұрғысынан үйрену болып табылады. Дүниенің бірлігі туралы ұғым қалыптастыру үшін заттар арсындағы генетикалық байланысты: бос күйдегі элемент пен құрамына осы элемент кіретін күрделі заттар арсындағы, əсіресе химиялық элементтер арасындағы байланысты ашудың маңызы зор. Əсіресе, заттардың құрылысы мен қасиеттерінің арасындағы байланыстарды ашу керек. Заттар жəне химиялық құбылысты бір-бірімен байланысты оқып үйрену химия заңдарын(жалпы жəне жеке) анықтауға мүмкіндік береді.Дегенмен, химия заңдарының көзқарастық мəні оларды оқып-үйренудің тереңдігіне байланысты.
Бейорганикалық жəне органикалық дүниедегі даму туралы ілім химиядан сабақ беруде көрініс табуы тиіс, ол заттар мен құбылыстардың өзара байланысы жəне тəуелділігі жөніндегі ілім тəрізді мектептегі химия курсының өн бойы қамтуы керек. Химияны оқыту əдістемесінің міндеті – біріншіден, химияны заңдарға сəйкес оқыту, екіншіден, қоғамтану сабақтарында бұл заңдарды саналы игеруге оқушыларды дайындау.
Органикалық реакциялардың түрлері.
Органикалық қосылыстардың химиялық өзгерістері бағыттылығымен, жылдамдығымен және механизмімен сипатталады.Органикалық қосылыстардың реакциялары көбінесе екі бағытпен жүреді. Реакция бағыты заттың құрамына, құрылысына, сонымен бірге сыртқы жағдайларға тәуелді. Реакция бағыты химиялық реакциялардың жалпы теориясы негізінде шешіледі.
Екі заттың арасында реакция жүру үшін олар соқтығысулары қажет, бірақ реакция жүруі үшін олардың энергиялары реакция жүруіне қажет энергиядан (реакцияның активациялық энергиясынан) жоғары болуы керек.
Органикалық өзгерістер көміртегі тізбегі өзгеріп не өзгермей жүреді. Көптеген реакцияларда көміртегі тізбегі (қаңқасы) өзгермейді, бұл жағдайға мына реакциялар жатады: орынбасу, қосылу, элиминирлеу (бөліп алу), изомерлену.
Көміртегі қаңқасы өзгере жүретін реакцияларға: тізбектің ұзаруы (орын басу және қосылу реакциялары арқылы), тізбектің қысқаруы (крекинг және изомерлену), тізбектің изомерленуі, циклдену, циклдің ашылуы, циклдің сығылуы және кеңеюі жатады.
Органикалық реакциялардың типтері:
1.Орынбасу реакциясы – органикалық заттың құрамындағы атом реагенттің молекуласындағы атомға немесе атомдар тобына орын алмасады:
СН4 +
СІ2  CH3Cl+
НСІ
CH3Cl+
НСІ
хлорметан
2.Қосылу реакциясы – еселікбайланысы бар қанықпаған қосылыстар үшін тән..
CH2=CH2 + СІ2 → CH2СІ -CH2СІ,
1,2- дихлорметан
3. Бөліп алу реакциясы (элиминирлеу) -органикалық заттың құрамындағы атом атом немесе атомдар тобы көмірсутек радикалынан үзілгенде қанықпаған қосылыстың түзілуі
С2Н5ОН
 СН2=
СН2 +
Н2О
СН2=
СН2 +
Н2О
4. Айырылу реакциясы –бір органикалық заттың айырылуы нәтижесінде екі жаңа органикалық заттар түзіледі.
СН3-
СН2
–СН2
–СН3
 СН3
–СН3
+
СН2
=
СН2
СН3
–СН3
+
СН2
=
СН2
этан этен
5.Изомеризация реакциясы – берілген заттың өзінің изомеріне айналу реакциясы.
СН3-
СН2
–СН2
–СН3
 СН3-
СН(СН2)
–СН2
–СН3
СН3-
СН(СН2)
–СН2
–СН3
2-метилбутан
6. Тотығу реакциясы - органикалық заттың құрамына кіретін көміртектің тотығу дәрежесі артады.
а) толық тотығу
СН4
+
2О2
 СО2
+
2Н2О
СО2
+
2Н2О
б) шала тотығу
СН4
+
2О2
 НСОН +
2Н2О
НСОН +
2Н2О
метаналь
Именные реакции:
Вюрц С2Н5CІ +2Na
+C3H7CІ →
C5H12+2NaCІ
2CH3
–CH2
–CH(CH3)Br-CH3+2Na→CH3-CH2-
C(CH3)2
-C(CH3)2
-CH2-
CH3
+
2NaCl
Вагнер3CH2
=CH2+
2KMnO4
+4H2O→CH2(OH)-CH2(OH)+2KOH+2MnO2
Марковников СН2=СН-СН3+НCІ
→CH3-
CH(CІ)-CH3
ЗайцевСН3-СН(Вr)CH2
–CH3+NaOH(спирт) →СH3-CH=CH-CH3+NaBr+
H2O
КучеровC2H2+H2O→CH3-CОН
Зинин C6H5
–NO2
+6H→
C6H5–NH2
+2H2O
Густавсон CІCH2–CH2–
CH2-CH2- CІ +Zn→
C4H8
+ZnCІ2
ДюмаCH3-COONa+NaOH →
CH4+Na2CO3
Кольбе 2CH3-COONa+2H2O→
C2H6 +
2CO2↑+H2↑+
2NaOН
Изменение длины углеродной
цепи:
Реактив
Гриньяра
СН3
-Mg
–Cl+C2H5
-Cl→
C3H8
+MgCl2
CO2
+
CH3-Mg-Cl→
CH3-COOMgCl→
CH3
–COOH
+MgCl2
алкил
реакциясы
С6H6
+СН3
–Сl→
C6Н5
–СН3
+HCl
декарбоксилдеу
реакциясы
С6
H5
-COOH→
C6H6
+CO2
↑
CH3
–CH2
-COONa +NaOH→
C2H6
+
Na2CO3
Димерлену
2
С2Н2
→
винилацетилен
Полимерлену
СН2
=СН- СОО
–СН3
→
Поливинилацетаты
Сапалық
реакция
1. С2Н2 +
2[Ag(NH3)2]OH→
C2Ag2↓+4NH3↑ +
2Н2О
2. СH3COH+2[Ag(NH3)2]OH →
CH3COOH+2Ag ↓
+4NH3↑+H2O
3. CH3COH+ 2
[Ag(NH3)2]OH →
CH3CООNH4 +2Ag↓+3NH3↑+ H2O
4. CH3COH +Ag2O +NH3 → CH3COONH4+2Ag↓
5. CH3COH+
2Cu(OH)2→ CH3COOH +Cu2O↓+ 2H2O
6. C6H12O6+ 2Сu(OH)2 → CH2OH-(CHOH)4-COOH
+Cu2O↓+ 2H2O
7. C6H12O6+2[Ag(NH3)2]OH → CH2OH
–(CHOH)4-COOH+2Ag↓ +
2H2O
8. 2C3HO3 + Cu(OH)2→ Глицератмеди II+ 2H2O
9. HCOOH+ 2[Ag(NH3)2]OH → CO2+2Ag+
4NH3 + 2H2O
Алкандардың химиялық қасиеттері
Алкандар орынбасу, айырылу изомерлену және тотығу реакцияларына түседі. Алкандардың басқа көмірсутектермен салыстырғандағы бір ерекшелігі — олардың құрамындағы көміртек атомдарының валенттіктері толығымен сутек атомдарымен қаныққан. Сондықтан алкандар қосылу реакцияларына түспейді.
Алкандар құрамындағы тағы бір ерекшелік — оларда едәуір берік коваленттік σ-байланыстың болуы. Бұл байланыстың полюстігі төмен, сондықтан алкандар, негізінен, SRмеханизмі бойынша реакцияларға түседі. С—С байланыс едәуір қатаң жағдайда үзіліп, реакцияға қиын түседі. Алкандардың парафиндер деп аталу себебі осы.
Алкандар химиялық реакцияларға энергия берген (қыздыру немесе ультракүлгін сәулелердің әсерінен) жағдайда ғана түседі. Реакция барысында көміртек пен сутек С—Н арасындағы байланыс үзіліп, сутек атомы басқа атомдар мен атом топтарына алмасады немесе көміртек атомдарының С—С араларындағы байланыстар үзіледі. Алкандар полюссіз қосылыстар болғандықтан, байланыстардың үзілуі негізінен радикалдар түзе, гомолиттік механизм бойынша жүреді.
.
 СnН2n +
1CI
СnН2n +
1CI
 құрылымдық
изомер
құрылымдық
изомер
 СО2
+
Н2О
СО2
+
Н2О
![]() СnН2n +2
СnН2n +2
 СnН2n +
1NО2
СnН2n +
1NО2
 СnН2n +
1SО3Н
СnН2n +
1SО3Н
 СnН2n
немесе
СnН2n
-2
СnН2n
немесе
СnН2n
-2
 СnН2n +
2/2
СnН2n +
2/2

![]()
Қаныққан көмірсутектерге тән реакциялар
Галогендену реакциялары қаныққан көмірсутектердің маңызды реакцияларының бірі.
Жарықтың әсерінен жүретін реакциялар фотохимиялық реакциялар деп аталады.Бұл реакция хлорметан түзілген сатыда тоқтап қалмайды. Тізбекті реакциялар нәтижесіндеСН3СІ, СН2СІ2, СНСІ3 және ССІ4 тәрізді орынбасу реакциясының өнімдері түзіледі. Жалпы түрде бұл реакция былай жазылады:
СН4 СН3СІ
СН3СІ
 СН2СІ2
СН2СІ2 СНСІ3
СНСІ3 ССІ4
ССІ4
Алкандардың галогендермен орынбасу реакциялары хлормен жеңіл, броммен қиындау, йодпен қиын жүреді. Ал фтормен қопарылыс түзе жүретін болғандықтан, реакцияны инертті газ қатысында сұйылтып жүргізеді. Сутектердің орнын галогендерге алмастырғанда, алкандардың галогентуындылары түзіледі. F2 > Cl2> Br2> I2.
CH3-CH2-CH2-CH3 + CІ2 → CH3-CHCІ-CH2-CH3 + HCІ,
CH3-CHCІ-CH2-CH3+ CІ2 → CH3-CCІ2-CH2-CH3 + HCІ.
Сумен әрекеттесуі.Метанды су буымен никель өршіткісі үстінен 800 — 850°С-та өткізгенде, көміртек (II) оксиді мен сутек түзіледі. Өршіткі ретінде Сг2О3 алуға да болады:
CH4+
H2O
 CO +
3H2.
CO +
3H2.
Термиялық айырылады. Алкандардың термиялық айырылуы молекула құрамын анықтаудың дәлелі. Метанды С қыздырғанда дегидрлеу (сутектің бөлінуі) реакциясы жүреді де ацетилен түзеледі. Бұл реакцияның өнеркәсіпте көксағыз, пластмасса, күйе, бояу алуда маңызы зор.
Сутек бөліне жүретін ыдырау реакциялары дегидрлену реакциясы деп аталады.
Алкандардың дегидрлену реакцияларының басқа қанықпаған көмірсутектер алу үшін өнеркәсіптік маңызы зор. Алкандарды өршіткі қатысында қыздырғанда (Ni, 500°С), дегидрленіп, сутек бөлінеді және канықпаған көмірсутектер түзіледі:
2CH4 H2C=CH2+
2H2
H2C=CH2+
2H2
Қыздырғанда алкандар термиялық айырылады. Метанды жоғары температурада (1000°С шамасында) ауа қатыстырмай қыздырғанда жай заттарға айырылады:
CH4 C +
2H2,
C +
2H2,
Метанды бұдан да жоғарырақ температурада қыздырғанда (15000С), реакция қанықпаған көмірсутек - ацетилен түзе және сутек бөле жүреді:
2CH4 HC≡CH +
3H2.
HC≡CH +
3H2.
Тотығу реакциялары
Қаныққан көмірсутектер катализатор қатысында жоғары температурада және жоғары қысымда тотығу реакциясына түсіп альдегидтер, кетондар, спирттер, карбон қышқылдарын түзеді.
2CH3-CH2-CH2-CH3 + 5O2 → 4CH3COOH + 2H2O,
2CH3-CH2-CH2-CH3 + 13O2 → 8CO2 + 10H2O.
Жану реакция —алкандар түсетін ең маңызды реакциялардың бірі болып табылады. Көмірсутектердің қолданылуының негізгі бір саласы жану реакциясының нәтижесінде энергия бөлінуіне байланысты. Ауада қыздырғанда, алкандар тұтанып жанады. Оттек жеткілікті болса, реакция нәтижесінде көміртек (IV) оксиді мен су түзіледі және жылу бөлінеді:
СН4 + 2O2 → СO2 + 2Н2O ΔН =-890 кДж/моль
Метанның конверсиялануы— оттекпен, су буымен және көміртек (IV) оксидімен тотығуы оның негізгі қолданылу салаларының бірі:
2СН4 + O2 → 2СО + 4Н2
СН4 + Н2O → СО + ЗН2
СН4 + СO2 → 2СО + 2Н2
Бұл реакциялардың нәтижелерінде түзілген синтез-газ (су газы) көмірсутектер, метанол, метаналь, т.б. органикалық қосылыстар алынатын бағалы шикізат болып табылады.
Алкандардың ыдырау температурасы, олардың молекулалық массасына және құрылысына тәуелді. Сутек бөліне жүретін ыдырау реакциялары дегидрлену реакциясы деп аталады.
![]() CH2
=CH
–CH2
–CH3
CH2
=CH
–CH2
–CH3
CH3
–CH2
–CH2
–CH3

![]() CH3–CH= CH
–CH3
,
CH3–CH= CH
–CH3
,
CH3
–CH
2–CH2
–CH3 CH2
= CH—CH =
CH2
+
2H2.
CH2
= CH—CH =
CH2
+
2H2.
Изомерлену реакциялары барысында С—С байланыстары үзіліп, түзу көміртек тізбегі тармақталғанға айналады. Изомерлену процесі өршіткі (АІСІ3) қатысында және қыздырғанда (-400 °С) жүреді.
CH3
–CH2
–CH2–CH3
 CH3
–CH(CH3)
–CH3.
CH3
–CH(CH3)
–CH3.
Крекинг:
C4H10 → CH3—CH3 + CH2=CH2
Риформинг реакциялары нәтижесінде алкандар ароматты көмірсутектерге, мысалы, гексан бензолға айналады:
C6H14 → С6Н12 + H2 ,
C7H16 → С6Н5 -CH3 + 4H2
Нитрлеу реакциясы. Бұл реакцияны орыс ғалымы М.И.Коновалов (1888ж.) ашқандықтан, Коновалов реакциясы деп аталады. Қысым мен температураны аздап жоғарылатқанда, алкандар сұйылтылған азот қышқылы мен орынбасу реакциясына түседі:
CH4 + HNO3 → CH3NO2 + H2O,
CH3-CH2-CH3 + HNO3 → CH3-CH(NO2)-CH3 + H2O.
Алкендердің химиялық қасиеттері
Алкендер химиялық белсенді болғандықтан табиғатта өте сирек кездеседі. Оларға қосылу реакциялары тән. Еселі- қанықпаған (қос) байланысы бойынша алкендер қосылу реакцияларына жеңіл түседі. Себебі σ –байланысқа қарағанда әлсіз π-байланысы оңай үзіліп, көміртек атомының босаған валенттіктеріне әрекеттесуші реагент молекуласының атомдары мен атом топтары қосылады. Реакция нәтижесіне көмірсутек молекуласындағы қос байланыстың біреуі –дара (σ-) байланыс қалып, алкандар немесе олардың туындылары түзіледі. Қосылу реакцияларының жылдамдығы, галогенсутек қышқылының күші өсуіне байланысты артады:HF < HCl < НВг < HI. Галогенсутектердің симметриялы емес алкендерге қосылу реакциялары В. В. Марковников ережесі бойынша жүреді
СnН2n
![]()
СnН2n +
2  СnН2n +
2
СnН2n +
2
СnН2n -
2 
(-СnН2n-)n
 СО2
+
Н2О
СО2
+
Н2О
Этилен мен оның гомологтары қосылу, полимерлену және тотығу реакцияларына түседі.
Этен:
Гидрлеу реакциясы.Алкендер сутекті қосып алып, сәйкес алкандарға айналады. Реакция металл катализаторлар Ni, Pt, Pd қатысында жүреді. Мысалы этенге сутек косылғанда, этан түзіледі:
CH2=CH2 + H2 → CH3 -CH3,
Немесе осы реакцияны ықшамдап жазсақ:
C2H4 + H2 → C2H6
Сутек қосыла журетін реакцияларды гидрлену реакциясы деп атайды.
Гидрлену реакциясын зерттеуде Д. В. Сокольскийдің еңбегі зор.
Галогендеу реакциясы.Галогенденуі (галогендердің қосылуы). Алкендер галогендермен әрекеттескенде, реакция қос байланыс бойынша жүріп, нәтижесінде, алкандардың дигалогентуындылары түзіледі. Реакция алкенді галогеннің ерітіндісімен кәдімгі температурада әрекеттестіргенде жүреді. Алкендерді бромды сумен (бромның судағы ерітіндісі) әрекеттестіргенде, ерітіндідегі бромның қызыл қоңыр түсі жойылып, түссіз дибромалкандар (СnН2nВг2) түзіледі:
Н2С = СН2 + Вг2 → ВгН2С - СН2Вr
этилен 1,2-дихлорбром
Бромдау реакциясы алкендердің сапалық реакциясы болып табылады, бромның түссізденуі бойынша алкендерді сапалық анықтауға болады.
Алкендердің фтормен әрекеттесуі шабытты жүреді, ал йодпен әрекеттесуі баяу жүреді.
Этиленге хлор қосып, дихлорэтан С2Н4СІ2 алуға да болады.
Н2С = СН2 + СІ2 → СІН2С - СН2СІ
этилен 1,2-дихлорэтан
Галогенсутектерді қосып алу. Галогенсутектердің алкендердің қосып алу реакциясына түсуі ионды механизм арқылы іске асады. Симметриясыз алкендерге галогенсутектер қосылғанда екі түрлі өнім түзілетінін, реакция Марковников ережесі бойынша жүреді.
H2C=CH2 + HBr → CH3 -CH2Br,
Гидратация реакциясы. Суды қосып алу. Мұнда өршіткі ретіде күкірт Н2SО4 немесе Н3РО4 фосфор қышқылдары пайдаланылады. Алкендердің қышқылдық ортадағы гидратациясы иондық механизммен жүреді
CH2=CH2 + H2O → CH3-CH2OH.
Бұл реакцияның өнеркәсіптік маңызы зор.
Пропен молекуласына судың қосылуы Марковников ережесі бойынша жүріп, пропанол-1 емес, пропанол-2 түзіледі:
СH3—СH =CH2 + H - OH →H3C - CHOH-CH3
Галоген сутектер мен судың симметриялы емес алкендерге қосылу реакциялары В.В. Марковников ережесіне сәйкес жүреді. Ол былай тұжырымдалады: Гидрогалогендеу және гидраттау реакцияларында сутегі атомы субстрат құрамындағы сутегі атомы көп, яғни көп гидрогенденген, көміртегі атомына қосылады:
СН3-СН=СН2 + НСІ→ Н3С-СНСІ –СН3
Тотығу реакциясы. Этиленді көмірсутектер толық тотыққанда (жанғанда) жарқыраған жалын шығара жанады:
H2C=CH2 + 3O2 → 2CO2 + 2H2O,
Алкендер ауадағы оттектің және басқа тотықтырғыштардың әсерінен тотығады.Тотығудың бағыты реакция жағдайына және тотықтырғыштың табиғатына тәуелді. Күміс өршіткінің қатысуында ауадағы оттектің әсерінен алкенгдер органикалық оксидтерге яғни эпоксидтерге дейін тотығады.
CH2
=
CH2
+
O2 H2C -О
-CH2,
H2C -О
-CH2,
2H2C=CH2
+
O2 2CH3C(O)H,
2CH3C(O)H,
Жұмсақ тотығу кезінде бөлме температурасында сілтілік орта жағдайында КМnО4-тің судағы ерітіндісі этилен газын түссіздендіреді. Алкендердің қалыпты жағдайда тотығуы (Вангер реакциясы)
3CH2 = CH2 + 2KMnO4 + 4H2O → 3HO -CH2 -CH2 -OH + 2MnO2 + 2KOH,
С6Н6
+
CH2
=CH2 С6Н5
-CH2CH3,
С6Н5
-CH2CH3,
Полимерленуі реакциясы. Қысымның немесе өршіткінің әсерінен этилен қатты күйдегі үлкен молекулалы қосылыс полиэтиленге айналады.
CH2 = CH2 → (-CH2-CH2-)n.
CH2 = CH2 → HC≡CH + H2,
Пропен:
H2C=CH -CH3 + H2 → CH3 -CH2 -CH3,
H2C=CH -CH3 + Br2 → BrCH2 -CHBr -CH3,
H2C=CH -CH3 + HCІ → CH3 -CHCІ -CH3,
H2C=CH -CH3 + H2O → CH3 -CH(OH) -CH3,
H2C =CH -CH3 + С6Н6 → С6Н5- H3C–CH-CH3,
CH2
=
CH2
+
O2 H2C -О -СН
-CH3,
H2C -О -СН
-CH3,
3H2C = CH -CH3 + 2KMnO4 + 4H2O → 3HO -CH2 -CH(OH) -CH3 + 2MnO2 + 2KOH,
H2C = CH -CH3 → (-CH2 -C(CH3)H-)n.
Катализаторлар қатысында алкандар мен алкендер арасында алкилдеу реакциясы жүреді:
CH3 -CH(CH3) -CH3 + CH2 = C(CH3) -CH3 → CH3 -C(CH3)2 -CH2 -CH(CH3) -CH3.
CH2=CH-CH3
+
CІ2
 CH2=CH-CH2CІ +
HCІ,
CH2=CH-CH2CІ +
HCІ,
H2C=CH -CH3 → HC ≡ C -CH3 + H2.
Алкиндердің химиялық қасиеттері
Алкиндерге де алкендер тәрізді көміртек қаңқасына, еселі байланыс орнына сәйкес изомерлер тән. Сонымен қатар алкиндердің де көмірсутектердің басқа кластарынан изомері болады. Алкиндер мен жалпы формулалары бірдей (СnН2n-2) алкадиендер арасында класаралық изомерлер бар.
 СnН2n
+2
СnН2n
+2
![]() СnН2n -2
СnН2n -2
 СnН2n –
2Вr4
СnН2n –
2Вr4
 СО2
+Н2О
СО2
+Н2О
 СН2
=СН -
С≡СН
СН2
=СН -
С≡СН

![]()
Алкиндерге:
а) қосылу (гидрленуі,
галогенденуі, галогенсутектерді қосып алуы, гидратация реакциялары)
Марковников ережесі бойынша сутек атомы сутек атомы көбірек
көміртек атомына, ал галоген атомы сутек атомы азырақ көміртек
атомына қарай тартылады.
В.В. Марковников – орыс органик-химигі. Ол еңбектерін мұнай
химиясына, органикалық синтезге арнады. Нафтендерді зерттеді.
Гидратация реакциясы сынап (II) сульфатының қатысында жүреді. Оны
1881 жылы М.Г.Кучеров ашқан. Өнеркәсіпте осы жолмен алынады. Аралық
тұрақсыз өнім – винил спирті түзіліп, ол изомерленіп,
ацетальдегидке айналады:
Ацетилен:
Гидрогендеу реакциясы. Катализатор Nі, Рt, Рd қатысында ацетилен сутекті қосып алады, ол процесс сатылап жүреді:
HC≡CH
 CH2=CH2
CH2=CH2 CH3
-СH3,
CH3
-СH3,
Галогендеу реакциясы. Алкиндердің галогенденуі алкендерге қарағанда баяу жүреді және реакция барысында дигалогеналкендер түзілуі мүмкін. Оларды бөліп алу жеңіл. Ал галогенденудің 1,1,2,2- тетрабромэтан түзу сатысы қиындау жүреді. Ацетиленнің бром суымен әрекеттесуі еселі байланысы бар заттарға сапалық реакция болып табылады.
HC ≡CH +
Br2
→
BrCH=CHBr  Br2CH
-CHBr2,
Br2CH
-CHBr2,
Реакция соңында бром суы түссізденеді.
Гидрогалогендеу реакциясы. Галогенсутекті қосып алу. Алкиндердің галогенсутекті қосып алуы баяу жүреді, бірақ сынап (ІІ) хлориді НgСІ2 , т.б. катализаторлар қатысумен реакция жүруі тездейді:
HC ≡CH + HCІ →
CH2=CHCІ
 CH3
-CHCІ2.
CH3
-CHCІ2.
Кучеров реакциясы:
C2H2+
H2O
 [CH2
=CHOH] →
CH3COH
[CH2
=CHOH] →
CH3COH
Винил реакциясы:
CH ≡CH + C2H5OH → CH2 =CH -O -C2H5,
винилэтиловый эфир
CH ≡CH + HCN → CH2 = CH -CN,
синильная к-та акрилонитрил
CH ≡CH + H3C -COOH → CH3COO- CH=CH2
винилацетат
ди- мен тримерлену реакциясы:
2СH≡CН
 CH≡C
-CH=CH2,
CH≡C
-CH=CH2,
винилацетилен
3СH≡CН

![]()
Орынбасу реакциясы:
CH≡CH + 2Na → Na -С≡C -Na + H2,
CH≡CH + 2AgNO3 + 2NH3 → Ag -С≡C -Ag + 2NH4NO3,
CH≡CH + 2CuCІ +2NH3 → Cu-С≡C-Cu + 2NH4Cl.
Тотығу реакциясы:
3HC≡CH + 8KMnO4 → 3KO(O)C-C(O)OK + 8MnO2+ 2KOH + 2H2O,
2C2H2 + 5O2 → 4CO2 + 2H2O.
Пропин:
HC≡C-CH3
 CH2=CH—CH3
CH2=CH—CH3
 C3H8
C3H8
H3C–C≡CH +
Br2
→
H3C−CBr =
CHBr  H3C−CBr2−
CHBr2
H3C−CBr2−
CHBr2
HC≡C—CH3 + HBr → H2C=CBr—CH3 → H3C—CBr2—CH3,
С![]() Н3-С ≡СН +
Н2О
Н3-С ≡СН +
Н2О

тримерлену:
3CH ≡C -CH3 → С6Н3 –(СН3)3.
2CH3 -C≡CH + 2Na → 2CH3 -С≡C -Na + H2
CH3 -C≡CH + [Cu(NH3)2]OH → H3C -C≡CСu + 2NH3 + H2O
Алкадиендердің химиялық қасиеттері
Алкадиендер — қанықпаған көмірсутектердің маңызды түрлерінің бірі.
Алкадиендер — құрамында екі қос байланысы бар, жалпы формуласы СnН2n-2 болатын қанықпаған көмірсутектер.
Алкадиендерді кысқартып диен көмірсутектері деп те атайды. Диен көмірсутектерінің бірінші мүшесі пропадиен (аллен) СН2 = С = СН2. Диендерде қос байланыстардың өзара орналасуы әр түрлі болуы мүмкін. алкадиендердің номенклатурасы алкендерге ұқсас екенін, бар айырмашылығы — қос байланыстың саны екеу болғандықтан, -ен жұрнағының алдына оның саны көрсетіліп, -диен деп аталатындығын және бір кос байланыстан кейін үтірден соң екінші қос байланыстың орны көрсетілетінді.
Молекулаларында қос байланыстары болғандықтан, диендердің химиялық қасиеттері алкендерге ұқсас, бұлар да қосылу және полимерлену реакцияларына оңай түседі. Алкадиендер галогендерді, сутекті, галогенсутекті қосып алады. Молекулаларындағы қос байланыстары дара байланыспен бөлінген диендер қасиеттерінің ерекшеліктері бар. Бұл диендер реагенттерді бір немесе екі қос байланыстары бойынша (1,2 және 3,4 қосылу) да, молекуланың екі шетіне де (1,4 қосылу) қосып алады.
Косылу реакциясы. Галогендерді қосып алуы галогеннің табиғатына және реакция жағдайына тәуелді болады.Температура жоғарылағанда және хлордан йодқа қарай ауысқанда 1,4- реакция өнімінің мөлшері артады. Сондықтан да алкендердегі секілді қосып лау реакциясы әрі иондық, әрі радикалдық механизммен жүреді.
![]() BrCH2
–CHBr - CH
=CH2
BrCH2
–CHBr - CH
=CH2
H2C =CH -CH =CH2 + 2Br2
![]() Br
-CH2
–CH =CH
-=CH2Br
Br
-CH2
–CH =CH
-=CH2Br
Диен көмірсутектерінде электрондар тығыздығы атомдар арасына бірдей таралған. Қосылу реакциясы бір қос байланыс арқылы жүрсе, онда 1,2- қосылу деп, ал косарланған жүйе бұзылу арқылы жүрсе, онда 1,4 қосылу деп аталады.
Гидрленуі реакциясы.
Сутекті косып алуы (гидрленуі) сатылап жүреді:
Жартылай гидлену
H2C=CH -CH=CH2 + 2H2 → CH3 -CH =CH -CH3.
бутадиен – 1,3 бутен-2
толық гидрлену
CH3 -CH =CH -CH3+ 2H2 → CH3 -CH2 -CH2 -CH3.
бутен-2 бутан
Полимерленуі:
nH2C=CH -CH=CH2 → (-CH2 –CH = CH -CH2-)n.
Ароматты көмірсутектердің химиялық қасиеттері. Бензол.
Арендер — молекулаларының құрамында бензол сақинасы (бензол ядросы) бар жалпы формуласы СnН2n -6 болатын көмірсутектер. Арендердің ең қарапайым мүшесі — бензол С6Н6.
Бензол өте қанықпаған қосылыс бола тұра, кәдімгі жағдайда қанықпаған көмірсутектерге тән реакцияларға қатыспайды: бром суы мен калий перманганаты ерітіндісін түссіздендірмейді. Оның себебін бензолдың электрондық формуласы түсіндіреді: әр көміртектің р-электрондарының (6р)тұтасуынан түзілген
π-байланыс сақинаға орынбасуды, қосып алуды қиындатады. Сондықтан ароматты көмірсутектер қасиеттері жөнінен қаныққан және қанықпаған көмірсутектердің аралығында деуге болады.
Бензолдардың химиялық қасиеттері:
 С6Н6CI6
С6Н6CI6
 С6Н5-СН3
С6Н5-СН3
 СО2
+
Н2О
СО2
+
Н2О
![]() С6Н6
С6Н6
 С6Н5Вr
С6Н5Вr
 С6Н5
-SО3Н
С6Н5
-SО3Н
 С6Н12
С6Н12
 С6Н5
-NО2
С6Н5
-NО2
Бензол гомологтарының химиялық қасиеттері:
 С6Н5
-СН2CI
С6Н5
-СН2CI
 С6Н5-СН3СІ
С6Н5-СН3СІ
 СО2
+
Н2О
СО2
+
Н2О
![]() С7Н8
С7Н8
 С6Н5СООН
С6Н5СООН
 С6Н5
-СН3-SО3Н
С6Н5
-СН3-SО3Н
 С6Н5
–(NО2)3СН3
С6Н5
–(NО2)3СН3
C6H6
+
Cl2 C6H5CІ + HCІ
(галогендеу)
C6H5CІ + HCІ
(галогендеу)
C6H6
+
HNO3 C6H5-NO2
+
H2O
(нитлеу)
C6H5-NO2
+
H2O
(нитлеу)
С6Н6 С6Н5-SO3H +
H2O
(сульфендеу)
С6Н5-SO3H +
H2O
(сульфендеу)
С6Н6 +
RCІ
 С6Н5-R +
HCІ
(алкилдеу)
С6Н5-R +
HCІ
(алкилдеу)
С6Н6 + СН3СОCІ
 С6Н5-СОСН3
+ HCІ
(алкилдеу)
С6Н5-СОСН3
+ HCІ
(алкилдеу)
С6Н6 +
ЗН2 С6Н12 циклогексан (сутекті қосып
алуы)
С6Н12 циклогексан (сутекті қосып
алуы)
(1,2,3,4,5,6-гексахлороциклогексан, хлордй қосып алуы)
C6H6+
3СІ2 C6H6CІ6
C6H6CІ6
Толуол С6Н5 — СН3 судан жеңіл, суда ерімейтін, түссіз сұйықтық. Дәрі-дәрмектер, бояулар және қопарылғыш заттар (тротил, тол), синтетикалық жуғыш заттар, капролактам алу үшін қолданылады. Полимерлердің жаксы еріткіші болып табылады. Антидетонаторлық қасиетін өсіретін болғандықтан, бензинге қоспа ретінде қолданылады.
КMnO4- тің қызғылт түсті ерітіндісін түссіз толуолға құйып, қоспаны аздап қыздырғанның өзінде ерітінді біртіндеп түссізденеді. Оның себебі бензол сақинасының әсерінен метил тобындағы атомдарда белсенділік байқалып, ол тез тотығады да карбоксил –СООН тобына айналады:
C6H5-CH3 + 3О → C6H5-CООН + H2O
С6Н5-CH3 + [О] → С6Н5-COOH кипячение с раствором КMnO4 (окисление алкилбензолов)
Толуолдағы метил СН3–тобының бензол сақинасына әсерін оның азот қышқылымен әрекеттесуінің оңай жүреді. Нәтижесінде бензол сақинасындағы 2,4,6- орындарында электрон тығыздықтары өседі де үш сутек атомдары орынбасу реакциясына оңай түседі.
C6H5-CH3 + НОNО2 → C6H2(NО2)3-CH3 + 3Н2О
Метил тобының –СН3 электрон тығыздығы бензол сақинасына қарай ығысуы нәтижесінде сақинадағы электрон тығыздығының біркелкі бөлінуі бұзылады.
C6H5-CH3
+
СІ2
 C6H5-CH2СІ +
НСІ
C6H5-CH2СІ +
НСІ
C6H5-CH2СІ +
СІ2
 C6H5-CHСІ2
+ НСІ
C6H5-CHСІ2
+ НСІ
C6H5-CHСІ2
+
СІ2
 C6H5-CСІ3
+ НСІ
C6H5-CСІ3
+ НСІ
C6H5-CH3 + 2KMnO4 → C6H5COOK + 2MnO2 + KOH + H2O,
5C6H5-CH3 + 6KMnO4 + 9H2SO4→ 5C6H5COOH + 6MnSO4+ 3K2SO4+ 14H2O.
Оттекті органикалық қосылыстар. Спирттер.
Қаныққан біратомды спирттердің химиялық қасиеттері.
 R
-ОNа
R
-ОNа
 R
–Гал.
R
–Гал.

![]() R-ОН
R-ОН СnН2n
СnН2n
 R-О-R
R-О-R
 СО2
+
Н2О
СО2
+
Н2О

Спирттердің химиялық қасиеттерін анықтайтын гидроксил тобы және ол байланысқан радикалдардыц құрылысы. Гидроксил тобы қатысында өтетін реакциялар О—Н немесе С—ОН байланыстарын үзу арқылы жүреді. Спирттер (алканолдар) полюсті косылыстар, көміртек пен оттек және оттек пен сутек атомдарының арасында екі полюсті байланысы бар: С → О жәнө О ← Н . О ← Н байланысының полюстігі С → О байланысының полюстігіне қарағанда жоғары. Оттектің жұп электрондары спирттерге электрондонорлық қасиет береді.
Қаныққан біратомды спирттердің жалпы формуласы СН- ОН . Олар сутектің бір атомы гидроксил тобына алмасқан алкандардың туындылары. Ең қарапайым спирт метанол СНОН. Спирттер молекуалаларының арасындағы сутектік байланыс олардың қасиеттеріне әсер етеді
Спирттердің химиялық қасиеттері
Спирттің гидроксил тобындағы сутек атомының орнын белсенді металдар баса алады:
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2.
Спирттер галогенсутектермен әрекеттеседі, бұл гидроксил тобының орнын галоген басу арқылы өтетін қайтымды реакция:
C![]()
![]() 2H5OH + НBr
C2H5Br +
H2O,
2H5OH + НBr
C2H5Br +
H2O,
Гидроксил тобының алмасуы:
CH3CH2CH2-OH + PCl5 → CH3CH2CH2CІ + POCІ3 + HCІ,
CH3CH2CH2-OH + SOCІ2 → CH3CH2CH2CІ + HCІ + SO2.
Дегидратация реакциялары.
Жоғарырақ температурада t0 > 1400С дегидратациялағанда, реакция молекула ішінде өтеді, нәтижесінде алкен түзіледі:
CH3CH2CH2OH → СH3CH=CH2 + H2O,
CH3CH2CH(OH)CH3 → СH3CH=CHCH3 + Н2О.
Егер дегидратациян төменірек температурада жүргізсе, онда реакция молекулааралық өтеді де, жай эфир түзіледі:
2CH3
-CH2
–OH
 CH3
-CH2
–O
-CH2
-CH3
+
Н2О.
CH3
-CH2
–O
-CH2
-CH3
+
Н2О.
Мыс (ІІ) оксидімен тотығып, альдегид түзуі біріншілік спирттердің сапалық реакциясы:
C2H5OH + CuO → CH3C(O)H + Cu + H2O,
Тотығу реакциялары.
Тотықтырғыштардың әсерінен (хромды қоспа K2Cr2O7+ H2SO4), біріншілік спирттер альдегидке дейін, ал екіншілік спирттер кетонға дейін тотығады:
3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3COH + Cr2(SO4)3 + K2SO4 + 7H2O,
3C2H5OH + 2K2Cr2O7 + 8H2SO4 → 3CH3COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O.

Көпатомды спирттер.
Молекуласында екі гидроксил тобы бар спирттерді екі атомды спирттер немесе гликольдер деп атайды. СnH2n(OH)2.
HOCH2 -CH2OH.
Химиялқ қасиеттері:
Көпатомды спирттердің құрамында гидроксил топтары болғандықтан, химиялық қасиеттері біратомды спирттерге ұқсас. Олармен белсенді металдар әрекеттесіп, гидроксил тобында сутекті ығыстырады, галогенсутектермен орынбасу реакциясына түседі, спирттермен әрекеттесіп жай эфирлер, карбон қышқылдарымен әрекеттесіп күрделі эфирлер түзіледі. Реакцияға бір гидроксил тобы түсуі мүмкін:
HOCH2 -CH2OH + 2Na → NaOCH2 -CH2ONa + H2↑,
HOCH2 -CH2OH + CH3OH → HOCH2 -CH2 -O-CH3 + H2O,
HOCH2 -CH2OH + 2CH3OH → СH3OCH2 -CH2OCH3 +2H2O,
HOCH2 -CH2OH + HCІ → HOCH2 -CH2CІ,
4HOCH2 -CH2OH + 2PCІ5 → CІCH2 -CH2CІ + 2P(O)CІ3 + 2HCІ,

![]()
Көпатомды спирттердің құрамында бірнеше гидроксотоптардың болуынан сутек атомдары қозғалғыш келеді де, олар ауыр металдардың гидроксидтермен де әрекеттеседі. Бұл реакция –көпатомды спирттерге сапалық рекция.

![]()
![]()
![]()
![]()
Үш атомды спирттер
Бұлардың ең қарапайым өкілі - глицерин
HOCH2-CH(OH)-CH2OH.
2HOCH2-CH(OH)-CH2OH + 6Na → 2NaOCH2-CH(ONa)-CH2ONa + 3H2,


немесе реакция теңдеуін ықшамдап былай жазуға болады:
HOCH2-CH(OH)-CH2OH
 →
СІCH2-CH(OH)-CH2OH
→
СІCH2-CH(OH)-CH2OH
 →
→
→ СІCH2-CH(СІ)-CH2OH
 →
СІCH2-CH(СІ)-CH2СІ
→
СІCH2-CH(СІ)-CH2СІ
Этерификация реакциясы:

![]()

![]()
Фенолдың химиялық реакциясы
 С6Н5
-ОNа
С6Н5
-ОNа
 С6Н5
–СІ
С6Н5
–СІ
 С6Н2Вr3ОН
С6Н2Вr3ОН
![]() С6Н5-ОН
С6Н5-ОН С6Н2(NО2)3ОН
С6Н2(NО2)3ОН
 С6Н4SО3НОН
С6Н4SО3НОН
 С6Н5
–О-СН2-СН3
С6Н5
–О-СН2-СН3
 (-C6H3OH-CH2-)n
(-C6H3OH-CH2-)n
 С6Н5ОССН3О
С6Н5ОССН3О
Фенол молекуласындағы –ОН тобының бензол сақинасының орта-және пара- орындарына әсері едәуір болғандықтан оттек атомы сутек атомынан электрондық тығыздықты өзіне қатты тартады. О ← Н арасындағы ковалентті байланыс полярлы болғандықтан сутек атомы қозғалғыш күйге түседі. Бұл жағдайда фенол сілтімен оңай әрекеттесіп фенолят түзіледі.Бензол сақинасыына электрон-акцепторлы орынбасушылар нитротоп пен галогендер енгізсе, фенолдың қышқылдық қасиеті жоғарылайды.
Гидроксил тобының реакциялары. Қышқылдығы. Фенолдың қышқылдық қасиеті спирттерден басым болғанмен, ол әлсіз қышқыл. Тіпті көмір қышқылы мен сірке қышқылынан да әлсіз, лакмустың түсін өзгерте алмайды.
Спирттен өзгешелігі-фенол қышқылдармен әрекеттеспейді.
1. Фенолдың балқу температурасына дейін қыздырып, оған металл натрий салса, реакция сутек бөліне жүреді:
2C6H5OH + 2Na → 2C6H5ONa + H2.
Фенолдың бұл қасиеті спирттерге ұқсас
2. Спирттерден ерекшелігі- фенол қышқылдық қасиет көрсететіндіктен, сілтілердің судағы ерітіндісімен әрекеттесіп, реакция нәтижесінде тұздар (фенолят) түзіледі:
C6H5OH + NaOH → C6H5ONa + H2O,
Фенолдың қышқылдығы төмен болғандықтан , фенолят әлсіз қышқылдың әсерінен-ақ ыдырап кетеді:
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
Бензол сақинасының реакциялары. Электрофильді орынбасу реакциясы. Фенолдың гидроксил тобы бензолдың (орто- және пара-орындарына үлкен әсерін тигізеді.Бұл орындарда (электрофильді) орынбасу реакциялары оңай өтеді.
3. Фенол бромды сумен оңай әрекеттесіп, ақ түсті 2,4,6-трибромфенол тұнбаға түседі. Бұл-фенолдың сапалық реакциясы:
![]()
![]()


![]()
![]()
![]()
4. Концентрациялы азот қышқылымен әрекеттескенде ,2,4,6-тринитрофенол алынады, Бұл қосылысты пикрин қышқылы деп те атайды:

![]()

![]()
![]()
С6Н5ОН + (СН3СО)2О → СН3СООС6Н5 + СН3СООН ( о-ацилирование)
С6Н5ОН + СН3СОСІ → СН3СООС6Н5 + НСІ
6. Фенол формальдегидпен оңай әрекеттеседі. Реакция қышқыл немесе негіз қатысында жүреді. Бұл реакция нәтижесінде, жоғары молекулалы қосылыс фенолформальдегид шайыры алынады.
7. Фенол темір (ІІІ) хлоридімен күлгін түсті кешенді қосылыс түзеді, бұл реакция фенол үшін сапалық реакция ретінде пайдалануға болады.
Фенолдар спирттерге қарағанда қышқылдық қасиеттері күштірек. Бұл қасиет Фенолдарда теріс электрлігі жоғары топ қосылған сайын күшейе береді, мысалы, нитротоп, галоген, күкірт. Фенолдар сілтілерде еріп феноляттар, сілтілік ортада оңай ацилденіп алифатты және хош иісті қышқылдардың күрделі эфирлерін, алкилденіп жай эфирлер түзеді.
Фенолдың альдегидтермен поликонденсациялануы.
Фенол формальдегидпен поликонденсация реакциясына қатысады, нәтижесінде, фенолформальдегид шайыры түзіледі:
n C6H5OH + n CH2O → n H2O + (-C6H3OH-CH2-)n
Альдегидтер мен кетондардың химиялық қасиеттері
 R
-СН2
–ОН
R
-СН2
–ОН
![]() R-СОН
R-СОН  R–НСОН-SО3Nа
R–НСОН-SО3Nа
 R
-СООН
R
-СООН
Альдегидтер мен кетондар кұрамында >С=Окарбонил тобы болады. Оларды кейде оксоқосылыстар деп атайды, ал карбонил тобын оксотоп дейді. Альдегидтерде карбонил тобы бір радикалмен және сутек атомымен байланыскан, ал кетонда карбонил тобы екі радикалмен байланысқан.
Құрамында еселі байланыс болғандықтан, карбонилді қосылыстарға қосылу реакциясы тән. Қосылатынреагенттің теріс зарядталған бөлігі көміртек атомына, ал оң зарядталған бөлігі оттек атомына қосылады. Басқа органикалық қосылыстарменсалыстырғанда, альдегидтерде карбонилді топпен байланысқан С-Н байланысының белсенділігі жоғары және реакцияға жеңіл түседі.Альдегидтер мен кетондар көптеген химиялық реакцияға белсенді қатысады. Бұл карбонил тобындағы қос байланыстың біреуі σ- байланыс, ал екінші π- байланыс болғандықтан, электрон тығыздығы көміртек атомынан оттегі атомына қарай ығысып, поляризациялануынан болады. Сондықтан химиялық реакция кезінде карбонил тобы жоғарғы белсенділік көрсетеді. Олар қосып алу, алмасу, тотығу, полимерлену, конденсация реакцияларына қатысады.
Альдегидтердің химиялық қасиеттері:
Қосылу реакциялары.
а)Қос байланысқа сутектің қосылуы. Альдегидтер мен кетондар карбонил тобының қос байланысы бойынша металл катализаторлар (Nі, Рt) қатысында сутекті қосып алып, тотықсызданады. Реакция нәтижесінде альдегидтер біріншілік спиртке, ал кетондар екіншілік спиртке айналады.
CH3 -COH + H2 → CH3 -CH2OH,
б) Көгерткіш қышқылды (НСN) қосып алу. Оксинитрилдер түзіледі.
CH3 –COH + HCN → CH3OHCH -C≡N
циангидрин.
в) Альдегидтер спирттерді қосып алып, жартылайацетальдар түзіледі.Егер реакцияны хлорлы сутек қатысында қыздыру арқылы жүргізсе, толық ацеталь түзіледі.

![]()
![]()

![]()
![]()
![]()
CH3
-COH
 CH3
-CH2OH,
CH3
-CH2OH,

5CH3-COH + 2KMnO4 + 3H2SO4 → 5CH3-COOH + + 2MnSO4 + K2SO4+ 3H2O,
CH3-CH2-COH + 2[Ag(NH3)2]OH → CH3-CH2-COONH4 + 2Ag + 3NH3 + H2O
(«Күміс-айна» реакциясы),
Альдегидтерге сапалық реакция ретінде мыс (II) гидроксидімен жүретіп реакцияны да қолдануға болады. Алғаш сары тұнба — мыс (I) гидроксиді түіледі. Содан кейін ол қызыл түсті мыс (I) оксидіне айырылады:
CH3-(CH2)2-COH +
2Cu(OH)2 CH3-
(CH2)2-COOH +
Cu2O +
2H2O.
CH3-
(CH2)2-COOH +
Cu2O +
2H2O.
Дигалогеналкандардың алынуы
CH3-(CH2)2-C(O)H + PCl5 → CH3-(CH2)2-CHCІ2 + POCІ3.
Орынбасу реакциясы:
CH3 -CH2 -CH2 -COH + CІ2 → CH3-CH2 -CHCІ -COH + HCl.
Полимеризация реакциясы:
nH-COH → [-O-CH2-]nn= 10—100.
Кетондардың химиялық қасиеттері:
CH3-CH2-C(O)-CH3 + H2 → CH3-CH2-CH(OH)-CH3,
CH3-CH2-C(O)-CH3 + PCІ5 → CH3-CH2-CCІ2-CH3 + POCІ3,
CH3-C(O)-CH3 + Br2 → BrCH2-C(O)-CH3 + HBr,
C6H5-C(O)-CH3 + CІ2 → C6H5-C(O)-CH2CІ + HCІ.
Карбон қышқылдарының химиялық қасиеттері.
![]() R-СООМе
R-СООМе
 R-СООМе
R-СООМе
 R-СООМе
R-СООМе
 R-СООNа +
СО2↑
R-СООNа +
СО2↑
![]()
![]() R-СООН
R-СООН R-СООR1
R-СООR1
 R-ОС-О-СО-
R
R-ОС-О-СО-
R
 R
–СО-СІ
R
–СО-СІ
R-СІСН-СООН
Карбон қышқылындағы карбоксил тобы-СООН-тың әсерінен көмірсутек радикалындағы сутектің қозғалғыштығы артып (-СООН жақын болса) ол галогенмен орынбасу реакциясына түседі
Карбон қышқылдарының химиялық қасиеттері:
бірнеше карбоксил тобы -СООН болады.Жалпы формуласы СnH2nO2 не CnH2n+1COOH. Карбон қышқылдары қаныққан, қанықпаған және ароматты болып бөлінеді. Құрамындағы карбоксил тобының санына байланысты бір негізді, екі негізді, көп негізді болып бөлінеді. Бір негізді карбон қышқылы: СН3СООН, СН3 – СН2 – СООН.
Қаныққан бір негізді карбон қышқылдарының изомериясы көміртегі тізбегінің құрылысына байланысты, изомері көміртегі атомдар саны 4-тен жоғары басталады. C3H7COOH – екі изомер; C4H9COOH – төрт изомері болады. HCOOH – құмырсқа (метан) қышқылы; СН3-СООН - сірке (этан) қышқылы; С2Н5-СООН - пропион (пропан) қышқылы; С3Н7-СООН - май (бутан) қышқылы; СН3- СН(СН3) – СООН - изомай (2-метилпропан) қышқылы
Тұз түзу. Карбон қышқылдары металдармен, сілтілермен, карбонаттармен әрекеттесіптұздартүзеді:
Белсенді және орташа белсенді металдармен әрекеттескенде, тұз түзіліп, сутек ығысады:
2CH3-COOH + Ba → (CH3-COO)2Ba + H2↑,
2CH3COOH + Fe → (CH3COO)2Fe + Н2
Металл оксидтерімен және гидроксидтерімен әрекеттескенде, тұз және су түзіледі:
2CH3-COOH + CuO → (CH3-COO)2Cu + H2O,
2CH3COOH + MgO → (CH3COO)2Mg + Н2O
HCOOH + KOH → HCOOK + H2O,
CH3COOH + KOH → CH3COОК + Н2O
Әлсіз қышқылдарды тұздарынан ығыстырады:
CH3COOH + NaHCO3 → CH3COONa + CO2 + Н2O
Аммиакпен әрекеттескенде, аммоеий тұзы түзіледі:
HCOOH + NH3 → HCOONH4
C![]()
![]() H3COONa +
H2O
CH3COOH +
NaOH
H3COONa +
H2O
CH3COOH +
NaOH
2СH3COOH → СH3 -ОC-O-СО-CH3 + H2O,
СH3CH2COOH + SOCІ2 → СH3CH2COCІ + HCІ + SO2,
СH3CH2COOH + PBr5 → СH3CH2COBr + HBr + P(O)Br3,
СH3COOH + PCІ5 → СH3COCІ + HCІ + P(O)CІ3.
Күрделіэфиртүзу.
Карбон қышқылдары спирттермен әрекеттесіп, күрделі эфирлер түзіледі, су тартатын конц. күкірт қышқылы қатысады.
С![]() H3CH2COOH +
CH3OH
H3CH2COOH +
CH3OH
 СH3CH2–COOCH3
+
H2O.
СH3CH2–COOCH3
+
H2O.
СH3CH2COOH + CH≡CH → СH3CH2COO-CH=CH2
Күрделі эфирлердің химиялық қасиеттері.
Гидролиздену реакциясы. Күрделі эфирлердің гидролизі этерификация реакциясына кері реакция, қышқыл немесе сілті қатысында жүреді. Күрделі эфир сумен әрекеттесіп айырылып, реакция нәтижесінде қышқыл және спирт түзіледі:
CH3–COOC2H5 + H2O → CH3COOН + C2H5OН
С![]()
![]() H3CH2COOH +
CH3OH
СH3CH2–COOCH3
+
H2O.
H3CH2COOH +
CH3OH
СH3CH2–COOCH3
+
H2O.
қышқыл спирт күрделі эфир
CH3–COOC2H5 + NаOН → CH3COONа + C2H5OН
Күрделі эфир карбон қышқылының тұзды
Майлардың химиялық қасиеттері.
Глицеридтерді түзуге, негізінен, қаныққан қышқылдардан пальмитин С15Н31СООН мен стеарин С17Н35СООН қышқылдары, қанықпаған қышқылдардан — олеин С17Н33СООН, линол С17Н31СООН, линолен С17Н29СООН қышқылдары қатысады. Кейбір майлардың құрамына төменгі қышқыл қалдықтары кіреді. Мысалы, сары майда май қышқылының (С4Н9СООН) қалдығы болады. Сиырдың сары майы құрамына май қышқылымен қатар пальмитин және олеин қышқылдарының қалдықтары кіреді.
Майлардыц гидролизі. Күрделі эфир болғандықтан, майлар минерал қышқылдар, сілтілер қатысында қыздырғанда, гидролизденеді. Сонымен қатар майлар тірі организмде ферменттердің әсерінен гидролизденеді. Реакция нәтижесінде глицерин мен карбон қышқылы түзіледі:

![]()
![]()
Сілті қатысында гидролизденгенде, глицерин мен карбон қышқылының тұзы (сабын) түзіледі. Бұл реакция майдың сабындану реакциясы деп аталады:

![]()
Гидролиз процесін жүргізу үшін майларды сумен қосып, автоклавта (қысымда) қыздырады. Егер майларды сода немесе сілті қосып қыздырса, сабын түзіледі. Сабынды бөлу үшін натрий хлоридін қосады. Сабын алу үшін қатты майлар қолданылады. Қатты майлар бағалы тамақ өнімдері, сондықтан құрамында қанықпаған қышқылдары бар сұйық майларды қатты майларға айналдырады.
2. Майларды гидрлеу (гидрогендеу). Өсімдік майларының құрамына қанықпаған қышқылдардың күрделі эфирлері кіретін болғандықтан, оларды гидрлеуге болады. Қыздырылған май (150—160°С температурада) және ұнтақталған никель катализаторы қоспасына сутек жібергенде, май құрамындағы еселі байланыстар сутекпен қанығады. Реакция нәтижесінде сұйық май қатты майға айналады. Ол майды саломас немесе құрама май деп атайды:

![]()
Аминдердің химиялық қасиеттері
Аминдер аммиакқа ұқсас негіздік қасиет көрсетеді. Аминдердің негіздік қасиеті — аммиактан жоғары. Себебі аммиакта үш сутек атомының электрон бұлттары азотқа қарай ығысады, ал алкиламиндерде, мысалы, метиламинде екі сутек атомы тікелей жоне үш сутек көміртектің атомы арқылы барлығы бес сутектің электрондары азотқа қарай ығысады. Осының әсерінен метиламинде азот атомындағы теріс зарядтың мөлшері аммиактағы азот атомына қарағанда жоғары болады:
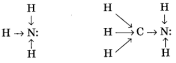
Теріс заряды көп болғандықтан, амин молекуласындағы азот атомы протон қосып алуға бейім болады да, негіздік қасиет көрсетеді.
Аминдердің протон қосып алуы
Аминдер сулы ерітінділерінде аммиак сияқты оң зарядталған сутек ионын (протонды) қосып алып, аммонийлі қосылысқа айналады. Ерітіндіде гидроксил иондары босап, сілтілік орта береді, лакмусты көк түске, фенолфталеинді таңқурай түске бояйды
1. Қышқылдарға протонды бөлу тән болса, негіздерге протонды қосып алу тән болады:
CH3-NH2 + Н2O → [CH3-NH3]+OH-
2. Негіздік қасиет көрсететіндіктен, аминдер аммиак сияқты қышқылдармен әрекеттесіп, тұз түзеді:
(CH3)2NH + HCІ → [(CH3)2NH2]CІ
хлорид диметиламмония
[(CH3)2NH2]CІ + NaOH → (CH3)2NH + NaCІ + H2O
Анилин химиялық реакцияларға амин тобы жәнө бензол ядросы бойынша түседі.
1) Амин тобы бойынша жүретін реакциялар. Анилин қышқылдармен әрекеттесіп, тұз түзеді:
C6H5-NH2 + HCІ → [C6H5-NH3]+CІ-
Аминқышқылдардың химиялық қасиеттері
Аминқышқылдары екідайлы қасиет көрсететіндіктен, қышқылдармен де, негіздермен де әрекеттесетін амфотерлі қосылыстар.
Негіздік қасиет қөрсетіп, қышқылдармен әрекеттеседі:
H2N-CH2-COOH + H+CІ- → [H3N-CH2-COOH]+Cl-
Тұздар түзуі
H2N-CH2-COOH + NaOH → H2N-CH2-COONa+ + H2O
Аминқышқылдарының өзара әрекеттесуі- олардың маңызды қасиеті. Реакцияға бірдей немесе әр түрлі аминқышқылдары түсулері мүмкін. Реакция бір аминқышқылының карбоксил тобы мен екінші қышқылдың амин тобының әрекеттесуі арқылы жүреді.
Аминқышқылдырының қалдықтары өзара –СО-NН- пептид (амид) тобымен жалғасады. Бұл байланыс (-СО-NН-) пептидтік (амидтік) байланыс деп аталады.
Екі аминқышқылының әрекеттесуі нәтижесінде дипептид түзіледі:
H2N-CH2-CO OH + H-NН-CH2-COOH → H2N-CH2-CO-NН-CH2-COOH + H2О
дипептид
Көмірсулардың химиялық қасиеттері
Глюкоза құрамында альдегид тобы бар көпатомды спирт болғандықтан, альдегидтерге және көпатомды спирттерге тән екі жақты қасиет көрсетеді.Альдегид тобына тән реакциялары. Глюкоза жақсы тотықсыздандырғыш, жұмсақ тотықтырғыштардың әсерінен, мысалы, күміс оксидінің аммиактағы ерітіндісімен альдегид тобы ғана тотығып, глюкон қышқылына айналады:
С5Н11O5-CHO +
Ag2O
 CH2OH-(CHOH)4-COOH +
2Ag↓
CH2OH-(CHOH)4-COOH +
2Ag↓
(глюконовая кислота)
Мыс (II) гидроксидімен қыздырғанда, альдегид тобы тотығып, карбоксил тобына айналады және мыс (І) оксидінің қызыл түсті тұнбасы түзіледі:
С5Н11O5-CHO +
Сu(ОН)2
 CH2OH-(CHOH)4-COOH +
Сu2О↓ +
2Н2О
CH2OH-(CHOH)4-COOH +
Сu2О↓ +
2Н2О
С5Н11O5-CHO + Вr2 + Н2O → CH2OH-(CHOH)4-COOH + 2НВr
Никель өршіткісі қатысында сутекпен тотықсызданып, алтыатомды спирт –сорбитті түзеді:
С5Н11O5 -CHO
+ Н2
 CH2OH-(CHOH)4-CH2OH
CH2OH-(CHOH)4-CH2OH
сорбит
Спирттік ашу. Ашытқы ферменті әсерінен ашып, глюкозадан этанол түзіледі. Бұл процестің химизмі өте күрделі. Жүретін өзгерістерді қысқаша былай жазады:
а) С6Н12O6 → 2С2Н5OH + 2CO2
Сүт қышқылды ашу. Глюкоза сүт қышқылды ашығанда, сүт қышқылы түзіледі. Процесс сүт қышқылды бактерия ферменттерінің әсерінен жүреді: Сүт қышқылды ашуы. Глюкоза сүт қышқылды ашығанда, сүт қышқылы түзіледі. Процесс сүт қышқылды бактерия ферменттерінің әсерінен жүреді:
С6Н12O6 → 2CH3-CH(OH)-COOH
Май қышқылы ашу.
С6Н12O6 → С3Н7COOH + 2CO2 + 2Н2O
С6Н12O6+ O2 → HOOC-CH2-С(OH)(COOH)-CH2-COOH + 2Н2O
С6Н12O6 → С4Н9OH + CH3-CO-CH3 + 5CO2 + 4Н2
«Сызбанұсқа бойынша өзгерістерді жүзеге асыру»
Органикалық реакциялар тізбектерін немесе химиялық өзгерістер тізбектерін шешу.
І. Ашық тізбектер
1-жаттығу. Төменде келтірілген өзгерістерді орындауға мүмкіндік беретін реакция теңдеулерін жазып, олардың жүру жағдайларын көрсетіндер:
СН4 → СН3Br → С2Н6 → С2Н5Cl → С2Н5ОН → СН3СОН → СН3СООН → СН3СООС2Н5
Шешуі.
Галогеналкилдерді алкандарды галогендеп алуға болады.Метанның бромдау реакциясы жарықтың немесе температураның әсерінен жүреді:
СН4
+
Br2 CH3Br +
HBr
CH3Br +
HBr
Вюрц реакциясы металл натрий қатысында жүреді, реакция нәтижесінде алкандардың көміртек саны көбірек гомологтарын алуға болады. Көмірсутектердің галогентуындылары металл натриймен әрекеттескенде (Вюрц реакциясы) көміртек қаңқасы ұзарып, галогенид ионы бөлінеді:
CH3Br + 2Na → H3C -CH3 + 2NaBr
C2H6
+
СІ2 CH3CH2СІ
+
HСІ
CH3CH2СІ
+
HСІ
Галогеналкилдердің галоген атомдарын басқа атом топтарына ауыстыруы, олардың маңызды реакциясы болып табылады. Осы реакциялар арқылы органикалық қосылыстардың басқа кластарына өтуге болады. Галогеналкил сілтінің судағы ерітіндісімен әрекеттескенде спирт түзіледі:
С2Н5Cl
+ KOH C2H5OH
+ KCl
C2H5OH
+ KCl
Мыс (ІІ) оксидімен тотығып, альдегид түзуі біріншілік спирттердің сапалық реакциясы. Реакция барысында қара түсті мыс (ІІ) оксиді тотықсызданып, қызғылт түсті мыс түзіледі және альдегидтің өткір иісі сезіледі:
C2H5OH + CuO → CH3-CHO + Cu + H2O
Альдегидтерге сапалық реакция ретінде мыс (ІІ) гидроксидімен жүретін реакцияны да қолдануға болады. Алғаш сары тұнба- мыс (І) гидроксиді түзіледі. Содан кейін ол қызыл түсті мыс (І) оксидіне айырылаы:
CH3-CHO
+2Cu(OН)2 CH3-COOH +
Cu2O+2H2O
CH3-COOH +
Cu2O+2H2O
Карбон қышқылдары сусорғыш заттар қатысында (мысалы, концентрлі Н2SО4) спирттермен әрекеттесіп, күрделі эфир түзеді, бұл –этерификация реакциясы:
CH3-COOH + HO
-CH2
–
CH3 CH3-COO
-CH2
–
CH3
+
H2O
CH3-COO
-CH2
–
CH3
+
H2O
2-жаттығу. Мына айналуларды:
CaC2
 C2Н2
C2Н2 C2Н4
C2Н4 C2Н5Br
C2Н5Br
 C2Н5NH2
C2Н5NH2 [C2Н5NH3]HSO4
[C2Н5NH3]HSO4
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар
Шешуі.
Ацетиленді кальций карбидін сумен әрекеттестіріп алады
CaC2 + 2H2O →Ca(OH)2 ↓ + C2Н2↑
Сутектің қосылуы өршіткі (никель, платина) қатысында қыздыру арқылы жүреді.
C2Н2
+Н2
 C2Н4
C2Н4
Алкендерге галогенсутектердің қосылуы оңай жүріп, нәтижесінде, галогеналкандар түзіледі
C2Н4+ HBr→C2Н5Br
3-жаттығу. Мна айналуларды:
С4Н8О→С4Н8Вr2О→С4Н7Вr3→С4Н10О3.
жүзеге асыруға мүмкіндік беретін реакция теңдеулерін жазыңдар. Реакция теңдеулеріндегі бастапқы затпен өнімнің құрылым формуласын көрсетіндер.
Шешуі.
1) СН2 = СН-СН2-СН2ОН 2) СН3 –СН = СН -СН2ОН

Реакция теңдеулері:



Жауабы. Бастапқы зат- бутен-3-ол-2, соңғы - бутан-3-ол-1,2,3.
4-жаттығу. Мына айналуларды:
С4Н10О→ С4Н8О → C5H9ON → C5H13O3N.
жүзеге асыруға мүмкіндік беретін реакция теңдеулерін жазыңдар.
Шешуі.
C5H9ON -C4H8O = HCN,
СН3СН2СН2-СН=О + HCN→СН3СН2СН2-СН -ОН
CN
С4Н8О C5H9ON
СН3СН2СН2-СН2ОН +
СuО СН3СН2СН2-СН = О + Сu +
Н2О
СН3СН2СН2-СН = О + Сu +
Н2О
С4Н10О С4Н8О
СН3СН2СН2-СН-ОН +
2Н2О СН3СН2СН2-СН-ОН
СН3СН2СН2-СН-ОН
CN COONH4
C5H9ON C5H13O3N
Жауабы. Бастапқы зат-бутанол-1, соңғы зат - 2-гидроксипентан қышқылы аммоний тұзы.
5-жаттығу. Берілген айналуларды орындауға мүмкіндік беретін реакция теңдеулерін жазыңдар:
натрияацетаты → сірке қышқылы → хлорсірке қышқылы
Шешуі.
CH3COONa + HCІ → СН3СООН + NaCІ.
СН3СООН + СІ2→ СН2СІСООН + НСІ
6-жаттығу. Берілген айналуларды орындауға мүмкіндік беретін реакция теңдеулерін жазыңдар:
сахароза→ глюкоза → глюкон қышқылы
Шешуі.
С12Н22О11
+
Н2О С6Н12О6+
С6Н12О6
С6Н12О6+
С6Н12О6
сахароза глюкоза фруктоза
СН2ОН-(СНОН)4
-СНО +
2Сu(ОН)2
 СН2ОН—(СНОН)4-СООН +
Cu2O↓ +
2Н2О.
СН2ОН—(СНОН)4-СООН +
Cu2O↓ +
2Н2О.
7-жаттығу. Берілген айналуларды орындауға мүмкіндік беретін реакция теңдеулерін жазыңдар:.
С6Н6 →С6Н5С2H5→ С6Н5СOOH→ С6Н5СOOСH3→ СН3OH→CH3OCH3
Шешуі.
C6H6 +
C2H5Cl
 C6H5-C2H5 +
HCl
C6H5-C2H5 +
HCl
5C6H5-C2H5 + 12KMnO4 + 18H2SO4 = 5С6Н5СOOH + 5CO2 + 12MnSO4 + 6K2SO4 + 28H2O
С6Н5СOOH + CH3OH С6Н5СOOCH3 + H2O
С6Н5СOOCH3 + H2O
С6Н5СOOCH3 + NaOH → С6Н5СOONa + CH3OH
2CH3OH CH3OCH3 + H2O
CH3OCH3 + H2O
8-жаттығу. Мына айналуларды:
CaCO3
 CaO
CaO  CaC2
CaC2 C2Н2
C2Н2 CH2
= CНСІ
CH2
= CНСІ
 (-
CH2
=
CНСІ-)n
(-
CH2
=
CНСІ-)n
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар
Шешуі.
1)
CaCO3
 CaO+CO2↑
CaO+CO2↑
2) CaO + 3C → CaC2+ CO↑
3) CaC2 + 2H2O →Ca(OH)2 ↓ + C2Н2↑
4) CH≡CH+ HCI→CH2 = CНСІ
5)nCH2
= CНСІ
 (-
CH2
=
CНСІ-)n
(-
CH2
=
CНСІ-)n
9-жаттығу. Мына айналуларды:
CН4
 C2Н2
C2Н2 CН3СОН
CН3СОН
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар
Шешуі.
1) 2CH4 C2H2 + 3Н2
C2H2 + 3Н2
2) CH≡CH
+
Н2О CН3СОН
CН3СОН
10-жаттығу. Мына айналуларды:
CН4
 C2Н2
C2Н2 C6Н6
C6Н6 C6Н5СІ
C6Н5СІ
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар
Шешуі.
1) 2CH4 C2H2 + 3Н2
C2H2 + 3Н2
2) 3C2H2 C6Н6
C6Н6
3) C6Н6
+ CI2 C6Н5СІ
+ НСІ
C6Н5СІ
+ НСІ
11-жаттығу. Мына айналуларды:
CaCO3
 CaO
CaO  CaC2
CaC2 C2Н2
C2Н2 C6Н6
C6Н6 C6Н5NO2
C6Н5NO2
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
CaCO3
 CaO+CO2↑
CaO+CO2↑
2) CaO + 3C → CaC2+ CO↑
3) CaC2 + 2H2O →Ca(OH)2 ↓ + C2Н2↑
4) 3C2H2 C6Н6
C6Н6
5) C6Н6
+ HNO3 C6Н5NO2 + Н2О
C6Н5NO2 + Н2О
12-жаттығу. Мына айналуларды:
C2Н4
 C2Н5ОН
C2Н5ОН
 CН3
-СОН
CН3
-СОН
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар
Шешуі.
1) C2Н4
+Н2О C2Н5ОН
C2Н5ОН
2) C2Н5ОН + СuО
 CН3
-СОН + Сu +
Н2О
CН3
-СОН + Сu +
Н2О
13-жаттығу. Мына айналуларды:
C2Н5ОН C2Н4
C2Н4 CН2OH
- CH2OH
CН2OH
- CH2OH
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар
Шешуі.
1) C2Н5ОН C2Н4↑
+ 3Н2O
C2Н4↑
+ 3Н2O
2) 3C2Н4 + 2KMnO4 + 4H2O → 3CН2OH - CH2OH + 2MnO2↓ + 2KOH
14-жаттығу. Мына айналуларды:
C2H6 C2H4
C2H4 C2Н5ОН
C2Н5ОН
 CН3
-СОН
CН3
-СОН
 CН3
-СОOН
CН3
-СОOН
 CН3
-СОOC2Н5
CН3
-СОOC2Н5
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
C2H6 C2H4+H2↑
C2H4+H2↑
2) C2Н4
+Н2О C2Н5ОН
C2Н5ОН
3) C2Н5ОН + СuО
 CН3
-СОН + Сu↓ +
Н2О
CН3
-СОН + Сu↓ +
Н2О
4) CН3
-СОН +
Ag2О
 CН3
-СОOН +
2Ag↓
CН3
-СОOН +
2Ag↓
5) CН3
-СОOН
+ C2Н5ОН CН3
-СОOC2Н5
+ Н2О
CН3
-СОOC2Н5
+ Н2О
15-жаттығу. Мына
айналуларды: CН3СОOCН3
CН3СОOCН3
CH4
 C2H2
C2H2 CН3CОН
CН3CОН
 CН3СОOН
CН3СОOН
 CН3СОOC3Н7
CН3СОOC3Н7
 CН3СОONН4
CН3СОONН4
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
2CH4 C2H2 +
3Н2
C2H2 +
3Н2
2) CH≡ CH +
Н2О
 CН3СОН
CН3СОН
3)
CН3СОН +
Ag2О
 CН3СОOН +
2Ag↓
CН3СОOН +
2Ag↓
4) CН3СОOН
+ CН3ОН CН3СОOCН3 + Н2О
CН3СОOCН3 + Н2О
5) CН3СОOН
+ C3Н7ОН CН3СОOC3Н7 + Н2О
CН3СОOC3Н7 + Н2О
6) CН3СОOН + NН3 → CН3СОONН4
16-жаттығу. Мына айналуларды:
C6H12O6 C2Н5ОH
C2Н5ОH C2Н4
C2Н4

C3H6O3
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
C6H12O 2C2Н5ОH+2СО2↑
2C2Н5ОH+2СО2↑
2) C2Н5ОН C2Н4
+Н2О
C2Н4
+Н2О
3)
C6H12O
 2
C3H6O3
2
C3H6O3
17-жаттығу. Мына айналуларды:
CaCO3
 CaO
CaO  CaC2
CaC2 C2Н2
C2Н2 C6Н6
C6Н6 C6Н5NO2
C6Н5NO2 C6Н5NН2
C6Н5NН2  C6Н5NН2
· НСІ
C6Н5NН2
· НСІ
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
CaCO3
 CaO+CO2↑
CaO+CO2↑
2)
CaO
+
3C  CaC2+
CO↑
CaC2+
CO↑
3) CaC2 + 2H2O →Ca(OH)2 ↓ + C2Н2↑
4) 3C2H2 C6Н6
C6Н6
5) C6Н6
+ HNO3 C6Н5NO2 + Н2О
C6Н5NO2 + Н2О
6) C6Н5NO2+ 6H C6Н5NН2 +
2Н2О
C6Н5NН2 +
2Н2О
7) C6Н5NН2 + HCI→C6Н5NН2 · НСІ
18-жаттығу. Мына айналуларды:
CН4
 CН3СІ
CН3СІ
 CН3ОН
CН3ОН
 НСОН
НСОН  НСООН
НСООН НСООNа
НСООNа
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
CН4
+
СІ2
 CН3СІ
+
НСІ
CН3СІ
+
НСІ
2)
CН3СІ
+
КОН(водн.) CН3ОН
+
КСІ
CН3ОН
+
КСІ
3) CН3ОН
+ СuO НСОН + Сu +
Н2О
НСОН + Сu +
Н2О
4) НСОН
+ Аg2 НСООН +
2Ag
НСООН +
2Ag
5) НСООН+ NaOH НСООNа
+ Н2О
НСООNа
+ Н2О
19-жаттығу. Мына айналуларды:
CН4
 CO2
CO2 C6H12O6
C6H12O6 C2Н5ОH
C2Н5ОH CН3СОН
CН3СОН CН3СООН
CН3СООН (CН3СОО)2Са
(CН3СОО)2Са CaCO3
CaCO3
 CO2
CO2
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
СН4
+
2O2
 CO2+
2Н2О
CO2+
2Н2О
2) 6CO2 + 6Н2О C6H12O6+ 6O2
C6H12O6+ 6O2
3) C6H12O6
 2C2Н5ОH+ 2CО2↑
2C2Н5ОH+ 2CО2↑
4) C2Н5ОН + СuО
 CН3
-СОН + Сu↓ +
Н2О
CН3
-СОН + Сu↓ +
Н2О
5) CН3
-СОН +
Ag2О
 CН3
-СОOН +
2Ag↓
CН3
-СОOН +
2Ag↓
6) 2CН3СООН+ СаО →(CН3СОО)2Са + Н2О
7) (CН3СОО)2Са + К2СО3 →CaCO3↓ + 2СН3СООК
8)
CaCO3
 CaO+CO2↑
CaO+CO2↑
20-жаттығу. Мына айналуларды:
CaCO3
 CaO
CaO  CaC2
CaC2 C2Н2
C2Н2 C6Н6
C6Н6 C6Н5NO2
C6Н5NO2 C6Н5NН2
C6Н5NН2 
 триброманилин
триброманилин
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
CaCO3
 CaO +
CO2↑
CaO +
CO2↑
2)
CaO
+
3C  CaC2+
CO↑
CaC2+
CO↑
3) CaC2 + 2H2O →Ca(OH)2 ↓ + C2Н2↑
4) 3C2H2 C6Н6
C6Н6
5) C6Н6
+ HNO3 C6Н5NO2 + Н2О
C6Н5NO2 + Н2О
6) C6Н5NO2+ 6H C6Н5NН2 +
2Н2О
C6Н5NН2 +
2Н2О
7) C6Н5NН2 + 3Вr2→C6Н2Вr3NН2↓ + 3НВr
21-жаттығу. Мына айналуларды:
C2Н6
 C2Н4
C2Н4 C2Н5ОH
C2Н5ОH
 CН3СОН
CН3СОН CН3СООН
CН3СООН CICН2СООH
CICН2СООH NH2CН2СООH
NH2CН2СООH
 полипептид
полипептид
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
C2H6 C2H4+H2↑
C2H4+H2↑
2) C2Н4
+Н2О C2Н5ОН
C2Н5ОН
3) C2Н5ОН + СuО
 CН3
-СОН + Сu +
Н2О
CН3
-СОН + Сu +
Н2О
4) CН3
-СОН +
2Cu(OH)2 CН3
-СОOН +
Cu2O+
Н2О
CН3
-СОOН +
Cu2O+
Н2О
5) CН3
-СОOН
+ CI2 CICН2СООH
+ НСІ
CICН2СООH
+ НСІ
6) CICН2СООH+ 2NH3 →NH2CН2СООH + NH4CI
7) nNH2CН2СООH →(-NH-CН2-СОО-)n + (n-1)Н2О
22-жаттығу. Мына айналуларды:
CН4
 C2Н2
C2Н2 CН3СОН
CН3СОН CН3СООН
CН3СООН CICН2СООH
CICН2СООH NH2CН2СООH
NH2CН2СООH
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
2CH4 C2H2+3H2↑
C2H2+3H2↑
2) C2Н2+Н2О CН3CОН
CН3CОН
3) CН3
-СОН +
2Cu(OH)2 CН3СОOН +
Cu2O+
Н2О
CН3СОOН +
Cu2O+
Н2О
4) CН3
-СОOН
+ CI2 CICН2СООH
+ НСІ
CICН2СООH
+ НСІ
5) CICН2СООH+ 2NH3 →NH2CН2СООH + NH4CI
23-жаттығу. Мына айналуларды:
CaC2 C2Н2
C2Н2 C6Н6
C6Н6 C6Н5NO2
C6Н5NO2 C6Н5NН2
C6Н5NН2

C2Н4 C2Н5ОH
C2Н5ОH
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1) CaC2 + 2H2O → Ca(OH)2 ↓ + C2Н2↑
2) 3C2H2 C6Н6
C6Н6
3) C6Н6
+ HNO3 C6Н5NO2 + Н2О
C6Н5NO2 + Н2О
4) C6Н5NO2+ 3H2 C6Н5NН2 + Н2О
C6Н5NН2 + Н2О
5)
C2H2+H2 C2H4
C2H4
6) C2Н4
+Н2О C2Н5ОН
C2Н5ОН
24-жаттығу. Мына айналуларды:
CН4
 C2H2
C2H2 CН3СОН
CН3СОН
 C2Н5ОH
C2Н5ОH C2Н5CI
C2Н5CI C4Н10
C4Н10

CH3COOC2Н5
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
2СН4 C2H2+
3Н2
C2H2+
3Н2
2) C2Н2+Н2О CН3CОН
CН3CОН
3) CН3
СОН
+ Н2 C2Н5ОH
C2Н5ОH
4) C2Н5ОН +
HCI C2Н5CI
+
Н2О
C2Н5CI
+
Н2О
5) 2C2Н5CI
+
2Na C4Н10+
2NaCI
C4Н10+
2NaCI
6) C2Н5ОH+ CH3COOH CH3COOC2Н5+ Н2О
CH3COOC2Н5+ Н2О
25-жаттығу. Мына айналуларды:
C2Н6 C2H5Br
C2H5Br C2Н5ОH
C2Н5ОH
 CН3СОН
CН3СОН CН3СОOН
CН3СОOН

![]()
C2Н4
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
C2Н6
+Br2 C2H5Br
+
HBr
C2H5Br
+
HBr
2) C2H5Br+KOH →C2Н5ОH + KBr
3) C2Н5ОН + СuО
 CН3
-СОН + Сu +
Н2О
CН3
-СОН + Сu +
Н2О
4) CН3
-СОН +
2Cu(OH)2 CН3
-СОOН +
Cu2O+
Н2О
CН3
-СОOН +
Cu2O+
Н2О
4) C2Н5ОН
 C2Н4 +
Н2О
C2Н4 +
Н2О
6) C2Н4+ HBr C2Н5Br
C2Н5Br
26-жаттығу. Мына айналуларды:
CН4
 CH3CI
CH3CI C2Н6
C2Н6  C2Н4
C2Н4 C2Н5OH
C2Н5OH HCOOC2Н5
HCOOC2Н5

CH3COOН
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
CН4
+CI2 CH3CI
+
HCI
CH3CI
+
HCI
2)
2CH3CI
+2Na C2H6
+2NaCI
C2H6
+2NaCI
3)
C2Н6 C2H4+
Н2
C2H4+
Н2
4) C2Н4
+Н2О C2Н5ОН
C2Н5ОН
5) C2Н5ОH + HCOOH → HCOOC2Н5
6) C2Н4 + 2[O] → CH3COOН
27-жаттығу. Мына айналуларды:
CН4
 CH3Br
CH3Br C2Н6
C2Н6  C2Н4
C2Н4 C2Н5CI
C2Н5CI
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
CН4
+Br2 CH3Br
+
HBr
CH3Br
+
HBr
2)
2CH3Br
+2Na C2H6
+2NaBr
C2H6
+2NaBr
3)
C2Н6 C2H4+
Н2
C2H4+
Н2
4) C2Н4+ HCI C2Н5CI
C2Н5CI
28-жаттығу. Мына айналуларды:
C2Н6 C2Н4
C2Н4 C2Н2
C2Н2  C6Н6
C6Н6 C6Н5Br
C6Н5Br
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
C2Н6 C2H4+
Н2
C2H4+
Н2
2) C2Н4
 C2Н2 +Н2
C2Н2 +Н2
3)
3C2Н2 C6H6
C6H6
4) C6Н6
+ Br2 C6Н5Br+НBr
C6Н5Br+НBr
29-жаттығу. Мына айналуларды:
C CН4
CН4 CН3CI
CН3CI CН3OH
CН3OH
 CН3COOCН3
CН3COOCН3
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
C
+2H2 CH4
CH4
2)
CН4
+CI2 CH3CI
+
HCI
CH3CI
+
HCI
3) CH3CI +KOH → CН3OH +KCI
4)
CН3ОH+
CH3COOH CH3COOCН3
+
Н2О
CH3COOCН3
+
Н2О
30-жаттығу. Мына айналуларды:
HCOOH HCOOC2Н5
HCOOC2Н5 C2Н5ОН
C2Н5ОН
 CН3СОН
CН3СОН
 CН3СООН
CН3СООН CН3СООK
CН3СООK
қалай жүзеге асыруға болады? Реакция теңдеулерін жазыңдар.
Шешуі.
1)
HCOOH+
C2Н5ОН HCOOC2Н5 +
Н2О
HCOOC2Н5 +
Н2О
2) HCOOC2Н5 + NaОН → HCOONa+ C2Н5ОН
3) C2Н5ОН
+ СuO CН3СОН
+ Сu +
Н2О
CН3СОН
+ Сu +
Н2О
4) CН3СОН
+ Аg2 CН3СООН
+ 2Ag
CН3СООН
+ 2Ag
5) CН3СООН+ KOH CН3СООK
+ Н2О
CН3СООK
+ Н2О
21

шағым қалдыра аласыз















