
Электролиттік диссоциация теориясының негізгі қағидалары Электролиттер
Электролит деп ерітінділері не балқындылары электр тогын өткізетін заттарды айтамыз.
Ерітіндіде электр тогын тасымалдаушы бөлшектер – иондар, олай болса, зат молекулаларының полюсті еріткіштер және жоғары температура әсерінен иондарға ыдырауы диссоциация деп аталады.
1887 жылы швеция ғалымы С. Аррениус электролитік диссоцияция теориясын ұсынды, оның қағидалары төмендегідей:
1) негіз, қышқыл, тұзды суға еріткенде молекулалары оң және теріс зарядты иондарға ыдырайды;
2) электр өрісі әсерінен оң зарядты бөлшектер катодқа, ал теріс зарядты иондар анодқа тартылады (катион, анион);
3) барлық заттардың иондарға ыдырау дәрежесі бірдей емес, оның сан шамасы ерітуге алынған заттың табиғатына байланысты.
Электролит ерітінділерінің электр тогін өткізетіні және олардың ерітіндісінде зарядталған бөлшектер болу керек деген болжам XIX ғасырдың басынан бар. Бірақ, С. Аррениусқа дейінгі ғалымдар (Гроттус, Фарадей т.т) зат иондарға электр тогі әсерінен ыдырайды деп келді.
Аррениус теориясы бойынша зат молекуласы полюсті еріткіш молекуласы әсерінен иондарға ыдырайды. Бұл ғалым ерітінділердің физикалық теориясын жақтаушы еді, сондықтан заттардың иондарға ыдырау себебі анықталмады. Осыны түсіндіру үшін Д.И. Менделеев жасаған ерітінділердің химиялық теориясымен ұластыру керек болды, бұл жұмысты Каблуков И.А. орындап шықты.
Иондану – еріген заттың еріткіш молекулаларымен әсерлесу нәтижесінде болатын үдеріс, еріткіш молекулаларымен әсерлесіп, сольваттар түрінде жүреді.
Ионды және полюсті ковалентті байланысты қосылыстар тек суда ғана емес, сонымен қатар диэлектриктік тұрақтысы жоғары HCN (∑= 107), HCOOH (∑= 57), R-OH (∑ = 20-35) және т.с.с еріткіштерде диссоциацияланады.
Еріген заттарды диссоциялайтын еріткіштерді иондаушы еріткіштер деп атайды.
Ионды байланысты қосылыстар диссоциациясының механизмі
![]()
Катиондар гидратациясы донорлы-акцепторлы байланыс бойынша жүреді. Донор – су молекуласындағы оттегі, ал акцептор – катион; анион гидратациясының механизмін сутектік байланыс арқылы түсіндіруге болады.
Катиондарды қоршайтын су молекуласының саны (координациялық сан) көпшілік жағдайда ион зарядына екі еселі болады Al3+, Cr3+, Fe3+ - к.с. = 6, ал Be2+, Zn2+ иондары үшін к.с. = 4, ал хлор анионы (Cl-) үшін к.с. = 4.
Мысал ретінде BeCl2 диссоциациясын қарастырайық:

Сонда берилий ионында төрт
кванттық ұяшық бос тұрса, хлор ионындағы жұп электрондар және су
құрамындағы оттек атомының байланысқа жұмсалмаған жұп электрондары
болғандықтан олардың координациялық сандары төртке тең
болады: ![]()
![]() кешенді иондар түзіледі.
Көпшілік жағдайда кешенді (акво кешенді) қосылыстар
кристалогидраттар
кешенді иондар түзіледі.
Көпшілік жағдайда кешенді (акво кешенді) қосылыстар
кристалогидраттар ![]() береді.
береді.
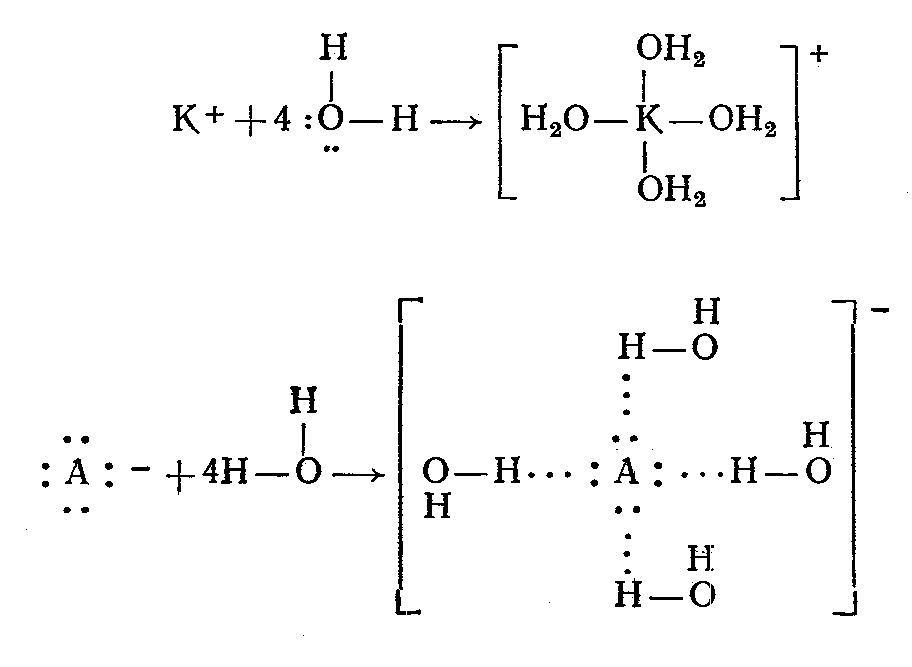
Полюсті байланысты молекулалар су молекуласы әсерінен ориентациялық поляризацияға ұшырап, ионға ыдырайды сурет 8.1 ал, полюссіз байланысты молекулалар иондарға ыдырамайды.
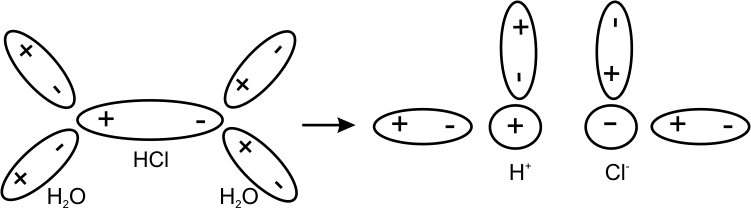
8.1 – сурет Тұз қышқылы құрамындағы иондардың гидратациялануы
Ионды қоршаушы су молекулаларының саны (координациялық сан) ион радиусы мен зарядына тәуелді болады.
Практикада заттардың диссоциациялану теңдеуін жазғанда иондар гидратациясын есепке алмай (жазуға, есте ұстауға оңай болуы үшін) төмендегідей етіп келтіреді.
Қышқылдар үшін: HxR ↔ хH+ + Rx-

Негіздер
үшін: ![]()

Екідайлы негіздер үшін:
![]()
Қышқылдар мен негіздердің қазіргі кезде бірнеше теориясы бар;
Ол мына ғалымдар есімдерімен байланысты: Шатенштейн, Льюис, Измайлов, Бренстед-Лоури, Усанович М.И.
Осы әлемге танымал теориялардың бірінің авторы М.И. Усанович Аль-Фараби атындағы Қазақтың мемлекеттік университетінің (Алматы) физхимия кафедрасының меңгерушісі болған академик. Усанович теориясы бойынша заттың негіздік не қышқылдық қасиеті тек сол заттың қасиетіне ғана байланысты емес, сонымен қатар ол затпен әсерлесетін зат қасиеттеріне де тәуелді болады деп қарастырады. Бұл тұжырым А.М.Бутлеровтың құрылыс теориясымен де үндеседі.
С.Аррениустің электролиттік диссоциация теориясы бойынша электролиттердің анықтамалары төмендегідей болады:
Қышқылдар –заттарды суда еріткенде молекулалары диссоциациялану кезінде сутек катиондары мен қышқыл қалдық аниондарына ыдырайтын заттар.
Негіздер – заттарды суда еріткенде молекулалары диссоциациялану барысында металл катиондарымен (NH4+ – аммоний ионына) гидроксил аниондарына ыдырайтын күрделі заттар.
Тұздар – заттарды суда еріткенде молекулалары диссоциациялану кезінде негіз және қышқыл қалдық иондарына ыдырайтын заттарды айтады.

жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
Электролиттік диссоциация теориясының негізгі қағидалары Электролиттер
Электролиттік диссоциация теориясының негізгі қағидалары Электролиттер
Электролиттік диссоциация теориясының негізгі қағидалары Электролиттер
Электролит деп ерітінділері не балқындылары электр тогын өткізетін заттарды айтамыз.
Ерітіндіде электр тогын тасымалдаушы бөлшектер – иондар, олай болса, зат молекулаларының полюсті еріткіштер және жоғары температура әсерінен иондарға ыдырауы диссоциация деп аталады.
1887 жылы швеция ғалымы С. Аррениус электролитік диссоцияция теориясын ұсынды, оның қағидалары төмендегідей:
1) негіз, қышқыл, тұзды суға еріткенде молекулалары оң және теріс зарядты иондарға ыдырайды;
2) электр өрісі әсерінен оң зарядты бөлшектер катодқа, ал теріс зарядты иондар анодқа тартылады (катион, анион);
3) барлық заттардың иондарға ыдырау дәрежесі бірдей емес, оның сан шамасы ерітуге алынған заттың табиғатына байланысты.
Электролит ерітінділерінің электр тогін өткізетіні және олардың ерітіндісінде зарядталған бөлшектер болу керек деген болжам XIX ғасырдың басынан бар. Бірақ, С. Аррениусқа дейінгі ғалымдар (Гроттус, Фарадей т.т) зат иондарға электр тогі әсерінен ыдырайды деп келді.
Аррениус теориясы бойынша зат молекуласы полюсті еріткіш молекуласы әсерінен иондарға ыдырайды. Бұл ғалым ерітінділердің физикалық теориясын жақтаушы еді, сондықтан заттардың иондарға ыдырау себебі анықталмады. Осыны түсіндіру үшін Д.И. Менделеев жасаған ерітінділердің химиялық теориясымен ұластыру керек болды, бұл жұмысты Каблуков И.А. орындап шықты.
Иондану – еріген заттың еріткіш молекулаларымен әсерлесу нәтижесінде болатын үдеріс, еріткіш молекулаларымен әсерлесіп, сольваттар түрінде жүреді.
Ионды және полюсті ковалентті байланысты қосылыстар тек суда ғана емес, сонымен қатар диэлектриктік тұрақтысы жоғары HCN (∑= 107), HCOOH (∑= 57), R-OH (∑ = 20-35) және т.с.с еріткіштерде диссоциацияланады.
Еріген заттарды диссоциялайтын еріткіштерді иондаушы еріткіштер деп атайды.
Ионды байланысты қосылыстар диссоциациясының механизмі
![]()
Катиондар гидратациясы донорлы-акцепторлы байланыс бойынша жүреді. Донор – су молекуласындағы оттегі, ал акцептор – катион; анион гидратациясының механизмін сутектік байланыс арқылы түсіндіруге болады.
Катиондарды қоршайтын су молекуласының саны (координациялық сан) көпшілік жағдайда ион зарядына екі еселі болады Al3+, Cr3+, Fe3+ - к.с. = 6, ал Be2+, Zn2+ иондары үшін к.с. = 4, ал хлор анионы (Cl-) үшін к.с. = 4.
Мысал ретінде BeCl2 диссоциациясын қарастырайық:

Сонда берилий ионында төрт
кванттық ұяшық бос тұрса, хлор ионындағы жұп электрондар және су
құрамындағы оттек атомының байланысқа жұмсалмаған жұп электрондары
болғандықтан олардың координациялық сандары төртке тең
болады: ![]()
![]() кешенді иондар түзіледі.
Көпшілік жағдайда кешенді (акво кешенді) қосылыстар
кристалогидраттар
кешенді иондар түзіледі.
Көпшілік жағдайда кешенді (акво кешенді) қосылыстар
кристалогидраттар ![]() береді.
береді.
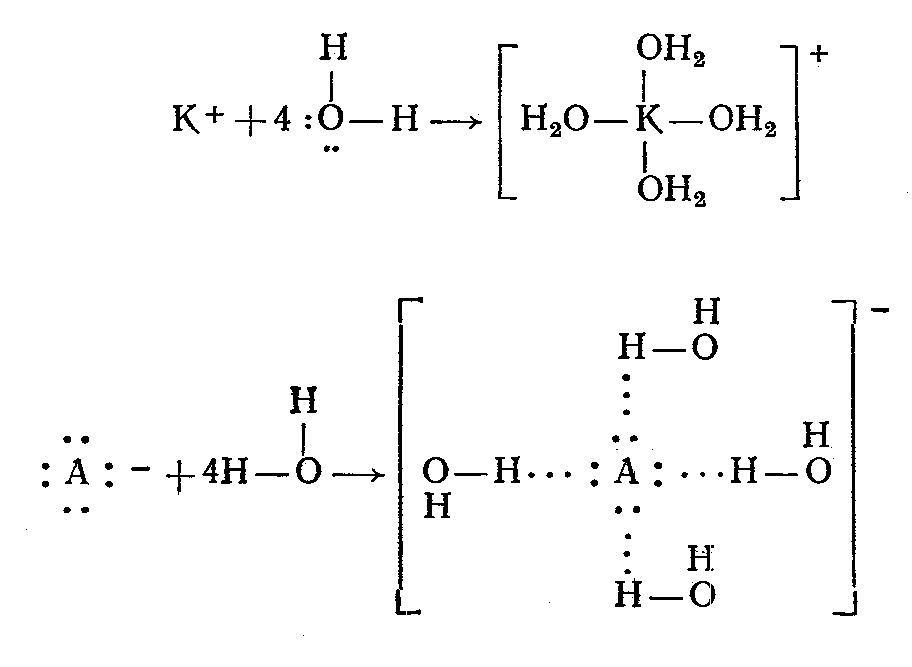
Полюсті байланысты молекулалар су молекуласы әсерінен ориентациялық поляризацияға ұшырап, ионға ыдырайды сурет 8.1 ал, полюссіз байланысты молекулалар иондарға ыдырамайды.

8.1 – сурет Тұз қышқылы құрамындағы иондардың гидратациялануы
Ионды қоршаушы су молекулаларының саны (координациялық сан) ион радиусы мен зарядына тәуелді болады.
Практикада заттардың диссоциациялану теңдеуін жазғанда иондар гидратациясын есепке алмай (жазуға, есте ұстауға оңай болуы үшін) төмендегідей етіп келтіреді.
Қышқылдар үшін: HxR ↔ хH+ + Rx-

Негіздер
үшін: ![]()

Екідайлы негіздер үшін:
![]()
Қышқылдар мен негіздердің қазіргі кезде бірнеше теориясы бар;
Ол мына ғалымдар есімдерімен байланысты: Шатенштейн, Льюис, Измайлов, Бренстед-Лоури, Усанович М.И.
Осы әлемге танымал теориялардың бірінің авторы М.И. Усанович Аль-Фараби атындағы Қазақтың мемлекеттік университетінің (Алматы) физхимия кафедрасының меңгерушісі болған академик. Усанович теориясы бойынша заттың негіздік не қышқылдық қасиеті тек сол заттың қасиетіне ғана байланысты емес, сонымен қатар ол затпен әсерлесетін зат қасиеттеріне де тәуелді болады деп қарастырады. Бұл тұжырым А.М.Бутлеровтың құрылыс теориясымен де үндеседі.
С.Аррениустің электролиттік диссоциация теориясы бойынша электролиттердің анықтамалары төмендегідей болады:
Қышқылдар –заттарды суда еріткенде молекулалары диссоциациялану кезінде сутек катиондары мен қышқыл қалдық аниондарына ыдырайтын заттар.
Негіздер – заттарды суда еріткенде молекулалары диссоциациялану барысында металл катиондарымен (NH4+ – аммоний ионына) гидроксил аниондарына ыдырайтын күрделі заттар.
Тұздар – заттарды суда еріткенде молекулалары диссоциациялану кезінде негіз және қышқыл қалдық иондарына ыдырайтын заттарды айтады.


шағым қалдыра аласыз















