АУЫСПАЛЫ МЕТАЛДАР ЖӘНЕ КОМПЛЕКСТІ ҚОСЫЛЫСТАР
АУЫСПАЛЫ МЕТАЛДАР ЖӘНЕ КОМПЛЕКСТІ ҚОСЫЛЫСТАР


#1 слайд
АУЫСПАЛЫ МЕТАЛДАР ЖӘНЕ
КОМПЛЕКСТІ ҚОСЫЛЫСТАР
Орындаған: Иманбек А.У.
Тексерген: Раманова Л.Б.
Тобы: М - 3
Қызылорда - 2020Қызылорда медициналық жоғарғы колледжі
1 слайд
АУЫСПАЛЫ МЕТАЛДАР ЖӘНЕ КОМПЛЕКСТІ ҚОСЫЛЫСТАР Орындаған: Иманбек А.У. Тексерген: Раманова Л.Б. Тобы: М - 3 Қызылорда - 2020Қызылорда медициналық жоғарғы колледжі

#2 слайд
ЖОСПАР
1. Кіріспе
2. Негізгі бөлім
3. Ауыспалы қосылыстар
4. Комплексті қосылыстар
5. Ауыспалы металдың химиялық қасиетті
6. Ауыспалы элементтердің жалпы қасиеттері
7. Ауыспалы металдың маңызы
8. Комплексті қосылыстар түрлері
9. Қорытынды
10. Пайдаланылған әдебиеттер
2 слайд
ЖОСПАР 1. Кіріспе 2. Негізгі бөлім 3. Ауыспалы қосылыстар 4. Комплексті қосылыстар 5. Ауыспалы металдың химиялық қасиетті 6. Ауыспалы элементтердің жалпы қасиеттері 7. Ауыспалы металдың маңызы 8. Комплексті қосылыстар түрлері 9. Қорытынды 10. Пайдаланылған әдебиеттер
#3 слайд
3 слайд

#4 слайд
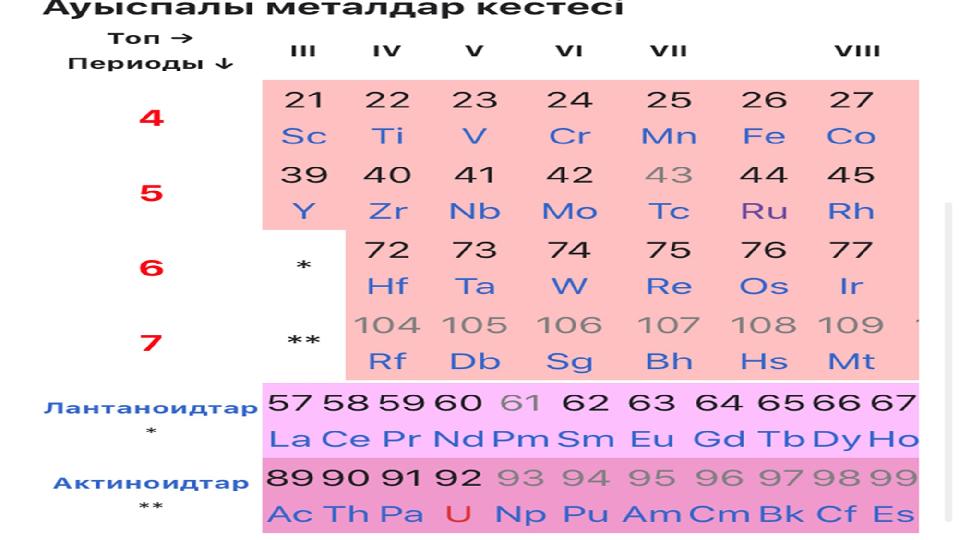
Ауыспалы металдар — валенттік d- және
f- электрондары бар элементтер, периодтық
жүйедегі қосымша топша элементтері.
Ауыспалы металдардың электрондық
құрылысын ( n−1)dxnsy ns-
орбитальдарында 1 немесе формуласымен
анықтайды. Атомдарының
2 электрон болады, қалған валентті
электрондар ( n−1)d орбитальдарда
орналасады. Поскольку число валентты
электрондар саны орбитальдар санынан
кем болғаннан кейін бұл
элементтер металдар болып саналады. БҰЛ ЭЛЕМЕНТТЕРДІҢ ӨЗДЕРІНЕ
ТӘН ҚАСИЕТТЕРІ БАР:
•
ТОТЫҒУ ДӘРЕЖЕЛЕРІНІҢ
АУЫСПАЛЫ БОЛУЫ,
•
КЕШЕНДІ ИОНДАР ТҮЗУГЕ
ҚАБІЛЕТТІ БОЛУЫ,
•
ТҮСТІ ҚОСЫЛЫСТАР ТҮЗУІ.
4 слайд
Ауыспалы металдар — валенттік d- және f- электрондары бар элементтер, периодтық жүйедегі қосымша топша элементтері. Ауыспалы металдардың электрондық құрылысын ( n−1)dxnsy ns- орбитальдарында 1 немесе формуласымен анықтайды. Атомдарының 2 электрон болады, қалған валентті электрондар ( n−1)d орбитальдарда орналасады. Поскольку число валентты электрондар саны орбитальдар санынан кем болғаннан кейін бұл элементтер металдар болып саналады. БҰЛ ЭЛЕМЕНТТЕРДІҢ ӨЗДЕРІНЕ ТӘН ҚАСИЕТТЕРІ БАР: • ТОТЫҒУ ДӘРЕЖЕЛЕРІНІҢ АУЫСПАЛЫ БОЛУЫ, • КЕШЕНДІ ИОНДАР ТҮЗУГЕ ҚАБІЛЕТТІ БОЛУЫ, • ТҮСТІ ҚОСЫЛЫСТАР ТҮЗУІ.

#5 слайд
Комплексті қосылыстар
Комплекс қосылыстар – күрделі иондар не молекулар
– кристалдық күйде де, еріген күйде де бола алады.
Комплекс қосылыстардың молекуларында комплекс
түзгіш не орталық атом көбінесе оң зарядты
атомдардың бірі орталық орынды алады, оған
координацияланған теріс иондар не бейтарап
молекулалар лигандалар болады. Комплекс түзгіш
және лигандалар ішкі сфераны құрайды да, квадрат
жақшамен бөлінеді. Комплекс түзгіш пен лиганда
арасында донарлы-акцепторлы механизм бойынша
түзілген σ- коваленті байланыс болады, бұл байланыс
саны координациялық сан деп аталады.
5 слайд
Комплексті қосылыстар Комплекс қосылыстар – күрделі иондар не молекулар – кристалдық күйде де, еріген күйде де бола алады. Комплекс қосылыстардың молекуларында комплекс түзгіш не орталық атом көбінесе оң зарядты атомдардың бірі орталық орынды алады, оған координацияланған теріс иондар не бейтарап молекулалар лигандалар болады. Комплекс түзгіш және лигандалар ішкі сфераны құрайды да, квадрат жақшамен бөлінеді. Комплекс түзгіш пен лиганда арасында донарлы-акцепторлы механизм бойынша түзілген σ- коваленті байланыс болады, бұл байланыс саны координациялық сан деп аталады.
#6 слайд
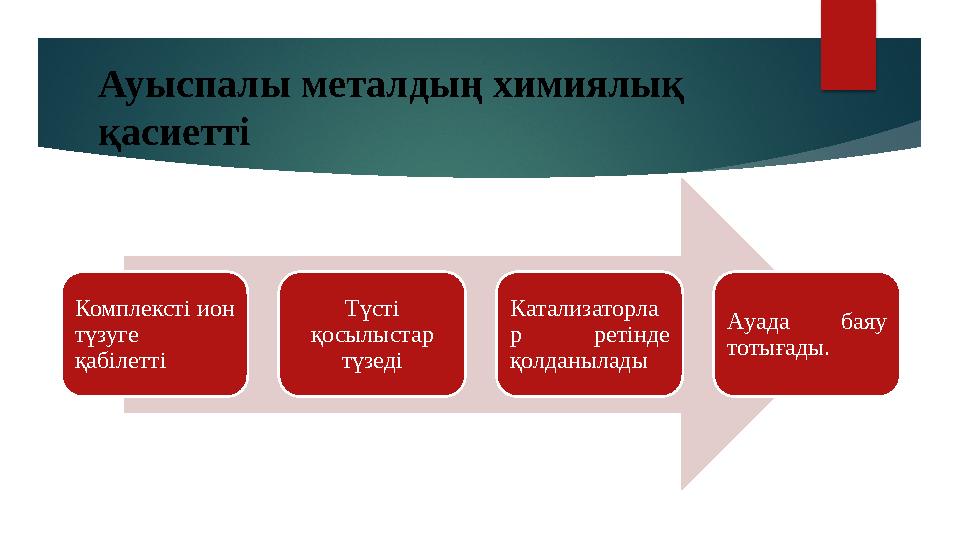
Ауыспалы металдың химиялық
қасиетті
Комплексті ион
түзуге
қабілетті Т үсті
қосылыстар
түзеді К атализаторла
р ретінде
қолданылады А уада баяу
тотығады.
6 слайд
Ауыспалы металдың химиялық қасиетті Комплексті ион түзуге қабілетті Т үсті қосылыстар түзеді К атализаторла р ретінде қолданылады А уада баяу тотығады.

#7 слайд
Ауыспалы элементтердің жалпы
қасиеттері
Төмен бағалайды electronegativity .
Барлық өтпелі элементтер күрделі қосылыстардың түзілуімен
сипатталады.
Айнымалы тотығу дәрежелері . Атомдарында сыртқы ns- деңгейінде
2 валенттік электрондар болатын барлық дерлік d- элементтер
үшін +2 тотығу дәрежесі белгілі .
ІІІ-тобына г-элементтерімен бастап Д.И. Менделеев химиялық
элементтердің периодтық кесте , элементтері ең төменгі тотығу
мемлекеттік танытуға нысаны қосылыстар негізгі қасиеттерін ,
жоғары жылы - қышқыл , аралық жылы - амфотерлі .
7 слайд
Ауыспалы элементтердің жалпы қасиеттері Төмен бағалайды electronegativity . Барлық өтпелі элементтер күрделі қосылыстардың түзілуімен сипатталады. Айнымалы тотығу дәрежелері . Атомдарында сыртқы ns- деңгейінде 2 валенттік электрондар болатын барлық дерлік d- элементтер үшін +2 тотығу дәрежесі белгілі . ІІІ-тобына г-элементтерімен бастап Д.И. Менделеев химиялық элементтердің периодтық кесте , элементтері ең төменгі тотығу мемлекеттік танытуға нысаны қосылыстар негізгі қасиеттерін , жоғары жылы - қышқыл , аралық жылы - амфотерлі .

#8 слайд
Ауыспалы металдың маңызы
Біздің денеміз өтпелі металдарсыз өмір сүре
алмайды. Темір -гемоглобиннің белсенді
принципі. Мырыш инсулин өндірісіне қатысады. Кобальт
- В-12 витаминінің
орталығы. Мыс, марганец және молибден, сондай-ақ
кейбір басқа металдар ферменттерде кездеседі.Көптеген
өтпелі металдар және олардың қосылыстары катализатор
ретінде қолданылады. Мысалы, платина немесе палладий
катализаторында алкендерді гидрлеу реакциясы. Этилен
полимеризациясы құрамында титан
бар катализаторларды қолдану арқылы жүзеге
асырылады. Өтпелі металдардың
қорытпаларын: болат , шойын, қола, жез, жеңіс.
8 слайд
Ауыспалы металдың маңызы Біздің денеміз өтпелі металдарсыз өмір сүре алмайды. Темір -гемоглобиннің белсенді принципі. Мырыш инсулин өндірісіне қатысады. Кобальт - В-12 витаминінің орталығы. Мыс, марганец және молибден, сондай-ақ кейбір басқа металдар ферменттерде кездеседі.Көптеген өтпелі металдар және олардың қосылыстары катализатор ретінде қолданылады. Мысалы, платина немесе палладий катализаторында алкендерді гидрлеу реакциясы. Этилен полимеризациясы құрамында титан бар катализаторларды қолдану арқылы жүзеге асырылады. Өтпелі металдардың қорытпаларын: болат , шойын, қола, жез, жеңіс.

#9 слайд
Комплексті қосылыстар түрлері
Анион комплекс былай аталады: катионды комплекс ионы сияқты оқылып, ↔аты» жұрнағымен
аяқталады:
[С r(NH
3 )
3 (SCN)
4 ] -
− тетрароданодиамминхроматы(ІІІ),
[ Pt( О H)
2 Cl
4 ] 2 -
− тетрахлородигидроксоплатинаты( IV).
Нейтрал комплекстерде комплекс түзгіштің тотығу дәрежесі көрсетілмейді, оқылуы катион
комплекстері сияқты:
[ Pt(NH
3 )
2 Cl
2 ] – дихлордиамминплатина.
Комплекс иондар диссоциацияға аз түседі, нәтижесінде комплекс ион, комплекс түзгіш және
лигандалар арасында тепе-теңдік орнайды, әрекеттесуші массалар заңын, тепе-теңдік константасын,
тұрақсыздық константасын жазады:
[ Ag(NH
3 )
2 ] +
↔ Ag +
+ 2NH
3 ; К
тз = [ Ag] +
[NH
3 ] 2
/
[Ag(NH
3 )
2 ] +
= 6,8×10 -8
Тұрақсыздық константасы аз болған сайын, комплекс ион тұрақтырақ болады .
9 слайд
Комплексті қосылыстар түрлері Анион комплекс былай аталады: катионды комплекс ионы сияқты оқылып, ↔аты» жұрнағымен аяқталады: [С r(NH 3 ) 3 (SCN) 4 ] - − тетрароданодиамминхроматы(ІІІ), [ Pt( О H) 2 Cl 4 ] 2 - − тетрахлородигидроксоплатинаты( IV). Нейтрал комплекстерде комплекс түзгіштің тотығу дәрежесі көрсетілмейді, оқылуы катион комплекстері сияқты: [ Pt(NH 3 ) 2 Cl 2 ] – дихлордиамминплатина. Комплекс иондар диссоциацияға аз түседі, нәтижесінде комплекс ион, комплекс түзгіш және лигандалар арасында тепе-теңдік орнайды, әрекеттесуші массалар заңын, тепе-теңдік константасын, тұрақсыздық константасын жазады: [ Ag(NH 3 ) 2 ] + ↔ Ag + + 2NH 3 ; К тз = [ Ag] + [NH 3 ] 2 / [Ag(NH 3 ) 2 ] + = 6,8×10 -8 Тұрақсыздық константасы аз болған сайын, комплекс ион тұрақтырақ болады .

#10 слайд
ПАЙДАЛАНЫЛҒАН ӘДЕБИЕТТЕР
Яндекс.Словари: Переходные элементы (орыс.). — Краткое
описание переходных элементов. Выдержка из БСЭ.
Ахметов Н.С. Жалпы және бейорганикалық химия: Жоғары
мектеп, 2001 ж.
Некрасов B.V. Жалпы химия негіздері: Химия, 1974 ж.
Спицын В.И., Мартыненко Л.И. Бейорганикалық химия:Мәскеу
мемлекеттік университеті, 1991, 1994 ж.
10 слайд
ПАЙДАЛАНЫЛҒАН ӘДЕБИЕТТЕР Яндекс.Словари: Переходные элементы (орыс.). — Краткое описание переходных элементов. Выдержка из БСЭ. Ахметов Н.С. Жалпы және бейорганикалық химия: Жоғары мектеп, 2001 ж. Некрасов B.V. Жалпы химия негіздері: Химия, 1974 ж. Спицын В.И., Мартыненко Л.И. Бейорганикалық химия:Мәскеу мемлекеттік университеті, 1991, 1994 ж.

#11 слайд
НАЗАРЛАРЫҢЫЗҒА РАҚМЕТ!!!
11 слайд
НАЗАРЛАРЫҢЫЗҒА РАҚМЕТ!!!

шағым қалдыра аласыз
















