Электролит және бейэлектролит ерітінділердің коллигативтік қасиеттері





1 слайд
Қабылдаған: Раманова Л.
Орындағандар: Кемелбек А.
Есентай Н,C ӨЖ
Электролит және бейэлектролит
ерітінділердің коллигативтік
қасиеттері
1 слайд
Қабылдаған: Раманова Л. Орындағандар: Кемелбек А. Есентай Н,C ӨЖ Электролит және бейэлектролит ерітінділердің коллигативтік қасиеттері

2 слайд
I. Ерiтiндiлер. Ағза тiршiлiгiндегi ерiтiндiлердiң
маңызы.
II. Бейэлектролит ерітінділерінің коллигативті
қасиеттері.
III. Рауль заңы және оның салдары (Рауль за ң дары)
IV. Осмос. Осмостық және онкотикалық қысым. Вант-
Гофф заңы.
V. Электролит ер i т i нд i лер i н i ң коллигативт i к
қасиеттер i .
VI. Қорытынды.
VII. Пайдаланылған әдебиеттер .ЖОСПАР :
2 слайд
I. Ерiтiндiлер. Ағза тiршiлiгiндегi ерiтiндiлердiң маңызы. II. Бейэлектролит ерітінділерінің коллигативті қасиеттері. III. Рауль заңы және оның салдары (Рауль за ң дары) IV. Осмос. Осмостық және онкотикалық қысым. Вант- Гофф заңы. V. Электролит ер i т i нд i лер i н i ң коллигативт i к қасиеттер i . VI. Қорытынды. VII. Пайдаланылған әдебиеттер .ЖОСПАР :

3 слайд
•
Мақсаты: Сұйық ерiтiндiлердiң ерiген
заттың санына тәуелдi – коллигативтi
қасиеттерiн қарау ағзадағы процесстерді
түсінуге мүмкіндік береді.
3 слайд
• Мақсаты: Сұйық ерiтiндiлердiң ерiген заттың санына тәуелдi – коллигативтi қасиеттерiн қарау ағзадағы процесстерді түсінуге мүмкіндік береді.

4 слайд
Ерітінділер туралы ілімнің дәрігерлер үшін ерекше мәні бар,
себебі негізгі биологиялық сұйықтар –қан плазмасы, жұлын
сұйықтығы, лимфа, несеп, тер, сілекей, судағы тұздар,
көмірсутектер, липидтер тірі ағзада ерітінділер күйінде
болады.
Дәрілік заттар тек ерітінді немесе ағзада еріген күйге
көшкен кезде ғана пайдалы Ерiтiндiлер. Ағза тiршiлiгiндегi
ерiтiндiлердiң маңызы.
4 слайд
Ерітінділер туралы ілімнің дәрігерлер үшін ерекше мәні бар, себебі негізгі биологиялық сұйықтар –қан плазмасы, жұлын сұйықтығы, лимфа, несеп, тер, сілекей, судағы тұздар, көмірсутектер, липидтер тірі ағзада ерітінділер күйінде болады. Дәрілік заттар тек ерітінді немесе ағзада еріген күйге көшкен кезде ғана пайдалы Ерiтiндiлер. Ағза тiршiлiгiндегi ерiтiндiлердiң маңызы.

5 слайд
Медицина үшін ең маңыздысы – сұйық ерітінділер. Тірі ағзаның
массасы 50-90% судан тұрады.
Су т і рш і л і к процестер і н де, атап айтқанда ісіну, осмос т.б.
белсенд і роль атқарады, қанда және ұлпаларда онкотикалық
қысымның белгілі бір шамасын құрайды ;
Күнделікті судың қажеттілігі 1 кг дене салмағына ересек адам
үшін 35 г, сәби үшін 100-130 г құрайды ;
Адам ағзасы 20% суды жоғалтқанда жасушаларда болатын
қайтымсыз өзгерістердің нәтижесінде адам қазаға ұшырайды .
5 слайд
Медицина үшін ең маңыздысы – сұйық ерітінділер. Тірі ағзаның массасы 50-90% судан тұрады. Су т і рш і л і к процестер і н де, атап айтқанда ісіну, осмос т.б. белсенд і роль атқарады, қанда және ұлпаларда онкотикалық қысымның белгілі бір шамасын құрайды ; Күнделікті судың қажеттілігі 1 кг дене салмағына ересек адам үшін 35 г, сәби үшін 100-130 г құрайды ; Адам ағзасы 20% суды жоғалтқанда жасушаларда болатын қайтымсыз өзгерістердің нәтижесінде адам қазаға ұшырайды .
6 слайд
ерітінділер Газды
қоспа
ҚаттыСұйық
6 слайд
ерітінділер Газды қоспа ҚаттыСұйық
7 слайд
Қайнау
Қату
Осмостық қысымӘсер етеді
7 слайд
Қайнау Қату Осмостық қысымӘсер етеді
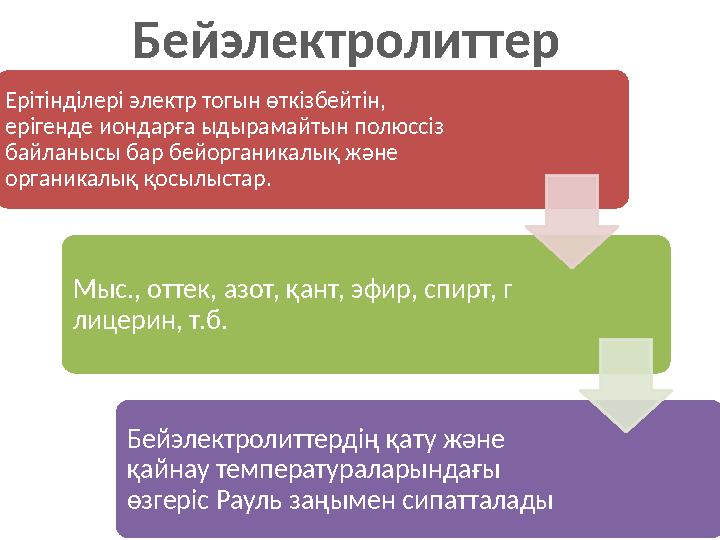
8 слайд
Ерітінділері электр тогын өткізбейтін,
ерігенде
иондарға ыдырамайтын полюссіз
байланысы бар бейорганикалық және
органикалық қосылыстар.
Мыс.,
оттек, азот, қант, эфир, спирт, г
лицерин, т.б.
Бейэлектролиттердің қату және
қайнау температураларындағы
өзгеріс
Рауль заңымен сипатталады Бейэлектролиттер
8 слайд
Ерітінділері электр тогын өткізбейтін, ерігенде иондарға ыдырамайтын полюссіз байланысы бар бейорганикалық және органикалық қосылыстар. Мыс., оттек, азот, қант, эфир, спирт, г лицерин, т.б. Бейэлектролиттердің қату және қайнау температураларындағы өзгеріс Рауль заңымен сипатталады Бейэлектролиттер
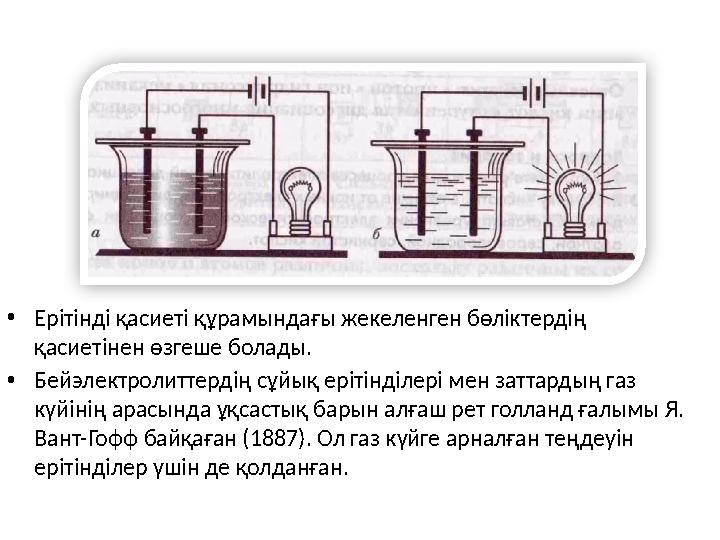
9 слайд
•
Ерітінді қасиеті құрамындағы жекеленген бөліктердің
қасиетінен өзгеше болады.
•
Бейэлектролиттердің сұйық ерітінділері мен заттардың газ
күйінің арасында ұқсастық барын алғаш рет голланд ғалымы Я.
Вант-Гофф
байқаған (1887). Ол газ күйге арналған теңдеуін
ерітінділер үшін де қолданған.
9 слайд
• Ерітінді қасиеті құрамындағы жекеленген бөліктердің қасиетінен өзгеше болады. • Бейэлектролиттердің сұйық ерітінділері мен заттардың газ күйінің арасында ұқсастық барын алғаш рет голланд ғалымы Я. Вант-Гофф байқаған (1887). Ол газ күйге арналған теңдеуін ерітінділер үшін де қолданған.
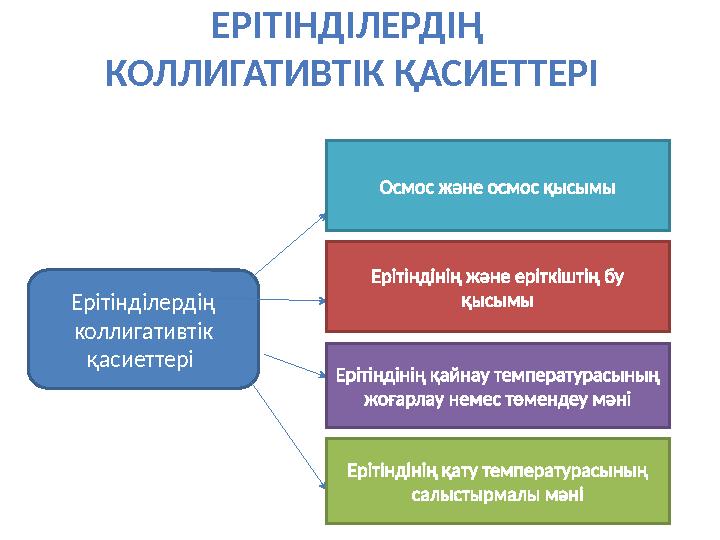
10 слайд
ЕРІТІНДІЛЕРДІҢ
КОЛЛИГАТИВТІК ҚАСИЕТТЕРІ
Ер ітінділердің
коллигативтік
қасиеттері Осмос және осмос қысымы
Ерітіндінің және еріткіштің бу
қысымы
Ерітіндінің қайнау температурасының
жоғарлау немес төмендеу мәні
Ерітіндінің қату температурасының
салыстырмалы мәні
10 слайд
ЕРІТІНДІЛЕРДІҢ КОЛЛИГАТИВТІК ҚАСИЕТТЕРІ Ер ітінділердің коллигативтік қасиеттері Осмос және осмос қысымы Ерітіндінің және еріткіштің бу қысымы Ерітіндінің қайнау температурасының жоғарлау немес төмендеу мәні Ерітіндінің қату температурасының салыстырмалы мәні

11 слайд
Раул ь заңы :
•
Сұйылтылған бейэлектролит ерітіндісінің бетіндегі
қаныққан бу қысымының салыстырмалы төмендеуі
еріген заттың табиғатына тәуелсіз және ерітіндідегі
еріген заттың мольдік үлесіне тең болады .
•
p = p
0 - p
•
p
0 – таза еріткіштің үстіндегі қаныққан бу қысымы ,
Па;
•
р – ерітіндінің үстіндегі еріткіштің қаныққан бу
қысымы , Па;
•
( x ) – еріген заттың мольдік үлесі ;
•
n – еріген зат мөлшері , моль;
•
N – еріткіштің зат мөлшері , моль. ) (
0
x
p
p
N n
n
p
p p
0
0
11 слайд
Раул ь заңы : • Сұйылтылған бейэлектролит ерітіндісінің бетіндегі қаныққан бу қысымының салыстырмалы төмендеуі еріген заттың табиғатына тәуелсіз және ерітіндідегі еріген заттың мольдік үлесіне тең болады . • p = p 0 - p • p 0 – таза еріткіштің үстіндегі қаныққан бу қысымы , Па; • р – ерітіндінің үстіндегі еріткіштің қаныққан бу қысымы , Па; • ( x ) – еріген заттың мольдік үлесі ; • n – еріген зат мөлшері , моль; • N – еріткіштің зат мөлшері , моль. ) ( 0 x p p N n n p p p 0 0

12 слайд
Раул ь заңынан туындайтын
бірінші салдар :
•
Ерітіндінің қату температурасының еріткіштің қату
температурасына қарағанда салыстырмалы төмендеуі
еріген заттың моляльдық концентрациясына тура
пропорционал болады :
Т
қату = К .
в(х),
мұндағы :
в(х) – ерітіндідегі еріген заттың моляльдық
концентрациясы , моль/кг;
К – еріткіштің криоскопи ялық тұрақтысы , К .
кг/моль;
• Т
қату = Т
қату ( ер-ді ) –Т
қату ( ер-ш )
12 слайд
Раул ь заңынан туындайтын бірінші салдар : • Ерітіндінің қату температурасының еріткіштің қату температурасына қарағанда салыстырмалы төмендеуі еріген заттың моляльдық концентрациясына тура пропорционал болады : Т қату = К . в(х), мұндағы : в(х) – ерітіндідегі еріген заттың моляльдық концентрациясы , моль/кг; К – еріткіштің криоскопи ялық тұрақтысы , К . кг/моль; • Т қату = Т қату ( ер-ді ) –Т қату ( ер-ш )

13 слайд
Раул ь заңынан туындайтын
екінші салдар :
•
Ерітіндінің қайнау температурасының еріткіштің қайнау
температурасына қарағанда салыстырмалы
жоғарылауы еріген заттың моляльдық
концентрациясына тура пропорционал болады :
Т
қайнау = Е .
в(х),
мұндағы:
в(х) – ерітіндідегі еріген заттың моляльдық
концентрациясы , моль/кг;
Е – еріткіштің эбуллиос копи ялық тұрақтысы ,
К .
кг/моль;
• Т
қайнау = Т
қайнау ( ер-ді ) – Т
қайнау ( ер-ш)
13 слайд
Раул ь заңынан туындайтын екінші салдар : • Ерітіндінің қайнау температурасының еріткіштің қайнау температурасына қарағанда салыстырмалы жоғарылауы еріген заттың моляльдық концентрациясына тура пропорционал болады : Т қайнау = Е . в(х), мұндағы: в(х) – ерітіндідегі еріген заттың моляльдық концентрациясы , моль/кг; Е – еріткіштің эбуллиос копи ялық тұрақтысы , К . кг/моль; • Т қайнау = Т қайнау ( ер-ді ) – Т қайнау ( ер-ш)
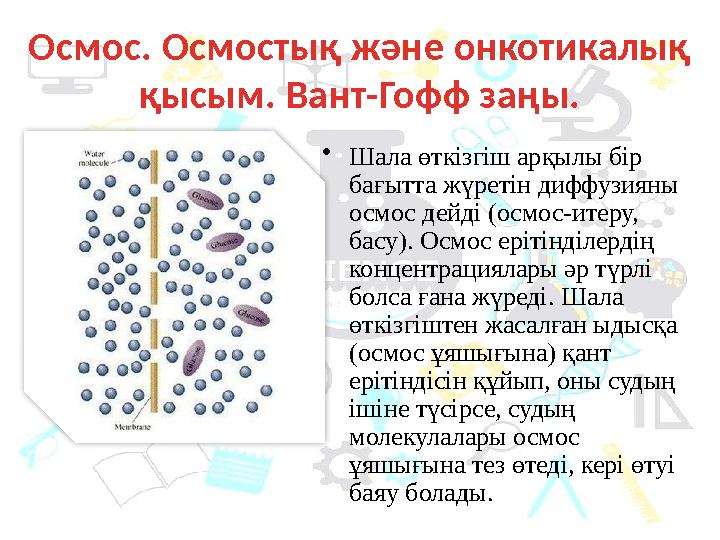
14 слайд
•
Шала өткізгіш арқылы бір
бағытта жүретін диффузияны
осмос дейді (осмос-итеру,
басу). Осмос ерітінділердің
концентрациялары әр түрлі
болса ғана жүреді. Шала
өткізгіштен жасалған ыдысқа
(осмос ұяшығына) қант
ерітіндісін құйып, оны судың
ішіне түсірсе, судың
молекулалары осмос
ұяшығына тез өтеді, кері өтуі
баяу болады. Осмос. Осмостық және онкотикалық
қысым. Вант-Гофф заңы.
14 слайд
• Шала өткізгіш арқылы бір бағытта жүретін диффузияны осмос дейді (осмос-итеру, басу). Осмос ерітінділердің концентрациялары әр түрлі болса ғана жүреді. Шала өткізгіштен жасалған ыдысқа (осмос ұяшығына) қант ерітіндісін құйып, оны судың ішіне түсірсе, судың молекулалары осмос ұяшығына тез өтеді, кері өтуі баяу болады. Осмос. Осмостық және онкотикалық қысым. Вант-Гофф заңы.

15 слайд
•
Осмос қысымы ерітілген зат бөлшектерінің тегіне емес,
олардың санына тәуелді болады. Вант- Гофф ашқан заң
бойынша: электролит емес заттың сұйытылған
ерітіндісінің осмос қысымы, сол еріген зат газ күйінде
болып, сол температурада ерітіндінің көлеміндей көлем
алып тұрғандағы туғызатын қысымына тең
•
Осмо стық қысым ( ) – осмосты тоқтату үшін
ерітіндіге қажет қысым , яғни, осмос құбылысын
туғызатын күш
•
Р
осм (адам қанының) = const және 37 0
С-та 740 – 780 кПа-ға
немесе 7,4-7,8 атм –ға тең
•
Ағзадағы биологиялық сұйықтықтардығы жоғары
молекулалық компоненттердің (мысалға ақуыз)
осмостық қысымы онкотикалық қысым (2,5 – 4 кПа) деп
аталады
15 слайд
• Осмос қысымы ерітілген зат бөлшектерінің тегіне емес, олардың санына тәуелді болады. Вант- Гофф ашқан заң бойынша: электролит емес заттың сұйытылған ерітіндісінің осмос қысымы, сол еріген зат газ күйінде болып, сол температурада ерітіндінің көлеміндей көлем алып тұрғандағы туғызатын қысымына тең • Осмо стық қысым ( ) – осмосты тоқтату үшін ерітіндіге қажет қысым , яғни, осмос құбылысын туғызатын күш • Р осм (адам қанының) = const және 37 0 С-та 740 – 780 кПа-ға немесе 7,4-7,8 атм –ға тең • Ағзадағы биологиялық сұйықтықтардығы жоғары молекулалық компоненттердің (мысалға ақуыз) осмостық қысымы онкотикалық қысым (2,5 – 4 кПа) деп аталады

16 слайд
Бірдей температурада концентрациясы бірдей екі
ерітіндінің осмос қысымы да тең бол са изотонды
ерітінділер
0, 9 % NaCl
4,5 – 5 % глюкоза ерітіндісі
•
Р
осм (ер-ді) > Р
осм (плазма), ерітінді гипертонды болады
•
Р
осм (ер-ді) < Р
осм (плазма), ерітінді гипотонды болады
•
Гемолиз – гипотоникалық ерітіндіде эритроцит
жасушаларының ісініп, жарылуы.
Плазмолиз – гипертоникалық ерітіндіде жасушаның
солуы. Физиологиялық ерітінділер
16 слайд
Бірдей температурада концентрациясы бірдей екі ерітіндінің осмос қысымы да тең бол са изотонды ерітінділер 0, 9 % NaCl 4,5 – 5 % глюкоза ерітіндісі • Р осм (ер-ді) > Р осм (плазма), ерітінді гипертонды болады • Р осм (ер-ді) < Р осм (плазма), ерітінді гипотонды болады • Гемолиз – гипотоникалық ерітіндіде эритроцит жасушаларының ісініп, жарылуы. Плазмолиз – гипертоникалық ерітіндіде жасушаның солуы. Физиологиялық ерітінділер

17 слайд
•
Берілген температурада сұйылтылған
ерітіндінің о смо стық қысымы еріген
заттың молярлық концентрациясына тура
пропорционал .
π = R * C ( x )* T
•
R – Универсал газ тұрақтысы = 8,31 кПа *
л/моль * К немесе 0,083 атм * л/моль *К
•
Т – абсолют ті температура по К (С О
+ 273);
•
С(х) – моляр лық концентрация (моль/л) –
1 л ерітіндідегі еріген заттың моль саны .
Вант-Гофф заңы :
17 слайд
• Берілген температурада сұйылтылған ерітіндінің о смо стық қысымы еріген заттың молярлық концентрациясына тура пропорционал . π = R * C ( x )* T • R – Универсал газ тұрақтысы = 8,31 кПа * л/моль * К немесе 0,083 атм * л/моль *К • Т – абсолют ті температура по К (С О + 273); • С(х) – моляр лық концентрация (моль/л) – 1 л ерітіндідегі еріген заттың моль саны . Вант-Гофф заңы :
18 слайд
( грек. lys і s – еру, ыдырау)
Е
р
і
т
к
і
ш
м
о
л
е
к
у
л
а
л
а
р
ә
с
е
р
і
н
е
н
,
и
о
н
д
а
р
ғ
а
ы
д
ы
р
а
п
,
е
р
і
г
е
н
н
е
м
е
с
е
б
а
л
қ
ы
ғ
а
н
к
ү
й
д
е
э
л
е
к
т
р
т
о
г
ы
н
ө
т
к
і
з
е
т
і
н
з
а
т
т
а
р
д
ы
а
т
а
й
м
ы
з
.
Қ
ы
ш
қ
ы
л
,
н
е
г
і
з
,
т
ұ
з
д
ы
ң
с
у
д
а
ғ
ы
е
р
і
т
і
н
д
і
л
е
р
і
ж
а
т
а
д
ы
;
б
ұ
л
а
р
д
а
э
л
е
к
т
р
т
о
г
ы
и
о
н
д
а
р
а
р
қ
ы
л
ы
т
а
с
ы
м
а
л
д
а
н
а
д
ы
Э
л
е
к
т
р
о
л
и
т
е
р
і
т
і
н
д
і
л
е
р
і
н
е
н
т
о
к
ө
т
к
е
н
д
е
э
л
е
к
т
р
о
д
т
а
р
д
а
т
о
т
ы
ғ
у
-
т
о
т
ы
қ
с
ы
з
д
а
н
у
п
р
о
ц
е
с
т
е
р
і
–
э
л
е
к
т
р
о
л
и
з
д
.
а
Электролиттер
18 слайд
( грек. lys і s – еру, ыдырау) Е р і т к і ш м о л е к у л а л а р ә с е р і н е н , и о н д а р ғ а ы д ы р а п , е р і г е н н е м е с е б а л қ ы ғ а н к ү й д е э л е к т р т о г ы н ө т к і з е т і н з а т т а р д ы а т а й м ы з . Қ ы ш қ ы л , н е г і з , т ұ з д ы ң с у д а ғ ы е р і т і н д і л е р і ж а т а д ы ; б ұ л а р д а э л е к т р т о г ы и о н д а р а р қ ы л ы т а с ы м а л д а н а д ы Э л е к т р о л и т е р і т і н д і л е р і н е н т о к ө т к е н д е э л е к т р о д т а р д а т о т ы ғ у - т о т ы қ с ы з д а н у п р о ц е с т е р і – э л е к т р о л и з д . а Электролиттер

19 слайд
Ғылым мен техникада элекртролиттердің маңызы
зор. Тірі организмдер денесіндегі барлық сұйықтар
электролиттер болып саналады.
Әлсіз Электролит.
диссоциацияланған
ерітінділерде
иондарға жартылай
ыдырайды (қ.
Электролиттік
диссоциация). Әлсіз
Э-ге көптеген
органик. қышқылдар,
H2S, H2SO3, HCN,
NH4OH Күшті Электролиттик
ерітінділерде
түгелдей ионға
ыдырайды. Барлық
тұздар, көптеген
органик. және
бейорганик.
қышқылдар мен
негіздер күшті Э-ге
( HCl, HBr, H І, HNO3,
H2SO4, L і OH, NaOH,
KOH) жатады
19 слайд
Ғылым мен техникада элекртролиттердің маңызы зор. Тірі организмдер денесіндегі барлық сұйықтар электролиттер болып саналады. Әлсіз Электролит. диссоциацияланған ерітінділерде иондарға жартылай ыдырайды (қ. Электролиттік диссоциация). Әлсіз Э-ге көптеген органик. қышқылдар, H2S, H2SO3, HCN, NH4OH Күшті Электролиттик ерітінділерде түгелдей ионға ыдырайды. Барлық тұздар, көптеген органик. және бейорганик. қышқылдар мен негіздер күшті Э-ге ( HCl, HBr, H І, HNO3, H2SO4, L і OH, NaOH, KOH) жатады

20 слайд
•
Электролит ерітінділері коллигативтік қасиеттерді сипаттайтын шама мәнінің
жоғарылауын береді. Оларға да бейэлектролиттерді есептеудегі сол
формулалар мен заңдар қолданылады, бірақ изотоникалық коэффициент
ескеріледі.
•
Электролит диссоциациясы бірдей молярлық концентрацияда ерітіндідегі
еріген зат (молекула, ион) бөлшектерінің жалпы саны бейэлектролит
ерітіндісімен салыстырғанда жоғарылауына әкеледі.
•
Бірдей молярлық концентрацияда электролит ерітіндісіндегі бөлшек саны
бейэлектролит ерітіндісімен салыстырғанда неше есе артқанын
изотоникалық коэффициент i көрсетеді. Изотоникалық коэффициент
электролиттік диссоциацияға тәуелді:
•
i =1- (n-1), - электролиттік диссоциация дәрежесі , n – диссоциация
нәтижесінде электролит ыдырағандағы ион саны Электролит ерітінділерінің
коллигативтік қасиеті :
20 слайд
• Электролит ерітінділері коллигативтік қасиеттерді сипаттайтын шама мәнінің жоғарылауын береді. Оларға да бейэлектролиттерді есептеудегі сол формулалар мен заңдар қолданылады, бірақ изотоникалық коэффициент ескеріледі. • Электролит диссоциациясы бірдей молярлық концентрацияда ерітіндідегі еріген зат (молекула, ион) бөлшектерінің жалпы саны бейэлектролит ерітіндісімен салыстырғанда жоғарылауына әкеледі. • Бірдей молярлық концентрацияда электролит ерітіндісіндегі бөлшек саны бейэлектролит ерітіндісімен салыстырғанда неше есе артқанын изотоникалық коэффициент i көрсетеді. Изотоникалық коэффициент электролиттік диссоциацияға тәуелді: • i =1- (n-1), - электролиттік диссоциация дәрежесі , n – диссоциация нәтижесінде электролит ыдырағандағы ион саны Электролит ерітінділерінің коллигативтік қасиеті :

21 слайд
•
Электролитті изотонды ерітінділер ағзадағы және сұйық
жетіспеушілігінен туындайтын сусыздану жағдайларында
(ұзақ уақыт құсу, зат алмасу бұзылуы) сулы тұзды
баланстың тұрақтылығын реттеп отырады. Сонымен қатар
қатты қыжыл, жарақат, жоғары мөлшерде қан жоғалту
жағдайларында қолданылады. Тағыда несептің ағзадан
шығарылу мөлшерін көбейте отырып және
улы(токсикалық) заттардың мөлшерін қаннан азайтып
ағзадан шығарушы дезинтоксикалаушы ретінде де
қолданысқа ие. Қорытынды :
21 слайд
• Электролитті изотонды ерітінділер ағзадағы және сұйық жетіспеушілігінен туындайтын сусыздану жағдайларында (ұзақ уақыт құсу, зат алмасу бұзылуы) сулы тұзды баланстың тұрақтылығын реттеп отырады. Сонымен қатар қатты қыжыл, жарақат, жоғары мөлшерде қан жоғалту жағдайларында қолданылады. Тағыда несептің ағзадан шығарылу мөлшерін көбейте отырып және улы(токсикалық) заттардың мөлшерін қаннан азайтып ағзадан шығарушы дезинтоксикалаушы ретінде де қолданысқа ие. Қорытынды :

22 слайд
•
Бейэлектролит және электролит
ерітінділерінің коллигативтік
қасиетін сипаттайтын заңдардан
ерітіндінің изотоникалық
коэффициентін қатынас ретінде
анықтауға болады: i
бейэл Т
эл Т
бейэл Т
эл Т
бейэл
эл
кату
кату
кайнау
кайнау
) (
) (
) (
) (
) (
) (
22 слайд
• Бейэлектролит және электролит ерітінділерінің коллигативтік қасиетін сипаттайтын заңдардан ерітіндінің изотоникалық коэффициентін қатынас ретінде анықтауға болады: i бейэл Т эл Т бейэл Т эл Т бейэл эл кату кату кайнау кайнау ) ( ) ( ) ( ) ( ) ( ) (
23 слайд
23 слайд
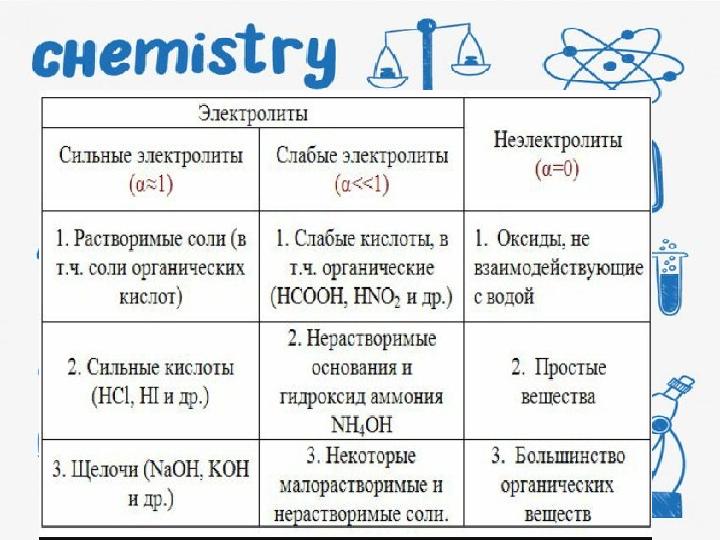
24 слайд
24 слайд

25 слайд
1. Ә. Қ. Патсаев, С.А Шитываев, Г.А. Төребекова,
“ Физиологиялық және коллоидтық химия ”
2. Жылысбаева Г.Н., Нұрділлаева Р.Н. , “ Жалпы химия ”,
“ Әдістемелік құрал ”
3. http://surgeryzone.net/medicina/elektrolity-natrij-i-kali
j.html
4. http://www.km.ru/referats/BBBFF652AD9046ACBC1A9
3C199A02E62
5. http://us-in.net/ph-balance.php
6. http://docplayer.ru/35879806-Veshchestva-elektrolity-
neelektrolity-veshchestva-vodnye-rastvory-ili-rasplavy-k
otoryh-provodyat-elektricheskih-tok.htmlПАЙДАЛАНЫЛҒАН ӘДЕБИЕТТЕР:
25 слайд
1. Ә. Қ. Патсаев, С.А Шитываев, Г.А. Төребекова, “ Физиологиялық және коллоидтық химия ” 2. Жылысбаева Г.Н., Нұрділлаева Р.Н. , “ Жалпы химия ”, “ Әдістемелік құрал ” 3. http://surgeryzone.net/medicina/elektrolity-natrij-i-kali j.html 4. http://www.km.ru/referats/BBBFF652AD9046ACBC1A9 3C199A02E62 5. http://us-in.net/ph-balance.php 6. http://docplayer.ru/35879806-Veshchestva-elektrolity- neelektrolity-veshchestva-vodnye-rastvory-ili-rasplavy-k otoryh-provodyat-elektricheskih-tok.htmlПАЙДАЛАНЫЛҒАН ӘДЕБИЕТТЕР:















