Электртерістілік. Коваленттік байланыс.Иондық байланыс
Электртерістілік. Коваленттік байланыс.Иондық байланыс


#1 слайд
Тақырыбы: Электртерістілік. Коваленттік байланыс. Иондық байланыс.
8 сынып
1 слайд
Тақырыбы: Электртерістілік. Коваленттік байланыс. Иондық байланыс. 8 сынып

#2 слайд
2
8.1.4.1. – электртерістілік ұғымы негізінде атомдар арасындағы ковалентті
байланыстың түзілуін түсіндіру;
8.1.4.2. – иондық байланыстың түзілу механизмін сипаттау және иондық
қосылыстардың қасиеттерін болжау.
Оқу мақсаты
Бағалау критерийлері
•электртерістілік ұғымы негізінде атомдар арасындағы ковалентті
байланыстың түзілуін түсінеді;
• иондық байланыстың түзілу механизмін сипаттау және иондық
қосылыстардың қасиеттерін болжайды.
2 слайд
2 8.1.4.1. – электртерістілік ұғымы негізінде атомдар арасындағы ковалентті байланыстың түзілуін түсіндіру; 8.1.4.2. – иондық байланыстың түзілу механизмін сипаттау және иондық қосылыстардың қасиеттерін болжау. Оқу мақсаты Бағалау критерийлері •электртерістілік ұғымы негізінде атомдар арасындағы ковалентті байланыстың түзілуін түсінеді; • иондық байланыстың түзілу механизмін сипаттау және иондық қосылыстардың қасиеттерін болжайды.
#3 слайд
3
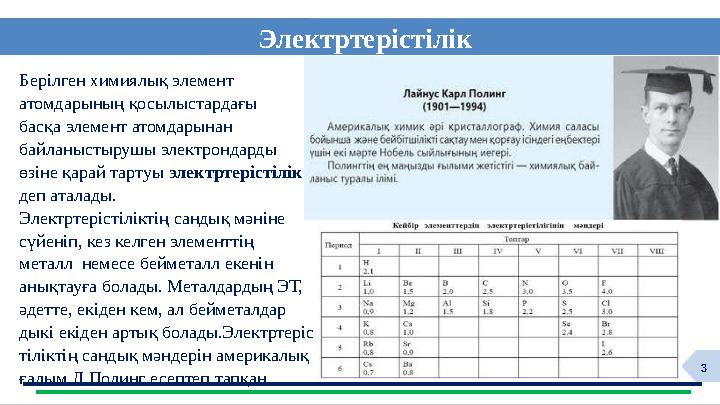
Электртерістілік
HYG
Берілген химиялық элемент
атомдарының қосылыстардағы
басқа элемент атомдарынан
байланыстырушы электрондарды
өзіне қарай тартуы электртерістілік
деп аталады.
Электртерістіліктің сандық мәніне
сүйеніп, кез келген элементтің
металл немесе бейметалл екенін
анықтауға болады. Металдардың ЭТ,
әдетте, екіден кем, ал бейметалдар
дыкі екіден артық болады.Электртеріс
тіліктің сандық мәндерін америкалық
ғалым Л.Полинг есептеп тапқан.
3 слайд
3 Электртерістілік HYG Берілген химиялық элемент атомдарының қосылыстардағы басқа элемент атомдарынан байланыстырушы электрондарды өзіне қарай тартуы электртерістілік деп аталады. Электртерістіліктің сандық мәніне сүйеніп, кез келген элементтің металл немесе бейметалл екенін анықтауға болады. Металдардың ЭТ, әдетте, екіден кем, ал бейметалдар дыкі екіден артық болады.Электртеріс тіліктің сандық мәндерін америкалық ғалым Л.Полинг есептеп тапқан.
#4 слайд
4
Химиялық байланыс
HYG
1. Атомдар электрондарды қосып алады немесе
электрондарын береді. Зарядталған бөлшектер
иондарға айналады
2. Атомдар өздерінің сыртқы электрондық қабатын ортақ
электрон жұбын түзу арқылы аяқтай алады. Сондықтан,
химиялық байланысты коваленттік, иондық, металдық,
сутектік деп жіктейді.
Химиялық байланыс молекуладағы
атомдарды бір-біріне байланыстырып ұстап
тұратын күш. Атомдардың өзара байланысуы
сыртқы электрон деңгейінің қатысуымен
жүзеге асады
4 слайд
4 Химиялық байланыс HYG 1. Атомдар электрондарды қосып алады немесе электрондарын береді. Зарядталған бөлшектер иондарға айналады 2. Атомдар өздерінің сыртқы электрондық қабатын ортақ электрон жұбын түзу арқылы аяқтай алады. Сондықтан, химиялық байланысты коваленттік, иондық, металдық, сутектік деп жіктейді. Химиялық байланыс молекуладағы атомдарды бір-біріне байланыстырып ұстап тұратын күш. Атомдардың өзара байланысуы сыртқы электрон деңгейінің қатысуымен жүзеге асады
#5 слайд
5
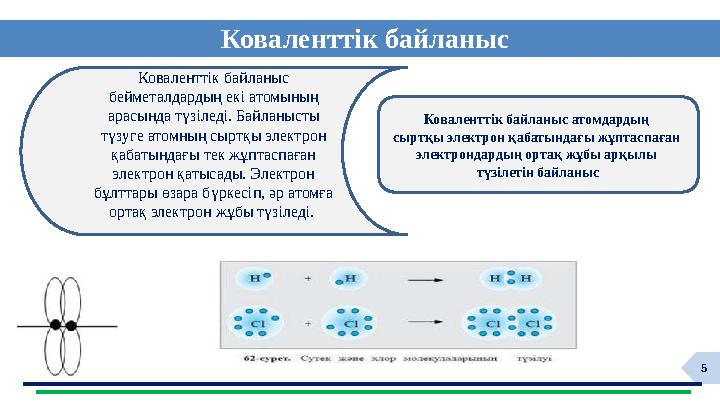
Коваленттік байланыс
HYG
Коваленттік байланыс атомдардың
сыртқы электрон қабатындағы жұптаспаған
электрондардың ортақ жұбы арқылы
түзілетін байланыс
Коваленттік байланыс
бейметалдардың екі атомының
арасында түзіледі. Байланысты
түзуге атомның сыртқы электрон
қабатындағы тек жұптаспаған
электрон қатысады. Электрон
бұлттары өзара бүркесіп, әр атомға
ортақ электрон жұбы түзіледі.
5 слайд
5 Коваленттік байланыс HYG Коваленттік байланыс атомдардың сыртқы электрон қабатындағы жұптаспаған электрондардың ортақ жұбы арқылы түзілетін байланыс Коваленттік байланыс бейметалдардың екі атомының арасында түзіледі. Байланысты түзуге атомның сыртқы электрон қабатындағы тек жұптаспаған электрон қатысады. Электрон бұлттары өзара бүркесіп, әр атомға ортақ электрон жұбы түзіледі.
#6 слайд
6
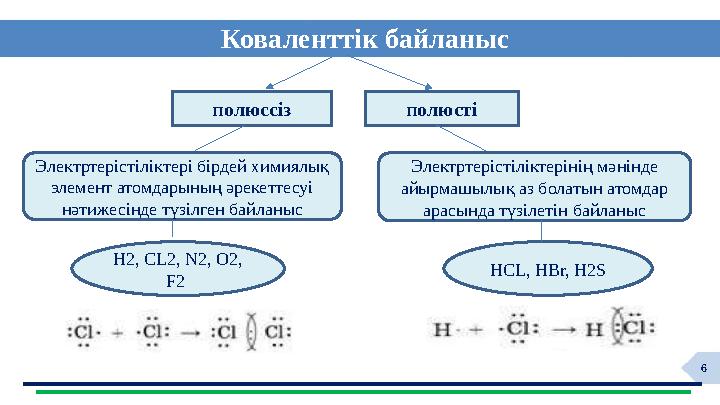
Коваленттік байланыс
HYG полюссіз полюсті
Электртерістіліктері бірдей химиялық
элемент атомдарының әрекеттесуі
нәтижесінде түзілген байланыс
Электртерістіліктерінің мәнінде
айырмашылық аз болатын атомдар
арасында түзілетін байланыс
H2, CL2, N2, O2,
F2
HCL, HBr, H2S
6 слайд
6 Коваленттік байланыс HYG полюссіз полюсті Электртерістіліктері бірдей химиялық элемент атомдарының әрекеттесуі нәтижесінде түзілген байланыс Электртерістіліктерінің мәнінде айырмашылық аз болатын атомдар арасында түзілетін байланыс H2, CL2, N2, O2, F2 HCL, HBr, H2S
#7 слайд
7
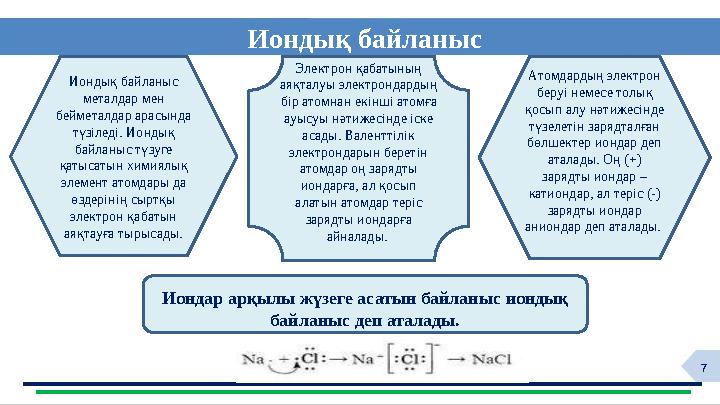
Иондық байланыс
HYG
Атомдардың электрон
беруі немесе толық
қосып алу нәтижесінде
түзелетін зарядталған
бөлшектер иондар деп
аталады. Оң (+)
зарядты иондар –
катиондар, ал теріс (-)
зарядты иондар
аниондар деп аталады.
Иондық байланыс
металдар мен
бейметалдар арасында
түзіледі. Иондық
байланыс түзуге
қатысатын химиялық
элемент атомдары да
өздерінің сыртқы
электрон қабатын
аяқтауға тырысады.
Иондар арқылы жүзеге асатын байланыc иондық
байланыс деп аталады.
Электрон қабатының
аяқталуы электрондардың
бір атомнан екінші атомға
ауысуы нәтижесінде іске
асады. Валенттілік
электрондарын беретін
атомдар оң зарядты
иондарға, ал қосып
алатын атомдар теріс
зарядты иондарға
айналады.
7 слайд
7 Иондық байланыс HYG Атомдардың электрон беруі немесе толық қосып алу нәтижесінде түзелетін зарядталған бөлшектер иондар деп аталады. Оң (+) зарядты иондар – катиондар, ал теріс (-) зарядты иондар аниондар деп аталады. Иондық байланыс металдар мен бейметалдар арасында түзіледі. Иондық байланыс түзуге қатысатын химиялық элемент атомдары да өздерінің сыртқы электрон қабатын аяқтауға тырысады. Иондар арқылы жүзеге асатын байланыc иондық байланыс деп аталады. Электрон қабатының аяқталуы электрондардың бір атомнан екінші атомға ауысуы нәтижесінде іске асады. Валенттілік электрондарын беретін атомдар оң зарядты иондарға, ал қосып алатын атомдар теріс зарядты иондарға айналады.

#8 слайд
8
Бекіту тапсырмасы
HYG
1-тапсырма.
Берілген заттар формулаларындағы электртерістілігі үлкен элементтердің астын
сызыңыз.
KCL, HJ, CuS, CO, NO, HCL, MgO, NaBr.
Дескриптор:
Білім алушы
- Электртерістіліктерін кесте бойынша қарастырады
8 слайд
8 Бекіту тапсырмасы HYG 1-тапсырма. Берілген заттар формулаларындағы электртерістілігі үлкен элементтердің астын сызыңыз. KCL, HJ, CuS, CO, NO, HCL, MgO, NaBr. Дескриптор: Білім алушы - Электртерістіліктерін кесте бойынша қарастырады

#9 слайд
9
Дұрыс жауабы
HYG KCL, HJ, CuS, CO, NO, HCL, MgO, NaBr
9 слайд
9 Дұрыс жауабы HYG KCL, HJ, CuS, CO, NO, HCL, MgO, NaBr
#10 слайд
10
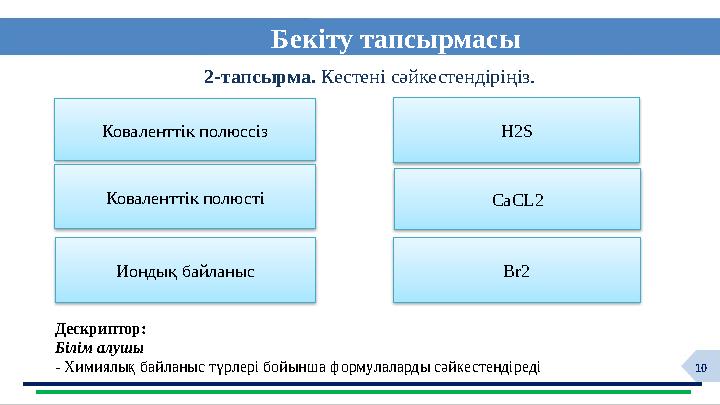
Бекіту тапсырмасы
2-тапсырма. Кестені сәйкестендіріңіз.
Дескриптор:
Білім алушы
- Химиялық байланыс түрлері бойынша формулаларды сәйкестендіреді
Коваленттік полюссіз
Коваленттік полюсті
Н2S
CaCL2
Иондық байланыс Br2
10 слайд
10 Бекіту тапсырмасы 2-тапсырма. Кестені сәйкестендіріңіз. Дескриптор: Білім алушы - Химиялық байланыс түрлері бойынша формулаларды сәйкестендіреді Коваленттік полюссіз Коваленттік полюсті Н2S CaCL2 Иондық байланыс Br2
#11 слайд
11
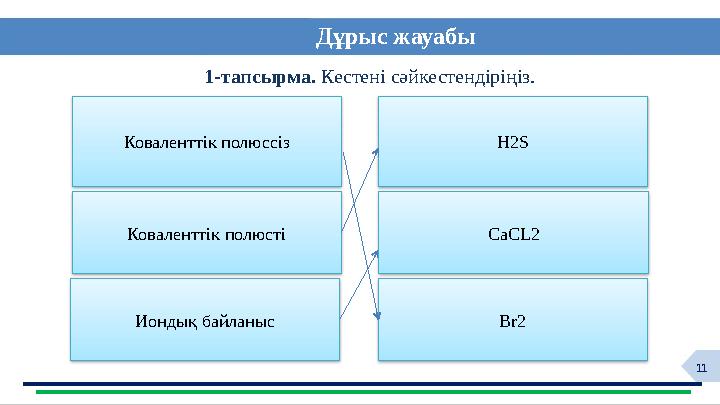
Дұрыс жауабы
1-тапсырма. Кестені сәйкестендіріңіз.
Коваленттік полюссіз
Коваленттік полюсті
Н2S
CaCL2
Иондық байланыс Br2
11 слайд
11 Дұрыс жауабы 1-тапсырма. Кестені сәйкестендіріңіз. Коваленттік полюссіз Коваленттік полюсті Н2S CaCL2 Иондық байланыс Br2

#12 слайд
12
Қорытынды
Бүгінгі сабақта:
электртерістілік ұғымы негізінде атомдар арасындағы ковалентті
байланыстың түзілуін білемін;
иондық байланыстың түзілу механизмін сипаттау және иондық
қосылыстардың қасиеттерін болжаймын.
12 слайд
12 Қорытынды Бүгінгі сабақта: электртерістілік ұғымы негізінде атомдар арасындағы ковалентті байланыстың түзілуін білемін; иондық байланыстың түзілу механизмін сипаттау және иондық қосылыстардың қасиеттерін болжаймын.

#13 слайд
13
Қосымша ресурстар
-Химия оқулығы 8 сынып Оспанова М.Қ., Белоусова Т.Г.
-https://bilimland.kz/kk/subject/ximiya/8-synyp/ehlektrteristi
lik-kovalenttik-bajlanys?mid=%info%
-https://bilimland.kz/kk/subject/ximiya/8-synyp/iondyq-
bajlanys?mid=ff7c09c0-9 9-11e9-be78-49d30a05e051
13 слайд
13 Қосымша ресурстар -Химия оқулығы 8 сынып Оспанова М.Қ., Белоусова Т.Г. -https://bilimland.kz/kk/subject/ximiya/8-synyp/ehlektrteristi lik-kovalenttik-bajlanys?mid=%info% -https://bilimland.kz/kk/subject/ximiya/8-synyp/iondyq- bajlanys?mid=ff7c09c0-9 9-11e9-be78-49d30a05e051

шағым қалдыра аласыз
















