Фосфор және оның химиялық қасиеті
Фосфор және оның химиялық қасиеті


#1 слайд
Фосфор және оның
маңызды қосылыстары
1 слайд
Фосфор және оның маңызды қосылыстары

#2 слайд
2 слайд

#3 слайд
3 слайд

#4 слайд
Атом құрылысы
Фосфордың сыртқы энергетикалық
деңгейінде 5 электрон бар.
Атомындағы электрондардың
орналасуы:
Электрондық құрылысы:
+15
Р )2е )8е )5
е
1s
2
2s
2
2p
6
3s
2
3p
3
4 слайд
Атом құрылысы Фосфордың сыртқы энергетикалық деңгейінде 5 электрон бар. Атомындағы электрондардың орналасуы: Электрондық құрылысы: +15 Р )2е )8е )5 е 1s 2 2s 2 2p 6 3s 2 3p 3
#5 слайд
Табиғатта кездесуі
5 слайд
Табиғатта кездесуі
#6 слайд
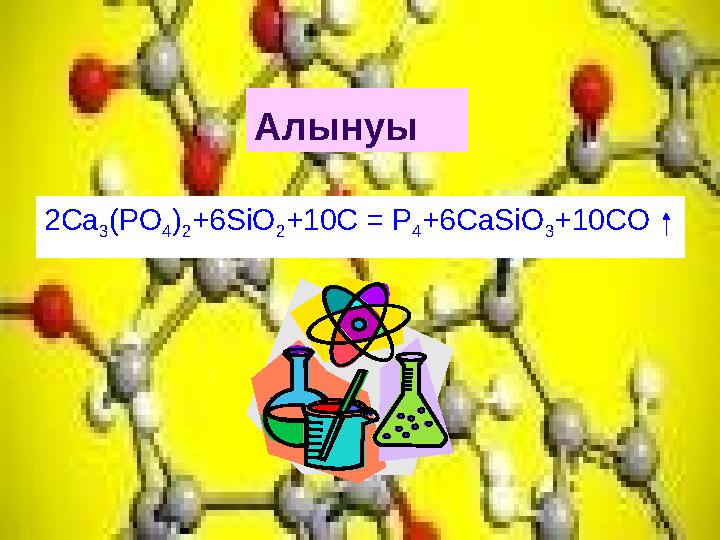
Алынуы
2Ca
3
(PO
4
)
2
+6SiO
2
+10C = P
4
+6CaSiO
3
+10CO
6 слайд
Алынуы 2Ca 3 (PO 4 ) 2 +6SiO 2 +10C = P 4 +6CaSiO 3 +10CO

#7 слайд
Физикалық қасиеттері
Ақ фосфор Қызыл фосфор
1.Ақ түсті кристалл зат, тығыздығы
1,83г/см
3
2.Қараңғыда жарқырайды
3.Кәдімгі жағдайда 30-40
0
С
температурада ауадағы оттекпен
тотығады
4.От алғыш қауіптілігіне
байланысты су астында сақтайды
5.Суда ерімейді,
(СS
2
) күкірткөміртекте ериді
6.Өте қауіпті, улы!
7.44
0
С-та балқиды, 280
0
С-та
қайнайды
1.Аморфты зат, кристалды емес,
тығыздығы 2,20 г/см
3
2.Қараңғыда жарқырамайды
3.Ауадағы оттекпен 260
0
С –та
тотығады
4.Отқа қауіпті емес. Қыздырғанда
оталады.
5.Суда да, (СS
2
) күкірткөміртекте
де ерімейді
6.Улы емес
7.400
0
С-та балқиды
7 слайд
Физикалық қасиеттері Ақ фосфор Қызыл фосфор 1.Ақ түсті кристалл зат, тығыздығы 1,83г/см 3 2.Қараңғыда жарқырайды 3.Кәдімгі жағдайда 30-40 0 С температурада ауадағы оттекпен тотығады 4.От алғыш қауіптілігіне байланысты су астында сақтайды 5.Суда ерімейді, (СS 2 ) күкірткөміртекте ериді 6.Өте қауіпті, улы! 7.44 0 С-та балқиды, 280 0 С-та қайнайды 1.Аморфты зат, кристалды емес, тығыздығы 2,20 г/см 3 2.Қараңғыда жарқырамайды 3.Ауадағы оттекпен 260 0 С –та тотығады 4.Отқа қауіпті емес. Қыздырғанда оталады. 5.Суда да, (СS 2 ) күкірткөміртекте де ерімейді 6.Улы емес 7.400 0 С-та балқиды

#8 слайд
Химиялық қасиеттері
1. Фосфор оттекте жанып, пентаоксид түзеді:
4Р+5О
2=2Р
2О
5
2. Фосфор хлормен ерекеттесіп, фосфор үш хлоридін
және 300
0
С-та фосфор пентахлоридін түзеді:
2Р+3Cl
2=2РCl
3
2Р+5Cl
2=2РCl
5
3. Фосфор сутекпен тікелей әрекеттесіп, фосфин
түзеді:
2Р+3Н
2=2РН
3
8 слайд
Химиялық қасиеттері 1. Фосфор оттекте жанып, пентаоксид түзеді: 4Р+5О 2=2Р 2О 5 2. Фосфор хлормен ерекеттесіп, фосфор үш хлоридін және 300 0 С-та фосфор пентахлоридін түзеді: 2Р+3Cl 2=2РCl 3 2Р+5Cl 2=2РCl 5 3. Фосфор сутекпен тікелей әрекеттесіп, фосфин түзеді: 2Р+3Н 2=2РН 3

#9 слайд
4. Фосфор металдармен фосфидтер түзе
әрекеттеседі:
3Са+2Р=Са
3Р
2 кальций
фосфиді
3Nа+Р=Na
3Р
натрий фосфиді
5. Күрделі заттармен әрекеттеседі:
5КСl
3+6P=3P
2O
5+5KCl
9 слайд
4. Фосфор металдармен фосфидтер түзе әрекеттеседі: 3Са+2Р=Са 3Р 2 кальций фосфиді 3Nа+Р=Na 3Р натрий фосфиді 5. Күрделі заттармен әрекеттеседі: 5КСl 3+6P=3P 2O 5+5KCl

#10 слайд
Қолданылуы
10 слайд
Қолданылуы
#11 слайд
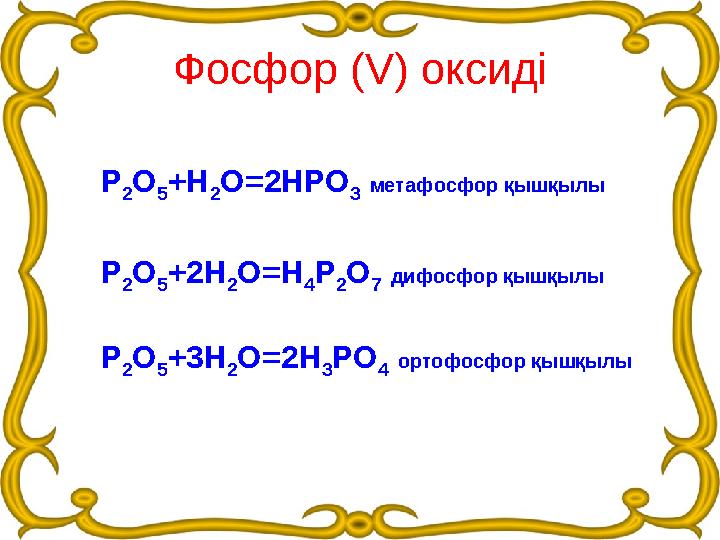
Фосфор (V) оксиді
Р
2О
5+Н
2О=2НРО
3 метафосфор қышқылы
Р
2О
5+2Н
2О=Н
4Р
2О
7 дифосфор қышқылы
Р
2О
5+3Н
2О=2Н
3РО
4 ортофосфор қышқылы
11 слайд
Фосфор (V) оксиді Р 2О 5+Н 2О=2НРО 3 метафосфор қышқылы Р 2О 5+2Н 2О=Н 4Р 2О 7 дифосфор қышқылы Р 2О 5+3Н 2О=2Н 3РО 4 ортофосфор қышқылы

#12 слайд
Алынуы
Зертханада алынуы:
P
2O
5+3H
2O=2H
3PO
4
Өнеркәсіпте алынуы:
Ca
3(PO
4)
2+3H
2SO
4=3CaSO
4 +2H
3PO
4
12 слайд
Алынуы Зертханада алынуы: P 2O 5+3H 2O=2H 3PO 4 Өнеркәсіпте алынуы: Ca 3(PO 4) 2+3H 2SO 4=3CaSO 4 +2H 3PO 4

#13 слайд
Химиялық қасиеттері:
2H
3
PO
4
+3СаО=Ca
3
(PO
4
)
2
+3H
2
O
Са
3
(PO
4
)
2
+4Н
3
PO
4
=3Са(Н
2
РО
4
)
2
13 слайд
Химиялық қасиеттері: 2H 3 PO 4 +3СаО=Ca 3 (PO 4 ) 2 +3H 2 O Са 3 (PO 4 ) 2 +4Н 3 PO 4 =3Са(Н 2 РО 4 ) 2
#14 слайд
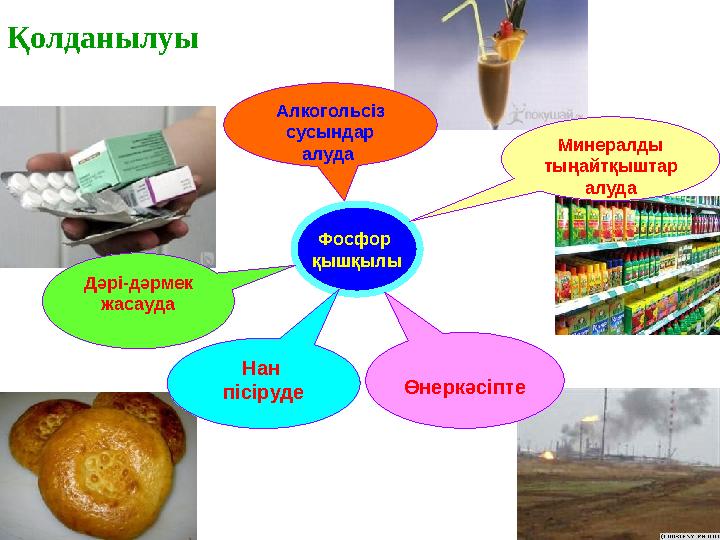
Қолданылуы
Фосфор
қышқылы
Алкогольсіз
сусындар
алуда
Дәрі-дәрмек
жасауда
Минералды
тыңайтқыштар
алуда
Өнеркәсіпте
Нан
пісіруде
14 слайд
Қолданылуы Фосфор қышқылы Алкогольсіз сусындар алуда Дәрі-дәрмек жасауда Минералды тыңайтқыштар алуда Өнеркәсіпте Нан пісіруде

#15 слайд
Сандарды сөйлетейік
1669 31 56
600 15
15 слайд
Сандарды сөйлетейік 1669 31 56 600 15
#16 слайд
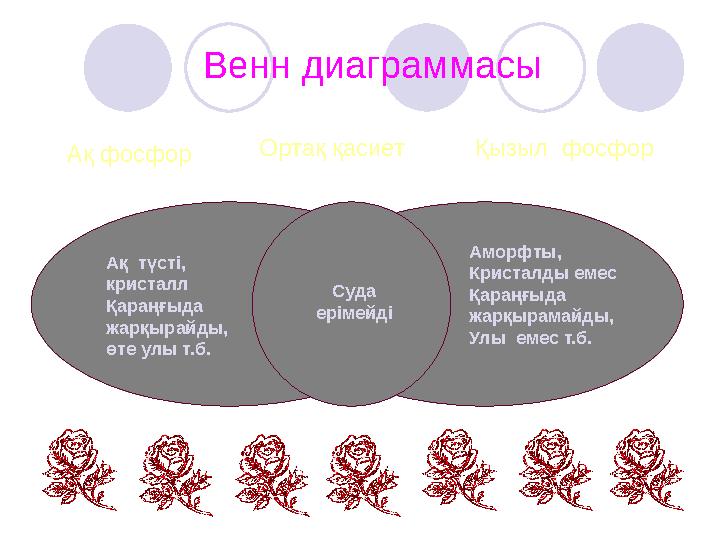
Венн диаграммасы
Ақ фосфор Қызыл фосфорОртақ қасиет
Ақ түсті,
кристалл
Қараңғыда
жарқырайды,
өте улы т.б.
Аморфты,
Кристалды емес
Қараңғыда
жарқырамайды,
Улы емес т.б.
Суда
ерімейді
16 слайд
Венн диаграммасы Ақ фосфор Қызыл фосфорОртақ қасиет Ақ түсті, кристалл Қараңғыда жарқырайды, өте улы т.б. Аморфты, Кристалды емес Қараңғыда жарқырамайды, Улы емес т.б. Суда ерімейді
#17 слайд
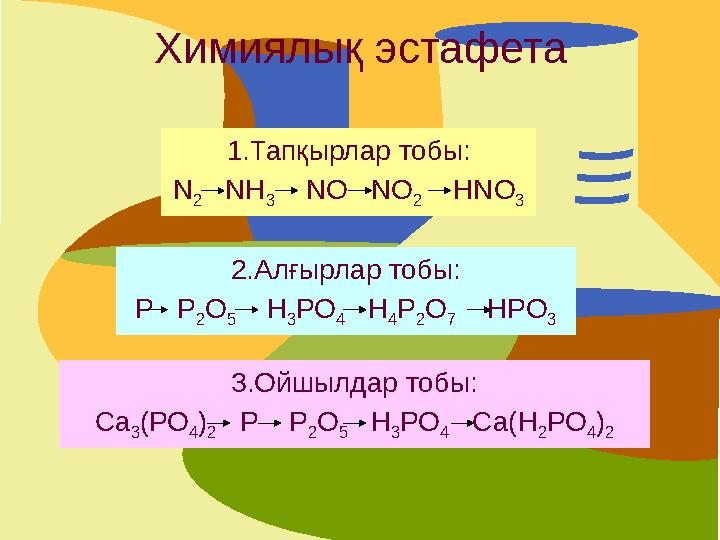
Химиялық эстафета
1.Тапқырлар тобы:
N
2
NH
3
NO NO
2
HNO
3
2.Алғырлар тобы:
Р Р
2
О
5
Н
3
РО
4
Н
4
Р
2
О
7
HРO
3
3.Ойшылдар тобы:
Са
3(РО
4)
2 Р Р
2О
5 Н
3РО
4 Са(Н
2РО
4)
2
17 слайд
Химиялық эстафета 1.Тапқырлар тобы: N 2 NH 3 NO NO 2 HNO 3 2.Алғырлар тобы: Р Р 2 О 5 Н 3 РО 4 Н 4 Р 2 О 7 HРO 3 3.Ойшылдар тобы: Са 3(РО 4) 2 Р Р 2О 5 Н 3РО 4 Са(Н 2РО 4) 2

#18 слайд
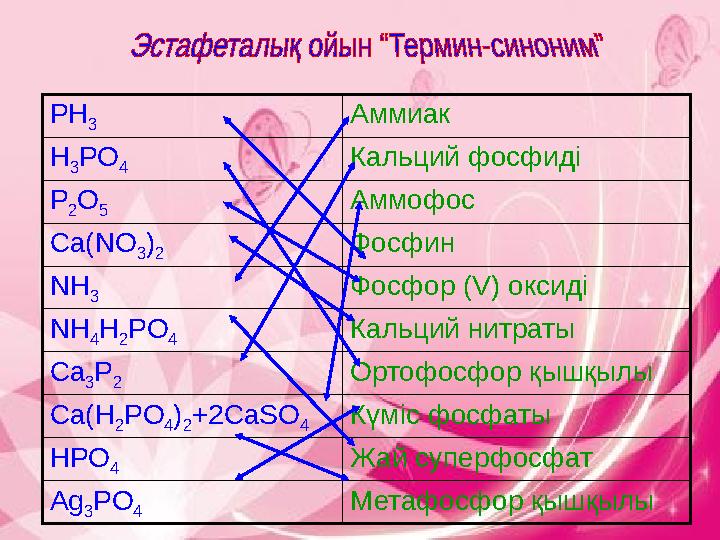
PH
3
Аммиак
H
3
PO
4
Кальций фосфиді
P
2
O
5
Аммофос
Ca(NO
3
)
2
Фосфин
NH
3 Фосфор (V) оксиді
NH
4H
2PO
4 Кальций нитраты
Ca
3P
2 Ортофосфор қышқылы
Ca(H
2PO
4)
2+2CaSO
4Күміс фосфаты
HPO
4
Жай суперфосфат
Ag
3
PO
4
Метафосфор қышқылы
18 слайд
PH 3 Аммиак H 3 PO 4 Кальций фосфиді P 2 O 5 Аммофос Ca(NO 3 ) 2 Фосфин NH 3 Фосфор (V) оксиді NH 4H 2PO 4 Кальций нитраты Ca 3P 2 Ортофосфор қышқылы Ca(H 2PO 4) 2+2CaSO 4Күміс фосфаты HPO 4 Жай суперфосфат Ag 3 PO 4 Метафосфор қышқылы
#19 слайд
PH
3
Аммиак
H
3
PO
4
Кальций фосфиді
P
2
O
5
Аммофос
Ca(NO
3
)
2
Фосфин
NH
3 Фосфор (V) оксиді
NH
4H
2PO
4 Кальций нитраты
Ca
3P
2 Ортофосфор қышқылы
Ca(H
2PO
4)
2+2CaSO
4Күміс фосфаты
HPO
4
Жай суперфосфат
Ag
3
PO
4
Метафосфор қышқылы
19 слайд
PH 3 Аммиак H 3 PO 4 Кальций фосфиді P 2 O 5 Аммофос Ca(NO 3 ) 2 Фосфин NH 3 Фосфор (V) оксиді NH 4H 2PO 4 Кальций нитраты Ca 3P 2 Ортофосфор қышқылы Ca(H 2PO 4) 2+2CaSO 4Күміс фосфаты HPO 4 Жай суперфосфат Ag 3 PO 4 Метафосфор қышқылы

#20 слайд
Оқушыларды бағалау.
Үйге тапсырма:
§ 20. Фосфор
§ 21. Фосфор оксидтері
№3; №4; №5
20 слайд
Оқушыларды бағалау. Үйге тапсырма: § 20. Фосфор § 21. Фосфор оксидтері №3; №4; №5

шағым қалдыра аласыз
















