Галогендерге жалпы сипаттама
Галогендерге жалпы сипаттама


#1 слайд
1 слайд

#2 слайд
1. Галогендердің периодтық жүйедегі орны
2. Галогендердің физикалық қасиеті
3. Галогендердің химиялық қасиеті
4. Галогендердің ашылуы
5.Галогендердің қолданылуы Жоспар:
Br
2I
2
Cl
2 F
2
At
2 слайд
1. Галогендердің периодтық жүйедегі орны 2. Галогендердің физикалық қасиеті 3. Галогендердің химиялық қасиеті 4. Галогендердің ашылуы 5.Галогендердің қолданылуы Жоспар: Br 2I 2 Cl 2 F 2 At
#3 слайд
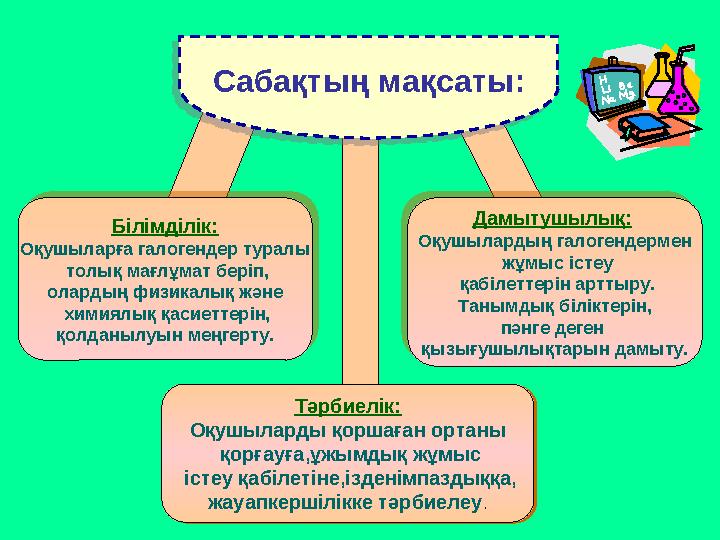
С а б а қ т ы ң м а қ с а т ы :Білімділік:
Оқушыларға галогендер туралы
толық мағлұмат беріп,
олардың физикалық және
химиялық қасиеттерін,
қолданылуын меңгерту.
Тәрбиелік:
Оқушыларды қоршаған ортаны
қорғауға,ұжымдық жұмыс
істеу қабілетіне,ізденімпаздыққа,
жауапкершілікке тәрбиелеу .Тәрбиелік:
Оқушыларды қоршаған ортаны
қорғауға,ұжымдық жұмыс
істеу қабілетіне,ізденімпаздыққа,
жауапкершілікке тәрбиелеу .Дамытушылық:
Оқушылардың галогендермен
жұмыс істеу
қабілеттерін арттыру.
Танымдық біліктерін,
пәнге деген
қызығушылықтарын дамыту.С а б а қ т ы ң м а қ с а т ы : Білімділік:
Оқушыларға галогендер туралы
толық мағлұмат беріп,
олардың физикалық және
химиялық қасиеттерін,
қолданылуын меңгерту. Дамытушылық:
Оқушылардың галогендермен
жұмыс істеу
қабілеттерін арттыру.
Танымдық біліктерін,
пәнге деген
қызығушылықтарын дамыту.
3 слайд
С а б а қ т ы ң м а қ с а т ы :Білімділік: Оқушыларға галогендер туралы толық мағлұмат беріп, олардың физикалық және химиялық қасиеттерін, қолданылуын меңгерту. Тәрбиелік: Оқушыларды қоршаған ортаны қорғауға,ұжымдық жұмыс істеу қабілетіне,ізденімпаздыққа, жауапкершілікке тәрбиелеу .Тәрбиелік: Оқушыларды қоршаған ортаны қорғауға,ұжымдық жұмыс істеу қабілетіне,ізденімпаздыққа, жауапкершілікке тәрбиелеу .Дамытушылық: Оқушылардың галогендермен жұмыс істеу қабілеттерін арттыру. Танымдық біліктерін, пәнге деген қызығушылықтарын дамыту.С а б а қ т ы ң м а қ с а т ы : Білімділік: Оқушыларға галогендер туралы толық мағлұмат беріп, олардың физикалық және химиялық қасиеттерін, қолданылуын меңгерту. Дамытушылық: Оқушылардың галогендермен жұмыс істеу қабілеттерін арттыру. Танымдық біліктерін, пәнге деген қызығушылықтарын дамыту.
#4 слайд
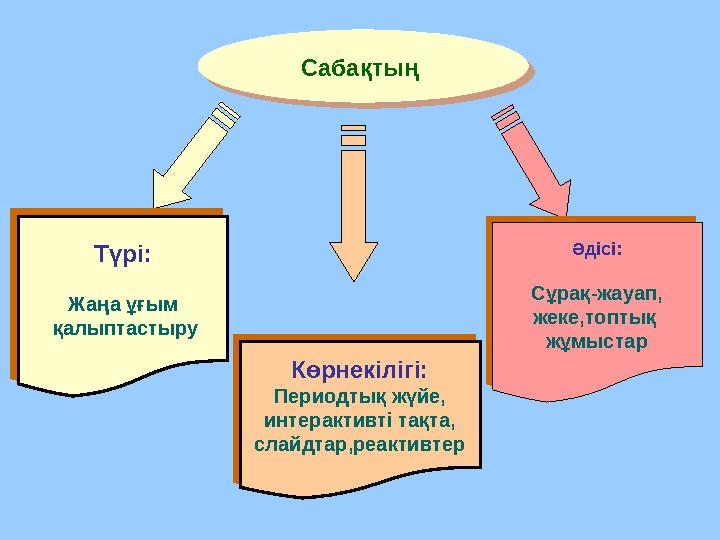
Сабақтың
Түрі:
Жаңа ұғым
қалыптастыру Түрі:
Жаңа ұғым
қалыптастыру
Көрнекілігі:
Периодтық жүйе,
интерактивті тақта,
слайдтар,реактивтер Көрнекілігі:
Периодтық жүйе,
интерактивті тақта,
слайдтар,реактивтер Әдісі:
Сұрақ-жауап,
жеке,топтық
жұмыстар Әдісі:
Сұрақ-жауап,
жеке,топтық
жұмыстарСабақтың
4 слайд
Сабақтың Түрі: Жаңа ұғым қалыптастыру Түрі: Жаңа ұғым қалыптастыру Көрнекілігі: Периодтық жүйе, интерактивті тақта, слайдтар,реактивтер Көрнекілігі: Периодтық жүйе, интерактивті тақта, слайдтар,реактивтер Әдісі: Сұрақ-жауап, жеке,топтық жұмыстар Әдісі: Сұрақ-жауап, жеке,топтық жұмыстарСабақтың
#5 слайд
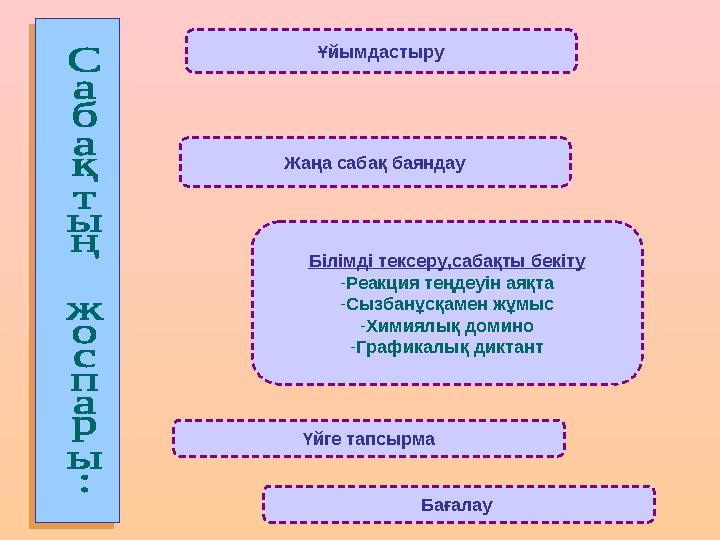
Ұйымдастыру
Жаңа сабақ баяндау
Білімді тексеру,сабақты бекіту
-
Реакция теңдеуін аяқта
-
Сызбанұсқамен жұмыс
-
Химиялық домино
-
Графикалық диктант
Үйге тапсырма
Бағалау
5 слайд
Ұйымдастыру Жаңа сабақ баяндау Білімді тексеру,сабақты бекіту - Реакция теңдеуін аяқта - Сызбанұсқамен жұмыс - Химиялық домино - Графикалық диктант Үйге тапсырма Бағалау
#6 слайд
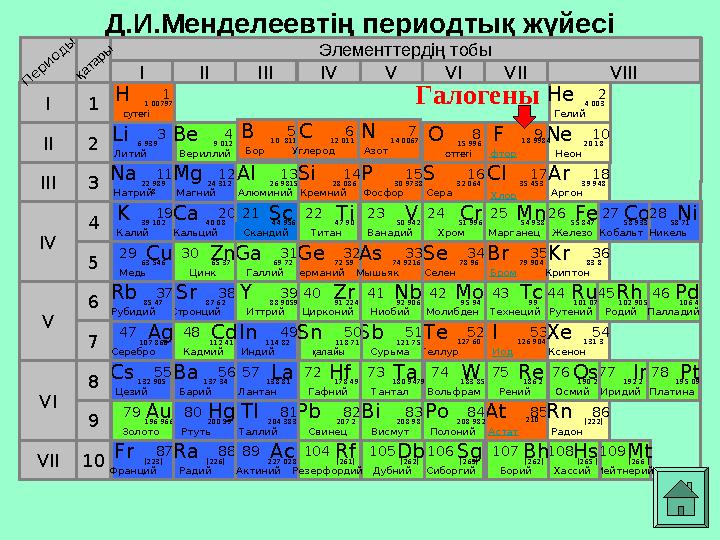
Д.И.Менделеевтің периодтық жүйесі
Элементтердің тобы
I III
II VIIIIV V VI VII
II I
III
VII VI VIV 21
3
4
5
6
7
10 Li
Литий 3
6,9 39Периоды
қатары
K
Калий 19
39.102Na
Натрий 11
22,989
8
Cu
Медь29
63.54 6 В
Бор 5
10 .811 Ne
Неон 1 0
20,18Be
Вериллий 4
9 ,012
Ca
Кальций 20
40,08
Ag
Серебро 47
107.868
Ra
Радий 88
[ 226 ] La
Лантан 57
138.81Al
Алюминий 13
26,9815 O
оттегі 8
15 .996N
Азот 7
14.0 067
Ge
Германий 32
72.59C
Углерод 6
12,011 F
фтор 9
18.9984
Br
Бром 35
79.904H
сутегі 1
1.00797
Se
Селен 34
78.96
I
Иод 53
126.904Cl
Хлор 1 7
35,453
As
Мышьяк 33
74.9216 He
Гелий 2
4,003
Ar
Аргон 1 8
39,948
Xe
Ксенон 54
131,3Kr
Криптон 36
83,8
Te
Теллур 52
127.60 Fe
Железо26
55.847Mg
Магний 1 2
24,312 S
Сера 1 6
32,064P
Фосфор 1 5
30,9738Si
Кремний 1 4
28,086
Ti
Титан22
47.90
Mo
Молибден 42
95.94 T с
Технеций 4 3
99 V
Ванадий2 3
50.942 Cr
Хром24
51.996 Mn
Марганец 25
54.938S с
Скандий21
44.956
Ga
Галлий 31
69.72
Re
Рений75
186.2 Rh
Родий45
102.905
Ir
Иридий77
192.2Ru
Рутений44
101.07
Os
Осмий76
190.2 Pt
Платина 78
195.09Pd
Палладий 46
106.4
At
Астат 85
210 Rn
Радон 8 6
[22 2 ]
Mt
Мейтнерий 109
[ 266 ]Hs
Хассий108
[ 265 ]Ba
Барий 56
137.34Sr
Стронций 38
87.62Rb
Рубидий 37
85.47
In
Индий 49
114 .82
Cs
Цезий 55
132.905
Fr
Франций 87
[ 223 ]98 Zn
Цинк30
65 . 37
W
Вольфрам 74
183.85
Po
Полоний 84
208.982Zr
Цирконий 40
91.224 Nb
Ниобий41
92.906
Ta
Тантал73
180.9479Cd
Кадмий48
112.41 Sb
Сурьма 51
121.75
Hf
Гафний72
178.49Sn
қалайы 50
118.71
Pb
Свинец 82
207.2 Bi
Висмут 83
208.98 Co
Кобальт 27
58.933 Ni
Никель28
58.71
Y
Иттрий 39
88.9059
Au
Золото 79
196.966 Tl
Таллий 81
204.383Hg
Ртуть 80
200.59
Ac
Актиний 89
227.028 Bh
Борий107
[ 262 ]Sg
Сиборгий 106
[ 263 ]Db
Дубний105
[ 262 ]Rf
Резерфордий 104
[ 261 ] Галогены
6 слайд
Д.И.Менделеевтің периодтық жүйесі Элементтердің тобы I III II VIIIIV V VI VII II I III VII VI VIV 21 3 4 5 6 7 10 Li Литий 3 6,9 39Периоды қатары K Калий 19 39.102Na Натрий 11 22,989 8 Cu Медь29 63.54 6 В Бор 5 10 .811 Ne Неон 1 0 20,18Be Вериллий 4 9 ,012 Ca Кальций 20 40,08 Ag Серебро 47 107.868 Ra Радий 88 [ 226 ] La Лантан 57 138.81Al Алюминий 13 26,9815 O оттегі 8 15 .996N Азот 7 14.0 067 Ge Германий 32 72.59C Углерод 6 12,011 F фтор 9 18.9984 Br Бром 35 79.904H сутегі 1 1.00797 Se Селен 34 78.96 I Иод 53 126.904Cl Хлор 1 7 35,453 As Мышьяк 33 74.9216 He Гелий 2 4,003 Ar Аргон 1 8 39,948 Xe Ксенон 54 131,3Kr Криптон 36 83,8 Te Теллур 52 127.60 Fe Железо26 55.847Mg Магний 1 2 24,312 S Сера 1 6 32,064P Фосфор 1 5 30,9738Si Кремний 1 4 28,086 Ti Титан22 47.90 Mo Молибден 42 95.94 T с Технеций 4 3 99 V Ванадий2 3 50.942 Cr Хром24 51.996 Mn Марганец 25 54.938S с Скандий21 44.956 Ga Галлий 31 69.72 Re Рений75 186.2 Rh Родий45 102.905 Ir Иридий77 192.2Ru Рутений44 101.07 Os Осмий76 190.2 Pt Платина 78 195.09Pd Палладий 46 106.4 At Астат 85 210 Rn Радон 8 6 [22 2 ] Mt Мейтнерий 109 [ 266 ]Hs Хассий108 [ 265 ]Ba Барий 56 137.34Sr Стронций 38 87.62Rb Рубидий 37 85.47 In Индий 49 114 .82 Cs Цезий 55 132.905 Fr Франций 87 [ 223 ]98 Zn Цинк30 65 . 37 W Вольфрам 74 183.85 Po Полоний 84 208.982Zr Цирконий 40 91.224 Nb Ниобий41 92.906 Ta Тантал73 180.9479Cd Кадмий48 112.41 Sb Сурьма 51 121.75 Hf Гафний72 178.49Sn қалайы 50 118.71 Pb Свинец 82 207.2 Bi Висмут 83 208.98 Co Кобальт 27 58.933 Ni Никель28 58.71 Y Иттрий 39 88.9059 Au Золото 79 196.966 Tl Таллий 81 204.383Hg Ртуть 80 200.59 Ac Актиний 89 227.028 Bh Борий107 [ 262 ]Sg Сиборгий 106 [ 263 ]Db Дубний105 [ 262 ]Rf Резерфордий 104 [ 261 ] Галогены

#7 слайд
Жаңа сабақты баяндау .
Периоттық жүйенің Y І I топша элементтері – фтор, хлор, бром, йод
және астатты галогендер деп атайды. “Галоген” сөзі “тұз түзуші” деген
мағынаны білдіреді.
Бұлар құрамы екі атомнан тұратын жай заттар – F 2 , CI2 , Br 2 , I 2 . Фтор мен
хлор өткір иісті газдар, бром –сұйық, йод – кристалл зат. Галогендер типтік
бейметалдар. Сыртқы электрондық қабатын аяқтауға оларға бір ғана
электрон жетпейді. Сондықтан олар бір электронды қосып алып, тұрақты
тотығу дәрежесіне өтеді. Галогендер көптеген металдармен (натрий, темір,
алтын) және бейметалдармен (сутегімен, күкіртпен, фосформен) белсенді
әрекеттеседі. Оттекті қосылыстарда барлығы YI I валентті. Галогендерде
атомдық масса өскен сайын бейметалдық қасиет күшейеді:
2 Na + CI2 = 2NaCI
2K + С I2 = 2KCI
2Na + F2 = 2NaF
7 слайд
Жаңа сабақты баяндау . Периоттық жүйенің Y І I топша элементтері – фтор, хлор, бром, йод және астатты галогендер деп атайды. “Галоген” сөзі “тұз түзуші” деген мағынаны білдіреді. Бұлар құрамы екі атомнан тұратын жай заттар – F 2 , CI2 , Br 2 , I 2 . Фтор мен хлор өткір иісті газдар, бром –сұйық, йод – кристалл зат. Галогендер типтік бейметалдар. Сыртқы электрондық қабатын аяқтауға оларға бір ғана электрон жетпейді. Сондықтан олар бір электронды қосып алып, тұрақты тотығу дәрежесіне өтеді. Галогендер көптеген металдармен (натрий, темір, алтын) және бейметалдармен (сутегімен, күкіртпен, фосформен) белсенді әрекеттеседі. Оттекті қосылыстарда барлығы YI I валентті. Галогендерде атомдық масса өскен сайын бейметалдық қасиет күшейеді: 2 Na + CI2 = 2NaCI 2K + С I2 = 2KCI 2Na + F2 = 2NaF
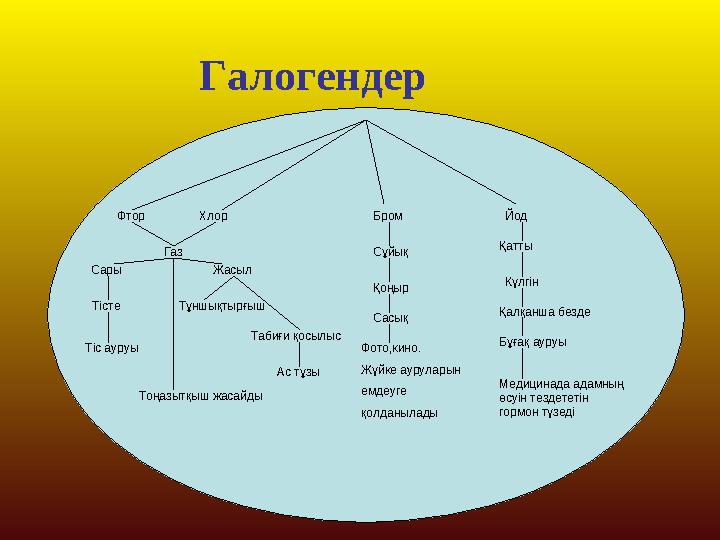
#8 слайд
Галогендер
Фтор Хлор
Газ
Сары Жасыл
Тісте
Тоңазытқыш жасайды Табиғи қосылыс
Тіс ауруы Тұншықтырғыш Бром Йод
Сұйық Қатты
Қоңыр
Сасық
Фото,кино.
Жүйке ауруларын
емдеуге
қолданылады Күлгін
Қалқанша безде
Бұғақ ауруы
Медицинада адамның
өсуін тездететін
гормон түзедіАс тұзы
8 слайд
Галогендер Фтор Хлор Газ Сары Жасыл Тісте Тоңазытқыш жасайды Табиғи қосылыс Тіс ауруы Тұншықтырғыш Бром Йод Сұйық Қатты Қоңыр Сасық Фото,кино. Жүйке ауруларын емдеуге қолданылады Күлгін Қалқанша безде Бұғақ ауруы Медицинада адамның өсуін тездететін гормон түзедіАс тұзы

#9 слайд
Периодтық жүйе
Группы элементов
I IIIII VIIIIV V VI VII
II I
III
VII VI VIV 21
3
4
5
6
7Периоды
Ряды
98
10 Фтор/Fluorum (F)
Жай заттың
сыртқы түрі Ашық сары түсті
улы газ
Электрондық
құрылысы [He] 2s 2
2p 5
Тотығу дәрежесі − 1
тығыздығы 1,108 г/см ³
Балқу
температурасы 53,53К
Қайнау
температурасы 85,01 К
9 слайд
Периодтық жүйе Группы элементов I IIIII VIIIIV V VI VII II I III VII VI VIV 21 3 4 5 6 7Периоды Ряды 98 10 Фтор/Fluorum (F) Жай заттың сыртқы түрі Ашық сары түсті улы газ Электрондық құрылысы [He] 2s 2 2p 5 Тотығу дәрежесі − 1 тығыздығы 1,108 г/см ³ Балқу температурасы 53,53К Қайнау температурасы 85,01 К

#10 слайд
Периодтық жүйе
Элементтің топтары
I IIIII VIIIIV V VI VII
II I
III
VII VI VIV 21
3
4
5
6
7Периоды
Ряды
98
10 Хлор / Chlorum (Cl)
Жай заттың
сыртқы түрі Сары жасыл
түсті,өткір иісті.
Электрондық
құрылысы [Ne] 3s 2
3p 5
Тотығу дәрежесі 7, 6, 5, 4, 3, 1, −1
Тығыздығы 1,56 г/см ³
Балқу
температурасы 172.2 К
Қайнау
температурасы 238.6 К
10 слайд
Периодтық жүйе Элементтің топтары I IIIII VIIIIV V VI VII II I III VII VI VIV 21 3 4 5 6 7Периоды Ряды 98 10 Хлор / Chlorum (Cl) Жай заттың сыртқы түрі Сары жасыл түсті,өткір иісті. Электрондық құрылысы [Ne] 3s 2 3p 5 Тотығу дәрежесі 7, 6, 5, 4, 3, 1, −1 Тығыздығы 1,56 г/см ³ Балқу температурасы 172.2 К Қайнау температурасы 238.6 К

#11 слайд
Периодтық жүйе
Элементтердің топтары
I IIIII VIIIIV V VI VII
II I
III
VII VI VIV 21
3
4
5
6
7Периоды
қатары
98
10 Бром / Bromum (Br)
Жай заттардың
сыртқы түрі Қою қызыл түсті
сұйықтық, өткір
иісті
Электрондық
құрылысы [Ar] 3d 10
4s 2
4p 5
Тотығу дәрежесі 7, 5, 3, 1, -1
Тығыздығы 3,12 г/см³
Балқу
температурасы 265,9 К
Қайнау
температурасы 331,9 К
11 слайд
Периодтық жүйе Элементтердің топтары I IIIII VIIIIV V VI VII II I III VII VI VIV 21 3 4 5 6 7Периоды қатары 98 10 Бром / Bromum (Br) Жай заттардың сыртқы түрі Қою қызыл түсті сұйықтық, өткір иісті Электрондық құрылысы [Ar] 3d 10 4s 2 4p 5 Тотығу дәрежесі 7, 5, 3, 1, -1 Тығыздығы 3,12 г/см³ Балқу температурасы 265,9 К Қайнау температурасы 331,9 К

#12 слайд
Периодтық жүйе
Элементтердің топтары
I IIIII VIIIIV V VI VII
II I
III
VII VI VIV 21
3
4
5
6
7Периоды
қатары
98
10 И
о Iд / Iodum (I)
Жай заттардың
сыртқы түрі Металдық
жылтыры бар қара
күлгін түсті
кристалл
Электрондық
формуласы [Kr] 4d 10
5s 2
5p 5
Тотығу дәрежесі 7, 5, 3, 1, -1
Тығыздығы 4,93г/см³
Балқу
температурасы 386,7 К
Қайнау
температурасы 457,5 К
12 слайд
Периодтық жүйе Элементтердің топтары I IIIII VIIIIV V VI VII II I III VII VI VIV 21 3 4 5 6 7Периоды қатары 98 10 И о Iд / Iodum (I) Жай заттардың сыртқы түрі Металдық жылтыры бар қара күлгін түсті кристалл Электрондық формуласы [Kr] 4d 10 5s 2 5p 5 Тотығу дәрежесі 7, 5, 3, 1, -1 Тығыздығы 4,93г/см³ Балқу температурасы 386,7 К Қайнау температурасы 457,5 К
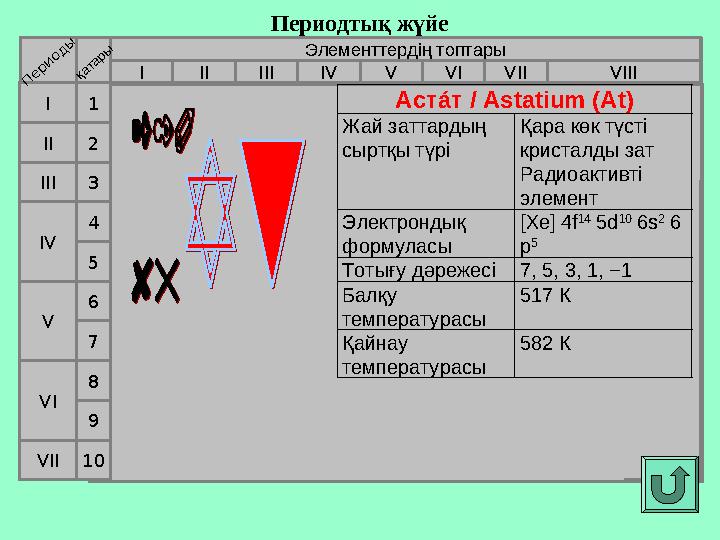
#13 слайд
Периодтық жүйе
Элементтердің топтары
I IIIII VIIIIV V VI VII
II I
III
VII VI VIV 21
3
4
5
6
7Периоды
қатары
98
10 Аст
аIт / Astatium (At)
Жай заттардың
сыртқы түрі Қара көк түсті
кристалды зат
Радиоактивті
элемент
Электрондық
формуласы [Xe] 4f 14
5d 10
6s 2
6
p 5
Тотығу дәрежесі 7, 5, 3, 1, −1
Балқу
температурасы 517 К
Қайнау
температурасы 582 К
13 слайд
Периодтық жүйе Элементтердің топтары I IIIII VIIIIV V VI VII II I III VII VI VIV 21 3 4 5 6 7Периоды қатары 98 10 Аст аIт / Astatium (At) Жай заттардың сыртқы түрі Қара көк түсті кристалды зат Радиоактивті элемент Электрондық формуласы [Xe] 4f 14 5d 10 6s 2 6 p 5 Тотығу дәрежесі 7, 5, 3, 1, −1 Балқу температурасы 517 К Қайнау температурасы 582 К
#14 слайд
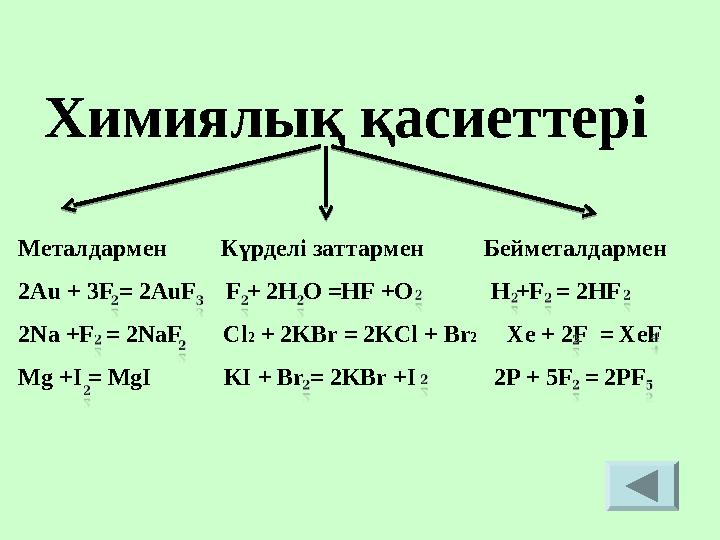
Металдармен Күрделі заттармен Бейметалдармен
2Au + 3F = 2AuF F + 2H O =HF +O H +F = 2HF
2Na +F = 2NaF Cl 2 + 2KBr = 2KCl + Br 2 Xe + 2F = XeF
Mg +I = MgI KI + Br = 2KBr +I 2P + 5F = 2PF Химиялық қасиеттері
14 слайд
Металдармен Күрделі заттармен Бейметалдармен 2Au + 3F = 2AuF F + 2H O =HF +O H +F = 2HF 2Na +F = 2NaF Cl 2 + 2KBr = 2KCl + Br 2 Xe + 2F = XeF Mg +I = MgI KI + Br = 2KBr +I 2P + 5F = 2PF Химиялық қасиеттері
#15 слайд
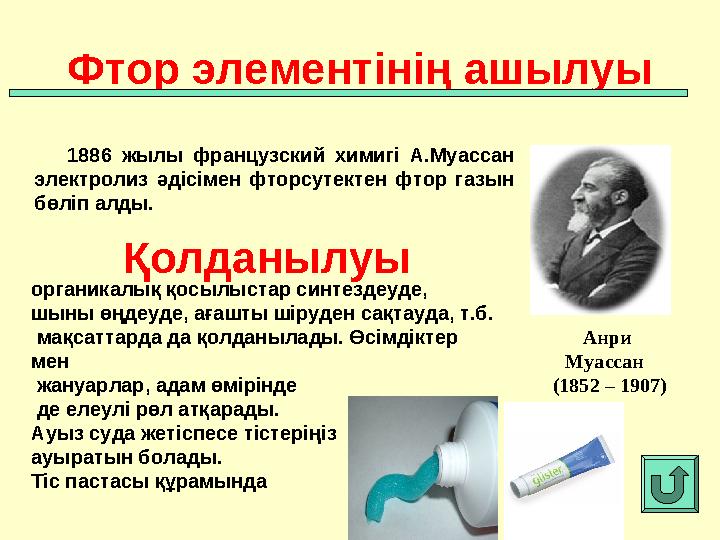
1886 жылы французский химигі А.Муассан
электролиз әдісімен фторсутектен фтор газын
бөліп алды. Фтор элементінің ашылуы
Анри
Муассан
(1852 – 1907)Қолданылуы
органикалық қосылыстар синтездеуде,
шыны өңдеуде, ағашты шіруден сақтауда, т.б.
мақсаттарда да қолданылады. Өсімдіктер
мен
жануарлар, адам өмірінде
де елеулі рөл атқарады.
Ауыз суда жетіспесе тістеріңіз
ауыратын болады.
Тіс пастасы құрамында
15 слайд
1886 жылы французский химигі А.Муассан электролиз әдісімен фторсутектен фтор газын бөліп алды. Фтор элементінің ашылуы Анри Муассан (1852 – 1907)Қолданылуы органикалық қосылыстар синтездеуде, шыны өңдеуде, ағашты шіруден сақтауда, т.б. мақсаттарда да қолданылады. Өсімдіктер мен жануарлар, адам өмірінде де елеулі рөл атқарады. Ауыз суда жетіспесе тістеріңіз ауыратын болады. Тіс пастасы құрамында

#16 слайд
1774жылы швед оқымыстысы
К. Шееле хлор газын алған.
1812 жылы Гей-Люсеок газге хлор
деген ат берді.Хлор элементінің ашылуы
Карл
Вильгельм
Шееле
(1742 – 1786) Қолданылуы
1 Пластмассалар, бояулар алуда1 Пластмассалар, бояулар алуда
2. Мата мен қағаздарды ағарту. 2. Мата мен қағаздарды ағарту.
3. Ауыз суын зарарсыздандыруда3. Ауыз суын зарарсыздандыруда
16 слайд
1774жылы швед оқымыстысы К. Шееле хлор газын алған. 1812 жылы Гей-Люсеок газге хлор деген ат берді.Хлор элементінің ашылуы Карл Вильгельм Шееле (1742 – 1786) Қолданылуы 1 Пластмассалар, бояулар алуда1 Пластмассалар, бояулар алуда 2. Мата мен қағаздарды ағарту. 2. Мата мен қағаздарды ағарту. 3. Ауыз суын зарарсыздандыруда3. Ауыз суын зарарсыздандыруда

#17 слайд
1825 жылы французский химигі
А.Ж.Балар бром элементін ашты.Бром элементінің ашылуы
Антуан Жером
Балар
(1802 – 1876) Өнеркәсіпте
сурет, кино материалдарын жасауда,
медицинада дәрі-дәрмектер алуда,
іштен жанатын двигательдердің
(автокөлік, авиация) бензин сапасын
жақсартып, этилдеуде қолданылады.
Нерв жүйесін реттейді. Қолданылуы
17 слайд
1825 жылы французский химигі А.Ж.Балар бром элементін ашты.Бром элементінің ашылуы Антуан Жером Балар (1802 – 1876) Өнеркәсіпте сурет, кино материалдарын жасауда, медицинада дәрі-дәрмектер алуда, іштен жанатын двигательдердің (автокөлік, авиация) бензин сапасын жақсартып, этилдеуде қолданылады. Нерв жүйесін реттейді. Қолданылуы

#18 слайд
1811 жылы французский химигі
Бернар Куртуа йод элементін ашты.
1813 жылы Ж.Л.Гей-Люссак
алынған элементті йод деп атады.Йод элементінің ашылуы
Бернар Куртуа
(1777 – 1838 ) Қолданылуы
Теңіз орман- жапырағы деп
аталатын ламинария балдырының
құрамында 0,1-0,6 %. Организмде йод
жетіспесе бақшаңкөз ауруына шалдығады,
сондықтан құрамында йоды бар асты пайдаланыңыздар.
Медицинада дәрілер даярлайды, тамақ өнеркәсібінде, фото,
кино ісінде, лабораториялық реактив ретінде де қолданылады .
18 слайд
1811 жылы французский химигі Бернар Куртуа йод элементін ашты. 1813 жылы Ж.Л.Гей-Люссак алынған элементті йод деп атады.Йод элементінің ашылуы Бернар Куртуа (1777 – 1838 ) Қолданылуы Теңіз орман- жапырағы деп аталатын ламинария балдырының құрамында 0,1-0,6 %. Организмде йод жетіспесе бақшаңкөз ауруына шалдығады, сондықтан құрамында йоды бар асты пайдаланыңыздар. Медицинада дәрілер даярлайды, тамақ өнеркәсібінде, фото, кино ісінде, лабораториялық реактив ретінде де қолданылады .

#19 слайд
1869 Д.И.Мендеелеев астат элементін,болашақта
алынатынын қарастырды.
Алғаш рет 1940 ж жасанды жолмен астат алынды
Радиоактивті элемент болғандықтан қолданылмайды. Астат элементінің ашылуы
Қолданылуы
19 слайд
1869 Д.И.Мендеелеев астат элементін,болашақта алынатынын қарастырды. Алғаш рет 1940 ж жасанды жолмен астат алынды Радиоактивті элемент болғандықтан қолданылмайды. Астат элементінің ашылуы Қолданылуы

#20 слайд
Реакция теңдеуін сәйкесінше
аяқта
Xe + 2F
2 =
H
2 + F
2 =
2Au + 3Cl
2 =
2Na Cl + 2H
2 O
=
2NaI + Cl
2 =2H
2 O + 2F
2 = 2NaOH + H
2 +Cl
2
2NaCl + I
2
XeF
4
4 HF + O
2
2HF 2AuCl
3
20 слайд
Реакция теңдеуін сәйкесінше аяқта Xe + 2F 2 = H 2 + F 2 = 2Au + 3Cl 2 = 2Na Cl + 2H 2 O = 2NaI + Cl 2 =2H 2 O + 2F 2 = 2NaOH + H 2 +Cl 2 2NaCl + I 2 XeF 4 4 HF + O 2 2HF 2AuCl 3
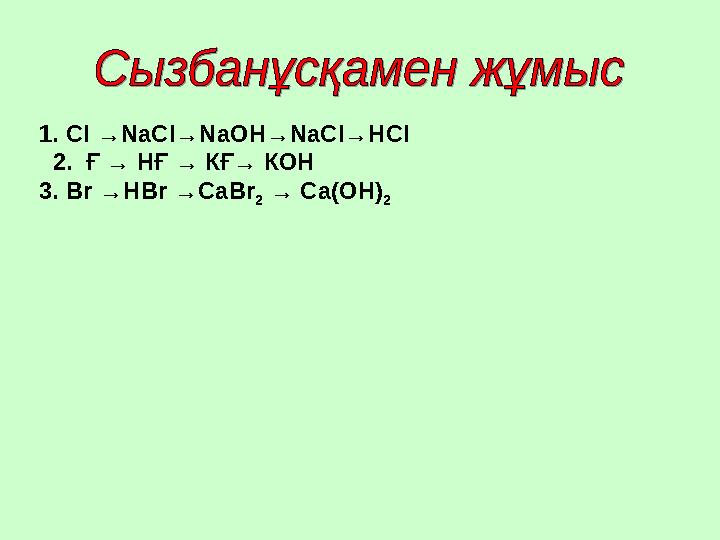
#21 слайд
1. СІ → Na СІ→ N аОН→ N аСІ→НСІ
2. Ғ → НҒ → КҒ→ КОН
3. В r → НВ r → СаВ r
2 → Са(ОН)
2
21 слайд
1. СІ → Na СІ→ N аОН→ N аСІ→НСІ 2. Ғ → НҒ → КҒ→ КОН 3. В r → НВ r → СаВ r 2 → Са(ОН) 2
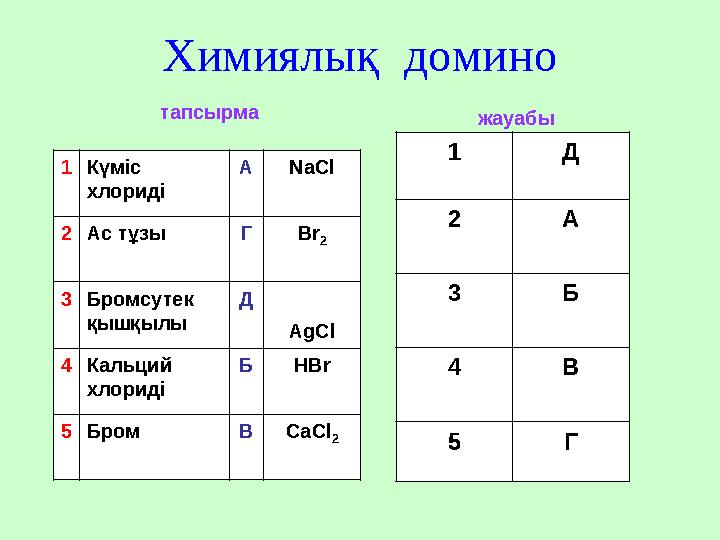
#22 слайд
Химиялық домино
1 Күміс
хлориді А NaCl
2 Ас тұзы Г Br
2
3 Бромсутек
қышқылы Д
AgCl
4 Кальций
хлориді Б HBr
5 Бром В CaCl
2 1 Д
2 А
3 Б
4 В
5 Гтапсырма
жауабы
22 слайд
Химиялық домино 1 Күміс хлориді А NaCl 2 Ас тұзы Г Br 2 3 Бромсутек қышқылы Д AgCl 4 Кальций хлориді Б HBr 5 Бром В CaCl 2 1 Д 2 А 3 Б 4 В 5 Гтапсырма жауабы
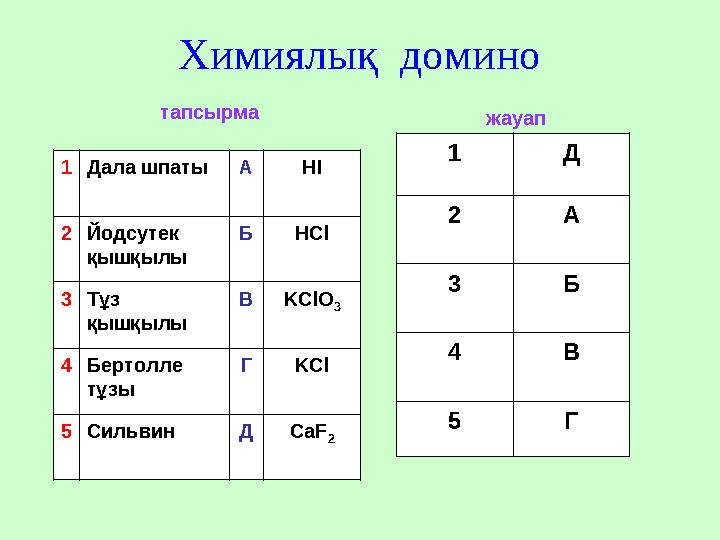
#23 слайд
Химиялық домино
1 Дала шпаты А НІ
2 Йодсутек
қышқылы Б HCl
3 Тұз
қышқылы В KClO
3
4 Бертолле
тұзы Г KCl
5 Сильвин Д CaF
2 1 Д
2 А
3 Б
4 В
5 Гтапсырма
жауап
23 слайд
Химиялық домино 1 Дала шпаты А НІ 2 Йодсутек қышқылы Б HCl 3 Тұз қышқылы В KClO 3 4 Бертолле тұзы Г KCl 5 Сильвин Д CaF 2 1 Д 2 А 3 Б 4 В 5 Гтапсырма жауап

#24 слайд
1. Фтор күшті тотықтырғыш:
2. Бром суда нашар ериді:
3. Йод сұйық газ:
4. Хлордың атомдық массасы 35,5г. :
5. Фтор қосылыстарда бір валентті:
6. Йодтың белсенділігі жоғары:
7. Бромды су бромның судағы ерітіндісі:
8. Галогендер 7 топта орналасқан: Графикалық диктант
( иә - +, жоқ - -)
24 слайд
1. Фтор күшті тотықтырғыш: 2. Бром суда нашар ериді: 3. Йод сұйық газ: 4. Хлордың атомдық массасы 35,5г. : 5. Фтор қосылыстарда бір валентті: 6. Йодтың белсенділігі жоғары: 7. Бромды су бромның судағы ерітіндісі: 8. Галогендер 7 топта орналасқан: Графикалық диктант ( иә - +, жоқ - -)

#25 слайд
Үйге тапсырма
Галогендер
Фтор,йод,хлор элементтерінің биологиялық рөлі.
( шығармашылық жұмыс)
25 слайд
Үйге тапсырма Галогендер Фтор,йод,хлор элементтерінің биологиялық рөлі. ( шығармашылық жұмыс)

#26 слайд
Бағалау
26 слайд
Бағалау

шағым қалдыра аласыз
















