химия саласының негіздері
химия саласының негіздері


#1 слайд
ОСНОВНЫЕ
ПОНЯТИЯ
ХИМИИ
1 полугодие 8 класс
Л.И.Настина,
учитель химии
1 слайд
ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ 1 полугодие 8 класс Л.И.Настина, учитель химии

#2 слайд
Химия – это наука о
веществах, их свойствах и
превращениях
Физическое тело
вещество
Химический элемент -
определенный вид
атомов
2 слайд
Химия – это наука о веществах, их свойствах и превращениях Физическое тело вещество Химический элемент - определенный вид атомов

#3 слайд
3 слайд
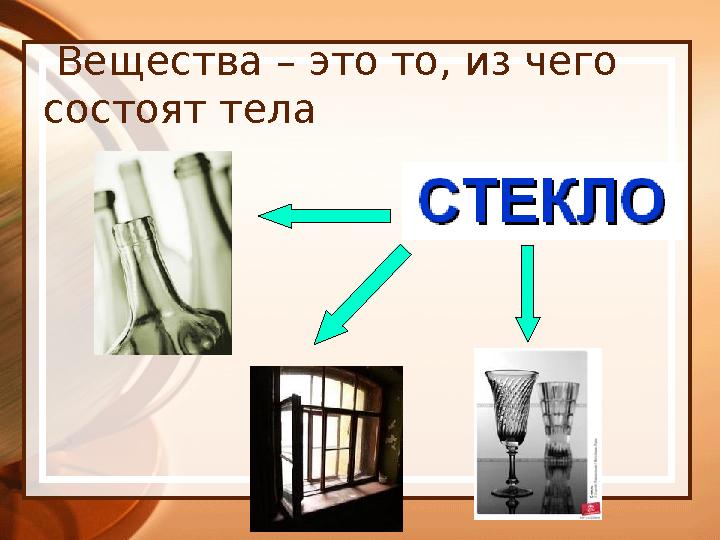
#4 слайд
Вещества – это то, из чего
состоят тела
4 слайд
Вещества – это то, из чего состоят тела
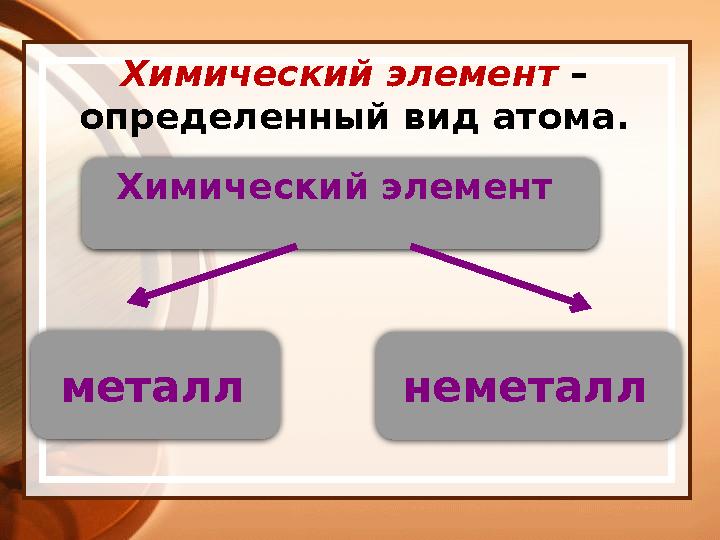
#5 слайд
Химический элемент
металл
неметаллХимический элемент –
определенный вид атома.
5 слайд
Химический элемент металл неметаллХимический элемент – определенный вид атома.

#6 слайд
План характеристики элемента:
1. Символ и название.
2. Положение в ПСХЭ.
3. Строение атома.
4. Электронная конфигурация.
5. Структурная конфигурация.
6. Формула и характер высшего
оксида.
7. Формула гидроксидного
соединения.
6 слайд
План характеристики элемента: 1. Символ и название. 2. Положение в ПСХЭ. 3. Строение атома. 4. Электронная конфигурация. 5. Структурная конфигурация. 6. Формула и характер высшего оксида. 7. Формула гидроксидного соединения.

#7 слайд
Ион -
Заряженная
частица вещества
NA +
, Cl -
,
SO
4 2-
, Al 3+
7 слайд
Ион - Заряженная частица вещества NA + , Cl - , SO 4 2- , Al 3+
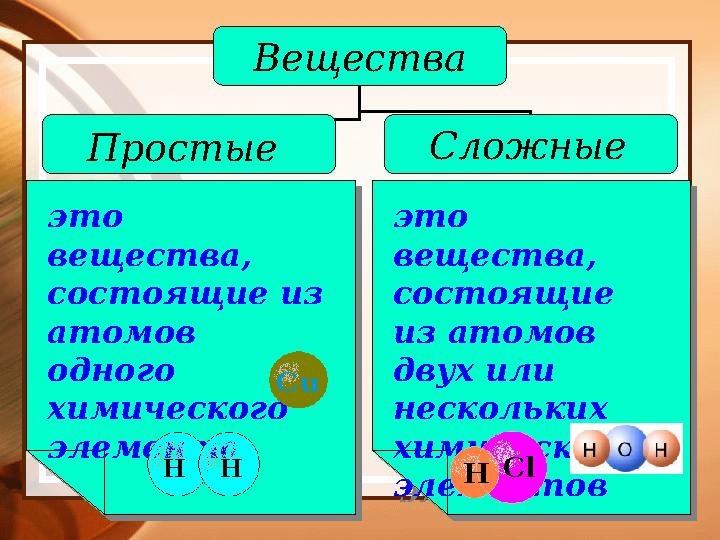
#8 слайд
это
вещества,
состоящие из
атомов
одного
химического
элементаэто
вещества,
состоящие из
атомов
одного
химического
элемента это
вещества,
состоящие
из атомов
двух или
нескольких
химических
элементовэто
вещества,
состоящие
из атомов
двух или
нескольких
химических
элементовВещества
Простые Сложные
H H Cu
H Cl
8 слайд
это вещества, состоящие из атомов одного химического элементаэто вещества, состоящие из атомов одного химического элемента это вещества, состоящие из атомов двух или нескольких химических элементовэто вещества, состоящие из атомов двух или нескольких химических элементовВещества Простые Сложные H H Cu H Cl
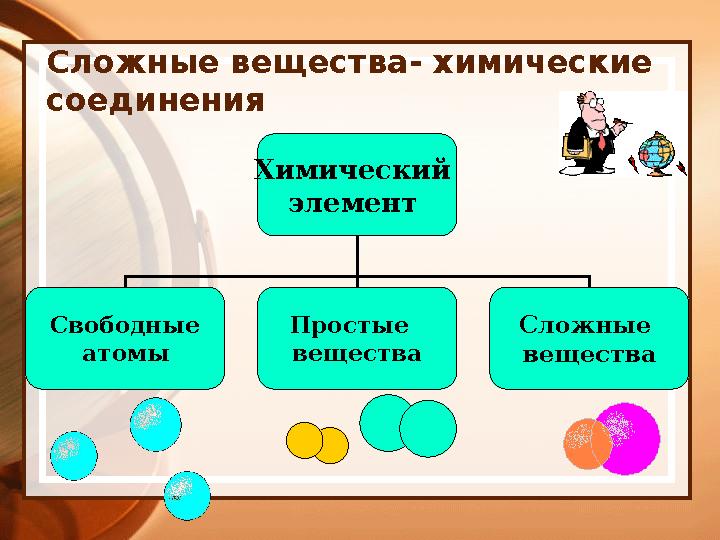
#9 слайд
Сложные вещества- химические
соединения
Химический
элемент
Свободные
атомы Простые
вещества Сложные
вещества
9 слайд
Сложные вещества- химические соединения Химический элемент Свободные атомы Простые вещества Сложные вещества
#10 слайд
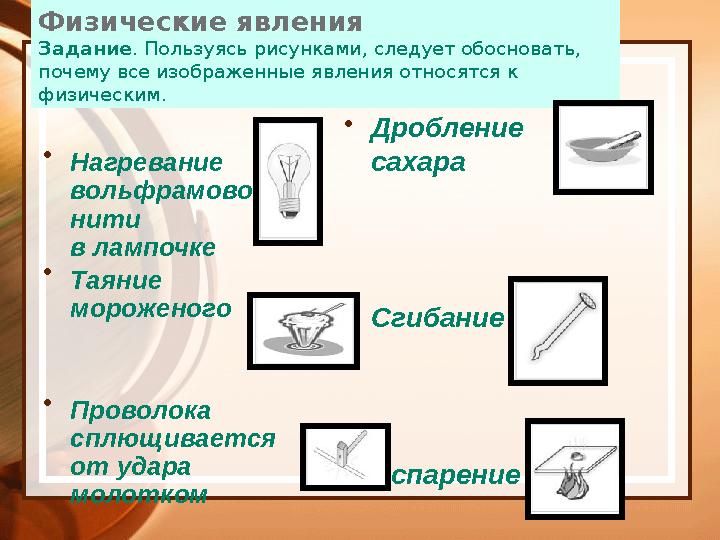
Физические явления
Задание . Пользуясь рисунками, следует обосновать,
почему все изображенные явления относятся к
физическим.
•
Нагревание
вольфрамовой
нити
в лампочке
•
Таяние
мороженого
•
Проволока
сплющивается
от удара
молотком •
Дробление
сахара
•
Сгибание гвоздя
•
Испарение воды
10 слайд
Физические явления Задание . Пользуясь рисунками, следует обосновать, почему все изображенные явления относятся к физическим. • Нагревание вольфрамовой нити в лампочке • Таяние мороженого • Проволока сплющивается от удара молотком • Дробление сахара • Сгибание гвоздя • Испарение воды
#11 слайд
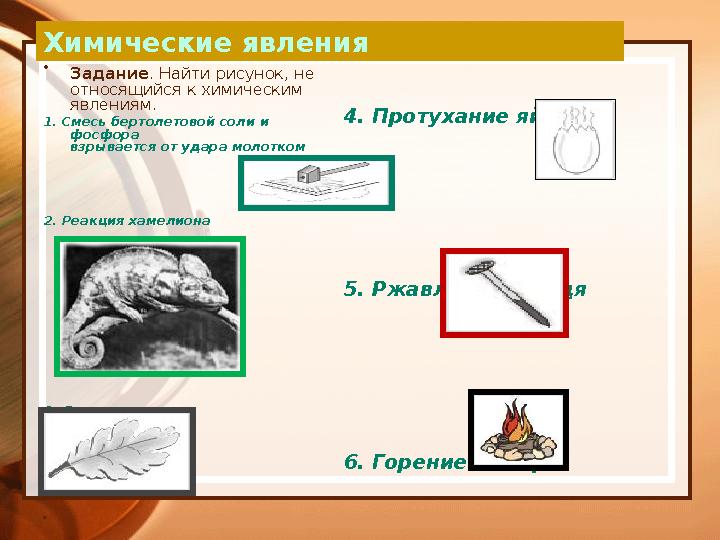
Химические явления
•
Задание . Найти рисунок, не
относящийся к химическим
явлениям.
1. Смесь бертолетовой соли и
фосфора
взрывается от удара молотком
2. Реакция хамелиона
3. Листопад
•
4. Протухание яйца
5. Ржавление гвоздя
6. Горение костра
11 слайд
Химические явления • Задание . Найти рисунок, не относящийся к химическим явлениям. 1. Смесь бертолетовой соли и фосфора взрывается от удара молотком 2. Реакция хамелиона 3. Листопад • 4. Протухание яйца 5. Ржавление гвоздя 6. Горение костра

#12 слайд
Признаки химической реакции
1. Изменение окраски.
2. Выделение или поглощение теплоты.
3. Появление запаха.
4. Образования осадка.
5. Выделение газа.
12 слайд
Признаки химической реакции 1. Изменение окраски. 2. Выделение или поглощение теплоты. 3. Появление запаха. 4. Образования осадка. 5. Выделение газа.

#13 слайд
ПЕРИОДИЧНОСТЬ СВОЙСТВ в ПЕРИОДАХ:
•
В пределах одного периода слева направо металлические
свойства ослабевают;
•
А неметаллические возрастают.
ПОТОМУ ЧТО:
1. Растет число электронов на внешнем уровне;
2. Радиус атома уменьшается;
3. Число энергетических уровней постоянно.
ПЕРИОДИЧНОСТЬ СВОЙСТВ В ГЛАВНЫХ ПОДРУППАХ:
•
В пределах одной и той же группы сверху вниз металлические
свойства усиливаются;
•
А неметаллические уменьшаются.
ПОТОМУ ЧТО:
1. Число электронов на внешнем уровне одинаково;
2. Радиус атома увеличивается;
3. Число энергетических уровней в атомах растет.
13 слайд
ПЕРИОДИЧНОСТЬ СВОЙСТВ в ПЕРИОДАХ: • В пределах одного периода слева направо металлические свойства ослабевают; • А неметаллические возрастают. ПОТОМУ ЧТО: 1. Растет число электронов на внешнем уровне; 2. Радиус атома уменьшается; 3. Число энергетических уровней постоянно. ПЕРИОДИЧНОСТЬ СВОЙСТВ В ГЛАВНЫХ ПОДРУППАХ: • В пределах одной и той же группы сверху вниз металлические свойства усиливаются; • А неметаллические уменьшаются. ПОТОМУ ЧТО: 1. Число электронов на внешнем уровне одинаково; 2. Радиус атома увеличивается; 3. Число энергетических уровней в атомах растет.

#14 слайд
•
Под ВАЛЕНТНОСТЬ (сила) понимают свойства
атомов образовывать химические связи с другими
атомами, а также число одинарных связей.
Валентность у элементов бывает: постоянная,
переменная.
•
Определять валентность можно также с помощью
ПСХЭ. ВАЛЕНТНОСТЬ
1 П Ш
ЭЛЕМЕНТЫ H, Na, Li,
K, Ag Mg, O, Ca,
Ba, Zn Al
14 слайд
• Под ВАЛЕНТНОСТЬ (сила) понимают свойства атомов образовывать химические связи с другими атомами, а также число одинарных связей. Валентность у элементов бывает: постоянная, переменная. • Определять валентность можно также с помощью ПСХЭ. ВАЛЕНТНОСТЬ 1 П Ш ЭЛЕМЕНТЫ H, Na, Li, K, Ag Mg, O, Ca, Ba, Zn Al

#15 слайд
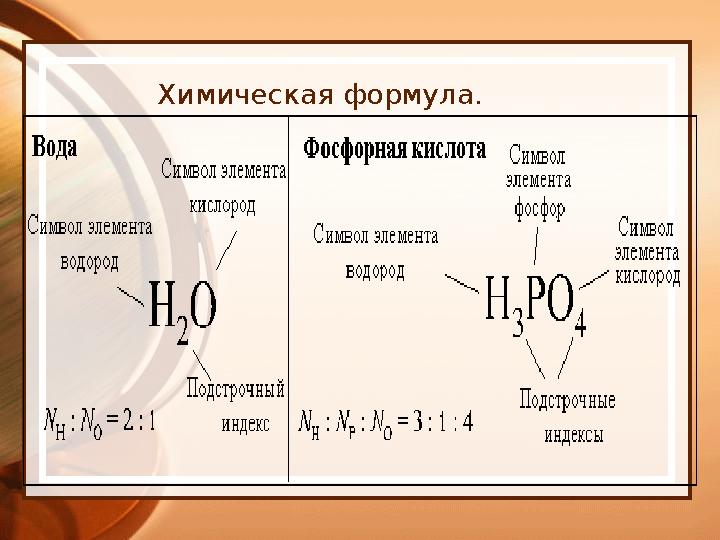
Химические формулы
•
Химическая формула – это
условная запись состава
вещества посредством
химических знаков и
индексов.
15 слайд
Химические формулы • Химическая формула – это условная запись состава вещества посредством химических знаков и индексов.
#16 слайд
Химическая формула.
16 слайд
Химическая формула.

#17 слайд
Закон постоянства состава
вещества
или закон Пруста.
каждое химически чистое
вещество с молекулярным
строением независимо от
места нахождения и способа
получения имеет один и тот же
постоянный качественный и
количественный состав.
•
17 слайд
Закон постоянства состава вещества или закон Пруста. каждое химически чистое вещество с молекулярным строением независимо от места нахождения и способа получения имеет один и тот же постоянный качественный и количественный состав. •

#18 слайд
Индекс
•
показывает количество атомов данного элемента в
молекуле.
Итак, состав веществ выражается химическими
формулами с целочисленными индексами,
например
Н
2 О, НСl, СН
4, H N O
3 ,
CuS , Na
3 PO
4 , P
2 O
5,
Na
2 SO
4
18 слайд
Индекс • показывает количество атомов данного элемента в молекуле. Итак, состав веществ выражается химическими формулами с целочисленными индексами, например Н 2 О, НСl, СН 4, H N O 3 , CuS , Na 3 PO 4 , P 2 O 5, Na 2 SO 4
#19 слайд
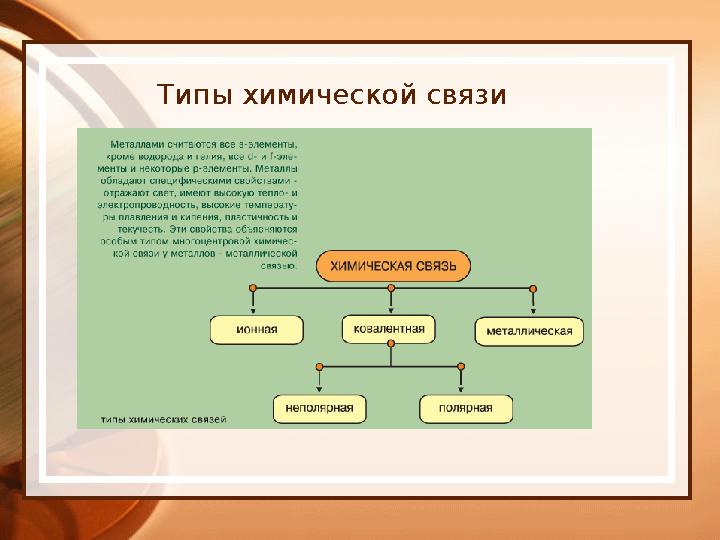
Типы химической связи
19 слайд
Типы химической связи
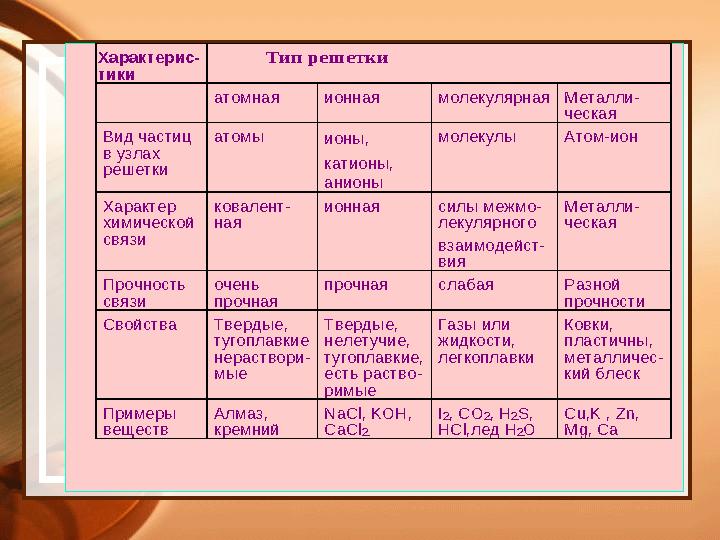
#20 слайд
Х арактерис -
тики
Тип решетки
атомная ионная молекулярная Метал ли-
ческая
Вид частиц
в узлах
решетки
атомы ионы,
катионы,
анионы
молекулы Атом -ион
Характер
химической
связи
ковалент -
ная
ионная силы межмо -
лекулярного
взаимодейст -
вия
Металли -
ческая
Прочность
связи
очень
прочная
прочная слабая Разной
прочности
Свойства Твердые,
тугоплав кие
нераствори -
мые
Твердые,
нелетучие,
тугоплавкие,
есть раство -
римые
Газы или
жидкости,
легкоплавки
Ковки,
пластичны,
металличес -
кий блеск
Примеры
веществ
Алмаз,
кремний
NaCl, KOH,
CaCl 2
I2, CO 2, H 2S,
HCl, лед Н 2О
Cu,K , Zn,
Mg, Ca
20 слайд
Х арактерис - тики Тип решетки атомная ионная молекулярная Метал ли- ческая Вид частиц в узлах решетки атомы ионы, катионы, анионы молекулы Атом -ион Характер химической связи ковалент - ная ионная силы межмо - лекулярного взаимодейст - вия Металли - ческая Прочность связи очень прочная прочная слабая Разной прочности Свойства Твердые, тугоплав кие нераствори - мые Твердые, нелетучие, тугоплавкие, есть раство - римые Газы или жидкости, легкоплавки Ковки, пластичны, металличес - кий блеск Примеры веществ Алмаз, кремний NaCl, KOH, CaCl 2 I2, CO 2, H 2S, HCl, лед Н 2О Cu,K , Zn, Mg, Ca

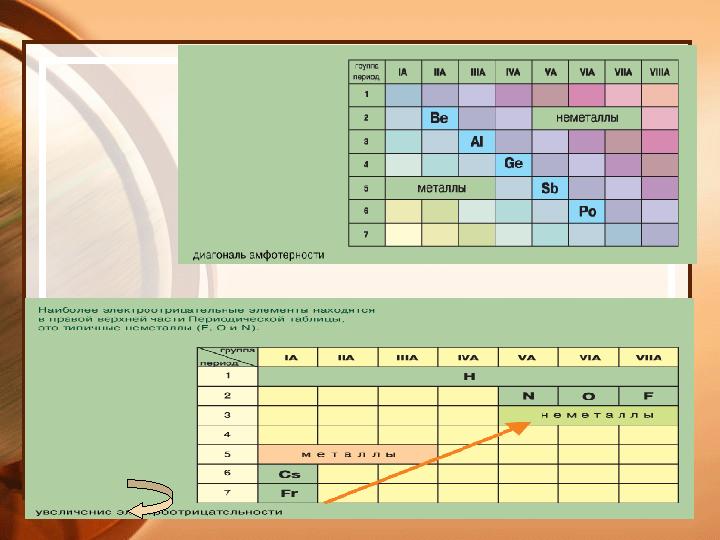
#21 слайд
Электроотрицательность -
способность атомов
оттягивать на себя
электроны.
Ряд ЭО: Si H P C S Br Cl N O F
ЭО –увеличивается
21 слайд
Электроотрицательность - способность атомов оттягивать на себя электроны. Ряд ЭО: Si H P C S Br Cl N O F ЭО –увеличивается
#22 слайд
22 слайд

#23 слайд
Русское
название
ПроизношениеМеталлыN a
K
C
a
B a
Cu
A
g
A uZn
P b
Hg
A
l
M
g
Mn Fe
натрий
натрий железо
феррум свинец
плюмбум цинк
цинкбарий
барий ртуть
гидраргирум алюминий
алюминий калий
калийсеребро
аргентум марганец
марганец медь
купрумкальций
кальций золото
ауруммагний
магний
◄
23 слайд
Русское название ПроизношениеМеталлыN a K C a B a Cu A g A uZn P b Hg A l M g Mn Fe натрий натрий железо феррум свинец плюмбум цинк цинкбарий барий ртуть гидраргирум алюминий алюминий калий калийсеребро аргентум марганец марганец медь купрумкальций кальций золото ауруммагний магний ◄

#24 слайд
Русское
название
ПроизношениеНеметаллыS
Cl
B
r
C
S
i
J
N
P
OF
H c ерауглерод водородкремнийкислород
фосфор бром
хлор фтор йодазот
бром
йодхлор фтор
эс энаш о
це пэсилициум
►
24 слайд
Русское название ПроизношениеНеметаллыS Cl B r C S i J N P OF H c ерауглерод водородкремнийкислород фосфор бром хлор фтор йодазот бром йодхлор фтор эс энаш о це пэсилициум ►

#25 слайд
Au 79
196, 97 Относительная
атомная масса
А
r -
число, показывающее во
сколько раз масса
данного атома больше
массы атома водорода
(округляем до целого) Порядковый
(атомный)
номер
25 слайд
Au 79 196, 97 Относительная атомная масса А r - число, показывающее во сколько раз масса данного атома больше массы атома водорода (округляем до целого) Порядковый (атомный) номер

#26 слайд
Массовые доли элементов.
ФОРМУЛА:
Ar (эл.)• n
W (эл.)
Mr (в-ва)
Единицы измерения [доли] или [%], в этом
случае умножаем на 100 %.
26 слайд
Массовые доли элементов. ФОРМУЛА: Ar (эл.)• n W (эл.) Mr (в-ва) Единицы измерения [доли] или [%], в этом случае умножаем на 100 %.
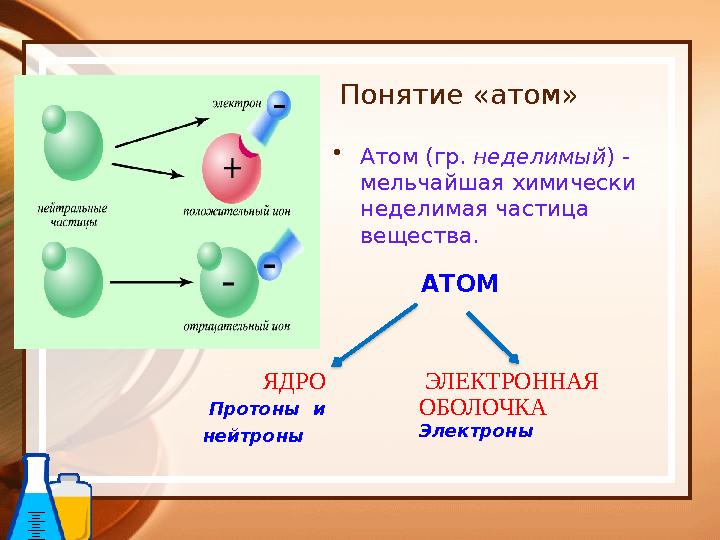
#27 слайд
ЯДРО
Протоны и
нейтроны ЭЛЕКТРОННАЯ
ОБОЛОЧКА
Электроны
Понятие «атом»
•
Атом (гр. неделимый ) -
мельчайшая химически
неделимая частица
вещества.
АТОМ
27 слайд
ЯДРО Протоны и нейтроны ЭЛЕКТРОННАЯ ОБОЛОЧКА Электроны Понятие «атом» • Атом (гр. неделимый ) - мельчайшая химически неделимая частица вещества. АТОМ

#28 слайд
ОСНОВНЫЕ ПОЛОЖЕНИЯ
ПЛАНЕТАРНОЙ МОДЕЛИ :
•
Атом – это микрочастица, которая имеет
форму шара.
•
Атом – это сложная система, состоящая из
ядра и электронов.
•
Ядра находятся в центре атома и имеют очень
маленький размер.
•
Ядро имеет положительный заряд, величина
которого определяется числом протонов в
нем.
•
Электроны движутся вокруг ядра, имеют
ничтожно малую массу и размеры, обладают
отрицательным зарядом.
•
Атом электронейтрален, поэтому число
протонов и электронов в нем одинаково.
28 слайд
ОСНОВНЫЕ ПОЛОЖЕНИЯ ПЛАНЕТАРНОЙ МОДЕЛИ : • Атом – это микрочастица, которая имеет форму шара. • Атом – это сложная система, состоящая из ядра и электронов. • Ядра находятся в центре атома и имеют очень маленький размер. • Ядро имеет положительный заряд, величина которого определяется числом протонов в нем. • Электроны движутся вокруг ядра, имеют ничтожно малую массу и размеры, обладают отрицательным зарядом. • Атом электронейтрален, поэтому число протонов и электронов в нем одинаково.

#29 слайд
Как измерить вещество?
•
Необходимо точно знать
число частиц вещества, т.е.
его количество
•
Единица количества
вещества – 1 моль, т.е.
6 ● 10 23
частиц
29 слайд
Как измерить вещество? • Необходимо точно знать число частиц вещества, т.е. его количество • Единица количества вещества – 1 моль, т.е. 6 ● 10 23 частиц
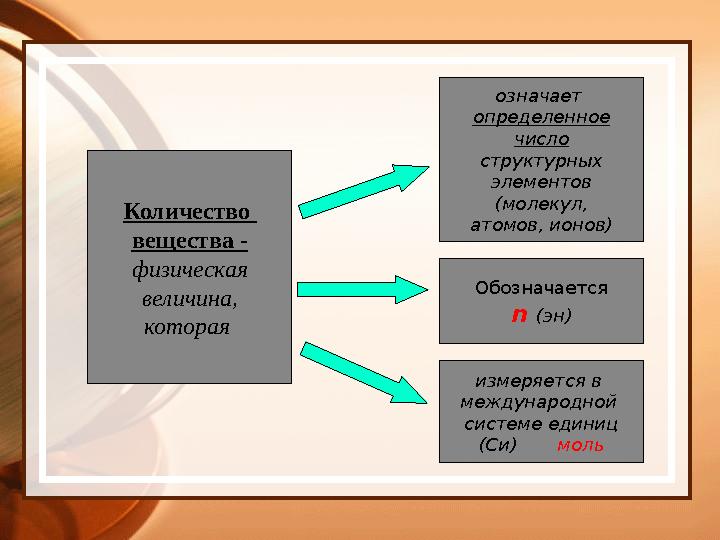
#30 слайд
Количество
вещества -
физическая
величина,
которая означает
определенное
число
структурных
элементов
(молекул,
атомов, ионов)
Обозначается
n (эн)
измеряется в
международной
системе единиц
(Си) моль
30 слайд
Количество вещества - физическая величина, которая означает определенное число структурных элементов (молекул, атомов, ионов) Обозначается n (эн) измеряется в международной системе единиц (Си) моль
#31 слайд
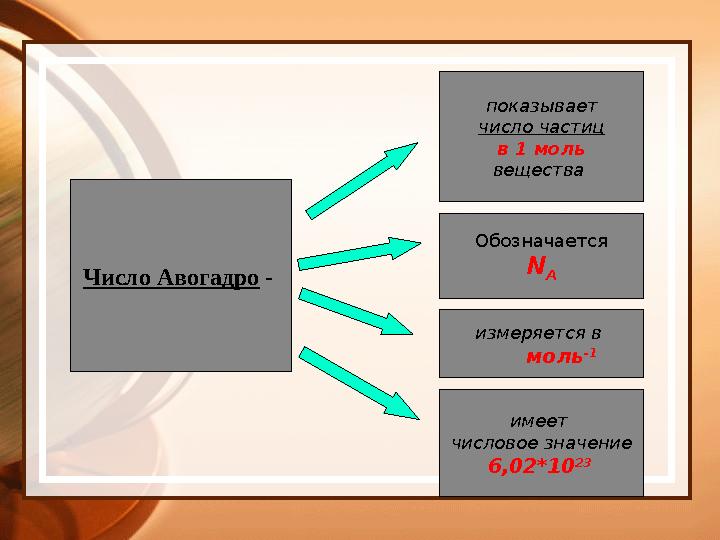
Число Авогадро - показывает
число частиц
в 1 моль
вещества
Обозначается
N
A
измеряется в
моль -1
имеет
числовое значение
6,02*10 23
31 слайд
Число Авогадро - показывает число частиц в 1 моль вещества Обозначается N A измеряется в моль -1 имеет числовое значение 6,02*10 23
#32 слайд
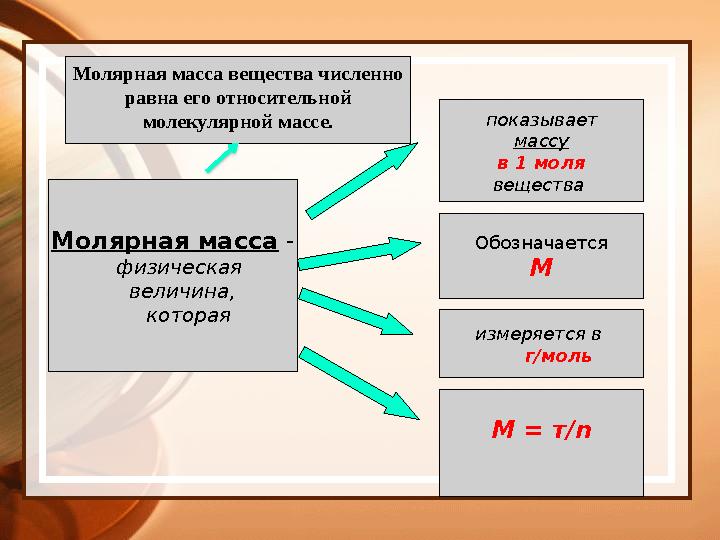
Молярная масса -
физическая
величина,
которая показывает
массу
в 1 моля
вещества
Обозначается
М
измеряется в
г/моль
М = т/ nМолярная масса вещества численно
равна его относительной
молекулярной массе.
32 слайд
Молярная масса - физическая величина, которая показывает массу в 1 моля вещества Обозначается М измеряется в г/моль М = т/ nМолярная масса вещества численно равна его относительной молекулярной массе.

#33 слайд
Для расчёта количества
n = m / М
n=V/V
m
n =N / N
a
33 слайд
Для расчёта количества n = m / М n=V/V m n =N / N a

#34 слайд
Но если число частиц известно?
В 1 моле содержится
6 ● 10 23
частиц
Эта величина
называется число
Авогадро
n =N / N
a
34 слайд
Но если число частиц известно? В 1 моле содержится 6 ● 10 23 частиц Эта величина называется число Авогадро n =N / N a

#35 слайд
Амедео
Авогадро
высказал
предположение
в 1811 году, что
В равных объемах различных газов
при одинаковых условиях
(температура, давление) содержится
одинаковое число молекул.
35 слайд
Амедео Авогадро высказал предположение в 1811 году, что В равных объемах различных газов при одинаковых условиях (температура, давление) содержится одинаковое число молекул.

#36 слайд
Молярный объем газа Vm
— величина, определяемая отношением объема данной порции
газа V к химическому количеству вещества n в этой порции:
Нормальные
условия:
температура — 0°С
давление — 101,325
кПа
36 слайд
Молярный объем газа Vm — величина, определяемая отношением объема данной порции газа V к химическому количеству вещества n в этой порции: Нормальные условия: температура — 0°С давление — 101,325 кПа
#37 слайд
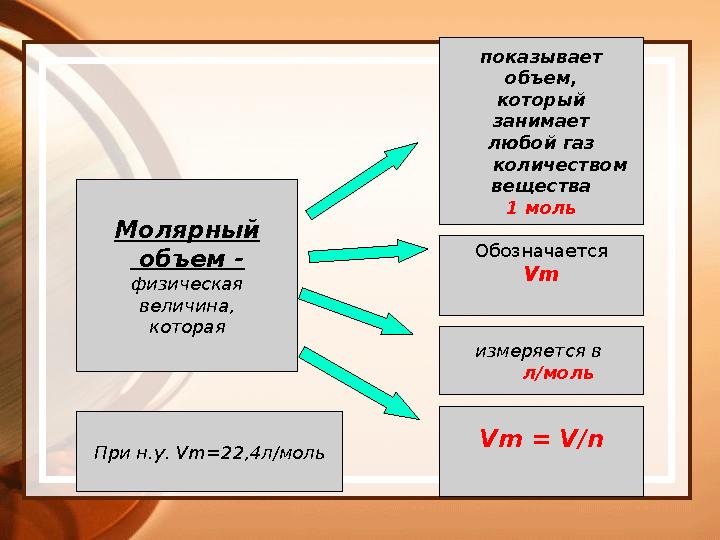
Молярный
объем -
физическая
величина,
которая показывает
объем,
который
занимает
любой газ
количеством
вещества
1 моль
Обозначается
Vm
измеряется в
л/моль
Vm = V / n
При н.у. Vm=22 , 4 л/моль
37 слайд
Молярный объем - физическая величина, которая показывает объем, который занимает любой газ количеством вещества 1 моль Обозначается Vm измеряется в л/моль Vm = V / n При н.у. Vm=22 , 4 л/моль

#38 слайд
38Производные формулы
Иванова Г.А. gale993@yandex.rum = n ●
М
V=n ●
V
m
N =n ●
N
a
38 слайд
38Производные формулы Иванова Г.А. gale993@yandex.rum = n ● М V=n ● V m N =n ● N a

#39 слайд
Отношение массы растворимого
вещества к общей массе
раствора называют массовой
долей растворенного
вещества.
Массовую долю обозначают
греческой буквой W (омега) и
выражают в долях единицы или
процентах.
39 слайд
Отношение массы растворимого вещества к общей массе раствора называют массовой долей растворенного вещества. Массовую долю обозначают греческой буквой W (омега) и выражают в долях единицы или процентах.

#40 слайд
Оцените своё состояние после урок
Мне хорошо Как всегда унылое
Я много знаю Я плохо
понял
и умею
40 слайд
Оцените своё состояние после урок Мне хорошо Как всегда унылое Я много знаю Я плохо понял и умею

шағым қалдыра аласыз
















