Жай, бинарлы және күрделі бейорганикалық заттардың қатысуымен тотығу –тотықсыздану реакциялары
Жай, бинарлы және күрделі бейорганикалық заттардың қатысуымен тотығу –тотықсыздану реакциялары


#1 слайд
Жай, бинарлы және күрделі
бейорганикалық заттардың
қатысуымен
тотығу –тотықсыздану
реакциялары
10 сынып ҚГБ химия
1 слайд
Жай, бинарлы және күрделі бейорганикалық заттардың қатысуымен тотығу –тотықсыздану реакциялары 10 сынып ҚГБ химия

#2 слайд
Оқу мақсаты
1
10.2.3.1 зат формуласы
бойынша элементтің тотығу
дәрежесін анықтай алу;
2 слайд
Оқу мақсаты 1 10.2.3.1 зат формуласы бойынша элементтің тотығу дәрежесін анықтай алу;
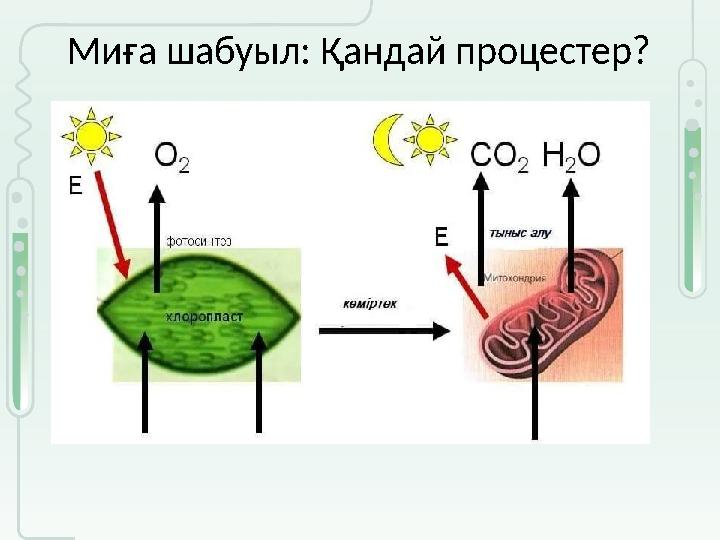
#3 слайд
Миға шабуыл: Қандай процестер?
3 слайд
Миға шабуыл: Қандай процестер?

#4 слайд
Тотығу – тотықсыздану реакциялары
Тотығу - тотықсыздану процесі ең кеңінен тараған
және теориямен практикада маңызды роль
атқаратын реакция болып табылады. Тірі
ағзаларда жүретін зат алмасу, шіру, ашу,
фотосинтез процестері тығыз байланысты. Тотығу
- тотықсыздану процесі табиғаттағы заттар
айналымын жүзеге асырады. Отынның жануы,
металдар коррозиясы, металдар құймаларын
дайындау және электролиз процестерінде жүзеге
асырады.
Олардың көмегімен сілті, қышқыл және бағалы
өнімдер алынады. Тотығу - тотықсыздану
реакциялары әрекеттесуші химиялық заттарда
гальвани және отын элементтерінде пайда болатын
электр энергиясын тудырады. Адамзат баласы
тотығу – тотықсыздану реакциясының мәнін толық
түсіне алмаса да, оны кеңінен пайдаланды.
4 слайд
Тотығу – тотықсыздану реакциялары Тотығу - тотықсыздану процесі ең кеңінен тараған және теориямен практикада маңызды роль атқаратын реакция болып табылады. Тірі ағзаларда жүретін зат алмасу, шіру, ашу, фотосинтез процестері тығыз байланысты. Тотығу - тотықсыздану процесі табиғаттағы заттар айналымын жүзеге асырады. Отынның жануы, металдар коррозиясы, металдар құймаларын дайындау және электролиз процестерінде жүзеге асырады. Олардың көмегімен сілті, қышқыл және бағалы өнімдер алынады. Тотығу - тотықсыздану реакциялары әрекеттесуші химиялық заттарда гальвани және отын элементтерінде пайда болатын электр энергиясын тудырады. Адамзат баласы тотығу – тотықсыздану реакциясының мәнін толық түсіне алмаса да, оны кеңінен пайдаланды.

#5 слайд
Химиялық реакцияларда әрекеттесуші заттардың
құрамына кіретін атомдардың тотығу дәрежесінің өзгеруі.
Тотығу - тотықсыздану реакциялары (ТТР)
•Жай заттардың құрамына кіретін элемент
атомының тотығу дәрежесі нөльге тең.
• Сутектің тотығу дәрежесі гидридтерден басқа
қосылыстарды +1 тең.
•Оттектің тотығу дәрежесі пероксидтер мен
фтор қосылыстарынан басқа
қосылыстарында -2 тең.
•Қосылыстың құрамындағы барлық
атомдардың тотығу дәрежесінің қосындысының
жиынтығы нөльге тең.
•Иондағы атомдардың тотығу дәрежесінің
жиынтық қосындысы ион зарядына тең
болады.
Mgº, Cl
2
º, O
2
º
+1 +1 -1
HCl, H
2
O, NaH
-2 -1 +2
H
2
O, Н
2
О
2
, OF
2
+1 +6 -2
H
2
SO
4
2(+1)+6+4(-2)=0
+6 -2
SO
4
6+4(-2)=-2
5 слайд
Химиялық реакцияларда әрекеттесуші заттардың құрамына кіретін атомдардың тотығу дәрежесінің өзгеруі. Тотығу - тотықсыздану реакциялары (ТТР) •Жай заттардың құрамына кіретін элемент атомының тотығу дәрежесі нөльге тең. • Сутектің тотығу дәрежесі гидридтерден басқа қосылыстарды +1 тең. •Оттектің тотығу дәрежесі пероксидтер мен фтор қосылыстарынан басқа қосылыстарында -2 тең. •Қосылыстың құрамындағы барлық атомдардың тотығу дәрежесінің қосындысының жиынтығы нөльге тең. •Иондағы атомдардың тотығу дәрежесінің жиынтық қосындысы ион зарядына тең болады. Mgº, Cl 2 º, O 2 º +1 +1 -1 HCl, H 2 O, NaH -2 -1 +2 H 2 O, Н 2 О 2 , OF 2 +1 +6 -2 H 2 SO 4 2(+1)+6+4(-2)=0 +6 -2 SO 4 6+4(-2)=-2

#6 слайд
•Реакция теңдеуіндегі барлық элементтердің тотығу дәрежесінің мәнін
жазу. Элемент атомының тотығу дәрежесі өзгеріске ұшырауын
анықтаймыз.
+2 -2 +1 -1 +2 -1 +1 -2
PbO + 2HCl → PbCl
2
+ H
2
O
•Тотығу дәрежесі өзгерімесе => реакция тотығу - тотықсыздану реакциясы
болмайды
+4 -2 +1 -1 +2 -1 0 +1 -2
PbO
2
+ 2HCl → PbCl
2
+ Cl
2
+ 2H
2
O
•Тотығу дәрежесі өзгеретін болса > реакция тотығу - тотықсыздану
реакциясы болып табылады
Қышқылды ортада:
2KMnO
4
+ 5Na
2
SO
3
+3H
2
SO
4
= 2MnSO
4
+ 5 Na
2
SO
4
+ 3H
2
O +
K
2
SO
4
2 Mn
+7
+ 5e
-
= Mn
+2
5 S
+4
-2e
-
= S
+6
6 слайд
•Реакция теңдеуіндегі барлық элементтердің тотығу дәрежесінің мәнін жазу. Элемент атомының тотығу дәрежесі өзгеріске ұшырауын анықтаймыз. +2 -2 +1 -1 +2 -1 +1 -2 PbO + 2HCl → PbCl 2 + H 2 O •Тотығу дәрежесі өзгерімесе => реакция тотығу - тотықсыздану реакциясы болмайды +4 -2 +1 -1 +2 -1 0 +1 -2 PbO 2 + 2HCl → PbCl 2 + Cl 2 + 2H 2 O •Тотығу дәрежесі өзгеретін болса > реакция тотығу - тотықсыздану реакциясы болып табылады Қышқылды ортада: 2KMnO 4 + 5Na 2 SO 3 +3H 2 SO 4 = 2MnSO 4 + 5 Na 2 SO 4 + 3H 2 O + K 2 SO 4 2 Mn +7 + 5e - = Mn +2 5 S +4 -2e - = S +6

#7 слайд
Бейтарап ортада:
2KMnO
4 + 3Na
2SO
3+H
2O= 2MnO
2 + 3Na
2SO
4 + 2KOH
2 Mn
+7
+3e
-
=Mn
+4
3 S
+4
-2e
-
= S
+6
Сілтілік ортада:
2KMnO
4
+ Na
2
SO
3
+2KOH= K
2
MnO
4
+ Na
2
SO
4
+ H
2
O
2 Mn
+7
+ e
-
=Mn
+6
3 S
+4
-2e
-
= S
+6
7 слайд
Бейтарап ортада: 2KMnO 4 + 3Na 2SO 3+H 2O= 2MnO 2 + 3Na 2SO 4 + 2KOH 2 Mn +7 +3e - =Mn +4 3 S +4 -2e - = S +6 Сілтілік ортада: 2KMnO 4 + Na 2 SO 3 +2KOH= K 2 MnO 4 + Na 2 SO 4 + H 2 O 2 Mn +7 + e - =Mn +6 3 S +4 -2e - = S +6

#8 слайд
№ Реакция Реакцияның типі және
тотығу –тотықсыздану
реакциясына жатады
1 2CO+O
2
→ 2CO
2
2 CaCO
3
→CaO+CO2
3 Mg(OH)
2
+HCl→
MgCl
2
+2H
2
O
4 Fe+S→ FeS
5 Zn+ 2HCl→ZnCl
2
+H
2
6 2NaOH+
H
2
SO
4
→Na
2
SO
4
+2H
2
O
Жұптық жұмыс тапсырмасы:
Дескриптор:
зат формуласы бойынша элементтің тотығу дәрежесін анықтай алады-2 балл
8 слайд
№ Реакция Реакцияның типі және тотығу –тотықсыздану реакциясына жатады 1 2CO+O 2 → 2CO 2 2 CaCO 3 →CaO+CO2 3 Mg(OH) 2 +HCl→ MgCl 2 +2H 2 O 4 Fe+S→ FeS 5 Zn+ 2HCl→ZnCl 2 +H 2 6 2NaOH+ H 2 SO 4 →Na 2 SO 4 +2H 2 O Жұптық жұмыс тапсырмасы: Дескриптор: зат формуласы бойынша элементтің тотығу дәрежесін анықтай алады-2 балл

#9 слайд
Топтық жұмыс тапсырмасы
Тотығу - тотықсыздану реакцияларын жазыңдар,
маңызын түсіндіріңдер
Ормандағы өрт
фотосинтез
Металдар коррозиясы
І топ
ІІ топ
ІІІ топ
Дескриптор:
зат формуласы
бойынша
элементтің тотығу
дәрежесін анықтай
алады-2 балл
9 слайд
Топтық жұмыс тапсырмасы Тотығу - тотықсыздану реакцияларын жазыңдар, маңызын түсіндіріңдер Ормандағы өрт фотосинтез Металдар коррозиясы І топ ІІ топ ІІІ топ Дескриптор: зат формуласы бойынша элементтің тотығу дәрежесін анықтай алады-2 балл

#10 слайд
Жеке жұмыс тапсырмасы:
Деңгейлік тапсырмалар
А-деңгей
1.Тотығу тотықсыздану деп қандай реакцияны айтамыз
В-деңгей
1.Мына заттардың қайсылары:
CrO
3
, MnO
2
, KClO
3
, NaI, H
2
O
2
, (NH
4
)
2
S, Cu, Ca
3
P
2
, K
2
CrO
4
, CO
а) тек қана тотықтырғыш;
ә) тек тотықсыздандырғыш;
б) әрі тотықтырғыш, әрі тотықсыздандырғыш бола алады;
С-деңгей
6Fe(OH)
2
+2 KMnO
4
+ 4 H
2
O
→ 6Fe (OH)
3
+ 2KOH + 2MnO
2
Мына реакция теңдеуінде тотықтырғыш пен
тотықсыздандырғышты анықта және тотығу дәрежелерін
көрсет Дескриптор:
А деңгей-1 балл
В деңгей-2 балл
С деңгей -3 балл
10 слайд
Жеке жұмыс тапсырмасы: Деңгейлік тапсырмалар А-деңгей 1.Тотығу тотықсыздану деп қандай реакцияны айтамыз В-деңгей 1.Мына заттардың қайсылары: CrO 3 , MnO 2 , KClO 3 , NaI, H 2 O 2 , (NH 4 ) 2 S, Cu, Ca 3 P 2 , K 2 CrO 4 , CO а) тек қана тотықтырғыш; ә) тек тотықсыздандырғыш; б) әрі тотықтырғыш, әрі тотықсыздандырғыш бола алады; С-деңгей 6Fe(OH) 2 +2 KMnO 4 + 4 H 2 O → 6Fe (OH) 3 + 2KOH + 2MnO 2 Мына реакция теңдеуінде тотықтырғыш пен тотықсыздандырғышты анықта және тотығу дәрежелерін көрсет Дескриптор: А деңгей-1 балл В деңгей-2 балл С деңгей -3 балл
#11 слайд
ЕББҚ-тапсырма:
химиялық диктант
Тотығу - ........... процесі ең кеңінен тараған және теориямен практикада маңызды роль атқаратын ....... болып
табылады. Тірі ............жүретін зат алмасу, шіру, ашу, фотосинтез .......... тығыз байланысты.
1-10балл
11 слайд
ЕББҚ-тапсырма: химиялық диктант Тотығу - ........... процесі ең кеңінен тараған және теориямен практикада маңызды роль атқаратын ....... болып табылады. Тірі ............жүретін зат алмасу, шіру, ашу, фотосинтез .......... тығыз байланысты. 1-10балл

#12 слайд
Үйге тапсырма: Тотығу- тотықсыздану реакциялары,№5 тапсырма
12 слайд
Үйге тапсырма: Тотығу- тотықсыздану реакциялары,№5 тапсырма

шағым қалдыра аласыз
















