Кальций және магний қосылыстары
Кальций және магний қосылыстары


#1 слайд
І.Ұйымдастыру
1 слайд
І.Ұйымдастыру

#2 слайд
2 слайд

#3 слайд
3 слайд

#4 слайд
4 слайд

#5 слайд
5 слайд

#6 слайд
•
Магний Мg ІІІ периодтың ІІ топтың негізгі топша
элементі
•
атомдық номері 12. Ядро санында12 протон ы бар
элемент
•
Мr-24г/моль Тотығу дәрежесі 0 +2
•
р-1,74 г/см 3
• t
балқу -651 0
с t
қайнау -1096 0
с
•
Мg-күмістей ақ түсті жеңіл, ауада оңай тотығып,
жарқырап жанады, тығыз оксид қабатпен
қапталатын металл.
6 слайд
• Магний Мg ІІІ периодтың ІІ топтың негізгі топша элементі • атомдық номері 12. Ядро санында12 протон ы бар элемент • Мr-24г/моль Тотығу дәрежесі 0 +2 • р-1,74 г/см 3 • t балқу -651 0 с t қайнау -1096 0 с • Мg-күмістей ақ түсті жеңіл, ауада оңай тотығып, жарқырап жанады, тығыз оксид қабатпен қапталатын металл.
#7 слайд
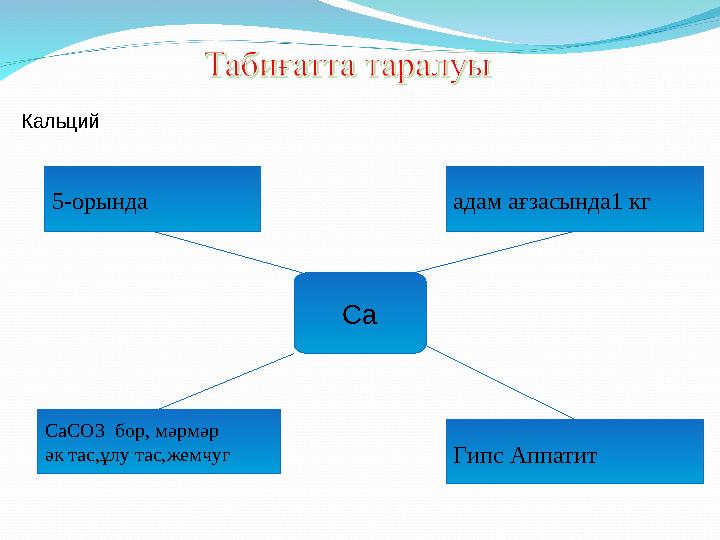
Кальций
5-орында адам ағзасында1 кг
Са
СаСО3 бор, мәрмәр
әк тас,ұлу тас,жемчуг
Гипс Аппатит
7 слайд
Кальций 5-орында адам ағзасында1 кг Са СаСО3 бор, мәрмәр әк тас,ұлу тас,жемчуг Гипс Аппатит
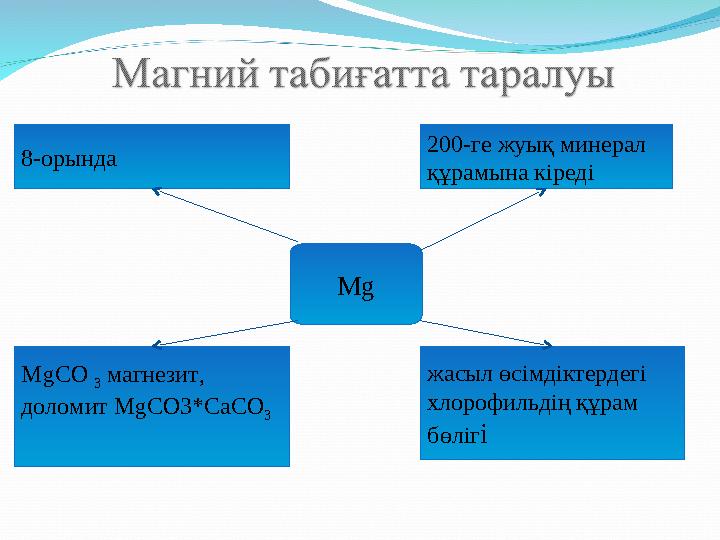
#8 слайд
8-орында 200-ге жуық минерал
құрамына кіреді
Мg
МgСО
3 магнезит,
доломит МgСО3*СаСО
3 жасыл өсімдіктердегі
хлорофильдің құрам
бөліг і
8 слайд
8-орында 200-ге жуық минерал құрамына кіреді Мg МgСО 3 магнезит, доломит МgСО3*СаСО 3 жасыл өсімдіктердегі хлорофильдің құрам бөліг і

#9 слайд
Кальций химиялық қасиеті
1.Жай заттармен әрекеттеседі
Са+Н
2 –СаН
2 кальций гидриді
Са+S—CaS кальций сульфиді
2.Күрделі заттармен әрекеттеседі Сумен бөлме температурасында оңай
әрекеттеседі
Са+Н
2 О –Са(ОН)
2 +Н
2
3.СаО-сөндірілмеген әк тас,негіздік оксид карбанатының айырылу арқылы
алады
СаСО
3 --------- СаО +СО
2
Кальций карбиді СаС
2 -түссіз кристалдық зат СаО мен кокстен электр
пешінде алады
СаО+С-- СаС
2 + СО
2
Көп жылу бөліне отырып сумен әрекеттеседі
СаС2 + Н
2 О-- Са(ОН)
2 + С
2 Н
2
9 слайд
Кальций химиялық қасиеті 1.Жай заттармен әрекеттеседі Са+Н 2 –СаН 2 кальций гидриді Са+S—CaS кальций сульфиді 2.Күрделі заттармен әрекеттеседі Сумен бөлме температурасында оңай әрекеттеседі Са+Н 2 О –Са(ОН) 2 +Н 2 3.СаО-сөндірілмеген әк тас,негіздік оксид карбанатының айырылу арқылы алады СаСО 3 --------- СаО +СО 2 Кальций карбиді СаС 2 -түссіз кристалдық зат СаО мен кокстен электр пешінде алады СаО+С-- СаС 2 + СО 2 Көп жылу бөліне отырып сумен әрекеттеседі СаС2 + Н 2 О-- Са(ОН) 2 + С 2 Н 2

#10 слайд
1.Жай заттармен әрекеттеседі
Mg +О
2 – MgO Магний оксиді
Mg +S— Mg S Магний сульфиді
2.Күрделі заттармен әрекеттеседі
Mg +Н
2 О – Mg О +Н
2
Mg+SIO
2 – MgO+SI
3.Магний көмір қышқыл газында жанады
Mg +СО
2 – MgO+C
Mg +СО
2 – MgO+CO
Нағыз металл ретінде қышқылдармен әрекеттеседі
Mg +НСІ-- Mg СІ
2 + Н
2
Магнезия Mg О-негіздік оксид магний карбанатын термиялық айырып алады
Mg СО
3 -800- Mg О + СО2
10 слайд
1.Жай заттармен әрекеттеседі Mg +О 2 – MgO Магний оксиді Mg +S— Mg S Магний сульфиді 2.Күрделі заттармен әрекеттеседі Mg +Н 2 О – Mg О +Н 2 Mg+SIO 2 – MgO+SI 3.Магний көмір қышқыл газында жанады Mg +СО 2 – MgO+C Mg +СО 2 – MgO+CO Нағыз металл ретінде қышқылдармен әрекеттеседі Mg +НСІ-- Mg СІ 2 + Н 2 Магнезия Mg О-негіздік оксид магний карбанатын термиялық айырып алады Mg СО 3 -800- Mg О + СО2

#11 слайд
Алынуы
Әкті су-мөлдір ертіндісі . Лаборатоияда СО
2 анықтау
үшін пайдаланады.
Са(ОН)
2 +СО
2 ----СаСО
3 +Н
2 О
11 слайд
Алынуы Әкті су-мөлдір ертіндісі . Лаборатоияда СО 2 анықтау үшін пайдаланады. Са(ОН) 2 +СО 2 ----СаСО 3 +Н 2 О

#12 слайд
Алынуы
•
Магний хлоридінің балқындысын 750 0
С
электролиздеп алады
MgСІ
2 ----------Mg+СІ
2
12 слайд
Алынуы • Магний хлоридінің балқындысын 750 0 С электролиздеп алады MgСІ 2 ----------Mg+СІ 2
#13 слайд
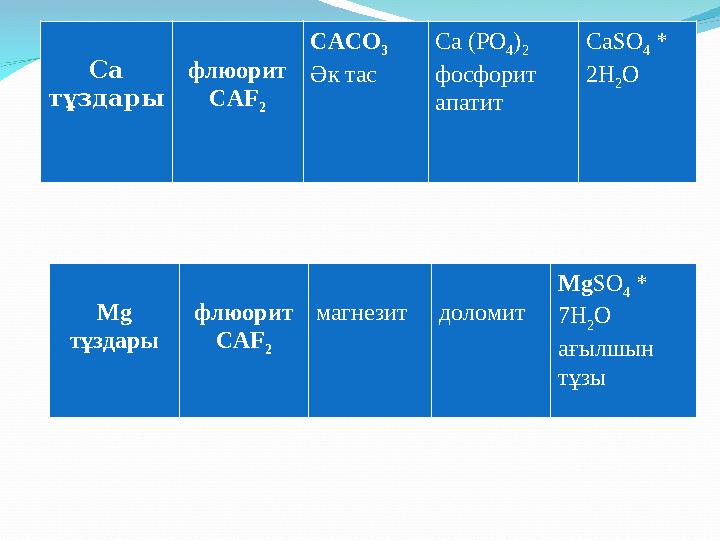
Са
тұздары флюорит
САF
2 CACO
3
Әк тас Са (РО
4 )
2
фосфорит
апатит СаSO
4 *
2H
2 O
Mg
тұздары флюорит
САF
2 магнезит доломит Mg SO
4 *
7H
2 O
ағылшын
тұзы
13 слайд
Са тұздары флюорит САF 2 CACO 3 Әк тас Са (РО 4 ) 2 фосфорит апатит СаSO 4 * 2H 2 O Mg тұздары флюорит САF 2 магнезит доломит Mg SO 4 * 7H 2 O ағылшын тұзы

#14 слайд
Са СаO Са(ОН)2 СаCL2
Mg MgO MgSO 4 Mg ( NO 3) 2
Мына айналуларды жүзеге асыр
14 слайд
Са СаO Са(ОН)2 СаCL2 Mg MgO MgSO 4 Mg ( NO 3) 2 Мына айналуларды жүзеге асыр

#15 слайд
15 слайд

#16 слайд
16 слайд

#17 слайд
17 слайд

#18 слайд
18 слайд

#19 слайд
19 слайд

#20 слайд
20 слайд

#21 слайд
21 слайд

#22 слайд
22 слайд

#23 слайд
23 слайд

#24 слайд
24 слайд

#25 слайд
25 слайд

#26 слайд
26 слайд

#27 слайд
27 слайд

#28 слайд
28 слайд

шағым қалдыра аласыз
















