Көмірсутектер
Көмірсутектер


#1 слайд
«Химия пәнін оқытуда оқушылардың
жаратылыстану сауаттылығын
арттыру мақсатында PIZA
тапсырмаларын және күрделі есептерді
шығару жолдары
№ 20 ЖОББМ химия пәнінің мұғалімі
Абдулова Сымбат Максимовна
1 слайд
«Химия пәнін оқытуда оқушылардың жаратылыстану сауаттылығын арттыру мақсатында PIZA тапсырмаларын және күрделі есептерді шығару жолдары № 20 ЖОББМ химия пәнінің мұғалімі Абдулова Сымбат Максимовна

#2 слайд
Мақсаты:
Оқушылардың ғылыми - жаратылыстану сауаттылығын дамыту
мақсатында PISA бағдарламасы тапсырмаларын орындау арқылы , алған
білімдерін күнделікті өмірде пайдалану дағдысын қалыптастыру .
Міндеттері:
– пәндік біліктіліктері мен дағдыларын жетілдіру;
– дарынды балалардың оқу мотивациясын арттыру;
– ақыл-ой қабілеттерін және зерек ойлылықты дамыту;
– өзін-өзі бақылай алу, өзін-өзі бағалау дағдыларын меңгеру;
– ізденушілік және өз бетінше білім алу әрекеттерін дамыту.
2 слайд
Мақсаты: Оқушылардың ғылыми - жаратылыстану сауаттылығын дамыту мақсатында PISA бағдарламасы тапсырмаларын орындау арқылы , алған білімдерін күнделікті өмірде пайдалану дағдысын қалыптастыру . Міндеттері: – пәндік біліктіліктері мен дағдыларын жетілдіру; – дарынды балалардың оқу мотивациясын арттыру; – ақыл-ой қабілеттерін және зерек ойлылықты дамыту; – өзін-өзі бақылай алу, өзін-өзі бағалау дағдыларын меңгеру; – ізденушілік және өз бетінше білім алу әрекеттерін дамыту.

#3 слайд
Жаратылыстану бағытындағы PISA зерттеулерінің әдісімен тест
тапсырмаларын жоспарлау кезінде ең алдымен оқушының оқу
сауаттылығының құзыреттілігін ескеру керек. Олар:
1.Табу және алу:
•
мәтінді көзбен жүгірту;
•
басты элементтерін анықтау;
•
ізденіс аймағын тарылту;
•
қажет ақпаратты айыру.
2. Түсіндіру және ықпал ету:
мәтіндегі ақпарат элементтерін бірге байланыстыру;
мәтіннен автор тезистерін дәлелейтін дәлелдер табу;
автор ой түйінінен қорытынды шығару;
мәтіндегі басты ой немесе автор ойы туралы қорытынды жасау.
3. Зерделеу және бағалау:
o
басқа ақпарат көздерінен алған біліммен мәтіннен алған ақпаратты
байланыстыру;
o
әлем туралы өзінің көзқарастарымен мәтінде берілген пікірді салыстыру;
o
автормен ішкі диалог жүргізу: өз көзқарастары мен автор көзқарасын
қорғауда дәлелдер іздеу.
3 слайд
Жаратылыстану бағытындағы PISA зерттеулерінің әдісімен тест тапсырмаларын жоспарлау кезінде ең алдымен оқушының оқу сауаттылығының құзыреттілігін ескеру керек. Олар: 1.Табу және алу: • мәтінді көзбен жүгірту; • басты элементтерін анықтау; • ізденіс аймағын тарылту; • қажет ақпаратты айыру. 2. Түсіндіру және ықпал ету: мәтіндегі ақпарат элементтерін бірге байланыстыру; мәтіннен автор тезистерін дәлелейтін дәлелдер табу; автор ой түйінінен қорытынды шығару; мәтіндегі басты ой немесе автор ойы туралы қорытынды жасау. 3. Зерделеу және бағалау: o басқа ақпарат көздерінен алған біліммен мәтіннен алған ақпаратты байланыстыру; o әлем туралы өзінің көзқарастарымен мәтінде берілген пікірді салыстыру; o автормен ішкі диалог жүргізу: өз көзқарастары мен автор көзқарасын қорғауда дәлелдер іздеу.

#4 слайд
Оқушының оқу сауаттылығының құзыреттілігін ескере отырып, тест
тапсырмаларын беру керек және төмендегі функционалдық сауаттылық
ерекшеліктерін де ескерген жөн:
жаратылыстанудың негізгі ерекшеліктерін адами таным мен зерттеу
формасы ретінде түсіну қабілеттілігі;
жаратылыстану ғылымдары мен технологияның материалдық,
интеллектуалдық және мәдени салаға әсер ететіндігі туралы білімді көрсету;
мектепте алған білімді түрлі өмірлік жағдайларда қолдана алу қабілеттігі,
қойылған мәселелерді ғылыми әдістермен шешу, ақпараттың түрлі
көздерімен жұмыс жасай және оны сыни тұрғыдан бағалай алу;
эксперимент тәжірибелер жасау, болжамдар келтіру және қолдайтын немесе
жоққа шығаратын зерттеулер өткізу, айтылған көзқарасқа қарсы шығу
немесе оны негіздеу .
Б елсенді оқыту әдістері мен логикалық тапсырмалар оқушының ой–өрісін
кеңейтеді, өмірлік тәжірибеде қолданады нақты бір жағдайға нақты
модельдерді қолданудың нәтижесінде оқушыларды әлеуметтендірудің қажетті
талаптары болып саналатын функционалды ғылыми-жаратылыстану
сауаттылық бағытын қалыптастыру
4 слайд
Оқушының оқу сауаттылығының құзыреттілігін ескере отырып, тест тапсырмаларын беру керек және төмендегі функционалдық сауаттылық ерекшеліктерін де ескерген жөн: жаратылыстанудың негізгі ерекшеліктерін адами таным мен зерттеу формасы ретінде түсіну қабілеттілігі; жаратылыстану ғылымдары мен технологияның материалдық, интеллектуалдық және мәдени салаға әсер ететіндігі туралы білімді көрсету; мектепте алған білімді түрлі өмірлік жағдайларда қолдана алу қабілеттігі, қойылған мәселелерді ғылыми әдістермен шешу, ақпараттың түрлі көздерімен жұмыс жасай және оны сыни тұрғыдан бағалай алу; эксперимент тәжірибелер жасау, болжамдар келтіру және қолдайтын немесе жоққа шығаратын зерттеулер өткізу, айтылған көзқарасқа қарсы шығу немесе оны негіздеу . Б елсенді оқыту әдістері мен логикалық тапсырмалар оқушының ой–өрісін кеңейтеді, өмірлік тәжірибеде қолданады нақты бір жағдайға нақты модельдерді қолданудың нәтижесінде оқушыларды әлеуметтендірудің қажетті талаптары болып саналатын функционалды ғылыми-жаратылыстану сауаттылық бағытын қалыптастыру

#5 слайд
№ 1 тапсырма.
Біздің дәуірімізге дейінгі 680 жыл теңіз соғысында арабтарға қарсы
византиялықтар тұңғыш рет жаңа өте күшті қару – «грек оты»
пайдаланды. «Грек оты» - бұл бейметалл. Ол ауада тұншықтырғыш және
өткір газ бөле, көгілдір жалын түзе жанады. Концентрлі азот қышқылымен
өңдегенде күкірт қышқылына айналады. Бұл бейметалл натрий
сульфитімен әрекеттескенде натрий тиосульфаты түзіледі. Бұл қандай
бейметалл екенін тауып, мәтінде келтірілген реакция теңдеулерін
жазыңдар:
Шешуі:
Реакция теңдеулері:
S + O
2 = SO
2 ( 1 )
SO
2 + 2 HNO
3 ( конц ) → H
2 SO
4 + 2 NO
2 ( 2 )
S + Na
2 SO
3 = Na
2 S
2 O
3 ( 3 )
5 слайд
№ 1 тапсырма. Біздің дәуірімізге дейінгі 680 жыл теңіз соғысында арабтарға қарсы византиялықтар тұңғыш рет жаңа өте күшті қару – «грек оты» пайдаланды. «Грек оты» - бұл бейметалл. Ол ауада тұншықтырғыш және өткір газ бөле, көгілдір жалын түзе жанады. Концентрлі азот қышқылымен өңдегенде күкірт қышқылына айналады. Бұл бейметалл натрий сульфитімен әрекеттескенде натрий тиосульфаты түзіледі. Бұл қандай бейметалл екенін тауып, мәтінде келтірілген реакция теңдеулерін жазыңдар: Шешуі: Реакция теңдеулері: S + O 2 = SO 2 ( 1 ) SO 2 + 2 HNO 3 ( конц ) → H 2 SO 4 + 2 NO 2 ( 2 ) S + Na 2 SO 3 = Na 2 S 2 O 3 ( 3 )

#6 слайд
№ 2 тапсырма.
ТТР өндірісте, тұрмыста жүзеге асып жататын процестер: газ пеште газдың
жануы, тамақ пісіру, кір жуу, үй заттарын тазарту, аяқ-киім, парфюмериялық заттар
дайындау, тоқыма бұйымдарын тазалау т.с.с. Сіріңке жақсақ, аспанға фейерверк атсақ
– бәрі де тотығу- тотықсыздану процестері. Ағартуға, дезинфекциялауға, сутек асқын
тотығының, калий перманганатының, хлор немесе хлорлы ағартқыш ізбестің
тотықтырғыш қасиеттері қолданылады. Заттың бетін тазартуға сутегі асқын тотығы
қолданылады. Ол, сонымен қатар, жібекті, жүнді ағарта алады. Ескі картиналарды
қалпына келтіреді. Ағзаға зиянсыз болғандықтан тамақ өнеркәсібінде шоколадты,
сосиска дайындайтын етті ағартуға қолданылады. Калий перманганатының
дезинфекциялағыш қасиеті де тотықтырғыш қасиетіне негізделген. Хлорды күшті
тотықтырғыш ретінде таза суды стерильдеуге және ағын суларды залалсыздандыруға
қолданады. Хлор көптеген бояуларды түссіздендіріп, ағартады. Сондықтан оны мата
мен қағазды ағартуға қолданады. Табиғатта ТТР кеңінен таралған. Ол биохимиялық
процестерде: тыныс алу, зат алмасу, жануарлар мен адамдардың жүйке қызметінде
маңызды роль атқарады. ТТР нәтижесінде біздің ағзамыз тамақтан алатын энергияны
жұмсау арқылы адамның іс-әрекеттері жүзеге асырылып жатады.
Сұрақ 1: ТТР- реакцияға қатысушы заттардың құрамындағы элементі тотығу
дәрежелерінің өзгеруімен жүретін реакциялар . Бұл әдіс реакция жүрген ортаның
табиғатына байланысты. Себебі.....
6 слайд
№ 2 тапсырма. ТТР өндірісте, тұрмыста жүзеге асып жататын процестер: газ пеште газдың жануы, тамақ пісіру, кір жуу, үй заттарын тазарту, аяқ-киім, парфюмериялық заттар дайындау, тоқыма бұйымдарын тазалау т.с.с. Сіріңке жақсақ, аспанға фейерверк атсақ – бәрі де тотығу- тотықсыздану процестері. Ағартуға, дезинфекциялауға, сутек асқын тотығының, калий перманганатының, хлор немесе хлорлы ағартқыш ізбестің тотықтырғыш қасиеттері қолданылады. Заттың бетін тазартуға сутегі асқын тотығы қолданылады. Ол, сонымен қатар, жібекті, жүнді ағарта алады. Ескі картиналарды қалпына келтіреді. Ағзаға зиянсыз болғандықтан тамақ өнеркәсібінде шоколадты, сосиска дайындайтын етті ағартуға қолданылады. Калий перманганатының дезинфекциялағыш қасиеті де тотықтырғыш қасиетіне негізделген. Хлорды күшті тотықтырғыш ретінде таза суды стерильдеуге және ағын суларды залалсыздандыруға қолданады. Хлор көптеген бояуларды түссіздендіріп, ағартады. Сондықтан оны мата мен қағазды ағартуға қолданады. Табиғатта ТТР кеңінен таралған. Ол биохимиялық процестерде: тыныс алу, зат алмасу, жануарлар мен адамдардың жүйке қызметінде маңызды роль атқарады. ТТР нәтижесінде біздің ағзамыз тамақтан алатын энергияны жұмсау арқылы адамның іс-әрекеттері жүзеге асырылып жатады. Сұрақ 1: ТТР- реакцияға қатысушы заттардың құрамындағы элементі тотығу дәрежелерінің өзгеруімен жүретін реакциялар . Бұл әдіс реакция жүрген ортаның табиғатына байланысты. Себебі.....

#7 слайд
І нұсқасы (сілтілік орта)
KMnО
4 +Na
2 SO
3 +KOH K
2 MnO
4 +Na
2 SO
4 + H
2 O
+7 +4 +6 +6
KMnО
4 +Na
2 SO
3 +KOH K
2 MnO
4 +Na
2 SO
4 + H
2 O
Mn +7
+ 1ē Mn +6
2
S +4
- 2ē S +6
1
2 KMnО
4 +Na
2 SO
3 + 2 KOH 2 K
2 MnO
4 +Na
2 SO
4 + H
2 O
Ерітінді күлгін түстен жасыл түске өзгереді
7 слайд
І нұсқасы (сілтілік орта) KMnО 4 +Na 2 SO 3 +KOH K 2 MnO 4 +Na 2 SO 4 + H 2 O +7 +4 +6 +6 KMnО 4 +Na 2 SO 3 +KOH K 2 MnO 4 +Na 2 SO 4 + H 2 O Mn +7 + 1ē Mn +6 2 S +4 - 2ē S +6 1 2 KMnО 4 +Na 2 SO 3 + 2 KOH 2 K 2 MnO 4 +Na 2 SO 4 + H 2 O Ерітінді күлгін түстен жасыл түске өзгереді

#8 слайд
ІІ нұсқасы (қышқылдық орта)
KMnО
4 +Na
2 SO
3 +H
2 SO
4 MnSO
4 + Na
2 SO
4 + К
2 SO
4 + H
2 O
+7 +4 +2 +6
KMnО
4 +Na
2 SO
3 +H
2 SO
4 MnSO
4 + Na
2 SO
4 + К
2 SO
4 + H
2 O
Mn +7
+ 5ē Mn +2
2
S +4
- 2ē S +6
5
2 KMnО
4 + 5 Na
2 SO
3 + 3 H
2 SO
4 2 MnSO
4 + 5 Na
2 SO
4 + К
2 SO
4 + 3 H
2 O
Ерітінді күлгін түстен түссізге өзгереді
8 слайд
ІІ нұсқасы (қышқылдық орта) KMnО 4 +Na 2 SO 3 +H 2 SO 4 MnSO 4 + Na 2 SO 4 + К 2 SO 4 + H 2 O +7 +4 +2 +6 KMnО 4 +Na 2 SO 3 +H 2 SO 4 MnSO 4 + Na 2 SO 4 + К 2 SO 4 + H 2 O Mn +7 + 5ē Mn +2 2 S +4 - 2ē S +6 5 2 KMnО 4 + 5 Na 2 SO 3 + 3 H 2 SO 4 2 MnSO 4 + 5 Na 2 SO 4 + К 2 SO 4 + 3 H 2 O Ерітінді күлгін түстен түссізге өзгереді

#9 слайд
ІІІ нұсқасы (бейтарап орта)
KMnО
4 +Na
2 SO
3 +H
2 O MnO
2 + Na
2 SO
4 + КOН
+7 +4 +4 +6
KMnО
4 +Na
2 SO
3 +H
2 O MnO
2 + Na
2 SO
4 + КOН
Mn +7
+ 3ē Mn +4
2
S +4
- 2ē S +6
3
2 KMnО
4 + 3 Na
2 SO
3 + H
2 O 2 MnO
2 + 3 Na
2 SO
4 + 2 КOН
Ерітінді күлгін түстен солғын сары түске өзгереді,
Соңынан қоңыр тұнба түзіледі
9 слайд
ІІІ нұсқасы (бейтарап орта) KMnО 4 +Na 2 SO 3 +H 2 O MnO 2 + Na 2 SO 4 + КOН +7 +4 +4 +6 KMnО 4 +Na 2 SO 3 +H 2 O MnO 2 + Na 2 SO 4 + КOН Mn +7 + 3ē Mn +4 2 S +4 - 2ē S +6 3 2 KMnО 4 + 3 Na 2 SO 3 + H 2 O 2 MnO 2 + 3 Na 2 SO 4 + 2 КOН Ерітінді күлгін түстен солғын сары түске өзгереді, Соңынан қоңыр тұнба түзіледі

#10 слайд
№ 3 тапсырма.
Каталиторлық конвертер
Айрықша замандас көлік маркалары пайдаланылған газды адам мен қоршаған орта
үшін зияны аз болуы үшін каталиторлық конвертерлермен жабдықталған.. 90%-ға
жуық зиянды пайдаланылған газдар одан әлдеқайда зияны кем газға айналады.
Төменде конвертерге түсетін және одан шығатын бірнеше газдың түрлері келтірілген.
Сұрақ : Берілген суреттегі ақпаратты қолданып, конвертердегі пайдаланылған
газдың зиянын қалай азайтатынына мысал келтіріңіз.
Көміртегі моноксидінің немесе азот оксидінің басқа қосындыларға айналуы
аталған. Көміртегі моноксиді көміртегі диоксидіне айналған.
·
Азот оксиді азотқа айналады.
·
Ол зиянда газдарды зиянсызға айналдырады:
·
CO-ны CO2 –ға (90%).
·
Көміртегі диоксиді мен азот - көміртегі моноксиді мен азот оксиді сияқты зиян
емес.
10 слайд
№ 3 тапсырма. Каталиторлық конвертер Айрықша замандас көлік маркалары пайдаланылған газды адам мен қоршаған орта үшін зияны аз болуы үшін каталиторлық конвертерлермен жабдықталған.. 90%-ға жуық зиянды пайдаланылған газдар одан әлдеқайда зияны кем газға айналады. Төменде конвертерге түсетін және одан шығатын бірнеше газдың түрлері келтірілген. Сұрақ : Берілген суреттегі ақпаратты қолданып, конвертердегі пайдаланылған газдың зиянын қалай азайтатынына мысал келтіріңіз. Көміртегі моноксидінің немесе азот оксидінің басқа қосындыларға айналуы аталған. Көміртегі моноксиді көміртегі диоксидіне айналған. · Азот оксиді азотқа айналады. · Ол зиянда газдарды зиянсызға айналдырады: · CO-ны CO2 –ға (90%). · Көміртегі диоксиді мен азот - көміртегі моноксиді мен азот оксиді сияқты зиян емес.

#11 слайд
Математикалық
сауаттылық
аспектісі Білімнің атауы, сабақ тақырыбы
Мазмұндық салалар Химия пәнінде алгебраны пайдаланамыз (есептер шығаруда формула,
теңдеу; қоспалар тақырыбында тіпті жүйе пайдаланып есептер
шығарылады);
Органикалық химияда геометрия пайдаланамыз (кеңстіктік изомерия
құбылысын түсіндіруде)
Тұжырымдамалық
шеңбер Химия пәнінде математикалық тұрғыдан тұжырымдар пайдаланамыз,
себебі нақты математикалық фактілер, пайымдаулар қажет
Ойлау процесстері Химия және математика пәндері күрделі пәндер болғандықтан, терең
ойлауды, терең білімді қажет етеді. Кез келген тапсырмалардың
мазмұнын, мәнмәтінін даярлауда оқушының ойлау процестері
тұрғысынан қарастыруды ұмытпауымыз абзалМатематиканың шынайы өмірмен байланысы: Математика ғылымы өмірмен
байланысты қиын және өте қызық пән екендігімен ерекше. Математика ең алғаш
пайда болған ғылымдардың бірі. Мысалы, күнтізбе жасау, құрылыс жүргізу, әртүрлі
ыдыстардың көлемін өлшеу, теңізде жүзу т.б математикалық сауаттылықты талап
етеді. Әр түрлі әдіс-тәсілдермен әрі өмірмен байланыстыра өтілген әр сабақ оқушы
санасына қонымды, әрі кейінгі өміріне азық болары сөзсіз. Математика біздің
өмірімізді тәртіпке келтіреді.
11 слайд
Математикалық сауаттылық аспектісі Білімнің атауы, сабақ тақырыбы Мазмұндық салалар Химия пәнінде алгебраны пайдаланамыз (есептер шығаруда формула, теңдеу; қоспалар тақырыбында тіпті жүйе пайдаланып есептер шығарылады); Органикалық химияда геометрия пайдаланамыз (кеңстіктік изомерия құбылысын түсіндіруде) Тұжырымдамалық шеңбер Химия пәнінде математикалық тұрғыдан тұжырымдар пайдаланамыз, себебі нақты математикалық фактілер, пайымдаулар қажет Ойлау процесстері Химия және математика пәндері күрделі пәндер болғандықтан, терең ойлауды, терең білімді қажет етеді. Кез келген тапсырмалардың мазмұнын, мәнмәтінін даярлауда оқушының ойлау процестері тұрғысынан қарастыруды ұмытпауымыз абзалМатематиканың шынайы өмірмен байланысы: Математика ғылымы өмірмен байланысты қиын және өте қызық пән екендігімен ерекше. Математика ең алғаш пайда болған ғылымдардың бірі. Мысалы, күнтізбе жасау, құрылыс жүргізу, әртүрлі ыдыстардың көлемін өлшеу, теңізде жүзу т.б математикалық сауаттылықты талап етеді. Әр түрлі әдіс-тәсілдермен әрі өмірмен байланыстыра өтілген әр сабақ оқушы санасына қонымды, әрі кейінгі өміріне азық болары сөзсіз. Математика біздің өмірімізді тәртіпке келтіреді.

#12 слайд
Химиялық есептерді сәтті (түсініп,оның маңызын біліп) шешу үшін:
1. Осы типтегі есептерді шешудің әдіс-тәсілдерін;
2. Есептің шартында қарастырылып отырған заттардың химиялық қасиеттері
жайлы білімдерді меңгеру қажет.
Есептерді шешу мына алгоритмге негізделген:
1. Есептің шартын мұқият оқып, оның мағынасын түсінуге тырысу;
2. Есептің химиялық бөлігін орындауға тырысу. Шамалардың жалпы
қолданылып жүрген белгілерін пайдаланып, есептің шартын жазу. Қосымша
мәліметтерді жазып алу, есепті сараптап оны шығару жоспарын жасау;
3. Есепті шығарудың ең тиімді тәсілін таңдап алу;
4. Қажетті есептеулер жүргізу;
5. Есептің жауабын жазу;
6. Алынған нәтижені тексеру.
Есеп шығару барысында оқушыларда еңбекқорлық, жауапкершілік сезімі,
қойылған мақсатқа ұмтылу және оған табандылықпен жету қасиеттері
дамиды. Өз бетінше есепті меңгеруге және оны шығаруға дағдыланады.
12 слайд
Химиялық есептерді сәтті (түсініп,оның маңызын біліп) шешу үшін: 1. Осы типтегі есептерді шешудің әдіс-тәсілдерін; 2. Есептің шартында қарастырылып отырған заттардың химиялық қасиеттері жайлы білімдерді меңгеру қажет. Есептерді шешу мына алгоритмге негізделген: 1. Есептің шартын мұқият оқып, оның мағынасын түсінуге тырысу; 2. Есептің химиялық бөлігін орындауға тырысу. Шамалардың жалпы қолданылып жүрген белгілерін пайдаланып, есептің шартын жазу. Қосымша мәліметтерді жазып алу, есепті сараптап оны шығару жоспарын жасау; 3. Есепті шығарудың ең тиімді тәсілін таңдап алу; 4. Қажетті есептеулер жүргізу; 5. Есептің жауабын жазу; 6. Алынған нәтижені тексеру. Есеп шығару барысында оқушыларда еңбекқорлық, жауапкершілік сезімі, қойылған мақсатқа ұмтылу және оған табандылықпен жету қасиеттері дамиды. Өз бетінше есепті меңгеруге және оны шығаруға дағдыланады.

#13 слайд
№ 4 тапсырма.
Массасы 2,1 г магний мен алюминийден тұратын қоспа тұз қышқылымен
әрекеттескенде 2,24л (қ.ж.) сутек бөлінген. Бастапқы қоспаның құрамы
қандай?
Шешуі:
Мg+2HC l =MgC l
2 +H
2
2A l +6HC l =2ALC l
3 +3H
2
n (Н2) ═ 2,24 / 22,4 = 0,1
24х + 54 у = 2,1
х + 3у = 0,1 х = 0,1 – 3 у
2,4 – 72у + 54у = 2,1
18у = 0,3
у = 0,0167
х = 0,05
m ( Mg ) = 0.0 5 * 24 = 1 .2
ⱳ ( Mg ) = 1 .2 / 2,1 * 100 % = 57,14 %
ⱳ ( Al ) = 100 – 57 , 14 = 42,86 %
Бұл есепті шығаруда жүйе, формула, теңдеу және алгебралық есептеуді
пайдаландық.
13 слайд
№ 4 тапсырма. Массасы 2,1 г магний мен алюминийден тұратын қоспа тұз қышқылымен әрекеттескенде 2,24л (қ.ж.) сутек бөлінген. Бастапқы қоспаның құрамы қандай? Шешуі: Мg+2HC l =MgC l 2 +H 2 2A l +6HC l =2ALC l 3 +3H 2 n (Н2) ═ 2,24 / 22,4 = 0,1 24х + 54 у = 2,1 х + 3у = 0,1 х = 0,1 – 3 у 2,4 – 72у + 54у = 2,1 18у = 0,3 у = 0,0167 х = 0,05 m ( Mg ) = 0.0 5 * 24 = 1 .2 ⱳ ( Mg ) = 1 .2 / 2,1 * 100 % = 57,14 % ⱳ ( Al ) = 100 – 57 , 14 = 42,86 % Бұл есепті шығаруда жүйе, формула, теңдеу және алгебралық есептеуді пайдаландық.

#14 слайд
№ 5 тапсырма
4АІ + 3О
2 = 2АІ
2 О
3 реакциядағы оттегінің концентрациясын 3 есе көбейткенде
реакция жылдамдығы ...
А) 27 есе артады
В) 27 есе кемиді
С) 12 есе артады
D) 9 есе кемиді
Е) 9 есе артады
Шешуі: 4АІ + 3О
2 = 2АІ
2 О
3
= κ [3О
2 ] 3
= 3 3
κ[О
2 ] 3
{дұрыс жауабы}= А
14 слайд
№ 5 тапсырма 4АІ + 3О 2 = 2АІ 2 О 3 реакциядағы оттегінің концентрациясын 3 есе көбейткенде реакция жылдамдығы ... А) 27 есе артады В) 27 есе кемиді С) 12 есе артады D) 9 есе кемиді Е) 9 есе артады Шешуі: 4АІ + 3О 2 = 2АІ 2 О 3 = κ [3О 2 ] 3 = 3 3 κ[О 2 ] 3 {дұрыс жауабы}= А
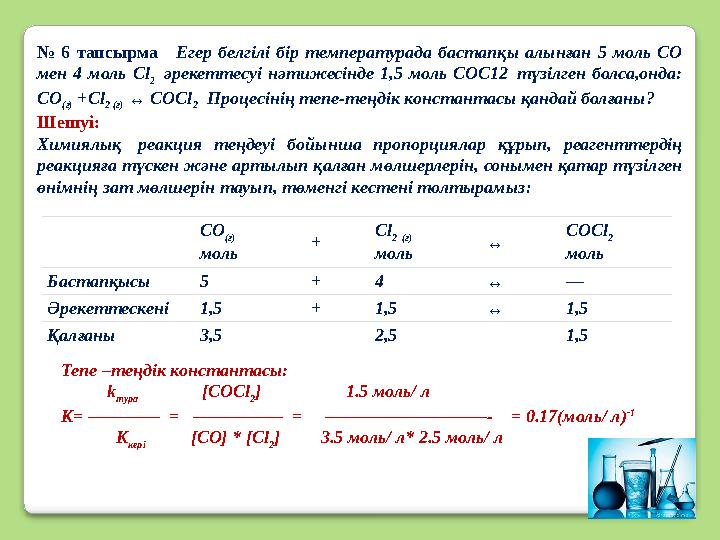
#15 слайд
№ 6 тапсырма Егер белгілі бір температурада бастапқы алынған 5 моль СО
мен 4 моль С l
2 әрекеттесуі нәтижесінде 1,5 моль СОС12 түзілген болса,онда:
СО
(г) +С l
2 ( г) ↔ COCl
2 Процесінің тепе-теңдік константасы қандай болғаны?
Шешуі:
Химиялық реакция теңдеуі бойынша пропорциялар құрып, реагенттердің
реакцияға түскен және артылып қалған мөлшерлерін, сонымен қатар түзілген
өнімнің зат мөлшерін тауып, төменгі кестені толтырамыз :
СО
(г)
моль + С l
2
( г)
моль ↔ COCl
2
моль
Бастапқысы 5 + 4 ↔ —
Әрекеттескені 1,5 + 1,5 ↔ 1,5
Қалғаны 3,5 2,5 1,5
Тепе –теңдік константасы:
k
тура [ COCl
2 ]
1.5 моль/ л
К= ———— = ————— = —————————- = 0.17(моль/ л) -1
K
кері [ CO] * [Cl
2 ] 3.5 моль/ л* 2.5 моль/ л
15 слайд
№ 6 тапсырма Егер белгілі бір температурада бастапқы алынған 5 моль СО мен 4 моль С l 2 әрекеттесуі нәтижесінде 1,5 моль СОС12 түзілген болса,онда: СО (г) +С l 2 ( г) ↔ COCl 2 Процесінің тепе-теңдік константасы қандай болғаны? Шешуі: Химиялық реакция теңдеуі бойынша пропорциялар құрып, реагенттердің реакцияға түскен және артылып қалған мөлшерлерін, сонымен қатар түзілген өнімнің зат мөлшерін тауып, төменгі кестені толтырамыз : СО (г) моль + С l 2 ( г) моль ↔ COCl 2 моль Бастапқысы 5 + 4 ↔ — Әрекеттескені 1,5 + 1,5 ↔ 1,5 Қалғаны 3,5 2,5 1,5 Тепе –теңдік константасы: k тура [ COCl 2 ] 1.5 моль/ л К= ———— = ————— = —————————- = 0.17(моль/ л) -1 K кері [ CO] * [Cl 2 ] 3.5 моль/ л* 2.5 моль/ л

#16 слайд
№ 7 тапсырма.
Егер реакцияның температуралық коэффициенті 3-ке тең болса,
температураны 150 0
С-дан 200 0
С-ға көтергенде, реакцияның жылдамдығы ...
артады
А) 243 есе
В) 245 есе
С) 244 есе
D) 246 есе
Е) 242 есе
Шешуі:
{дұрыс жауабы}= А
16 слайд
№ 7 тапсырма. Егер реакцияның температуралық коэффициенті 3-ке тең болса, температураны 150 0 С-дан 200 0 С-ға көтергенде, реакцияның жылдамдығы ... артады А) 243 есе В) 245 есе С) 244 есе D) 246 есе Е) 242 есе Шешуі: {дұрыс жауабы}= А

#17 слайд
№ 8 тапсырма.
Аммиак синтезі кезінде азот пен сутектің бастапқы концентрациялары 2
моль/л болса, азоттың 20 % - ті жұмсалғаннан кейінгі реакция
жылдамдығымен бастапқы жылдамдығын табыңдар.
Шешуі:
N
2 + 3H
2 = 2NH
3
1 3 2
Әрекеттесуші массалар заңы бойынша:
ϑ = К С(N
2 ) * С 3
(Н
2 ) ϑ
б = К 2 * 2 3
= 16 К
2 моль/л N
2 : 100 %
х моль/л N
2 : 20% х = 0,4 моль/л
С(N
2 ) = С
б - ∆С(N
2 ) = 2 – 0,4 = 1,6 моль/л
1 моль/л N
2 : 3 моль/л Н
2
0,4 моль/л N
2 : х моль/л Н
2 х = 1,2 моль/л
С(Н
2 ) = С
б - ∆С(Н
2 ) = 2 – 1,2 = 0,8 моль/л
ϑ = К 1,6 * 0,8 3
= 0,82 К
17 слайд
№ 8 тапсырма. Аммиак синтезі кезінде азот пен сутектің бастапқы концентрациялары 2 моль/л болса, азоттың 20 % - ті жұмсалғаннан кейінгі реакция жылдамдығымен бастапқы жылдамдығын табыңдар. Шешуі: N 2 + 3H 2 = 2NH 3 1 3 2 Әрекеттесуші массалар заңы бойынша: ϑ = К С(N 2 ) * С 3 (Н 2 ) ϑ б = К 2 * 2 3 = 16 К 2 моль/л N 2 : 100 % х моль/л N 2 : 20% х = 0,4 моль/л С(N 2 ) = С б - ∆С(N 2 ) = 2 – 0,4 = 1,6 моль/л 1 моль/л N 2 : 3 моль/л Н 2 0,4 моль/л N 2 : х моль/л Н 2 х = 1,2 моль/л С(Н 2 ) = С б - ∆С(Н 2 ) = 2 – 1,2 = 0,8 моль/л ϑ = К 1,6 * 0,8 3 = 0,82 К

#18 слайд
№ 9 тапсырма
Мына тепе – теңдік күйінде тұрған жүйедегі N
2(г) + 3H
2(г) ↔ 2NH
3(г) заттардың
концентрациялары төменгідей болса, [N
2 ] = 3 моль/л;[H
2 ] = 9 моль/л;[NH
3 ] = 4
моль/л. Осы реакция үшін тепе – теңдік константасын және азот пен сутегінің
бастапқы концентрацияларын анықтаңдар. Шешуі:
[NH
3 ] 2
4 2
N
2(г) + 3H
2(г) ↔ 2NH
3(г) К = ------------ = ------ = 0 , 0073 = 7,3 *10 -3
1 3 2 [N
2 ] [H
2 ] 3
3* 9 3
1 моль N
2 : 2 моль NH
3
х моль/л N
2 : 4 моль/л NH
3 х = 2 моль/л N
2
∆ С(N
2 ) = 2 моль/л
С
б = (N
2 ) +∆С(N
2 ) = 3 + 2 = 5
С
б (N
2 ) = 5 моль/л
3моль Н
2 : 2 моль NH
3
х моль/л Н
2 : 4моль/л NH
3 х = 6 моль/л
∆ С(Н
2 ) = 6 моль/л
С
б = (Н
2 ) +∆С(Н
2 ) = 9 + 6 = 15
С
б (Н
2 ) = 15 моль/л
18 слайд
№ 9 тапсырма Мына тепе – теңдік күйінде тұрған жүйедегі N 2(г) + 3H 2(г) ↔ 2NH 3(г) заттардың концентрациялары төменгідей болса, [N 2 ] = 3 моль/л;[H 2 ] = 9 моль/л;[NH 3 ] = 4 моль/л. Осы реакция үшін тепе – теңдік константасын және азот пен сутегінің бастапқы концентрацияларын анықтаңдар. Шешуі: [NH 3 ] 2 4 2 N 2(г) + 3H 2(г) ↔ 2NH 3(г) К = ------------ = ------ = 0 , 0073 = 7,3 *10 -3 1 3 2 [N 2 ] [H 2 ] 3 3* 9 3 1 моль N 2 : 2 моль NH 3 х моль/л N 2 : 4 моль/л NH 3 х = 2 моль/л N 2 ∆ С(N 2 ) = 2 моль/л С б = (N 2 ) +∆С(N 2 ) = 3 + 2 = 5 С б (N 2 ) = 5 моль/л 3моль Н 2 : 2 моль NH 3 х моль/л Н 2 : 4моль/л NH 3 х = 6 моль/л ∆ С(Н 2 ) = 6 моль/л С б = (Н 2 ) +∆С(Н 2 ) = 9 + 6 = 15 С б (Н 2 ) = 15 моль/л

#19 слайд
2021-2022 оқу жылында
9 а б в сыныптарында
32 оқушы жаратылыстану-
ғылыми сауаттылы қ бағыты
бойынша дәріс алып отыр
19 слайд
2021-2022 оқу жылында 9 а б в сыныптарында 32 оқушы жаратылыстану- ғылыми сауаттылы қ бағыты бойынша дәріс алып отыр

#20 слайд
№ 10 тапсырма
Берілген мәліметтерге сүйеніп Т = 298 К болғандағы жай заттардан мырыш
сульфатының түзілу жылуын есептеңдер:
ZnS
(қ) = Zn
(қ) + S
(қ) ∆Н˚
1 = 200,5 кДж
2ZnS
(қ) + 3O
2(г) = 2ZnO
(қ) + 2SO
2(г) ∆Н˚
2 = - 893,5 кДж
2SO
2(г) + O
2(г) = 2SO
3(г) ∆Н˚
3 = -198,2 кДж
ZnSO
4
(қ) = ZnO
(қ) + SO
3(г) ∆Н˚
4 = 235,0 кДж
Шешуі:
Алдымен жай заттарды реагентке және мырыш сульфатын өнімге қойып
айналдырып, Г.Гесс заңының төртінші салдарын қолданып шығарамыз:
Реакциялар Түзілу энтальпиясы
1 *
Zn
(қ) + S
(қ) = ZnS
(қ) ∆ Н˚
1 = 200,5 кДж
0,5 *
2ZnS
(қ) + 3O
2(г) = 2ZnO
(қ) + 2SO
2(г) ∆ Н˚
2 = - 893,5 кДж *0,5
0,5 *
2SO
2(г) + O
2(г) = 2SO
3(г) ∆ Н˚
3 = -198,2 кДж *0,5
1 *
ZnO
(қ) + SO
3(г) = ZnSO
4
(қ) ∆ Н˚
4 = 235,0 кДж
Zn
(қ) + S
(қ) + 2O
2(г) = ZnSO
4
(қ) ∆ Н˚
5 =∆Н˚
1 + 0,5*(∆Н˚
2 + ∆Н˚
3 ) + ∆Н˚
4
∆ Н˚
5 = (-200,5) + 0,5*[(-893,5) + (-198,2)] + (-235,0) = -981,35 кДж
20 слайд
№ 10 тапсырма Берілген мәліметтерге сүйеніп Т = 298 К болғандағы жай заттардан мырыш сульфатының түзілу жылуын есептеңдер: ZnS (қ) = Zn (қ) + S (қ) ∆Н˚ 1 = 200,5 кДж 2ZnS (қ) + 3O 2(г) = 2ZnO (қ) + 2SO 2(г) ∆Н˚ 2 = - 893,5 кДж 2SO 2(г) + O 2(г) = 2SO 3(г) ∆Н˚ 3 = -198,2 кДж ZnSO 4 (қ) = ZnO (қ) + SO 3(г) ∆Н˚ 4 = 235,0 кДж Шешуі: Алдымен жай заттарды реагентке және мырыш сульфатын өнімге қойып айналдырып, Г.Гесс заңының төртінші салдарын қолданып шығарамыз: Реакциялар Түзілу энтальпиясы 1 * Zn (қ) + S (қ) = ZnS (қ) ∆ Н˚ 1 = 200,5 кДж 0,5 * 2ZnS (қ) + 3O 2(г) = 2ZnO (қ) + 2SO 2(г) ∆ Н˚ 2 = - 893,5 кДж *0,5 0,5 * 2SO 2(г) + O 2(г) = 2SO 3(г) ∆ Н˚ 3 = -198,2 кДж *0,5 1 * ZnO (қ) + SO 3(г) = ZnSO 4 (қ) ∆ Н˚ 4 = 235,0 кДж Zn (қ) + S (қ) + 2O 2(г) = ZnSO 4 (қ) ∆ Н˚ 5 =∆Н˚ 1 + 0,5*(∆Н˚ 2 + ∆Н˚ 3 ) + ∆Н˚ 4 ∆ Н˚ 5 = (-200,5) + 0,5*[(-893,5) + (-198,2)] + (-235,0) = -981,35 кДж

#21 слайд
Қорытындылай келе, PISA зерттеулерінің әдісімен тест тапсырмаларын
құрастыруда мұғалімнен көп еңбек, терең білімділік, күш-жігер, жан-жақтылық,
ізденімпаздық, жаңа ақпарат көздерін мейлінше тиімді қолдана алатын қажыр-
қайрат талап етіледі. Осы аталған маңызды сипаттар мұғалімнің жан-жақты
ізденістегі шығармашылық тұлғасында тоғысып және де оқу үрдісінде ұтымды
қолданылған жағдайда құзыреттілік қалыптастырудың сапалы да өрелі мақсатына
жетуге өрісті ықпал етпек. Сонда ғана өскелең ұрпаққа сапалы білім алуына дұрыс
бағыт-бағдар беріліп, оқушылардың өмірде таңдайтын кәсіби бағытына жетуде
адастырмайтын жол ашылады әрі елшілдік ұстанымдағы зияткерлік тұлғасын
қалыптастыруға айқындауға жол ашылады деп білеміз.
Функционалдық сауаттылықты қалыптастыратын оқыту мазмұны
төмендегідей мамандықтарға жоғары сынып оқушыларын бейімдеуге икемделеді:
химия, химиялық технология және өндіріс, тұрмыстық химия, экологиялық химия,
медицина және фармакология негіздері, табиғи ресустарды қорғау, нанотехнология
бағыттары бойынша оқушыларды бейіналды және дайындау. Оқушының PISA
зерттеулерінің әдісімен тест тапсырмаларын орындаудағы функционалдық
сауаттылығы – оның берілген тапсырманы зейін қойып тыңдауы, берілген
сызбаларды салыстыруы, өзінің ойы...
21 слайд
Қорытындылай келе, PISA зерттеулерінің әдісімен тест тапсырмаларын құрастыруда мұғалімнен көп еңбек, терең білімділік, күш-жігер, жан-жақтылық, ізденімпаздық, жаңа ақпарат көздерін мейлінше тиімді қолдана алатын қажыр- қайрат талап етіледі. Осы аталған маңызды сипаттар мұғалімнің жан-жақты ізденістегі шығармашылық тұлғасында тоғысып және де оқу үрдісінде ұтымды қолданылған жағдайда құзыреттілік қалыптастырудың сапалы да өрелі мақсатына жетуге өрісті ықпал етпек. Сонда ғана өскелең ұрпаққа сапалы білім алуына дұрыс бағыт-бағдар беріліп, оқушылардың өмірде таңдайтын кәсіби бағытына жетуде адастырмайтын жол ашылады әрі елшілдік ұстанымдағы зияткерлік тұлғасын қалыптастыруға айқындауға жол ашылады деп білеміз. Функционалдық сауаттылықты қалыптастыратын оқыту мазмұны төмендегідей мамандықтарға жоғары сынып оқушыларын бейімдеуге икемделеді: химия, химиялық технология және өндіріс, тұрмыстық химия, экологиялық химия, медицина және фармакология негіздері, табиғи ресустарды қорғау, нанотехнология бағыттары бойынша оқушыларды бейіналды және дайындау. Оқушының PISA зерттеулерінің әдісімен тест тапсырмаларын орындаудағы функционалдық сауаттылығы – оның берілген тапсырманы зейін қойып тыңдауы, берілген сызбаларды салыстыруы, өзінің ойы...

шағым қалдыра аласыз
















