Координациялық сан
Координациялық сан


#1 слайд
Орындаған: Жаңбырбай М.
Қ.Жұбанов атындағы Ақтөбе өңірлік мемлекеттік университеті
Координациялық сан.
1 слайд
Орындаған: Жаңбырбай М. Қ.Жұбанов атындағы Ақтөбе өңірлік мемлекеттік университеті Координациялық сан.

#2 слайд
ЖОСПАР:
Жалпы түсінік
Координациялық сан
Полярлану қасиеттері.
Изоморфизм.
Полиморфизм
Кристалдық энергия.
2 слайд
ЖОСПАР: Жалпы түсінік Координациялық сан Полярлану қасиеттері. Изоморфизм. Полиморфизм Кристалдық энергия.

#3 слайд
3 слайд

#4 слайд
Координациялық теорияның негізін қалаушы Швед химигі
Альфред Вернер болды. А.Вернер координациялық теорияны
ұсынған кезде әлі атомның құрылысы ашылмаған еді.
Сондықтан ол ұсынған теория негізгі және қосымша
валенттіліктің мәнін түсіндіре алмады. 1911 ж. құрамында
көміртек атомы кездеспейтін, 40 жуық оптикалық белсенді
молекулаларды синтездеді. 1913 г. Цюрих университетінің
профессоры Вернерге ертеректе жасаған зерттеу
нәтижелеріне байланысты Нобель сыйлығы берілді. Бұл
теорияны орыс ғалымдары Л.А.Чугаев, И.И.Черняев және
А.А.Гринберг еңбектерінде толықтырды. (1866 – 1919) Швед
химигі Альфред Вернер
4 слайд
Координациялық теорияның негізін қалаушы Швед химигі Альфред Вернер болды. А.Вернер координациялық теорияны ұсынған кезде әлі атомның құрылысы ашылмаған еді. Сондықтан ол ұсынған теория негізгі және қосымша валенттіліктің мәнін түсіндіре алмады. 1911 ж. құрамында көміртек атомы кездеспейтін, 40 жуық оптикалық белсенді молекулаларды синтездеді. 1913 г. Цюрих университетінің профессоры Вернерге ертеректе жасаған зерттеу нәтижелеріне байланысты Нобель сыйлығы берілді. Бұл теорияны орыс ғалымдары Л.А.Чугаев, И.И.Черняев және А.А.Гринберг еңбектерінде толықтырды. (1866 – 1919) Швед химигі Альфред Вернер

#5 слайд
Координациялық теорияның негізгі қағидалары
Координация саны – комплекс түзуші қоса алатын
лигандалар саны. 3. Координация саны – орталық
ионға қарағанда 2 еседей көп болады +1 (2) +2 (4, 6)
+3 (6, 4) +4 (8, 6)
5 слайд
Координациялық теорияның негізгі қағидалары Координация саны – комплекс түзуші қоса алатын лигандалар саны. 3. Координация саны – орталық ионға қарағанда 2 еседей көп болады +1 (2) +2 (4, 6) +3 (6, 4) +4 (8, 6)

#6 слайд
Координациялық сан – кристалдық тордағы
әрбір атомның (ионның) айналасында бірдей
қашықтықта орналасқан ең жақын атомдардың
(иондардың) саны. Кристалдық тордағы металдар
үшін Координациялық сан 8 және 12, ал кешенді
қосылыстардағы Координациялық сан 1-ден 12-ге
дейін болады. Мысалы, кремний оттек
тетраэдрінде [SiO
4]
4-
кремнийдің бір ионын
[Si
4+
]
оның айнала-сында тетраэдр бұрыштарында
орналасқан оттектің 4 ионы O
2-
қоршаған, демек
кремнийдің координациялық саны 4-ке тең.
6 слайд
Координациялық сан – кристалдық тордағы әрбір атомның (ионның) айналасында бірдей қашықтықта орналасқан ең жақын атомдардың (иондардың) саны. Кристалдық тордағы металдар үшін Координациялық сан 8 және 12, ал кешенді қосылыстардағы Координациялық сан 1-ден 12-ге дейін болады. Мысалы, кремний оттек тетраэдрінде [SiO 4] 4- кремнийдің бір ионын [Si 4+ ] оның айнала-сында тетраэдр бұрыштарында орналасқан оттектің 4 ионы O 2- қоршаған, демек кремнийдің координациялық саны 4-ке тең.

#7 слайд
ПОЛЯРЛАНУ ҚАСИЕТТЕРІ.
Сыртқы электр өрісінің әсерінен иондық
сфера-ның (қабықтың) пішінінің өзгеріп
деформацияға ұшырауы полярлану деп
аталады. Иондық радиусы неғұрлым үлкен,
заряды неғұрлым аз болса оның полярлануы
күшті болады. Полярлану қасиеттері көбінесе
аниондарда байқалады.
7 слайд
ПОЛЯРЛАНУ ҚАСИЕТТЕРІ. Сыртқы электр өрісінің әсерінен иондық сфера-ның (қабықтың) пішінінің өзгеріп деформацияға ұшырауы полярлану деп аталады. Иондық радиусы неғұрлым үлкен, заряды неғұрлым аз болса оның полярлануы күшті болады. Полярлану қасиеттері көбінесе аниондарда байқалады.

#8 слайд
ИЗОМОРФИЗМ.
Грекше “изо”–бірдей, “морфе” – пішін, демек тең
формалық деген мағына береді. Валенттілігі, полярлану
күші, иондық радиустары бірдей атомдардың (иондардың)
кристалдық торды бұзбай бірінің орнын екіншісі
алғандағы кристалдық заттың химиялық құрамының
өзгеруін изоморфизм деп атайды. Изоморфизм
нәтижесінде химиялық элементер кристалдар мен
минералдарда бірін бірі алмастыру арқылы аралас
қосылыстар береді. Соның нәтижесінде түзілетін
қосылыстардың қасиеті ақырындап үздіксіз өзгереді.
8 слайд
ИЗОМОРФИЗМ. Грекше “изо”–бірдей, “морфе” – пішін, демек тең формалық деген мағына береді. Валенттілігі, полярлану күші, иондық радиустары бірдей атомдардың (иондардың) кристалдық торды бұзбай бірінің орнын екіншісі алғандағы кристалдық заттың химиялық құрамының өзгеруін изоморфизм деп атайды. Изоморфизм нәтижесінде химиялық элементер кристалдар мен минералдарда бірін бірі алмастыру арқылы аралас қосылыстар береді. Соның нәтижесінде түзілетін қосылыстардың қасиеті ақырындап үздіксіз өзгереді.

#9 слайд
ПОЛИМОРФИЗМ
(грекше “поли”–көп, “морфос” – пішін). Химиялық құрамы
бірдей заттардың әр түрлі құрылым
құрауын полиморфизм деп атайды. Осыған ең көрнекті
мысал ретінде алмазбен графитті алуға болады. Екеуіде
көміртектен (С) тұрады, бірақ құрылымы әртүрлі. Алмаздың
координациялық саны 4, графиттікі–3. Алмаз– мөлдір,
жарқырауық, ең қатты зат. Графит – қара, сұр түсті, күйе
тәрізді қолға жұғатын ең жұмсақ зат. Мұның себебі мынадай:
алмаздағы көміртек атомдары коваленттік байланысты, ал
графиттің қабаттардағы көміртек атомдары коваленттік
байланыста болса, ал қабаттар бір-бірімен әлсіз молекулалық
байланыста болады. Алмазбен графиттің осындай қасиеттері
болуы олардың әртүрлі қысымда және температурада пайда
болулары.
9 слайд
ПОЛИМОРФИЗМ (грекше “поли”–көп, “морфос” – пішін). Химиялық құрамы бірдей заттардың әр түрлі құрылым құрауын полиморфизм деп атайды. Осыған ең көрнекті мысал ретінде алмазбен графитті алуға болады. Екеуіде көміртектен (С) тұрады, бірақ құрылымы әртүрлі. Алмаздың координациялық саны 4, графиттікі–3. Алмаз– мөлдір, жарқырауық, ең қатты зат. Графит – қара, сұр түсті, күйе тәрізді қолға жұғатын ең жұмсақ зат. Мұның себебі мынадай: алмаздағы көміртек атомдары коваленттік байланысты, ал графиттің қабаттардағы көміртек атомдары коваленттік байланыста болса, ал қабаттар бір-бірімен әлсіз молекулалық байланыста болады. Алмазбен графиттің осындай қасиеттері болуы олардың әртүрлі қысымда және температурада пайда болулары.

#10 слайд
КРИСТАЛДЫҚ ЭНЕРГИЯ
Иондар қосылып кристалдық тор құрған
уақытта олардан белгілі мөлшерде
энергия бөлініп шығады. Кристалдық
энергиясы деп осыны атайды.
Кристалдық құрылыстың беріктігі мен
қасиеттерін және жаратылысын айыру
үшін осы кристалдану энергиясын
есептеп шығару керек. Оны есептеу әдісі
Кулон заңына негізделген.
10 слайд
КРИСТАЛДЫҚ ЭНЕРГИЯ Иондар қосылып кристалдық тор құрған уақытта олардан белгілі мөлшерде энергия бөлініп шығады. Кристалдық энергиясы деп осыны атайды. Кристалдық құрылыстың беріктігі мен қасиеттерін және жаратылысын айыру үшін осы кристалдану энергиясын есептеп шығару керек. Оны есептеу әдісі Кулон заңына негізделген.
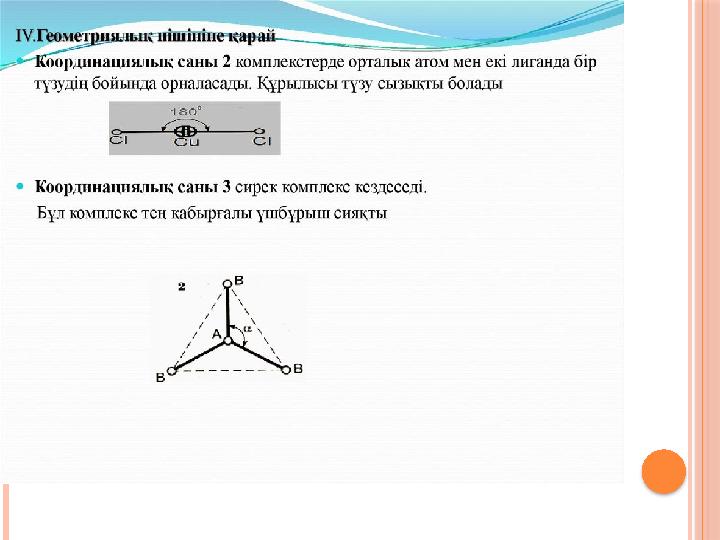
#11 слайд
11 слайд
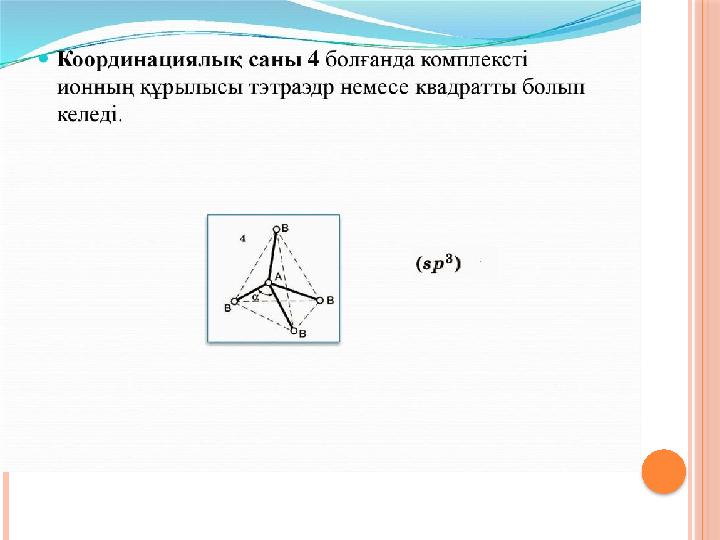
#12 слайд
12 слайд
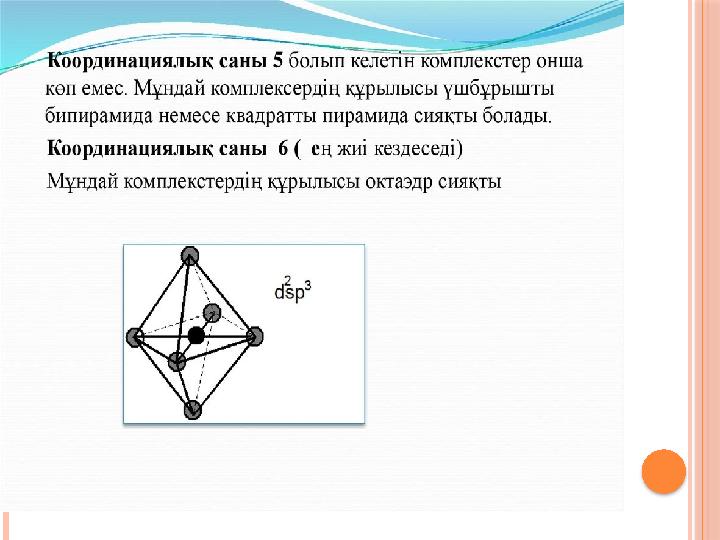
#13 слайд
13 слайд

#14 слайд
Алтыдан үлкен Координациялық
сан сирек кездеседі. Ондай
кешендерді 5-және 6-периодтағы d-
металдар, лантаноидтар мен
актиноидтар түзеді.
14 слайд
Алтыдан үлкен Координациялық сан сирек кездеседі. Ондай кешендерді 5-және 6-периодтағы d- металдар, лантаноидтар мен актиноидтар түзеді.

#15 слайд
Назарларыңызға рахмет!!!
15 слайд
Назарларыңызға рахмет!!!

шағым қалдыра аласыз
















