Күкірт қышқылы
Күкірт қышқылы


#1 слайд
Күкірт қышқылы
1 слайд
Күкірт қышқылы

#2 слайд
Күкірт қышқылы – күкірттің маңызды қосылыстарының бірі.
Химиялық формуласы H2SO4 . Ол – екі негізді күшті қышқыл, орта және
қышқыл тұздар түзеді. Техникада күкірт қышқылы деп күкірт (VI)
оксидінен және судың әр түрлі мөлшерінен тұратын жүйені айтады
(nSO3 * mH2O) :
H2SO4
Күкірт қышқылының моногидраты, n=m=1
(100% қышқыл)
H2SO4
(m-1)H2O – сулы күкірт қышқылы, m>n
H2SO4
(n-1)SO3 – олеум, m<n
2 слайд
Күкірт қышқылы – күкірттің маңызды қосылыстарының бірі. Химиялық формуласы H2SO4 . Ол – екі негізді күшті қышқыл, орта және қышқыл тұздар түзеді. Техникада күкірт қышқылы деп күкірт (VI) оксидінен және судың әр түрлі мөлшерінен тұратын жүйені айтады (nSO3 * mH2O) : H2SO4 Күкірт қышқылының моногидраты, n=m=1 (100% қышқыл) H2SO4 (m-1)H2O – сулы күкірт қышқылы, m>n H2SO4 (n-1)SO3 – олеум, m<n

#3 слайд
Физикалық қасиеттері
Концентрациялы күкірт қышқылы – түссіз, ұшпайтын, май тәріздес,
суда жақсы еритін, сұйық зат. Тығыздығы 1,85 г/см3, массалық үлесі
98 % . 553 К-де қайнайды, 283,4 К-де кристалданады.
Күкірт қышқылының ылғал тартқыштық қасиеті бар. Егер концентрлі
қышқыл бар стаканды біраз уақыт ашық қалдырса, ауадағы су буын
сіңіріп алады да, қышқыл ыдыстан асып төгіледі.
Концентрлі күкірт қышқылы адам терісіне, ағашқа, матаға тисе,
қарайтып күйдіреді. Сондықтан онымен жұмыс істегенде сақтану керек.
Теріге не матаға тиген кезде, тез арада сумен жуып, содан соң ас содасы
ерітіндісімен шаю керек.
3 слайд
Физикалық қасиеттері Концентрациялы күкірт қышқылы – түссіз, ұшпайтын, май тәріздес, суда жақсы еритін, сұйық зат. Тығыздығы 1,85 г/см3, массалық үлесі 98 % . 553 К-де қайнайды, 283,4 К-де кристалданады. Күкірт қышқылының ылғал тартқыштық қасиеті бар. Егер концентрлі қышқыл бар стаканды біраз уақыт ашық қалдырса, ауадағы су буын сіңіріп алады да, қышқыл ыдыстан асып төгіледі. Концентрлі күкірт қышқылы адам терісіне, ағашқа, матаға тисе, қарайтып күйдіреді. Сондықтан онымен жұмыс істегенде сақтану керек. Теріге не матаға тиген кезде, тез арада сумен жуып, содан соң ас содасы ерітіндісімен шаю керек.

#4 слайд
Концентрлі қышқыл бромсутек, йодсутек қышқылдарын тотықтырады:
8HI + H2SO4 = 4I2↓+ H2S↑ + 4H2O 2HBr + H2SO4 = Br2 + SO2↑ + 2H2O
Көміртекті көмірқышқыл газына , күкіртті күкірт екіоксидіне дейін
тотықтырады :
C + 2H2SO4 = 2SO2↑ + CO2 + 2H2O S + 2H2SO4 = 3SO2 + 2H2O
Бірнеше металдарды (Au, Pt, Ir, Rh, Th басқа ) күкірт екіоксидіне дейін
тотықтырады : Cu + 2H2SO4 = CuSO4 + 2SO2+ 2H2O
Концентрлі қышқыл Fe, Cr, Al, Ba, Ni, Co сияқты металдармен
әрекеттеспейді. Химиялық қасиеттері
4 слайд
Концентрлі қышқыл бромсутек, йодсутек қышқылдарын тотықтырады: 8HI + H2SO4 = 4I2↓+ H2S↑ + 4H2O 2HBr + H2SO4 = Br2 + SO2↑ + 2H2O Көміртекті көмірқышқыл газына , күкіртті күкірт екіоксидіне дейін тотықтырады : C + 2H2SO4 = 2SO2↑ + CO2 + 2H2O S + 2H2SO4 = 3SO2 + 2H2O Бірнеше металдарды (Au, Pt, Ir, Rh, Th басқа ) күкірт екіоксидіне дейін тотықтырады : Cu + 2H2SO4 = CuSO4 + 2SO2+ 2H2O Концентрлі қышқыл Fe, Cr, Al, Ba, Ni, Co сияқты металдармен әрекеттеспейді. Химиялық қасиеттері

#5 слайд
Сұйылтылған күкірт қышқылы кернеу қатарындағы сутектің сол жағындағы
металдармен әрекеттеседі:
Mg + H2SO4 = MgSO4 + H2
Сұйылтылған қышқылдың тотықтырғыштық қасиеті жоқ. Сульфаттар мен
гидросульфаттар түзеді:
NaOH + H2SO4 = NaHSO4 + H2O 2NaOH + H2SO4 = Na2SO4 + 2H2O
Күкірт қышқылы негіздік оксидтермен әрекеттесіп, сульфаттар мен су түзеді:
CuO + H2SO4 = CuSO4 + H2O
Күкірт қышқылы мен оның ерігіш тұздарына сапалық реакция:
BaCl2 + H2SO4 = BaSO4 + 2HCl Химиялық қасиеттері
5 слайд
Сұйылтылған күкірт қышқылы кернеу қатарындағы сутектің сол жағындағы металдармен әрекеттеседі: Mg + H2SO4 = MgSO4 + H2 Сұйылтылған қышқылдың тотықтырғыштық қасиеті жоқ. Сульфаттар мен гидросульфаттар түзеді: NaOH + H2SO4 = NaHSO4 + H2O 2NaOH + H2SO4 = Na2SO4 + 2H2O Күкірт қышқылы негіздік оксидтермен әрекеттесіп, сульфаттар мен су түзеді: CuO + H2SO4 = CuSO4 + H2O Күкірт қышқылы мен оның ерігіш тұздарына сапалық реакция: BaCl2 + H2SO4 = BaSO4 + 2HCl Химиялық қасиеттері

#6 слайд
Өндірісі
Күкірт қышқылын алу үшін шикізаттар: күкірт, металл
сульфидтері мен сульфаттары, жылу электр
станцияларының қалдық газдары, мұнай қалдықтары,
пирит.
6 слайд
Өндірісі Күкірт қышқылын алу үшін шикізаттар: күкірт, металл сульфидтері мен сульфаттары, жылу электр станцияларының қалдық газдары, мұнай қалдықтары, пирит.

#7 слайд
ХІХ ғасырда алхимик Валентин ашқан алғашқы әдіс. Бұл әдіс ауада күкірт
пен калий селитрасының қоспасының жануына негізделген. Процесс
қышқылда ерімейтін қорғасынмен қапталған камерада жүргізілді. Камералы әдіс
2 KNO3 + 2S + 2O2 = K2SO4 + SO3 + NO2 + NO
SO3 + H2O = H2SO4
7 слайд
ХІХ ғасырда алхимик Валентин ашқан алғашқы әдіс. Бұл әдіс ауада күкірт пен калий селитрасының қоспасының жануына негізделген. Процесс қышқылда ерімейтін қорғасынмен қапталған камерада жүргізілді. Камералы әдіс 2 KNO3 + 2S + 2O2 = K2SO4 + SO3 + NO2 + NO SO3 + H2O = H2SO4

#8 слайд
Нитрозды әдіспен күкірт қышқылын алу:
SO2 + NO2 = SO3 + NO
Күкірт ( VI) оксиді сумен көп жылу бөле жүріп әрекеттседі:
SO3 + H2O = H2SO4 + QПиритті не күкіртті өртеу:
4 FeS2 + 11O2 = 2Fe2O3 + 8SO2 + Q
2S + 2O2 = 2SO4
2SO2 + O2 = 2SO4
8 слайд
Нитрозды әдіспен күкірт қышқылын алу: SO2 + NO2 = SO3 + NO Күкірт ( VI) оксиді сумен көп жылу бөле жүріп әрекеттседі: SO3 + H2O = H2SO4 + QПиритті не күкіртті өртеу: 4 FeS2 + 11O2 = 2Fe2O3 + 8SO2 + Q 2S + 2O2 = 2SO4 2SO2 + O2 = 2SO4
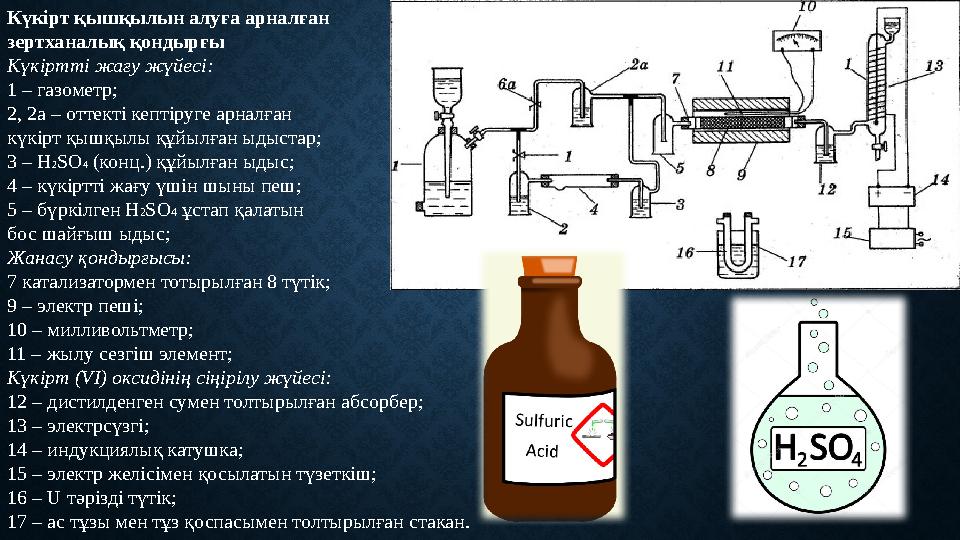
#9 слайд
Күкірт қышқылын алуға арналған
зертханалық қондырғы
Күкіртті жағу жүйесі:
1 – газометр;
2, 2а – оттекті кептіруге арналған
күкірт қышқылы құйылған ыдыстар;
3 – H 2 SO 4 (конц.) құйылған ыдыс;
4 – күкіртті жағу үшін шыны пеш;
5 – бүркілген H 2 SO 4 ұстап қалатын
бос шайғыш ыдыс;
Жанасу қондырғысы:
7 катализатормен тотырылған 8 түтік;
9 – электр пеші;
10 – милливольтметр;
11 – жылу сезгіш элемент;
Күкірт (VI) оксидінің сіңірілу жүйесі:
12 – дистилденген сумен толтырылған абсорбер;
13 – электрсүзгі;
14 – индукциялық катушка;
15 – электр желісімен қосылатын түзеткіш;
16 – U тәрізді түтік;
17 – ас тұзы мен тұз қоспасымен толтырылған стакан.
9 слайд
Күкірт қышқылын алуға арналған зертханалық қондырғы Күкіртті жағу жүйесі: 1 – газометр; 2, 2а – оттекті кептіруге арналған күкірт қышқылы құйылған ыдыстар; 3 – H 2 SO 4 (конц.) құйылған ыдыс; 4 – күкіртті жағу үшін шыны пеш; 5 – бүркілген H 2 SO 4 ұстап қалатын бос шайғыш ыдыс; Жанасу қондырғысы: 7 катализатормен тотырылған 8 түтік; 9 – электр пеші; 10 – милливольтметр; 11 – жылу сезгіш элемент; Күкірт (VI) оксидінің сіңірілу жүйесі: 12 – дистилденген сумен толтырылған абсорбер; 13 – электрсүзгі; 14 – индукциялық катушка; 15 – электр желісімен қосылатын түзеткіш; 16 – U тәрізді түтік; 17 – ас тұзы мен тұз қоспасымен толтырылған стакан.

#10 слайд
10 слайд

#11 слайд
Қорытынды
Күкірт қышқылы – шаруашылық маңызы жағынан ең күшті
қышқыл. Ол өнеркәсіптің түрлі салаларында қажетті өнімдер
алуға негізгі реагент ретінде аса маңызға ие. Күкірт
қышқылын табиғи шикізаттар азайған қазіргі заманда әр
түрлі өндіріс қалдықтарынан алу үлкен рөл атқарады
11 слайд
Қорытынды Күкірт қышқылы – шаруашылық маңызы жағынан ең күшті қышқыл. Ол өнеркәсіптің түрлі салаларында қажетті өнімдер алуға негізгі реагент ретінде аса маңызға ие. Күкірт қышқылын табиғи шикізаттар азайған қазіргі заманда әр түрлі өндіріс қалдықтарынан алу үлкен рөл атқарады

шағым қалдыра аласыз
















