Презентация « Галогеноалканы: получение, свойства и применение»
Презентация « Галогеноалканы: получение, свойства и применение»


#1 слайд
« Галогеноалканы:
получение,
свойства и
применение»
1 слайд
« Галогеноалканы: получение, свойства и применение»

#2 слайд
Галогеноалканы – это
предельные
алимфатические
соединения, в молекулах
которых присутствует
атом галогена.
2 слайд
Галогеноалканы – это предельные алимфатические соединения, в молекулах которых присутствует атом галогена.

#3 слайд
ОБЩАЯ ФОРМУЛА
CnH2n+1
3 слайд
ОБЩАЯ ФОРМУЛА CnH2n+1
#4 слайд
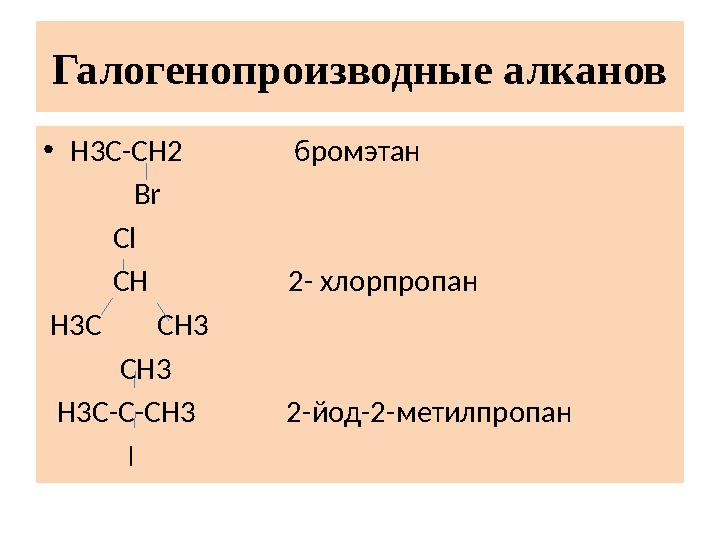
Галогенопроизводные алканов
•
H3C-CH2 бромэтан
Br
Cl
CH 2- хлорпропан
H3C CH3
CH3
H3C-C-CH3 2- йод-2-метилпропан
I
4 слайд
Галогенопроизводные алканов • H3C-CH2 бромэтан Br Cl CH 2- хлорпропан H3C CH3 CH3 H3C-C-CH3 2- йод-2-метилпропан I
#5 слайд
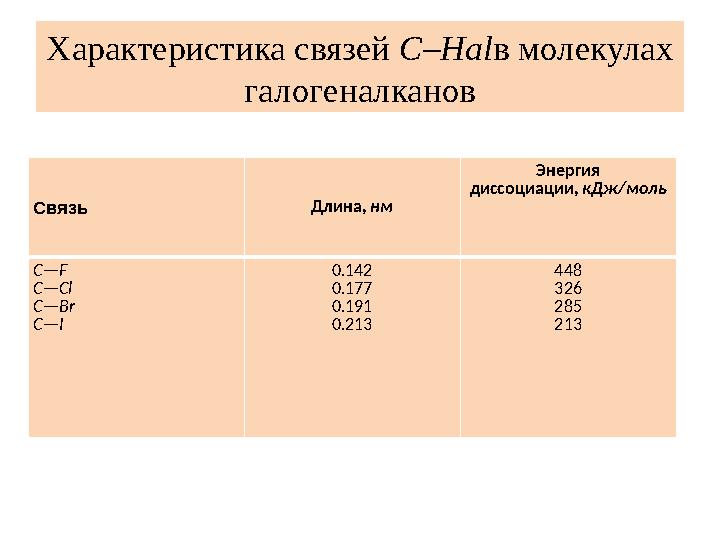
Характеристика связей C–Hal в молекулах
галогеналканов
Связь Длина, нм Энергия
диссоциации, кДж/моль
C—F
C—Cl
C—Br
C—I 0.142
0.177
0.191
0.213 448
326
285
213
5 слайд
Характеристика связей C–Hal в молекулах галогеналканов Связь Длина, нм Энергия диссоциации, кДж/моль C—F C—Cl C—Br C—I 0.142 0.177 0.191 0.213 448 326 285 213

#6 слайд
В зависимости от числа атомов галогена и от их
природы галогеналканы можно разделить на:
• моногалогеналканы, содержащие один атом
галогена, и
• ди-, три- и полигалогеналканы, в молекулах
которых несколько атомов галогена.
• Моногалогеналканы классифицируют на
первичные, вторичные и третичные в
зависимости от природы атома углерода, у
которого находится галоген.
• Среди дигалогеналканов выделяют геминальные ,
в которых атомы галогена находятся у одного
атома углерода, и вицинальные с расположением
атомов галогена у соседних углеродных атомов
6 слайд
В зависимости от числа атомов галогена и от их природы галогеналканы можно разделить на: • моногалогеналканы, содержащие один атом галогена, и • ди-, три- и полигалогеналканы, в молекулах которых несколько атомов галогена. • Моногалогеналканы классифицируют на первичные, вторичные и третичные в зависимости от природы атома углерода, у которого находится галоген. • Среди дигалогеналканов выделяют геминальные , в которых атомы галогена находятся у одного атома углерода, и вицинальные с расположением атомов галогена у соседних углеродных атомов
#7 слайд
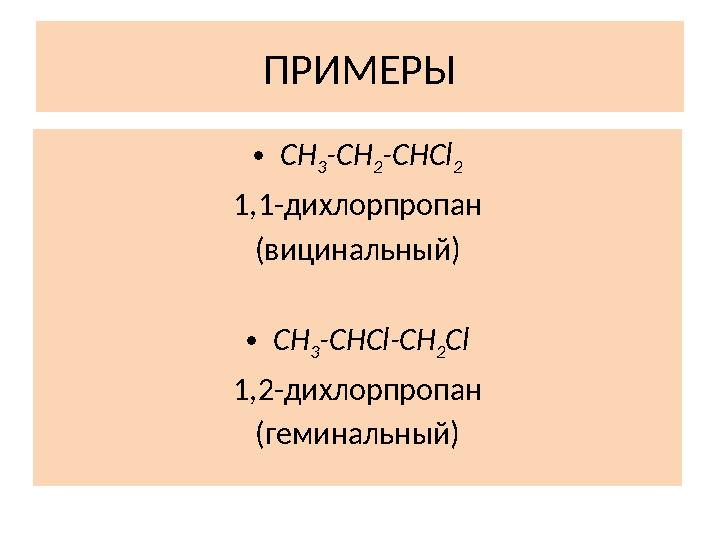
ПРИМЕРЫ
• CH
3 -CH
2 -CHCl
2
1, 1 - дихлорпропан
(вицинальный)
• CH
3 -CHCl-CH
2 Cl
1, 2 - дихлорпропан
(геминальный)
7 слайд
ПРИМЕРЫ • CH 3 -CH 2 -CHCl 2 1, 1 - дихлорпропан (вицинальный) • CH 3 -CHCl-CH 2 Cl 1, 2 - дихлорпропан (геминальный)

#8 слайд
Физические свойства
1. Летучесть . Молекулы фтор-, хлоралканов полярны, т.к. электроотрицательность
галогенов и углерода:
Связи С—F и С—Сl сильно полярны, что приводит к притяжению между диполями
соседних молекул:
2. Температуры кипения фтор- и хлоралканов близки к температурам кипения
углеводородов с такой же молекулярной массой. Молекулы бром- и иодалканов
малополярны. Атом брома имеет такую же массу, как шесть групп —СН2—, но размеры
молекулы бромалкана гораздо меньше, чем молекулы алкана равной массы. Меньший
размер молекул приводит к уменьшению взаимодействия между ними и к более
низкой температуре кипения.
Температура кипения бром- и иодалканов значительно ниже температуры кипения
алканов с той же молекулярной массой
3. Растворимость . Галогенопроизводные плохо растворимы в воде.
4. Запах . Галогеналканы имеют сладковатый запах (немного тошнотворный).
5. Плотность . Хлоралканы легче воды, а бром- и иодалканы — тяжелее.
8 слайд
Физические свойства 1. Летучесть . Молекулы фтор-, хлоралканов полярны, т.к. электроотрицательность галогенов и углерода: Связи С—F и С—Сl сильно полярны, что приводит к притяжению между диполями соседних молекул: 2. Температуры кипения фтор- и хлоралканов близки к температурам кипения углеводородов с такой же молекулярной массой. Молекулы бром- и иодалканов малополярны. Атом брома имеет такую же массу, как шесть групп —СН2—, но размеры молекулы бромалкана гораздо меньше, чем молекулы алкана равной массы. Меньший размер молекул приводит к уменьшению взаимодействия между ними и к более низкой температуре кипения. Температура кипения бром- и иодалканов значительно ниже температуры кипения алканов с той же молекулярной массой 3. Растворимость . Галогенопроизводные плохо растворимы в воде. 4. Запах . Галогеналканы имеют сладковатый запах (немного тошнотворный). 5. Плотность . Хлоралканы легче воды, а бром- и иодалканы — тяжелее.

#9 слайд
Химические свойства
галогеналканов
•
Реакция замещения:
C 2 H 3 Cl + 2NH 3 → C 2 H 3 NH 2 + NH 4 HCl
хлорэтан этиламин
С 2 H 3 С l+NaOH → C 2 H 3 OH + NaCl
хлорэтан этанол
9 слайд
Химические свойства галогеналканов • Реакция замещения: C 2 H 3 Cl + 2NH 3 → C 2 H 3 NH 2 + NH 4 HCl хлорэтан этиламин С 2 H 3 С l+NaOH → C 2 H 3 OH + NaCl хлорэтан этанол
#10 слайд
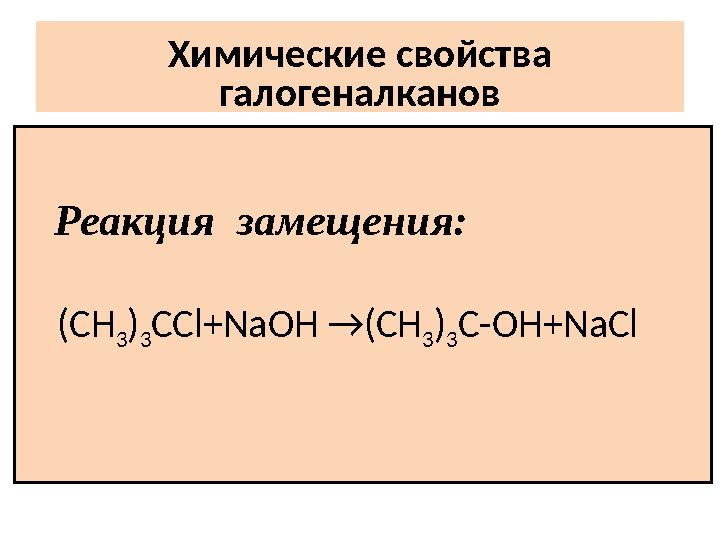
Химические свойства
галогеналканов
Реакция замещения:
(СН
3 )
3 СС l+Na ОН →(СН
3 )
3 C-O Н +Na С l
10 слайд
Химические свойства галогеналканов Реакция замещения: (СН 3 ) 3 СС l+Na ОН →(СН 3 ) 3 C-O Н +Na С l
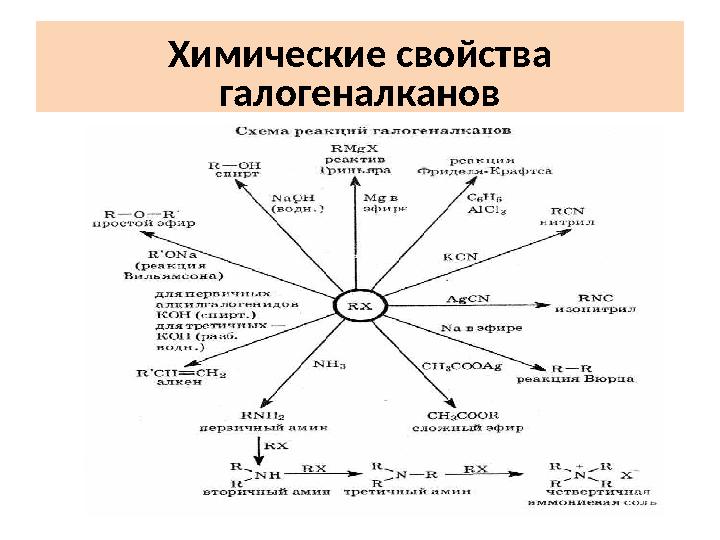
#11 слайд
Химические свойства
галогеналканов
11 слайд
Химические свойства галогеналканов

#12 слайд
Получение моногалогеналканов
•
Присоединение галогеноводородов к
алкенам .
R-CH=CH
2 +HCl→R-CHCl-CH
3
•
Реакции спиртов с галогеноводородами.
R-OH+H-Cl→R-Cl+H
2 O
•
Взаимодействие галогенидов фосфора или
тионилхлорида со спиртами.
3R-OH+PCl
3 →3R-Cl+H
3 PO
3
12 слайд
Получение моногалогеналканов • Присоединение галогеноводородов к алкенам . R-CH=CH 2 +HCl→R-CHCl-CH 3 • Реакции спиртов с галогеноводородами. R-OH+H-Cl→R-Cl+H 2 O • Взаимодействие галогенидов фосфора или тионилхлорида со спиртами. 3R-OH+PCl 3 →3R-Cl+H 3 PO 3

#13 слайд
Получение дигалогеналканов
•
Присоединение галогеноводородов к
алкинам .
R-C≡CH+2HCl→R-CCl
2 -CH
3
• Взаимодействие
альдегидов и кетонов с PCl
5 , PBr
5 или SF
4 .
Реакция идёт при нагревании.
R—CHO + PCl
5
→ R—CHCl
2 + POCl 3
•
Присоединение галогенов к алкенам
R-CH=CH
2
+ Cl
2 → R-CHCl-CHCl
•
Раскрытие циклических простых эфиров (например,
ТГФ ) при
реакции с NaI в среде H
3 PO
4 +P
2 O
5 .
C
4 H
8 O + HI → I-CH
2 CH
2 CH
2 CH
2 -I
•
При 180 °C ТГФ с
хлороводородом даёт 1,4-дихлорбутан
13 слайд
Получение дигалогеналканов • Присоединение галогеноводородов к алкинам . R-C≡CH+2HCl→R-CCl 2 -CH 3 • Взаимодействие альдегидов и кетонов с PCl 5 , PBr 5 или SF 4 . Реакция идёт при нагревании. R—CHO + PCl 5 → R—CHCl 2 + POCl 3 • Присоединение галогенов к алкенам R-CH=CH 2 + Cl 2 → R-CHCl-CHCl • Раскрытие циклических простых эфиров (например, ТГФ ) при реакции с NaI в среде H 3 PO 4 +P 2 O 5 . C 4 H 8 O + HI → I-CH 2 CH 2 CH 2 CH 2 -I • При 180 °C ТГФ с хлороводородом даёт 1,4-дихлорбутан

#14 слайд
Применение галогеналканов
Галогеналканы используются:
1) как
растворители для жиров и масел;
2)
в качестве хладагентов (например,
дихлорметан
CCl2H2);
3)
при тушении пожаров (например, CBr2ClF
—
дибромфторхлорметан ).
14 слайд
Применение галогеналканов Галогеналканы используются: 1) как растворители для жиров и масел; 2) в качестве хладагентов (например, дихлорметан CCl2H2); 3) при тушении пожаров (например, CBr2ClF — дибромфторхлорметан ).

#15 слайд
Спасибо за внимание
15 слайд
Спасибо за внимание

шағым қалдыра аласыз
















