Презентайия: "Галогендер. Хлор" 9 сынып
Презентайия: "Галогендер. Хлор" 9 сынып


#1 слайд
Галогендер. Хлор
1 слайд
Галогендер. Хлор

#2 слайд
Галогендер VIIА топшада
орналасқан, олар : фтор F,
хлор Cl , бром Br , йод I , астат
At. Астат – радиобелсенді
элемент.
2 слайд
Галогендер VIIА топшада орналасқан, олар : фтор F, хлор Cl , бром Br , йод I , астат At. Астат – радиобелсенді элемент.

#3 слайд
Сипаттама
•
Галогендер «тұз түзуші» деген мағына береді.
•
Ең күшті бейметалдық қасиеттер фторда , ең әлсіз
бейметалдық қасиеттер йодта байқалады.
•
Электртерістілігі ең жоғары элемент – фтор
•
Галогендердің молекулалары екіатомды, олар
өзара коваленттік полюссіз байланыспен
байланысып, кристалдық тор түзеді.
3 слайд
Сипаттама • Галогендер «тұз түзуші» деген мағына береді. • Ең күшті бейметалдық қасиеттер фторда , ең әлсіз бейметалдық қасиеттер йодта байқалады. • Электртерістілігі ең жоғары элемент – фтор • Галогендердің молекулалары екіатомды, олар өзара коваленттік полюссіз байланыспен байланысып, кристалдық тор түзеді.
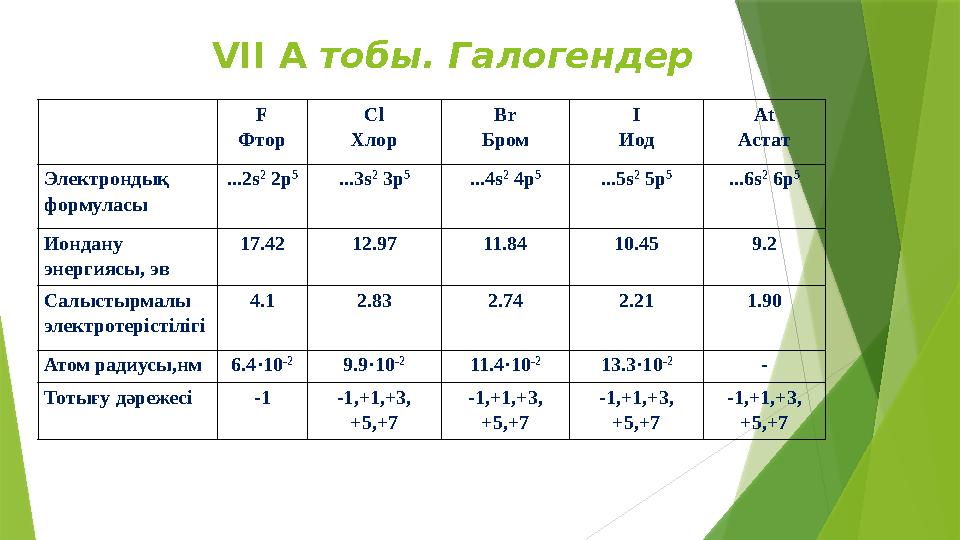
#4 слайд
VII A тобы. Галогендер
F
Фтор Cl
Хлор Br
Бром I
Иод At
Астат
Электронды қ
формуласы ... 2s 2
2p 5
... 3s 2
3p 5
... 4s 2
4p 5
... 5s 2
5p 5
... 6s 2
6p 5
Иондану
энергиясы , эв 17.42 12.97 11.84 10.45 9.2
Салыстырмалы
электротерістілігі 4.1 2.83 2.74 2.21 1.90
Атом радиусы,нм 6.4·10 -2
9.9·10 -2
11.4·10 -2
13.3·10 -2
-
Тотығу дәрежесі -1 -1,+1,+3,
+5,+7 -1,+1,+3,
+5,+7 -1,+1,+3,
+5,+7 -1,+1,+3,
+5,+7
4
4 слайд
VII A тобы. Галогендер F Фтор Cl Хлор Br Бром I Иод At Астат Электронды қ формуласы ... 2s 2 2p 5 ... 3s 2 3p 5 ... 4s 2 4p 5 ... 5s 2 5p 5 ... 6s 2 6p 5 Иондану энергиясы , эв 17.42 12.97 11.84 10.45 9.2 Салыстырмалы электротерістілігі 4.1 2.83 2.74 2.21 1.90 Атом радиусы,нм 6.4·10 -2 9.9·10 -2 11.4·10 -2 13.3·10 -2 - Тотығу дәрежесі -1 -1,+1,+3, +5,+7 -1,+1,+3, +5,+7 -1,+1,+3, +5,+7 -1,+1,+3, +5,+7 4

#5 слайд
Физикалық қасиеттері:
5Зат Кәдімгі
жағдайдағы
агрегаттық күйі Түсі Иісі Қайнау
темпера
турасы
Фтор F
2 Газ Ашық сары Өткір -188
Хлор Cl
2 Газ Сары жасыл Өткір -34
Бром Br
2 Сұйық Қою қоңыр Өткір +58
Йод l
2 Қатты зат Күлгін қара,
металдық
жарқылы бар Өткір +186
5 слайд
Физикалық қасиеттері: 5Зат Кәдімгі жағдайдағы агрегаттық күйі Түсі Иісі Қайнау темпера турасы Фтор F 2 Газ Ашық сары Өткір -188 Хлор Cl 2 Газ Сары жасыл Өткір -34 Бром Br 2 Сұйық Қою қоңыр Өткір +58 Йод l 2 Қатты зат Күлгін қара, металдық жарқылы бар Өткір +186

#6 слайд
Сыртқы деңгейінде ns 2
np 5
(7е) болады. Олар бір электрон қосып
алып, - 1-ге тең тотығу дәрежесін көрсетеді.
Фтор атомынан басқа галогендердің атомдары оң тотығу
дәрежесін +1, +3, +5, +7 көрсетеді.
Фтор атомының электротерістілігі жоғары болғандықтан фтор 2р –
деңгейшесіне тек қана бір электронды қабылдайды, бос квант
ұяшықтары жоқ.
Хлор атомының 3р – қосымша деңгейшесінен
3 d – деңгейшесінде 5 орбиталі бар.
Қыздырылған қалыпты хлор атомындағы 3р және
3 s –деңгейшелердегі электрондар 3 d – деңгейшеге ауысады.
Сондықтан Cl , Br , I атомдарының +1, +3, +5, +7
тотығу дәрежелері бар.
63р
3 s 3 d
6 слайд
Сыртқы деңгейінде ns 2 np 5 (7е) болады. Олар бір электрон қосып алып, - 1-ге тең тотығу дәрежесін көрсетеді. Фтор атомынан басқа галогендердің атомдары оң тотығу дәрежесін +1, +3, +5, +7 көрсетеді. Фтор атомының электротерістілігі жоғары болғандықтан фтор 2р – деңгейшесіне тек қана бір электронды қабылдайды, бос квант ұяшықтары жоқ. Хлор атомының 3р – қосымша деңгейшесінен 3 d – деңгейшесінде 5 орбиталі бар. Қыздырылған қалыпты хлор атомындағы 3р және 3 s –деңгейшелердегі электрондар 3 d – деңгейшеге ауысады. Сондықтан Cl , Br , I атомдарының +1, +3, +5, +7 тотығу дәрежелері бар. 63р 3 s 3 d
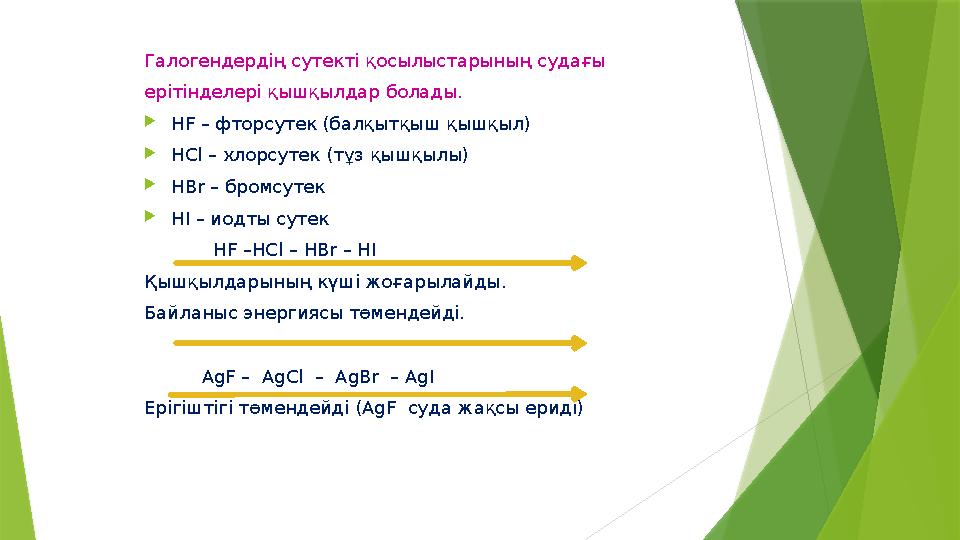
#7 слайд
Галогендердің сутекті қосылыстарының судағы
ерітінделері қышқылдар болады.
HF – фторсутек (балқытқыш қышқыл)
HCl – хлорсутек (тұз қышқылы)
HBr – бромсутек
HI – иодты сутек
HF –HCl – HBr – HI
Қышқылдарының күші жоғарылайды.
Байланыс энергиясы төмендейді.
AgF – AgCl – AgBr – AgI
Ерігіштігі төмендейді ( AgF суда жақсы ериді)
7
7 слайд
Галогендердің сутекті қосылыстарының судағы ерітінделері қышқылдар болады. HF – фторсутек (балқытқыш қышқыл) HCl – хлорсутек (тұз қышқылы) HBr – бромсутек HI – иодты сутек HF –HCl – HBr – HI Қышқылдарының күші жоғарылайды. Байланыс энергиясы төмендейді. AgF – AgCl – AgBr – AgI Ерігіштігі төмендейді ( AgF суда жақсы ериді) 7

#8 слайд
ГАЛОГЕНДЕРДІҢ ҚОЛДАНЫЛУЫ
8 слайд
ГАЛОГЕНДЕРДІҢ ҚОЛДАНЫЛУЫ

#9 слайд
Ашылу тарихы
Хлорды алғаш рет 1774 жылы швед оқымыстысы К.Шееле
алған :
4HCl + MnO
2 = Cl
2 + MnCl
2 + 2H
2 O
•
Шееле флагистон теориясын жақтаушы
болатын,сондықтан теңіз қышқылының флагистонын
марганец алған екен деп ойлап,ол газды
флагистонсызданған теңіз қышқылы деп атайды.
•
1810 жылы осылардың барлығына Дэви қарсы
шығып,тотыққан теңіз қышқылы деп жүрген күрделі зат
емес,жай зат деп оған хлорин деген ат берді.
9 слайд
Ашылу тарихы Хлорды алғаш рет 1774 жылы швед оқымыстысы К.Шееле алған : 4HCl + MnO 2 = Cl 2 + MnCl 2 + 2H 2 O • Шееле флагистон теориясын жақтаушы болатын,сондықтан теңіз қышқылының флагистонын марганец алған екен деп ойлап,ол газды флагистонсызданған теңіз қышқылы деп атайды. • 1810 жылы осылардың барлығына Дэви қарсы шығып,тотыққан теңіз қышқылы деп жүрген күрделі зат емес,жай зат деп оған хлорин деген ат берді.
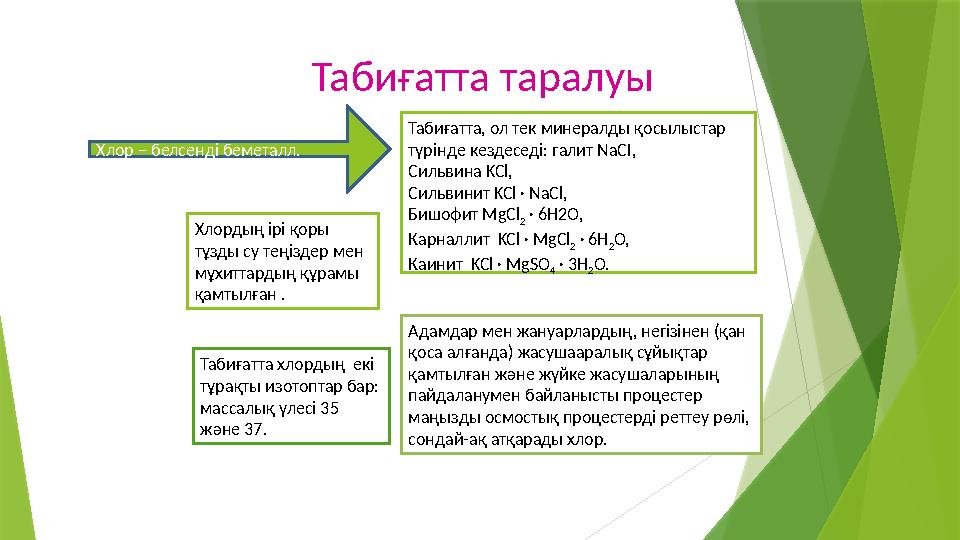
#10 слайд
Табиғатта таралуы
Хлор – белсенді беметалл. Табиғатта, ол тек минералды қосылыстар
түрінде кездеседі: галит NaCI,
Сильвина KCl,
Сильвинит KCl · NaCl,
Бишофит MgCl
2
· 6H2O,
Карналлит
KCl · MgCl
2 · 6Н
2 O,
Каинит
KCl · MgSO
4 · 3Н
2 О. Хлордың ірі қоры
тұзды су теңіздер мен
мұхиттардың құрамы
қамтылған .
Адамдар мен жануарлардың, негізінен (қан
қоса алғанда) жасушааралық сұйықтар
қамтылған және жүйке жасушаларының
пайдаланумен байланысты процестер
маңызды осмостық процестерді реттеу рөлі,
сондай-ақ атқарады хлор.Табиғатта хлордың екі
тұрақты изотоптар бар:
массалық үлесі 35
және 37.
10 слайд
Табиғатта таралуы Хлор – белсенді беметалл. Табиғатта, ол тек минералды қосылыстар түрінде кездеседі: галит NaCI, Сильвина KCl, Сильвинит KCl · NaCl, Бишофит MgCl 2 · 6H2O, Карналлит KCl · MgCl 2 · 6Н 2 O, Каинит KCl · MgSO 4 · 3Н 2 О. Хлордың ірі қоры тұзды су теңіздер мен мұхиттардың құрамы қамтылған . Адамдар мен жануарлардың, негізінен (қан қоса алғанда) жасушааралық сұйықтар қамтылған және жүйке жасушаларының пайдаланумен байланысты процестер маңызды осмостық процестерді реттеу рөлі, сондай-ақ атқарады хлор.Табиғатта хлордың екі тұрақты изотоптар бар: массалық үлесі 35 және 37.

#11 слайд
Химиялық қасиеттері
Колбаға Қойылтылған
аммиак ерітіндісін
хлор бірнеше
тамшысын Қапал
болды.
4NН3 + ЗСl2 = NСl3 + ЗNН4СlТеңдеуге сәйкес TSd3 (метилен
азот жарылғыш сары май)
қалыптасады аммиак хлордың
реакция:
Бір колбада жарықтары және шағын
тұтануына түсіндіреді бірден ыдырауға
біздің тәжірибе хлориді азот, тұрғысында
11 слайд
Химиялық қасиеттері Колбаға Қойылтылған аммиак ерітіндісін хлор бірнеше тамшысын Қапал болды. 4NН3 + ЗСl2 = NСl3 + ЗNН4СlТеңдеуге сәйкес TSd3 (метилен азот жарылғыш сары май) қалыптасады аммиак хлордың реакция: Бір колбада жарықтары және шағын тұтануына түсіндіреді бірден ыдырауға біздің тәжірибе хлориді азот, тұрғысында

#12 слайд
Жай заттармен әрекеттесуі
•
Cu+Cl2=CuCl2+Q
•
Fe+Cl2=FeCl3
•
H2+Cl2=2HCl
•
Cl2+H2O=HCl+HClO хлорлылау қышқыл
•
Хлормен қыздырылған натрий белсенді
әрекеттеседі:
•
2Na+Cl2=2NaCl
12 слайд
Жай заттармен әрекеттесуі • Cu+Cl2=CuCl2+Q • Fe+Cl2=FeCl3 • H2+Cl2=2HCl • Cl2+H2O=HCl+HClO хлорлылау қышқыл • Хлормен қыздырылған натрий белсенді әрекеттеседі: • 2Na+Cl2=2NaCl

#13 слайд
1-тапсырма
1 . Галогендер тобына жатады:
А) Ca,Mg,Ba,Si,In В) Cl,I,K,Al,At
Б) F,Cl,Br,I,At Г) Ne,F, He,Zn
2. Теңіз балдырында кездесетін элемент:
А)фтор В) бром
Б) хлор Г) йод
3. Галоген тобына жатпайтын элемент
А) C І В) I
Б) Br Г) Ne
Бекіту тапсырмасы
13 слайд
1-тапсырма 1 . Галогендер тобына жатады: А) Ca,Mg,Ba,Si,In В) Cl,I,K,Al,At Б) F,Cl,Br,I,At Г) Ne,F, He,Zn 2. Теңіз балдырында кездесетін элемент: А)фтор В) бром Б) хлор Г) йод 3. Галоген тобына жатпайтын элемент А) C І В) I Б) Br Г) Ne Бекіту тапсырмасы

#14 слайд
4. Галогендер атауын ең алғаш кім және қай жылы ашты?
А) 1811 ж. Швейгер В) 1855ж. Картуа
Б) 1911ж. Анри Муасан Г) 1920ж. Балар
5. Электртерістігі ең жоғары элемент:
А) C І В) I
Б) Br Г) F
Дескриптор:
Галогендер тобына жататын элементтерді көрсетеді.
Галогендердің қасиеттерін анықтайды.
14 слайд
4. Галогендер атауын ең алғаш кім және қай жылы ашты? А) 1811 ж. Швейгер В) 1855ж. Картуа Б) 1911ж. Анри Муасан Г) 1920ж. Балар 5. Электртерістігі ең жоғары элемент: А) C І В) I Б) Br Г) F Дескриптор: Галогендер тобына жататын элементтерді көрсетеді. Галогендердің қасиеттерін анықтайды.

шағым қалдыра аласыз
















