Скорость химических реакций. Факторы, влияющие на скорость химической реакции.
Скорость химических реакций. Факторы, влияющие на скорость химической реакции.


#1 слайд
1 слайд

#2 слайд
Раствор, содержащий 34 г нитрата серебра,
смешали с раствором, содержащим 34 г
хлорида натрия. Найдите массу полученного
осадка.
Дано:
m(AgNO₃)= 34 г
m(NaCl) = 34 г
Найти: m(осадка AgCl )= ?
Решение
Уравнение реакции:
AgNO₃ + NaCl → AgCl↓ + NaNO₃
Молярная масса AgNO₃ = 170 г/моль
Молярная масса NaCl = 58,5 г/моль
Молярная масса AgCl = 143,5 г/моль
Кол-во вещества AgNO₃: n = 34 / 170 =
0,2 моль
Кол-во вещества NaCl: n = 34 / 58,5 ≈
0,581 моль
Соотношение по уравнению: 1 : 1
→ AgNO₃ в недостатке, значит AgCl = 0,2
моль
Масса AgCl = 0,2 × 143,5 = 28,7 г
2 слайд
Раствор, содержащий 34 г нитрата серебра, смешали с раствором, содержащим 34 г хлорида натрия. Найдите массу полученного осадка. Дано: m(AgNO₃)= 34 г m(NaCl) = 34 г Найти: m(осадка AgCl )= ? Решение Уравнение реакции: AgNO₃ + NaCl → AgCl↓ + NaNO₃ Молярная масса AgNO₃ = 170 г/моль Молярная масса NaCl = 58,5 г/моль Молярная масса AgCl = 143,5 г/моль Кол-во вещества AgNO₃: n = 34 / 170 = 0,2 моль Кол-во вещества NaCl: n = 34 / 58,5 ≈ 0,581 моль Соотношение по уравнению: 1 : 1 → AgNO₃ в недостатке, значит AgCl = 0,2 моль Масса AgCl = 0,2 × 143,5 = 28,7 г

#3 слайд
Скажите, а вы встречались в своей жизни с
реакциями идущими очень быстро?
Приведите примеры реакций, которые идут очень
быстро или медленно.
(Взрыв - мгновенно, сжигание топлива в космическом
корабле). Назовем их- реакции «молнии».
А реакции идущие медленно? Назовем их- реакции
– «черепахи».
а) ржавление железа; б) скисание молока;
Для полного гниения брошенной в лесу газеты- 1 год.
Ржавление консервной банки – 10 лет.
Стекло практически не разрушается в течение
столетий. Эти реакции низкой скорости.
3 слайд
Скажите, а вы встречались в своей жизни с реакциями идущими очень быстро? Приведите примеры реакций, которые идут очень быстро или медленно. (Взрыв - мгновенно, сжигание топлива в космическом корабле). Назовем их- реакции «молнии». А реакции идущие медленно? Назовем их- реакции – «черепахи». а) ржавление железа; б) скисание молока; Для полного гниения брошенной в лесу газеты- 1 год. Ржавление консервной банки – 10 лет. Стекло практически не разрушается в течение столетий. Эти реакции низкой скорости.

#4 слайд
«Скорость химической
реакции. Факторы,
влияющие на скорость
химической
реакции»
4 слайд
«Скорость химической реакции. Факторы, влияющие на скорость химической реакции»

#5 слайд
Цели:
Актуализировать и углубить знания
о скорости химической реакции
Рассмотреть и экспериментально
изучить зависимость скорости
химической реакции от различных
факторов
5 слайд
Цели: Актуализировать и углубить знания о скорости химической реакции Рассмотреть и экспериментально изучить зависимость скорости химической реакции от различных факторов

#6 слайд
Что такое химическая
реакция?
Это активное сталкивание
молекул, где происходит разрыв
старых связей и образование новых
связей.
Раздел химии, изучающий
скорость химических реакций,
называют химической
кинетикой
6 слайд
Что такое химическая реакция? Это активное сталкивание молекул, где происходит разрыв старых связей и образование новых связей. Раздел химии, изучающий скорость химических реакций, называют химической кинетикой

#7 слайд
7 слайд

#8 слайд
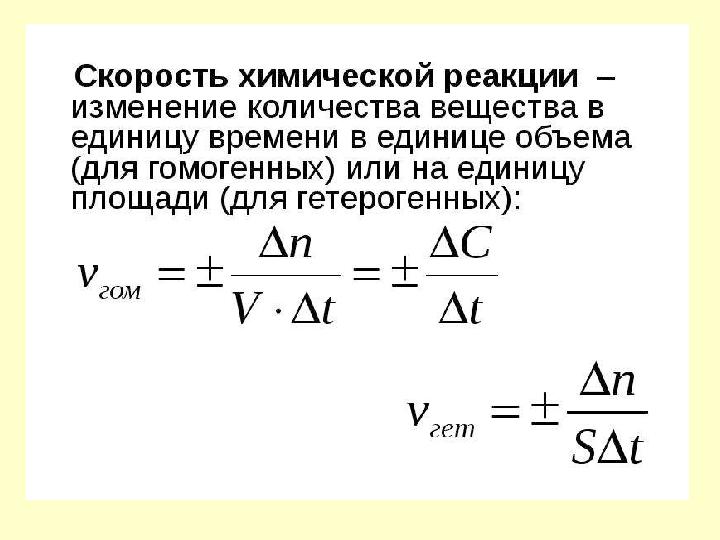
Выражение скорости химической
реакции
t
C
tt
CC
V
cр
12
12
8 слайд
Выражение скорости химической реакции t C tt CC V cр 12 12
#9 слайд
9 слайд
#10 слайд
10 слайд

#11 слайд
Лабораторный опыт № 6
«Влияние температуры
концентрации и размера
частиц на скорость
реакции»
11 слайд
Лабораторный опыт № 6 «Влияние температуры концентрации и размера частиц на скорость реакции»

#12 слайд
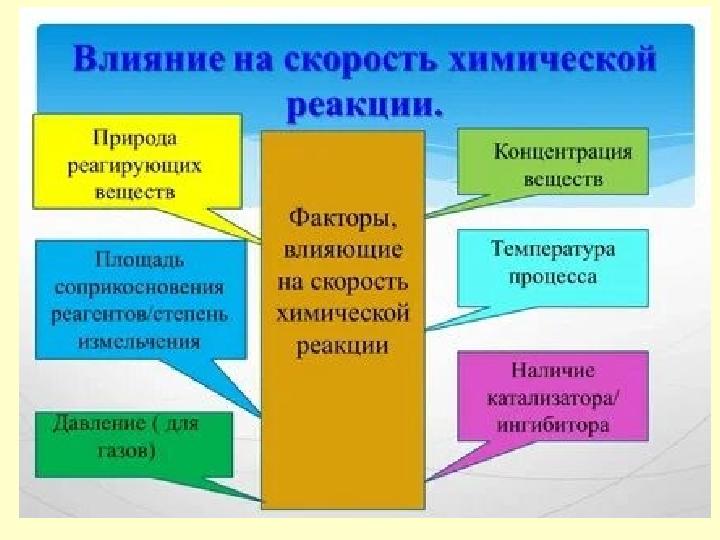
Задание 1. Природа
реагирующих веществ
Под природой реагирующих веществ понимают
их состав, строение, взаимное влияние атомов
в веществах.
Проведите опыт: В две пробирки поместите по
грануле цинка. В одну прилейте соляную
кислоту, а во вторую уксусную.
Что наблюдали в результате реакции? Почему
реакции имеют разные скорости?
Сформулируйте зависимость скорости
химической реакции от природы реагирующих
веществ.
12 слайд
Задание 1. Природа реагирующих веществ Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в веществах. Проведите опыт: В две пробирки поместите по грануле цинка. В одну прилейте соляную кислоту, а во вторую уксусную. Что наблюдали в результате реакции? Почему реакции имеют разные скорости? Сформулируйте зависимость скорости химической реакции от природы реагирующих веществ.

#13 слайд
Задание 2. Поверхность
соприкосновения веществ
Проведите опыт: В две пробирки прилейте уксусную
кислоту.
В одну поместите порошок мела, а во вторую кусочек мела.
Что наблюдали в результате реакции? Почему
реакции имеют разные скорости?
Сформулируйте зависимость скорости химической реакции
от
поверхности соприкосновения реагирующих веществ.
13 слайд
Задание 2. Поверхность соприкосновения веществ Проведите опыт: В две пробирки прилейте уксусную кислоту. В одну поместите порошок мела, а во вторую кусочек мела. Что наблюдали в результате реакции? Почему реакции имеют разные скорости? Сформулируйте зависимость скорости химической реакции от поверхности соприкосновения реагирующих веществ.

#14 слайд
Задание 3. Концентрация
реагирующих веществ
Проведите опыт: В две пробирки прилейте 2-3
мл соляной кислоты. В одну пробирку прилейте
столько же воды, как кислоты 2-3 мл. Затем в
каждую пробирку поместите гранулу цинка.
Что наблюдали в результате реакции? Почему
реакции имеют разные скорости?
Сформулируйте зависимость скорости
химической реакции от концентрации
реагирующих веществ.
14 слайд
Задание 3. Концентрация реагирующих веществ Проведите опыт: В две пробирки прилейте 2-3 мл соляной кислоты. В одну пробирку прилейте столько же воды, как кислоты 2-3 мл. Затем в каждую пробирку поместите гранулу цинка. Что наблюдали в результате реакции? Почему реакции имеют разные скорости? Сформулируйте зависимость скорости химической реакции от концентрации реагирующих веществ.

#15 слайд
Задание 4. Температура
реагирующих веществ
Проведите опыт: В две пробирки поместите
небольшое количество оксида меди и в
каждую прилейте 2-3 мл серной кислоты. Одну
из пробирок нагрейте.
Что наблюдали в результате реакции? Почему
реакции имеют разные скорости?
Сформулируйте зависимость скорости
химической реакции от увеличения
температуры.
15 слайд
Задание 4. Температура реагирующих веществ Проведите опыт: В две пробирки поместите небольшое количество оксида меди и в каждую прилейте 2-3 мл серной кислоты. Одну из пробирок нагрейте. Что наблюдали в результате реакции? Почему реакции имеют разные скорости? Сформулируйте зависимость скорости химической реакции от увеличения температуры.

#16 слайд
Правило Я. Вант-Гоффа : «При увеличении
температуры на каждые 10 градусов скорость
реакции увеличивается в 2-4 раза».
Математически закон выражается формулой:
V
2=V
1
γ(t2-t1)/10
γ- температурный коэффициент
Я. Вант-Гофф (1852 -
1911). Голландский химик.
Один из основателей
физической химии и
стереохимии
16 слайд
Правило Я. Вант-Гоффа : «При увеличении температуры на каждые 10 градусов скорость реакции увеличивается в 2-4 раза». Математически закон выражается формулой: V 2=V 1 γ(t2-t1)/10 γ- температурный коэффициент Я. Вант-Гофф (1852 - 1911). Голландский химик. Один из основателей физической химии и стереохимии

#17 слайд
Задача 1.
Начальная концентрация вещества А
равна 2,7 моль/л. Через 40сек.
концентрация его стала 2,5 моль/л.
Какова средняя скорость химической
реакции?
17 слайд
Задача 1. Начальная концентрация вещества А равна 2,7 моль/л. Через 40сек. концентрация его стала 2,5 моль/л. Какова средняя скорость химической реакции?

#18 слайд
Задача 2:
Во сколько раз возрастёт скорость
реакции при изменении температуры от
10
0
С до 50
0
С, если известно, что при
повышении температуры на каждые 10
0
С
скорость реакции возрастает в 2 раза.
18 слайд
Задача 2: Во сколько раз возрастёт скорость реакции при изменении температуры от 10 0 С до 50 0 С, если известно, что при повышении температуры на каждые 10 0 С скорость реакции возрастает в 2 раза.

#19 слайд
А теперь ответим на
вопросы:
По каким признакам можно судить о
скорости химической реакции?
Назовите причины, по которым вещества
в кислороде сгорают быстрее, чем на
воздухе.
Назовите причину, по которой угольная
пыль сгорает быстрее, чем кусок угля
такой же массы.
Почему продукты хранят в
холодильнике?
19 слайд
А теперь ответим на вопросы: По каким признакам можно судить о скорости химической реакции? Назовите причины, по которым вещества в кислороде сгорают быстрее, чем на воздухе. Назовите причину, по которой угольная пыль сгорает быстрее, чем кусок угля такой же массы. Почему продукты хранят в холодильнике?

#20 слайд
Домашнее
задание:
§14-15
20 слайд
Домашнее задание: §14-15

шағым қалдыра аласыз
















