Скорость химической реакции. Влияние катализаторов на химические реакции. Катализ.





1 слайд
ГККП «Колледж сервиса и новых технологий»
Скорость химической реакции. Влияние
катализаторов на химические реакции.
Катализ.
Подготовила преподаватиель химии Нургалиева Нургуль
Джангельдиновна
1 слайд
ГККП «Колледж сервиса и новых технологий» Скорость химической реакции. Влияние катализаторов на химические реакции. Катализ. Подготовила преподаватиель химии Нургалиева Нургуль Джангельдиновна

2 слайд
Химический диктант по теме “Круговорот химических
элементов в природе. Тепловые эффекты химических
реакций”.
1. Круговорот веществ в природе – это … .
2. Примеры круговоротов каких веществ (химических элементов) вы
можете привести?
3. Тепловым эффектом химической реакции называют … .
4. Тепловой эффект химической реакции обозначают … .
5. Тепловой эффект химической реакции выражают в … .
6. Формулировка закона Лавуазье–Лапласа: « … ».
7. «Тепловой эффект реакции зависит только от начального и конечного
состояния веществ и не зависит от промежуточных стадий процесса».
Этот закон сформулировал … .
2 слайд
Химический диктант по теме “Круговорот химических элементов в природе. Тепловые эффекты химических реакций”. 1. Круговорот веществ в природе – это … . 2. Примеры круговоротов каких веществ (химических элементов) вы можете привести? 3. Тепловым эффектом химической реакции называют … . 4. Тепловой эффект химической реакции обозначают … . 5. Тепловой эффект химической реакции выражают в … . 6. Формулировка закона Лавуазье–Лапласа: « … ». 7. «Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса». Этот закон сформулировал … .
3 слайд
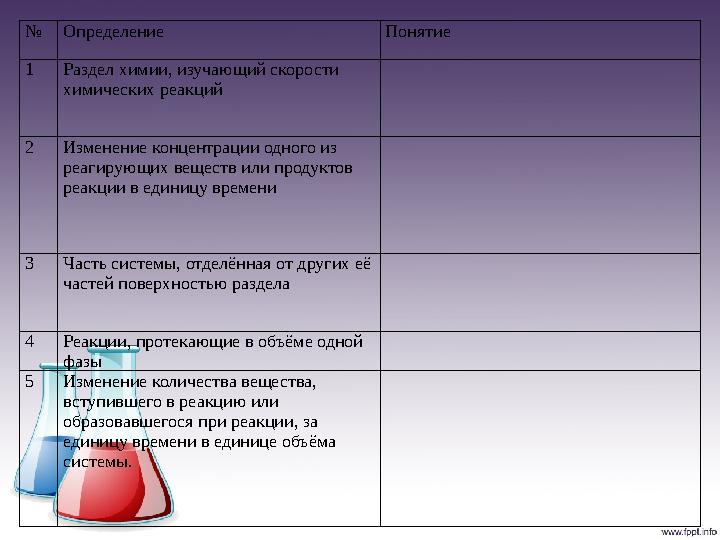
№ Определение Понятие
1 Раздел химии, изучающий скорости
химических реакций
2 Изменение концентрации одного из
реагирующих веществ или продуктов
реакции в единицу времени
3 Часть системы, отделённая от других её
частей поверхностью раздела
4 Реакции, протекающие в объёме одной
фазы
5 Изменение количества вещества,
вступившего в реакцию или
образовавшегося при реакции, за
единицу времени в единице объёма
системы.
3 слайд
№ Определение Понятие 1 Раздел химии, изучающий скорости химических реакций 2 Изменение концентрации одного из реагирующих веществ или продуктов реакции в единицу времени 3 Часть системы, отделённая от других её частей поверхностью раздела 4 Реакции, протекающие в объёме одной фазы 5 Изменение количества вещества, вступившего в реакцию или образовавшегося при реакции, за единицу времени в единице объёма системы.
4 слайд
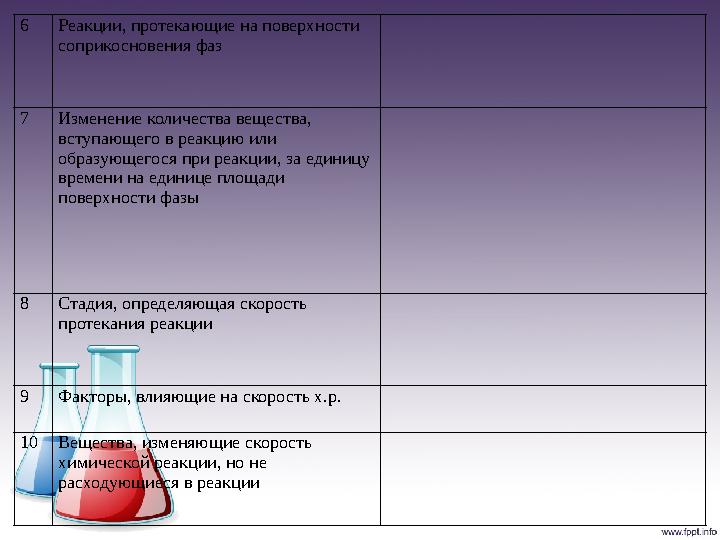
6 Реакции, протекающие на поверхности
соприкосновения фаз
7 Изменение количества вещества,
вступающего в реакцию или
образующегося при реакции, за единицу
времени на единице площади
поверхности фазы
8 Стадия, определяющая скорость
протекания реакции
9 Факторы, влияющие на скорость х.р.
10 Вещества, изменяющие скорость
химической реакции, но не
расходующиеся в реакции
4 слайд
6 Реакции, протекающие на поверхности соприкосновения фаз 7 Изменение количества вещества, вступающего в реакцию или образующегося при реакции, за единицу времени на единице площади поверхности фазы 8 Стадия, определяющая скорость протекания реакции 9 Факторы, влияющие на скорость х.р. 10 Вещества, изменяющие скорость химической реакции, но не расходующиеся в реакции
5 слайд
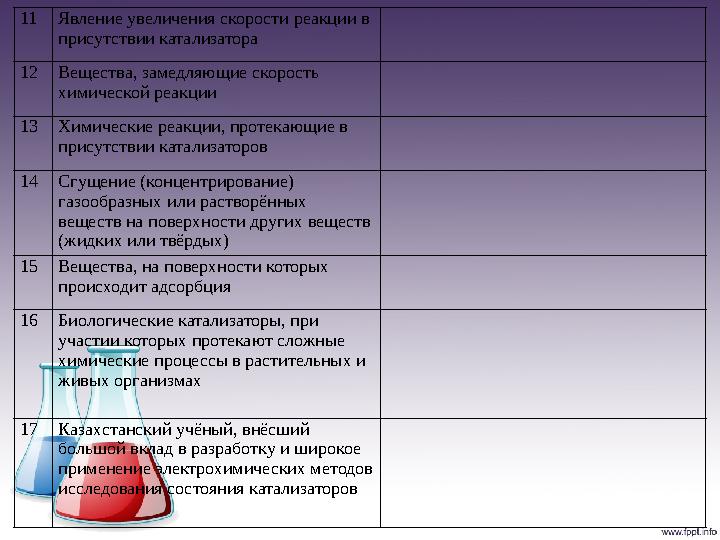
11 Явление увеличения скорости реакции в
присутствии катализатора
12 Вещества, замедляющие скорость
химической реакции
13 Химические реакции, протекающие в
присутствии катализаторов
14 Сгущение (концентрирование)
газообразных или растворённых
веществ на поверхности других веществ
(жидких или твёрдых)
15 Вещества, на поверхности которых
происходит адсорбция
16 Биологические катализаторы, при
участии которых протекают сложные
химические процессы в растительных и
живых организмах
17 Казахстанский учёный, внёсший
большой вклад в разработку и широкое
применение электрохимических методов
исследования состояния катализаторов
5 слайд
11 Явление увеличения скорости реакции в присутствии катализатора 12 Вещества, замедляющие скорость химической реакции 13 Химические реакции, протекающие в присутствии катализаторов 14 Сгущение (концентрирование) газообразных или растворённых веществ на поверхности других веществ (жидких или твёрдых) 15 Вещества, на поверхности которых происходит адсорбция 16 Биологические катализаторы, при участии которых протекают сложные химические процессы в растительных и живых организмах 17 Казахстанский учёный, внёсший большой вклад в разработку и широкое применение электрохимических методов исследования состояния катализаторов

6 слайд
Влияние различных факторов на скорость химических реакций:
- природа реагирующих веществ : более прочные молекулы труднее вступают в
реакцию, и скорость такой реакции мала;
- их концентрации : основной закон химической кинетики, устанавливающий
зависимость зависимость скорости х.р. от концентрации реагирующих
веществ: скорость химической реакции пропорциональна произведению
концентраций реагирующих веществ (ЗДМ)
- присутствие в системе катализатора ,
- величина поверхности соприкосновения (гетерог.р.)
- температура : согласно правилу Вант-Гоффа: скорость большинства
химических реакцийв гомогенных системах возрастает приблизительно в 2-4
раза при повышении температуры на каждые 10 градусов. – температурный
коэффициент химической реакции , или коэффициент Вант-Гоффа .
Теория активных столкновений. С. Аррениус (1889). Энергия,
которую надо сообщить частицам реагирующих веществ, чтобы превратить
их в активные, столкновение которых могло бы привести к образованию
новых веществ, называется энергией активации .
6 слайд
Влияние различных факторов на скорость химических реакций: - природа реагирующих веществ : более прочные молекулы труднее вступают в реакцию, и скорость такой реакции мала; - их концентрации : основной закон химической кинетики, устанавливающий зависимость зависимость скорости х.р. от концентрации реагирующих веществ: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ (ЗДМ) - присутствие в системе катализатора , - величина поверхности соприкосновения (гетерог.р.) - температура : согласно правилу Вант-Гоффа: скорость большинства химических реакцийв гомогенных системах возрастает приблизительно в 2-4 раза при повышении температуры на каждые 10 градусов. – температурный коэффициент химической реакции , или коэффициент Вант-Гоффа . Теория активных столкновений. С. Аррениус (1889). Энергия, которую надо сообщить частицам реагирующих веществ, чтобы превратить их в активные, столкновение которых могло бы привести к образованию новых веществ, называется энергией активации .

7 слайд
Дмитрий Владимирович Сокольский
•
(1910—1987) — химик, академик АН
КазССР ( 1951 ), доктор химических наук
( 1949 ), профессор ( 1949 ), заслуженный
деятель науки КазССР ( 1960 ),
Герой Социалистического Труда ( 1969 ),
лауреат Государственной премии
КазССР ( 1974 ), почётный доктор
Будапештского политехнического
университета ( 1975 ).
•
Создал теорию оптимизации
катализаторов гидрогенизации.
Разработал потенциометрический метод
изучения работающих катализаторов-
электродов.
7 слайд
Дмитрий Владимирович Сокольский • (1910—1987) — химик, академик АН КазССР ( 1951 ), доктор химических наук ( 1949 ), профессор ( 1949 ), заслуженный деятель науки КазССР ( 1960 ), Герой Социалистического Труда ( 1969 ), лауреат Государственной премии КазССР ( 1974 ), почётный доктор Будапештского политехнического университета ( 1975 ). • Создал теорию оптимизации катализаторов гидрогенизации. Разработал потенциометрический метод изучения работающих катализаторов- электродов.

8 слайд
Катализ
•
Одно из наиболее эффективных средств воздействия на скорость химических
реакций – использование катализаторов, то тесть веществ, которые повышают
скорость химической реакции, но сами не расходуются в этом
процессе. Реакции, протекающите под действием катализаторов, называют
каталитическими . Около 90% промышленных химических процессов –
каталитические . Катализаторы подразделяются на гомогенные и
гетерогенные.Влияние катализаторов на скорость реакции называется
катализом . Различают гомогенный и гетерогенный катализ.
•
Гомогенным называют катализ, при котором и реагенты, и катализатор
находятся в одном агрегатном состоянии. Типичными гомогенными
катализаторами являются кислоты и основания.
•
Гетерогенными называют катализ, при котором реагенты и катализатор
находятся в различных агрегаиных состояниях. В качестве гетерогенных
катализаторов применяют металлы, их оксиды и др.
•
Наряду с катализаторами существуют вещества, которые замедляют
химические процессы.Такие вещества называют ингибиторами.
8 слайд
Катализ • Одно из наиболее эффективных средств воздействия на скорость химических реакций – использование катализаторов, то тесть веществ, которые повышают скорость химической реакции, но сами не расходуются в этом процессе. Реакции, протекающите под действием катализаторов, называют каталитическими . Около 90% промышленных химических процессов – каталитические . Катализаторы подразделяются на гомогенные и гетерогенные.Влияние катализаторов на скорость реакции называется катализом . Различают гомогенный и гетерогенный катализ. • Гомогенным называют катализ, при котором и реагенты, и катализатор находятся в одном агрегатном состоянии. Типичными гомогенными катализаторами являются кислоты и основания. • Гетерогенными называют катализ, при котором реагенты и катализатор находятся в различных агрегаиных состояниях. В качестве гетерогенных катализаторов применяют металлы, их оксиды и др. • Наряду с катализаторами существуют вещества, которые замедляют химические процессы.Такие вещества называют ингибиторами.

9 слайд
Что узнали нового? Что
понравилось? Что не
понравилось?
9 слайд
Что узнали нового? Что понравилось? Что не понравилось?

10 слайд
Домашнее задание:
1.Химический диктант по теме “Круговорот химических
элементов в природе. Тепловые эффекты химических
реакций”.
2. Заполнить таблицу
10 слайд
Домашнее задание: 1.Химический диктант по теме “Круговорот химических элементов в природе. Тепловые эффекты химических реакций”. 2. Заполнить таблицу















