Спирттер және оның қасиеттері
Спирттер және оның қасиеттері


#1 слайд
СПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ
СПИРТЫ
Спирты – соединения общей формулы
R – ОН
Соединения, в которых ОН – группа связана с
ароматическим радикалом, называются фенолами:
А r – ОНгде R – углеводородный радикал; ОН – гидроксигруппа.
1 слайд
СПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ СПИРТЫ Спирты – соединения общей формулы R – ОН Соединения, в которых ОН – группа связана с ароматическим радикалом, называются фенолами: А r – ОНгде R – углеводородный радикал; ОН – гидроксигруппа.

#2 слайд
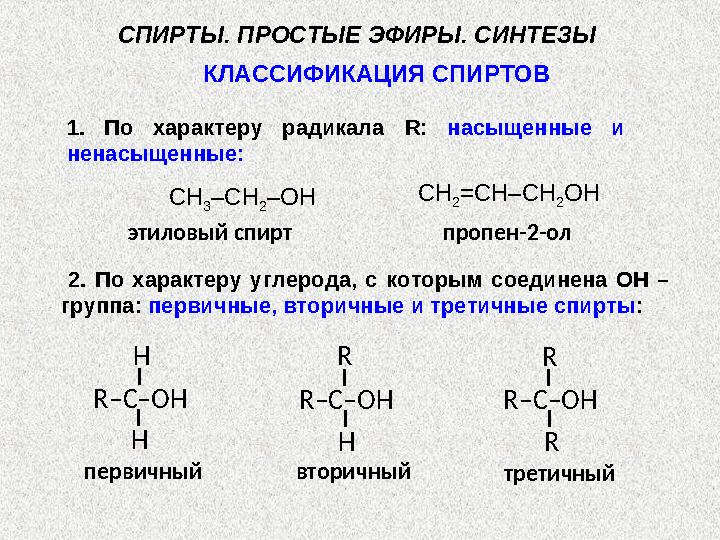
2. По характеру углерода, с которым соединена ОН –
группа: первичные, вторичные и третичные спирты :
первичный
вторичный
третичныйR –С–ОН H
H R
HR –С–ОН R
RR –С–ОН СПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ
КЛАССИФИКАЦИЯ СПИРТОВ
1. По характеру радикала R : насыщенные и
ненасыщенные:
СН
3 –СН
2 –ОН
этиловый спирт СН
2 =СН–СН
2 ОН
пропен-2-ол
2 слайд
2. По характеру углерода, с которым соединена ОН – группа: первичные, вторичные и третичные спирты : первичный вторичный третичныйR –С–ОН H H R HR –С–ОН R RR –С–ОН СПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ КЛАССИФИКАЦИЯ СПИРТОВ 1. По характеру радикала R : насыщенные и ненасыщенные: СН 3 –СН 2 –ОН этиловый спирт СН 2 =СН–СН 2 ОН пропен-2-ол
#3 слайд
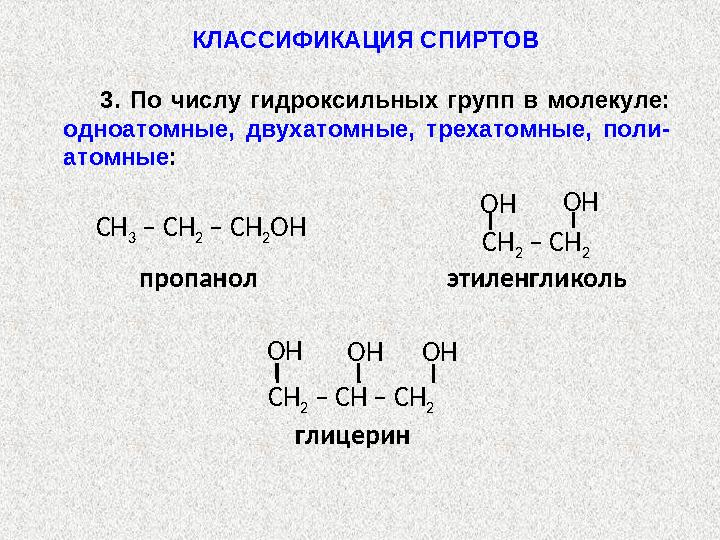
3. По числу гидроксильных групп в молекуле:
одноатомные, двухатомные, трехатомные, поли -
атомные :
пропанолСН
3 – СН
2 – СН
2 ОН
этиленгликоль СН
2 – СН
2OH
OH
глицеринСН
2 – СН – СН
2OHOHOHКЛАССИФИКАЦИЯ СПИРТОВ
3 слайд
3. По числу гидроксильных групп в молекуле: одноатомные, двухатомные, трехатомные, поли - атомные : пропанолСН 3 – СН 2 – СН 2 ОН этиленгликоль СН 2 – СН 2OH OH глицеринСН 2 – СН – СН 2OHOHOHКЛАССИФИКАЦИЯ СПИРТОВ
#4 слайд
НОМЕНКЛАТУРА СПИРТОВ
1. Рациональная номенклатура : спирты называют
по радикалу, связанному с ОН – группой:
СН
3 ОН
метиловый спирт СН
3 – СН – СН
3
СПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ
изопропиловый спиртOH
СН
2 = СН – СН‒ОН
СН
3 – СН – ОН
С
6 H
5
аллиловый спирт
а - фенилэтиловый спирт
4 слайд
НОМЕНКЛАТУРА СПИРТОВ 1. Рациональная номенклатура : спирты называют по радикалу, связанному с ОН – группой: СН 3 ОН метиловый спирт СН 3 – СН – СН 3 СПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ изопропиловый спиртOH СН 2 = СН – СН‒ОН СН 3 – СН – ОН С 6 H 5 аллиловый спирт а - фенилэтиловый спирт
#5 слайд
СН
3 ОН
метанол СН
3 –СН–СН
3
СН
3 –СН
2 –СН– СН
2 СН
3 пропанол-2 OH
CH
2 OHНОМЕНКЛАТУРА СПИРТОВСПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ
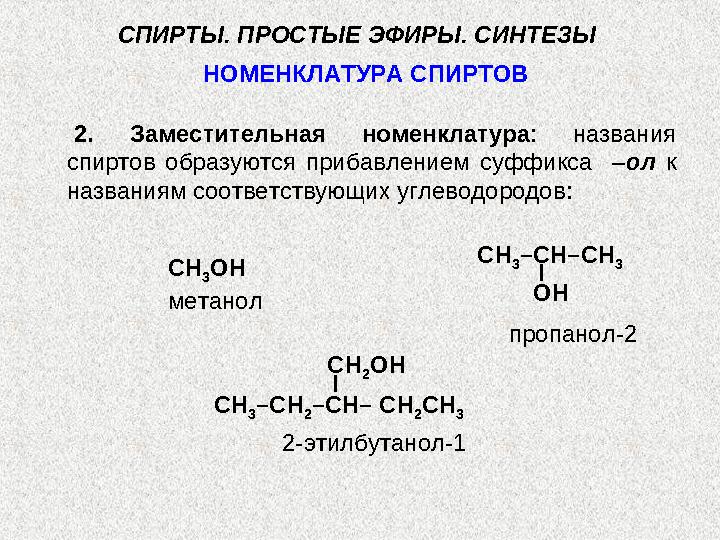
2. Заместительная номенклатура : названия
спиртов образуются прибавлением суффикса – ол к
названиям соответствующих углеводородов:
2-этилбутанол-1
5 слайд
СН 3 ОН метанол СН 3 –СН–СН 3 СН 3 –СН 2 –СН– СН 2 СН 3 пропанол-2 OH CH 2 OHНОМЕНКЛАТУРА СПИРТОВСПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ 2. Заместительная номенклатура : названия спиртов образуются прибавлением суффикса – ол к названиям соответствующих углеводородов: 2-этилбутанол-1
#6 слайд
СН
3 – ОН
карбинол СН
3 – СН – ОН НОМЕНКЛАТУРА СПИРТОВСПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ
3. Карбинольная номенклатура : в этом случае
спирты рассматривают как производные карбинола
(метанола):
диметилкарбинол СН
3
6 слайд
СН 3 – ОН карбинол СН 3 – СН – ОН НОМЕНКЛАТУРА СПИРТОВСПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ 3. Карбинольная номенклатура : в этом случае спирты рассматривают как производные карбинола (метанола): диметилкарбинол СН 3

#7 слайд
ФИЗИЧЕСКИЕ СВОЙСТВА СПИРТОВ
СН
3 – СН
3 ………….. 30 - 88,5
СН
3 – С l ……………. 50,5 - 24,2
СН
3 – NH
2 …………. 31 - 6,7
СН
3 – OH ………….. 32 + 64,7 мол. масса Т. кип., СП ССПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ
7 слайд
ФИЗИЧЕСКИЕ СВОЙСТВА СПИРТОВ СН 3 – СН 3 ………….. 30 - 88,5 СН 3 – С l ……………. 50,5 - 24,2 СН 3 – NH 2 …………. 31 - 6,7 СН 3 – OH ………….. 32 + 64,7 мол. масса Т. кип., СП ССПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ
#8 слайд
Влияние водородной связи на температуру
кипения:
«В группах периодической системы уменьшение
молекулярной массы в ряду однотипных соединений
сопровождается понижением температуры кипения». Общее правило гласит:
Исключения из правила:
Водородные соединения F , O , N , такие как HF , H
2 O ,
NH
3 имеют аномальные температуры кипения: ФИЗИЧЕСКИЕ СВОЙСТВА СПИРТОВ
8 слайд
Влияние водородной связи на температуру кипения: «В группах периодической системы уменьшение молекулярной массы в ряду однотипных соединений сопровождается понижением температуры кипения». Общее правило гласит: Исключения из правила: Водородные соединения F , O , N , такие как HF , H 2 O , NH 3 имеют аномальные температуры кипения: ФИЗИЧЕСКИЕ СВОЙСТВА СПИРТОВ

#9 слайд
молекулярная масса5010 0
-50
-100
-150
-200 0T
кип , 0
С
CH
4SiH
4 PH
3 NH
3
HBr HCIHI
H
2 S HF
H
2 SeH
2 Te H
2 O
Для объяснения этих аномалий было предложено
понятие водородная связь. ФИЗИЧЕСКИЕ СВОЙСТВА СПИРТОВ
9 слайд
молекулярная масса5010 0 -50 -100 -150 -200 0T кип , 0 С CH 4SiH 4 PH 3 NH 3 HBr HCIHI H 2 S HF H 2 SeH 2 Te H 2 O Для объяснения этих аномалий было предложено понятие водородная связь. ФИЗИЧЕСКИЕ СВОЙСТВА СПИРТОВ
#10 слайд
ВОДОРОДНАЯ СВЯЗЬ
Атом водорода служит мостиком между двумя
электроотрицательными атомами, причем с одним из
них он связан ковалентной связью, а с другим –
электростатическими силами притяжения.
Водородные связи обычно изображают
пунктирными линиями:
δ + δ - δ + δ -
H – F --- H –
F δ - δ + δ - δ + δ -
H H HH – O --- H – O --- H – O
H
H
δ - δ + δ - δ +
H – N – H --- O – H δ -
HHH – N --- H – NH H
δ +
δ + δ -
ФИЗИЧЕСКИЕ СВОЙСТВА СПИРТОВ
10 слайд
ВОДОРОДНАЯ СВЯЗЬ Атом водорода служит мостиком между двумя электроотрицательными атомами, причем с одним из них он связан ковалентной связью, а с другим – электростатическими силами притяжения. Водородные связи обычно изображают пунктирными линиями: δ + δ - δ + δ - H – F --- H – F δ - δ + δ - δ + δ - H H HH – O --- H – O --- H – O H H δ - δ + δ - δ + H – N – H --- O – H δ - HHH – N --- H – NH H δ + δ + δ - ФИЗИЧЕСКИЕ СВОЙСТВА СПИРТОВ
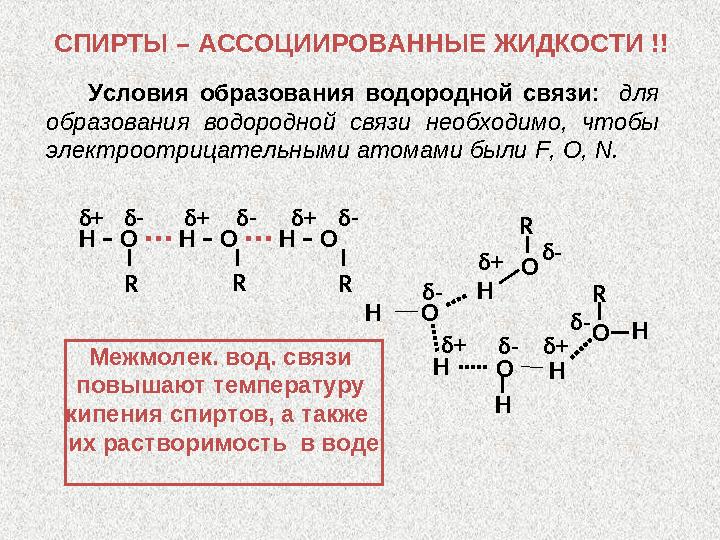
#11 слайд
Условия образования водородной связи : для
образования водородной связи необходимо, чтобы
электроотрицательными атомами были F , O , N .
R
RR δ +
δ - δ -
δ -
δ +
δ +
H – O ∙∙∙ H – O ∙∙∙ H – O
δ -
δ -
δ -
δ -δ +
δ +
δ +
H HH R
RО
Н
О
ННО
ОСПИРТЫ – АССОЦИИРОВАННЫЕ ЖИДКОСТИ !!
Межмолек. вод. связи
повышают температуру
кипения спиртов, а также
их растворимость в воде
11 слайд
Условия образования водородной связи : для образования водородной связи необходимо, чтобы электроотрицательными атомами были F , O , N . R RR δ + δ - δ - δ - δ + δ + H – O ∙∙∙ H – O ∙∙∙ H – O δ - δ - δ - δ -δ + δ + δ + H HH R RО Н О ННО ОСПИРТЫ – АССОЦИИРОВАННЫЕ ЖИДКОСТИ !! Межмолек. вод. связи повышают температуру кипения спиртов, а также их растворимость в воде
#12 слайд
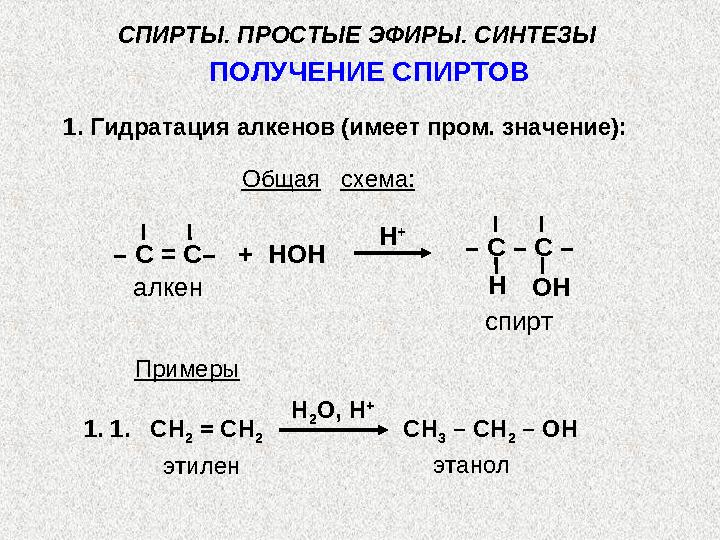
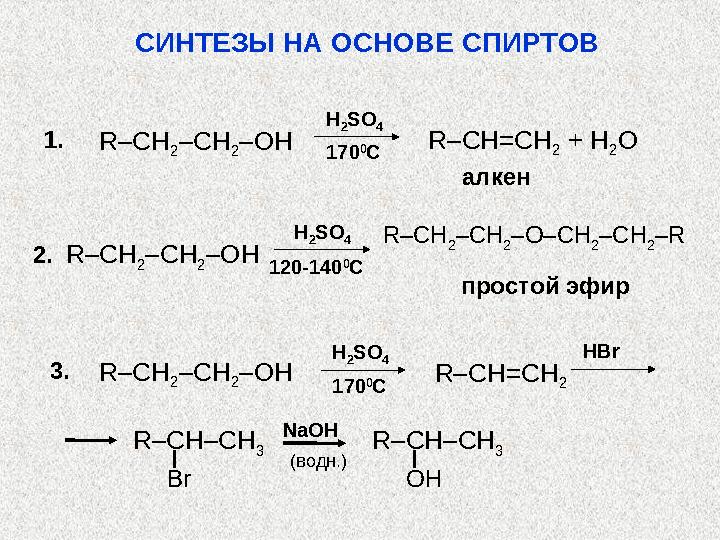
ПОЛУЧЕНИЕ СПИРТОВ
1. Гидратация алкенов (имеет пром. значение):
Общая схема:
Н +
алкен
спирт– С = С– + НОН
Н
ОН– С – С –
Примеры
этилен этанол1. 1. СН
2 = СН
2 СН
3 – СН
2 – ОНН
2 О, H +СПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ
12 слайд
ПОЛУЧЕНИЕ СПИРТОВ 1. Гидратация алкенов (имеет пром. значение): Общая схема: Н + алкен спирт– С = С– + НОН Н ОН– С – С – Примеры этилен этанол1. 1. СН 2 = СН 2 СН 3 – СН 2 – ОНН 2 О, H +СПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ
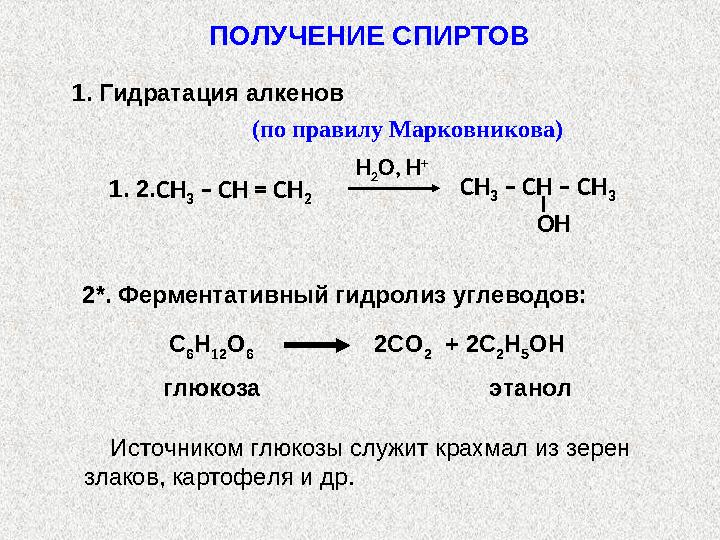
#13 слайд
Н
2 О, H +
СН
3 – СН – СН
3
OHСН
3 – СН = СН
21. 2. (по правилу Марковникова)
2*. Ферментативный гидролиз углеводов:
С
6 Н
12 О
6 2СО
2 + 2С
2 Н
5 ОН
глюкоза этанол
Источником глюкозы служит крахмал из зерен
злаков, картофеля и др. ПОЛУЧЕНИЕ СПИРТОВ
1. Гидратация алкенов
13 слайд
Н 2 О, H + СН 3 – СН – СН 3 OHСН 3 – СН = СН 21. 2. (по правилу Марковникова) 2*. Ферментативный гидролиз углеводов: С 6 Н 12 О 6 2СО 2 + 2С 2 Н 5 ОН глюкоза этанол Источником глюкозы служит крахмал из зерен злаков, картофеля и др. ПОЛУЧЕНИЕ СПИРТОВ 1. Гидратация алкенов

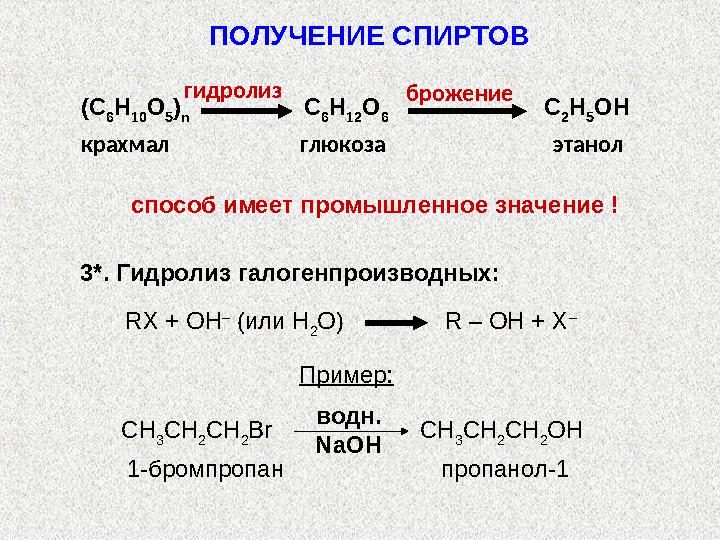
#14 слайд
(С
6 Н
10 О
5 )
n С
6 Н
12 О
6 С
2 Н
5 ОН гидролиз
брожение
крахмал глюкоза этанол
способ имеет промышленное значение !
3*. Гидролиз галогенпроизводных:
RX + OH –
( или H
2 O) R – OH + X –
Пример:
СН
3 СН
2 СН
2 Br СН
3 СН
2 СН
2 OH водн.
NaOH
1-бромпропан пропанол-1ПОЛУЧЕНИЕ СПИРТОВ
14 слайд
(С 6 Н 10 О 5 ) n С 6 Н 12 О 6 С 2 Н 5 ОН гидролиз брожение крахмал глюкоза этанол способ имеет промышленное значение ! 3*. Гидролиз галогенпроизводных: RX + OH – ( или H 2 O) R – OH + X – Пример: СН 3 СН 2 СН 2 Br СН 3 СН 2 СН 2 OH водн. NaOH 1-бромпропан пропанол-1ПОЛУЧЕНИЕ СПИРТОВ

#15 слайд
Условия реакции галогенпроизводных с
NaOH :
1) водный ра-р NaOH – замещение
2) спиртовый ра-р NaOH – отщепление
способность к отщеплению растет
первичный – вторичный – третичный
RX RX RX
способность к замещению растет ПОЛУЧЕНИЕ СПИРТОВ
15 слайд
Условия реакции галогенпроизводных с NaOH : 1) водный ра-р NaOH – замещение 2) спиртовый ра-р NaOH – отщепление способность к отщеплению растет первичный – вторичный – третичный RX RX RX способность к замещению растет ПОЛУЧЕНИЕ СПИРТОВ
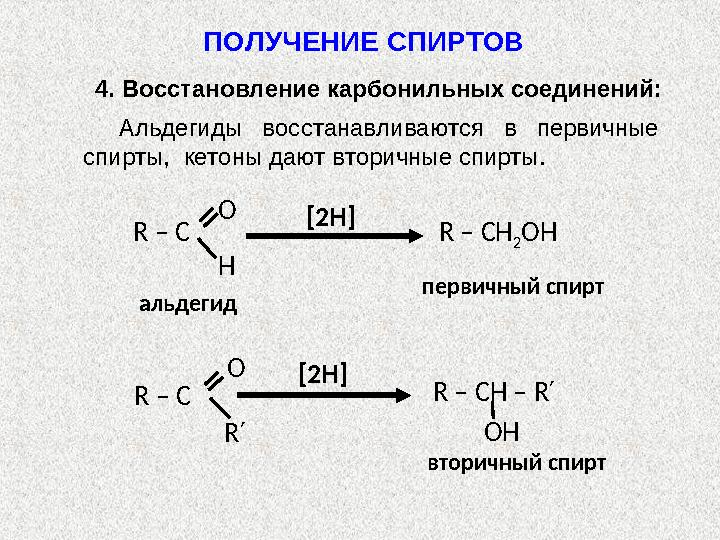
![Альдегиды восстанавливаются в первичные спирты, кетоны дают вторичные спирты. [ 2Н ] альдегид R – СН 2 ОН первичный спиртR Альдегиды восстанавливаются в первичные спирты, кетоны дают вторичные спирты. [ 2Н ] альдегид R – СН 2 ОН первичный спиртR](https://api.ust.kz/storage/files/materials/ppt/image/2019/june/d07/1559935901-23.jpeg)
#16 слайд
Альдегиды восстанавливаются в первичные
спирты, кетоны дают вторичные спирты.
[ 2Н ]
альдегид R – СН
2 ОН
первичный спиртR – С O
H
[ 2Н ]
вторичный спиртO
R ′R – С R – СН – R ′
OHПОЛУЧЕНИЕ СПИРТОВ
4. Восстановление карбонильных соединений:
16 слайд
Альдегиды восстанавливаются в первичные спирты, кетоны дают вторичные спирты. [ 2Н ] альдегид R – СН 2 ОН первичный спиртR – С O H [ 2Н ] вторичный спиртO R ′R – С R – СН – R ′ OHПОЛУЧЕНИЕ СПИРТОВ 4. Восстановление карбонильных соединений:

#17 слайд
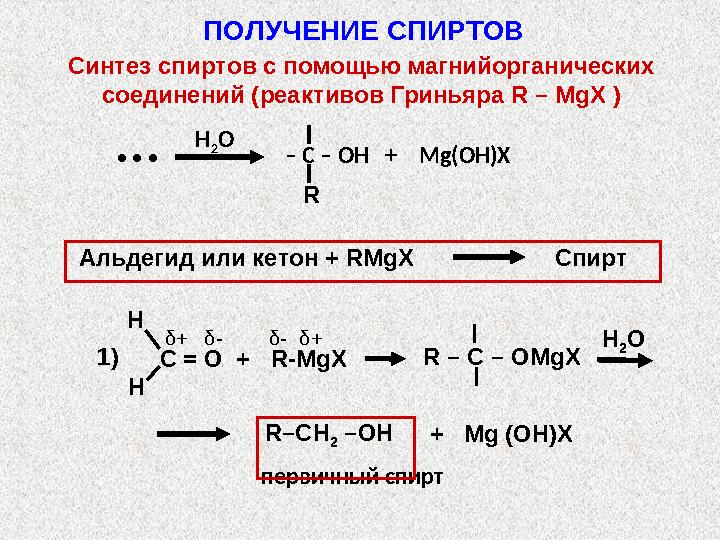
Синтез спиртов с помощью магнийорганических
соединений (реактивов Гриньяра R – MgX )
Реактив Гриньяра RMgX получают по
схеме:
R – X + Mg R – MgXбезводный эфир
(X = Cl, Br, I)
Спирты синтезируют из альдегидов, кетонов
или сложных эфиров по схеме:
Н
2 О
R– C – OMgXδ -δ +
С = О
R: MgX– ПОЛУЧЕНИЕ СПИРТОВ
+ •••
17 слайд
Синтез спиртов с помощью магнийорганических соединений (реактивов Гриньяра R – MgX ) Реактив Гриньяра RMgX получают по схеме: R – X + Mg R – MgXбезводный эфир (X = Cl, Br, I) Спирты синтезируют из альдегидов, кетонов или сложных эфиров по схеме: Н 2 О R– C – OMgXδ -δ + С = О R: MgX– ПОЛУЧЕНИЕ СПИРТОВ + •••
#18 слайд
Н
2 О
R– C – OH + Mg(OH)X
Альдегид или кетон + RMgX Спирт
Н
2 О
R – C – OMgX δ -
δ -
δ +
δ +
Н
Н С = О + R - MgX1)
первичный спирт + Mg (OH)X
R–CH
2 –OH
Синтез спиртов с помощью магнийорганических
соединений (реактивов Гриньяра R – MgX )ПОЛУЧЕНИЕ СПИРТОВ
•••
18 слайд
Н 2 О R– C – OH + Mg(OH)X Альдегид или кетон + RMgX Спирт Н 2 О R – C – OMgX δ - δ - δ + δ + Н Н С = О + R - MgX1) первичный спирт + Mg (OH)X R–CH 2 –OH Синтез спиртов с помощью магнийорганических соединений (реактивов Гриньяра R – MgX )ПОЛУЧЕНИЕ СПИРТОВ •••

#19 слайд
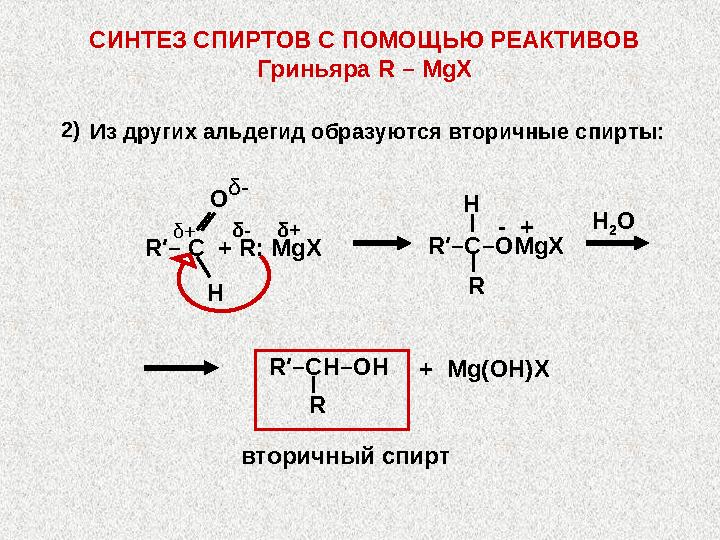
Н
2 О
RН
R′–C–OMgXδ -
δ + δ +
Н О δ -
R′– C + R: MgX2)
вторичный спирт + Mg(OH)X R′–CH–OH
RСИНТЕЗ СПИРТОВ С ПОМОЩЬЮ РЕАКТИВОВ
Гриньяра R – MgX
Из других альдегид образуются вторичные спирты:
+-
19 слайд
Н 2 О RН R′–C–OMgXδ - δ + δ + Н О δ - R′– C + R: MgX2) вторичный спирт + Mg(OH)X R′–CH–OH RСИНТЕЗ СПИРТОВ С ПОМОЩЬЮ РЕАКТИВОВ Гриньяра R – MgX Из других альдегид образуются вторичные спирты: +-
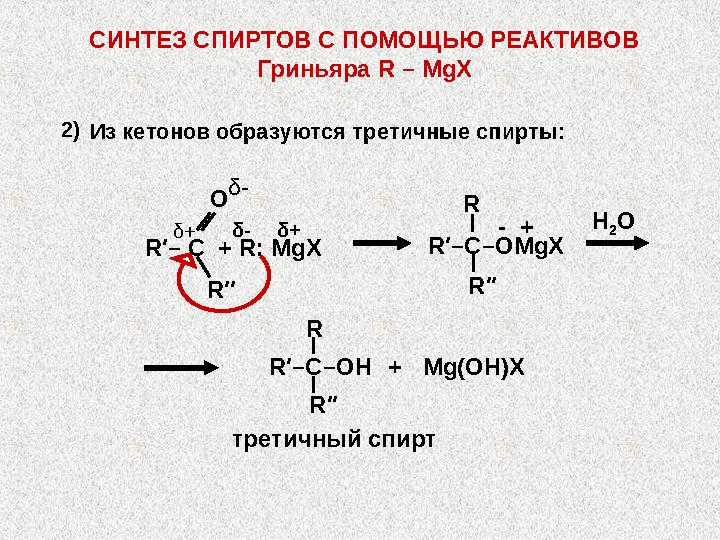
#20 слайд
Н
2 О
R′′R
R′–C–OMgXδ -
δ + δ +
R′′ О δ -
R′– C + R: MgX2)
третичный спирт + Mg(OH)X R′–C–OH
R′′СИНТЕЗ СПИРТОВ С ПОМОЩЬЮ РЕАКТИВОВ
Гриньяра R – MgX
Из кетонов образуются третичные спирты:
+-
R
20 слайд
Н 2 О R′′R R′–C–OMgXδ - δ + δ + R′′ О δ - R′– C + R: MgX2) третичный спирт + Mg(OH)X R′–C–OH R′′СИНТЕЗ СПИРТОВ С ПОМОЩЬЮ РЕАКТИВОВ Гриньяра R – MgX Из кетонов образуются третичные спирты: +- R
#21 слайд
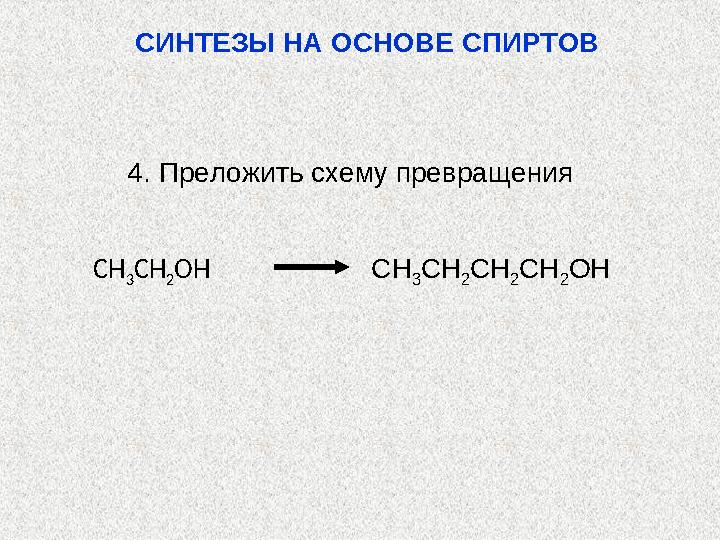
ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ
РАБОТЫ
Предложите схему возможного в лаборатории синтеза
приведенных ниже соединений, исходя из н – бутилового
спирта , и, используя любые необходимые неорганические
реагенты.
а) н-октан
б) октин-3
в) цис -октен-3
г) октанол-4
д) октанон-4
е) 5-( н-пропил) нонанол – 5
ж) н-бутиловый эфир масляной кислоты СПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ
21 слайд
ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ Предложите схему возможного в лаборатории синтеза приведенных ниже соединений, исходя из н – бутилового спирта , и, используя любые необходимые неорганические реагенты. а) н-октан б) октин-3 в) цис -октен-3 г) октанол-4 д) октанон-4 е) 5-( н-пропил) нонанол – 5 ж) н-бутиловый эфир масляной кислоты СПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ

#22 слайд
ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
Химия спиртов определяется их
функциональной группой – гидроксильной
группой ОН .
Для спиртов характерны две группы
реакций:
1. Реакции с разрывом связи О – Н .
2. Реакции с разрывом связи С – О .СПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ
22 слайд
ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ Химия спиртов определяется их функциональной группой – гидроксильной группой ОН . Для спиртов характерны две группы реакций: 1. Реакции с разрывом связи О – Н . 2. Реакции с разрывом связи С – О .СПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ
#23 слайд
ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
Атом водорода ОН – группы способен замещаться
атомом металла:
RO – H + M RO –
M +
+ 1/2 H
2
спирт
алкоголят (соль)
М = Na , K , Mg , Al и др.СПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ
1. Кислотные свойства спиртов
Пример:
2С
2 Н
5 ОН + 2 Na 2С
2 Н
5 ОNa + H
2
этилат натрия
23 слайд
ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ Атом водорода ОН – группы способен замещаться атомом металла: RO – H + M RO – M + + 1/2 H 2 спирт алкоголят (соль) М = Na , K , Mg , Al и др.СПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ 1. Кислотные свойства спиртов Пример: 2С 2 Н 5 ОН + 2 Na 2С 2 Н 5 ОNa + H 2 этилат натрия

#24 слайд
Алкоголяты легко разлагаются водой, что
указывает на то, что спирты – более слабые
кислоты, чем вода !
RO –
Na +
+ H–OH Na +
OH –
+ RO–H
более
сильная
кислота более
слабая
кислотаХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
АЛКОГОЛЯТЫ
соль слабой
кислоты соль сильной
кислоты
24 слайд
Алкоголяты легко разлагаются водой, что указывает на то, что спирты – более слабые кислоты, чем вода ! RO – Na + + H–OH Na + OH – + RO–H более сильная кислота более слабая кислотаХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ АЛКОГОЛЯТЫ соль слабой кислоты соль сильной кислоты
#25 слайд
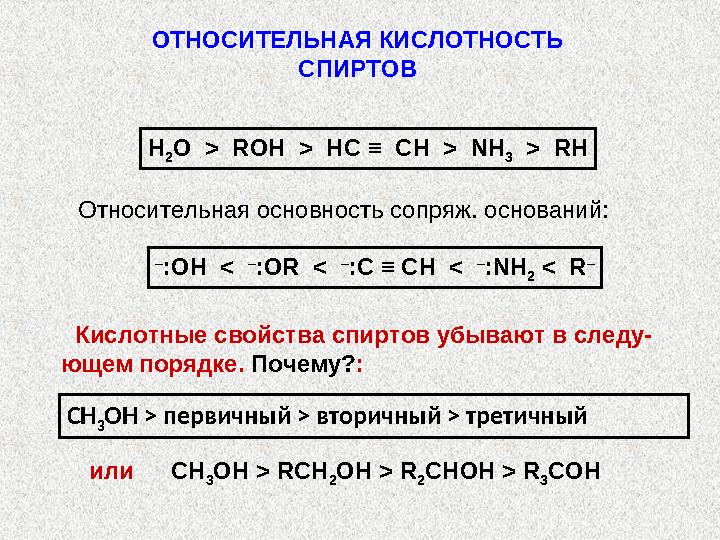
ОТНОСИТЕЛЬНАЯ КИСЛОТНОСТЬ
СПИРТОВ
Н
2 О > ROH > HC ≡ CH > NH
3 > R Н
Относительная основность сопряж. оснований:
–
:ОН < –
: OR < –
: C ≡ CH < –
: NH
2 < R –
Кислотные свойства спиртов убывают в следу-
ющем порядке. Почему? :
СН
3 ОН > RCH
2 OH > R
2 CHOH > R
3 COHСН
3 ОН > первичный > вторичный > третичный
или
25 слайд
ОТНОСИТЕЛЬНАЯ КИСЛОТНОСТЬ СПИРТОВ Н 2 О > ROH > HC ≡ CH > NH 3 > R Н Относительная основность сопряж. оснований: – :ОН < – : OR < – : C ≡ CH < – : NH 2 < R – Кислотные свойства спиртов убывают в следу- ющем порядке. Почему? : СН 3 ОН > RCH 2 OH > R 2 CHOH > R 3 COHСН 3 ОН > первичный > вторичный > третичный или
#26 слайд
ОБЩИЕ ЗАКОНОМЕРНОСТИ:
сопряженная сопряженное протон Н +
:А –
+A – H
Кислотность кислоты АН зависит от того,
насколько хорошо сопряженный ей анион :А –
может
распределить отрицательный заряд, т. е. от его
устойчивости. ОЦЕНКА КИСЛОТНЫХ СВОЙСТВ
кислота основание
Устойчивость иона определяется присутствием
электронодонорных или электроноакцепторных
заместителей.
26 слайд
ОБЩИЕ ЗАКОНОМЕРНОСТИ: сопряженная сопряженное протон Н + :А – +A – H Кислотность кислоты АН зависит от того, насколько хорошо сопряженный ей анион :А – может распределить отрицательный заряд, т. е. от его устойчивости. ОЦЕНКА КИСЛОТНЫХ СВОЙСТВ кислота основание Устойчивость иона определяется присутствием электронодонорных или электроноакцепторных заместителей.

#27 слайд
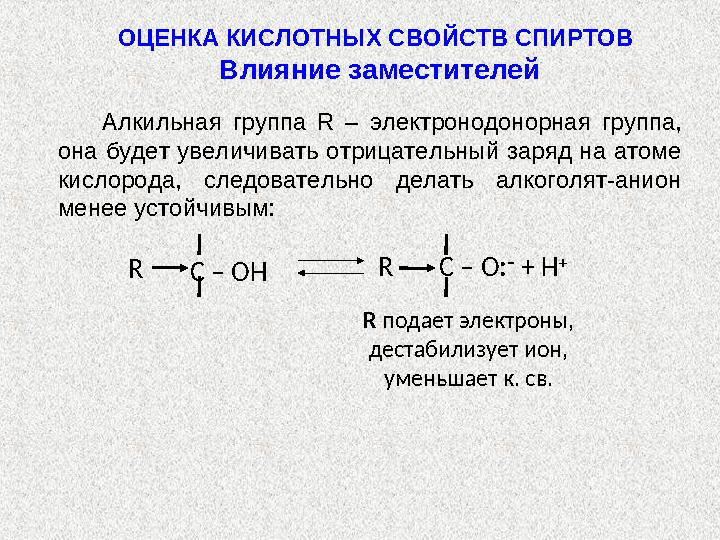
Алкильная группа R – электронодонорная группа,
она будет увеличивать отрицательный заряд на атоме
кислорода, следовательно делать алкоголят-анион
менее устойчивым:
C – O : –
+ H +
R
R
C – OH
R подает электроны,
дестабилизует ион,
уменьшает к. св.ОЦЕНКА КИСЛОТНЫХ СВОЙСТВ СПИРТОВ
Влияние заместителей
27 слайд
Алкильная группа R – электронодонорная группа, она будет увеличивать отрицательный заряд на атоме кислорода, следовательно делать алкоголят-анион менее устойчивым: C – O : – + H + R R C – OH R подает электроны, дестабилизует ион, уменьшает к. св.ОЦЕНКА КИСЛОТНЫХ СВОЙСТВ СПИРТОВ Влияние заместителей
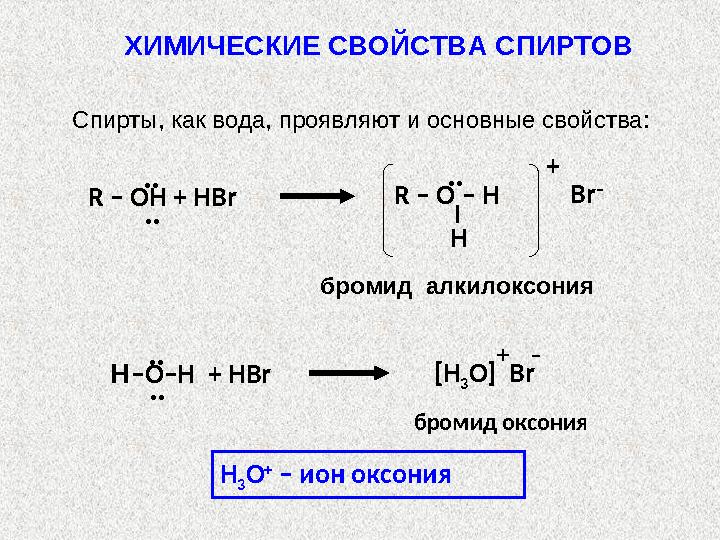
![бромид алкилоксония···· + Br –·· HR – O – H R – OH + HBr бромид оксония·· ·· [Н 3 О] Br Н – O – H + HBr + бромид алкилоксония···· + Br –·· HR – O – H R – OH + HBr бромид оксония·· ·· [Н 3 О] Br Н – O – H + HBr +](https://api.ust.kz/storage/files/materials/ppt/image/2019/june/d07/1559935901-34.jpeg)
#28 слайд
бромид алкилоксония···· +
Br –··
HR – O – H
R – OH + HBr
бромид оксония··
·· [Н
3 О] Br
Н – O – H + HBr +
–
Н
3 О +
– ион оксонияСпирты, как вода, проявляют и основные свойства: ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
28 слайд
бромид алкилоксония···· + Br –·· HR – O – H R – OH + HBr бромид оксония·· ·· [Н 3 О] Br Н – O – H + HBr + – Н 3 О + – ион оксонияСпирты, как вода, проявляют и основные свойства: ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ

#29 слайд
2. Образование простых эфиров R–О –
R ′
При взаимодействии алкоголятов (вернее алкоголят-
ионов) с алкилгалогенидами получают простые
эфиры R – O – R ′ :
RO –
Na +
+ R–Br R–O–R + NaBr
алкоголят алкил-
галогенид простой
эфир
Реакция протекает по S
N 1 или S
N 2 – механизму.
Нуклеофил RO : –
вытесняет галогенид ион : Br –
.ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
29 слайд
2. Образование простых эфиров R–О – R ′ При взаимодействии алкоголятов (вернее алкоголят- ионов) с алкилгалогенидами получают простые эфиры R – O – R ′ : RO – Na + + R–Br R–O–R + NaBr алкоголят алкил- галогенид простой эфир Реакция протекает по S N 1 или S N 2 – механизму. Нуклеофил RO : – вытесняет галогенид ион : Br – .ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ

#30 слайд
ПРОСТЫЕ ЭФИРЫ
Простые эфиры – химически малоактивные
соединения. Разбавленные кислоты, щелочи, Na , на
холоду на них не действуют. Но многие из них
подвергаются самоокислению (аутоокислению) при
контакте с воздухом с образованием взрывоопасных
пероксидных соединений.
Важнейшим представителем простых эфиров
является диэтиловый эфир:
применяется в медицине, как растворитель
органических веществ. СН
3 – СН
2 ‒ О–СН
2 ‒СН
3
30 слайд
ПРОСТЫЕ ЭФИРЫ Простые эфиры – химически малоактивные соединения. Разбавленные кислоты, щелочи, Na , на холоду на них не действуют. Но многие из них подвергаются самоокислению (аутоокислению) при контакте с воздухом с образованием взрывоопасных пероксидных соединений. Важнейшим представителем простых эфиров является диэтиловый эфир: применяется в медицине, как растворитель органических веществ. СН 3 – СН 2 ‒ О–СН 2 ‒СН 3
#31 слайд
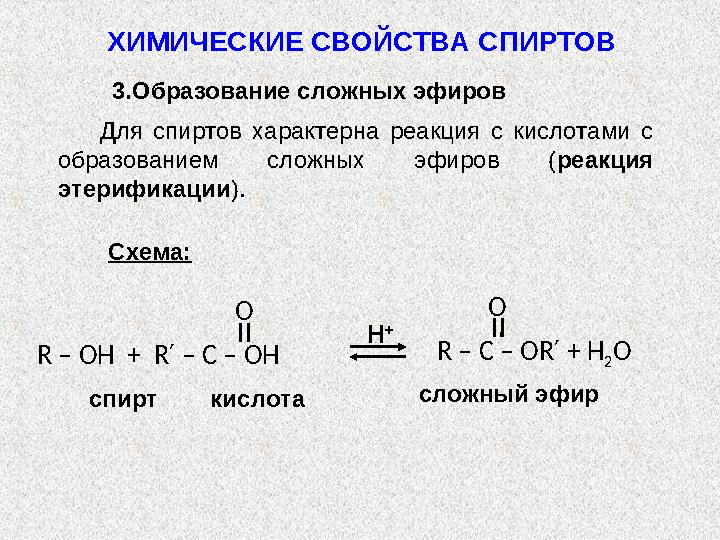
Для спиртов характерна реакция с кислотами с
образованием сложных эфиров ( реакция
этерификации ).
С хема:
Н +
спирт кислота сложный эфир O
R – C – OR + H′
2 OO
R – OH + R – C – OH ′ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
3.Образование сложных эфиров
31 слайд
Для спиртов характерна реакция с кислотами с образованием сложных эфиров ( реакция этерификации ). С хема: Н + спирт кислота сложный эфир O R – C – OR + H′ 2 OO R – OH + R – C – OH ′ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ 3.Образование сложных эфиров
#32 слайд
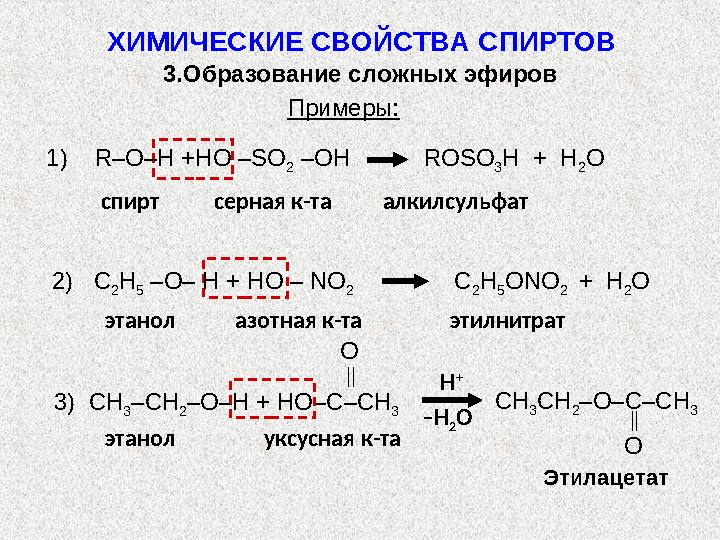
Примеры :
1) R–O–H +HO –SO
2 –OH ROSO
3 Н + H
2 O
спирт серная к-та алкилсульфат
2) С
2 Н
5 –О– Н + HO – NO
2 С
2 Н
5 О NO
2 + H
2 O
этанол азотная к-та этилнитрат
3) CH
3 –CH
2 –O–H + HO–C–CH
3
этанол уксусная к-таO H +
– H
2 O
Этилацетат OCH
3 CH
2 –O–C–CH
3ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
3.Образование сложных эфиров
32 слайд
Примеры : 1) R–O–H +HO –SO 2 –OH ROSO 3 Н + H 2 O спирт серная к-та алкилсульфат 2) С 2 Н 5 –О– Н + HO – NO 2 С 2 Н 5 О NO 2 + H 2 O этанол азотная к-та этилнитрат 3) CH 3 –CH 2 –O–H + HO–C–CH 3 этанол уксусная к-таO H + – H 2 O Этилацетат OCH 3 CH 2 –O–C–CH 3ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ 3.Образование сложных эфиров
#33 слайд
Реакции с разрывом связи С – О:
4. Замещение OH – группы галогеном:
R – X + H
2 O
R – OH + HX
( X = Cl , Br , I )
ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
Замещение ОН – группы на галоген может
происходить не только под действием
галогеноводородов Н X , но и таких реагентов
как галогениды фосфора ( PCl
3 , PCl
5 ,
PBr
3 , PBr
5 )
и тионилхлорид ( SOCl
2 ).
33 слайд
Реакции с разрывом связи С – О: 4. Замещение OH – группы галогеном: R – X + H 2 O R – OH + HX ( X = Cl , Br , I ) ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ Замещение ОН – группы на галоген может происходить не только под действием галогеноводородов Н X , но и таких реагентов как галогениды фосфора ( PCl 3 , PCl 5 , PBr 3 , PBr 5 ) и тионилхлорид ( SOCl 2 ).

#34 слайд
Механизм взаимодействия спиртов
с галогеноводородами:
факты:
1. Реакция катализируется кислотами
2. Порядок изменения реакционной способности
спиртов ( ROH ) по отношению к HX следующий:
Третичный > вторичный > первичный > СН
3 ОН
эти данные легко объясняются, если предположить,
что замещение ОН – группы на галоген происходит
по S
N – механизму:ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
34 слайд
Механизм взаимодействия спиртов с галогеноводородами: факты: 1. Реакция катализируется кислотами 2. Порядок изменения реакционной способности спиртов ( ROH ) по отношению к HX следующий: Третичный > вторичный > первичный > СН 3 ОН эти данные легко объясняются, если предположить, что замещение ОН – группы на галоген происходит по S N – механизму:ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ

#35 слайд
1 . По S
N 1 – механизму : для всех спиртов исключая
метанол и первичные спирты.
Реакции предшествует предварительная стадия ‒
стадия протонирования спирта
ROH + HX ROH
2 + :X –+
1 . ROH
2 R +
+ H
2 O1. Диссоциация протонированного спирта:
+
2. R +
+ : X –
RXХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
2. Нейтрализация карбкатиона галогенид - ионом:
35 слайд
1 . По S N 1 – механизму : для всех спиртов исключая метанол и первичные спирты. Реакции предшествует предварительная стадия ‒ стадия протонирования спирта ROH + HX ROH 2 + :X –+ 1 . ROH 2 R + + H 2 O1. Диссоциация протонированного спирта: + 2. R + + : X – RXХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ 2. Нейтрализация карбкатиона галогенид - ионом:
#36 слайд
S
N 2 – механизм : характерен для метанола и
большинства первичных спиртов.
Предварительная стадия:
H +
+ : X –
R – O – H··
··R – O – H + H : X
X :
+ ROH
2 X ∙∙∙ R ∙∙∙ OH
2 X–R + H
2 O ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
механизм реакций замещения
+
δ- δ+– S
N 2 – замещение
36 слайд
S N 2 – механизм : характерен для метанола и большинства первичных спиртов. Предварительная стадия: H + + : X – R – O – H·· ··R – O – H + H : X X : + ROH 2 X ∙∙∙ R ∙∙∙ OH 2 X–R + H 2 O ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ механизм реакций замещения + δ- δ+– S N 2 – замещение

#37 слайд
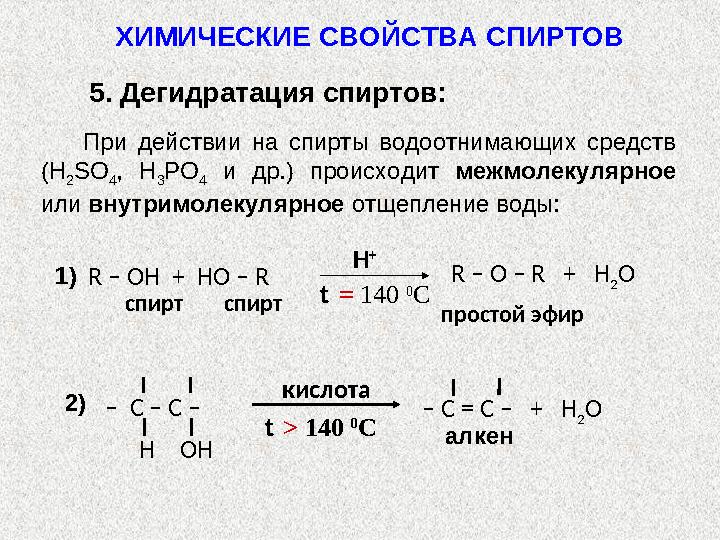
5. Дегидратация спиртов:
При действии на спирты водоотнимающих средств
( H
2 SO
4 , H
3 PO
4 и др.) происходит межмолекулярное
или внутримолекулярное отщепление воды:
простой эфир R – O – R + H
2 OH +
R – OH + HO – R
спирт1)
алкен– C = C – + H
2 Oкислота
t
> 140 0
C
OHH– C – C –2) ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
спирт t
= 140 0
C
37 слайд
5. Дегидратация спиртов: При действии на спирты водоотнимающих средств ( H 2 SO 4 , H 3 PO 4 и др.) происходит межмолекулярное или внутримолекулярное отщепление воды: простой эфир R – O – R + H 2 OH + R – OH + HO – R спирт1) алкен– C = C – + H 2 Oкислота t > 140 0 C OHH– C – C –2) ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ спирт t = 140 0 C

#38 слайд
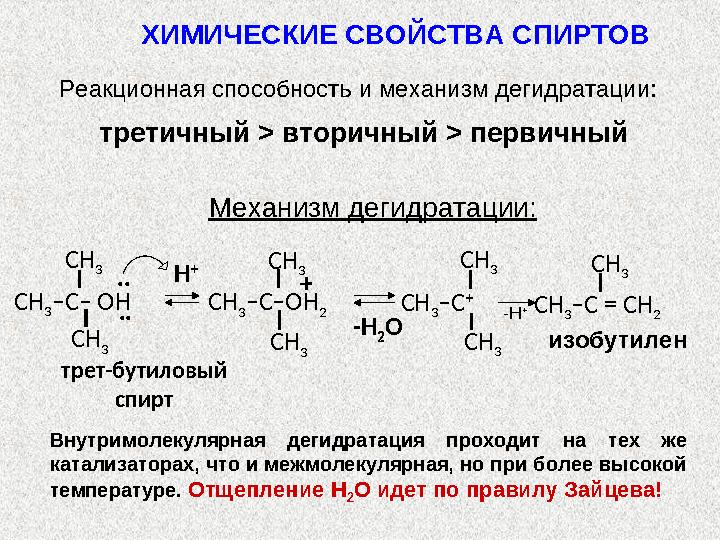
Реакционная способность и механизм дегидратации:
третичный > вторичный > первичный
Механизм дегидратации:
трет-бутиловый
спирт Н +
-Н
2 О CH
3
CH
3 –C = СН
2
CH
3CH
3
CH
3 –C +
CH
3CH
3
+
CH
3 –C–OH
2
....
CH
3CH
3
CH
3 –C– OH ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
-Н +
изобутилен
Внутримолекулярная дегидратация проходит на тех же
катализаторах, что и межмолекулярная, но при более высокой
температуре. Отщепление Н
2 О идет по правилу Зайцева!
38 слайд
Реакционная способность и механизм дегидратации: третичный > вторичный > первичный Механизм дегидратации: трет-бутиловый спирт Н + -Н 2 О CH 3 CH 3 –C = СН 2 CH 3CH 3 CH 3 –C + CH 3CH 3 + CH 3 –C–OH 2 .... CH 3CH 3 CH 3 –C– OH ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ -Н + изобутилен Внутримолекулярная дегидратация проходит на тех же катализаторах, что и межмолекулярная, но при более высокой температуре. Отщепление Н 2 О идет по правилу Зайцева!
#39 слайд
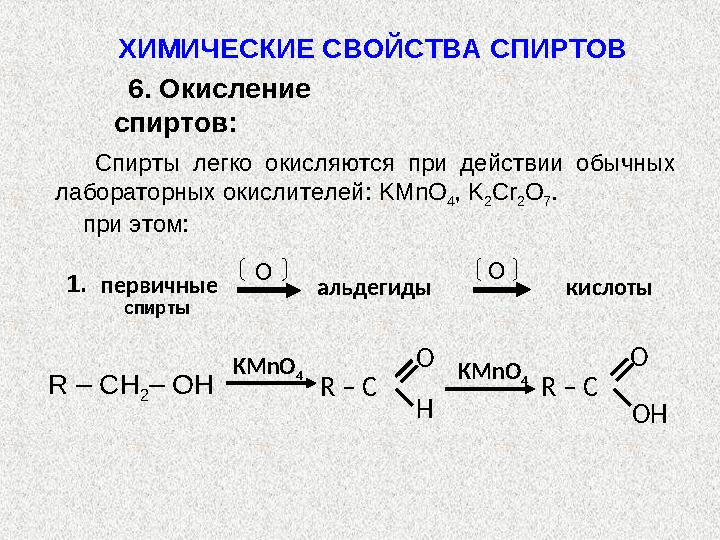
6. Окисление
спиртов:
Спирты легко окисляются при действии обычных
лабораторных окислителей: KMnO
4 , K
2 Cr
2 O
7 .
при этом:
1.
первичные
кислотыальдегидыO OХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
спирты
KMnO
4 KMnO
4
R – CH
2 – OH O
О HR – CO
HR – C
39 слайд
6. Окисление спиртов: Спирты легко окисляются при действии обычных лабораторных окислителей: KMnO 4 , K 2 Cr 2 O 7 . при этом: 1. первичные кислотыальдегидыO OХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ спирты KMnO 4 KMnO 4 R – CH 2 – OH O О HR – CO HR – C
#40 слайд
3. Третичные спирты устойчивы к окислению, но в
жестких условиях происходит разрыв углерод-
углеродной связи с образованием кетонов и кислот,
содержащих меньшее число атомов углерода, чем
исходный спирт. ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
6. Окисление
спиртов:
2 . Вторичные спирты образуют кетоны
О H
CH
3 –C Н ‒ СН
3 KMnO
4 О
CH
3 –C ‒ СН
3
40 слайд
3. Третичные спирты устойчивы к окислению, но в жестких условиях происходит разрыв углерод- углеродной связи с образованием кетонов и кислот, содержащих меньшее число атомов углерода, чем исходный спирт. ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ 6. Окисление спиртов: 2 . Вторичные спирты образуют кетоны О H CH 3 –C Н ‒ СН 3 KMnO 4 О CH 3 –C ‒ СН 3

#41 слайд
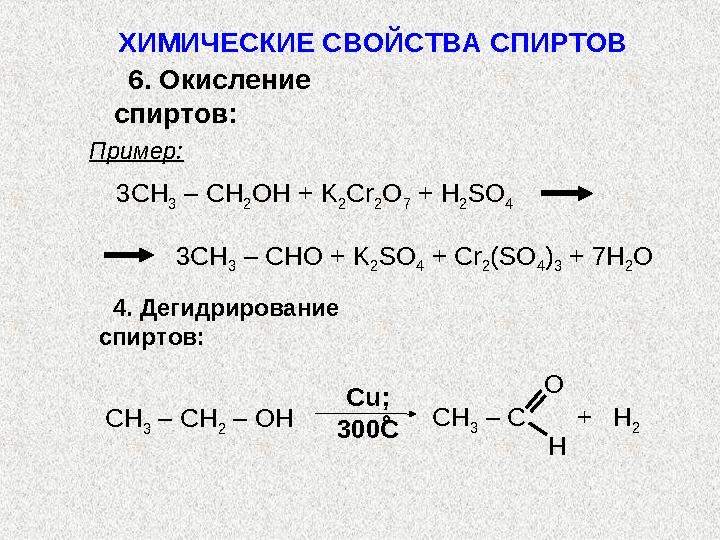
Пример:
3 С H
3 – CH
2 OH + K
2 Cr
2 O
7 + H
2 SO
4
3CH
3 – CHO + K
2 SO
4 + Cr
2 (SO
4 )
3 + 7H
2 O
4. Дегидрирование
спиртов:
Cu ;
300 ПCСН
3 – СН
2 – ОН СН
3 – С + Н
2O
HХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
6. Окисление
спиртов:
41 слайд
Пример: 3 С H 3 – CH 2 OH + K 2 Cr 2 O 7 + H 2 SO 4 3CH 3 – CHO + K 2 SO 4 + Cr 2 (SO 4 ) 3 + 7H 2 O 4. Дегидрирование спиртов: Cu ; 300 ПCСН 3 – СН 2 – ОН СН 3 – С + Н 2O HХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ 6. Окисление спиртов:
#42 слайд
СПИРТЫ. ЭФИРЫ. СИНТЕЗЫ
МНОГОТОМНЫЕ СПИРТЫ
Этиленгликоль – представитель
двухатомных спиртов –гликолей
(диолов)
(Т. кип. 197 СП С)OH
OHСН
2 – СН
2
Глицерин
(пропантриол – 1, 2, 3)
(Т. кип. 290 СП С)OH
OH
OHСН
2 – СН – СН
2
42 слайд
СПИРТЫ. ЭФИРЫ. СИНТЕЗЫ МНОГОТОМНЫЕ СПИРТЫ Этиленгликоль – представитель двухатомных спиртов –гликолей (диолов) (Т. кип. 197 СП С)OH OHСН 2 – СН 2 Глицерин (пропантриол – 1, 2, 3) (Т. кип. 290 СП С)OH OH OHСН 2 – СН – СН 2
#43 слайд
Гликоли (диолы) – спирты с двумя гидроксиль-
ными группами при разных углеродных атомах.
Общая формула
С
n H
2 n ( OH )
2
Триолы содержат три гидроксильные группы при
разных углеродных атомах.
Общая формула
С
n H
2 n -1 ( OH )
3МНОГОТОМНЫЕ СПИРТЫ
43 слайд
Гликоли (диолы) – спирты с двумя гидроксиль- ными группами при разных углеродных атомах. Общая формула С n H 2 n ( OH ) 2 Триолы содержат три гидроксильные группы при разных углеродных атомах. Общая формула С n H 2 n -1 ( OH ) 3МНОГОТОМНЫЕ СПИРТЫ

#44 слайд
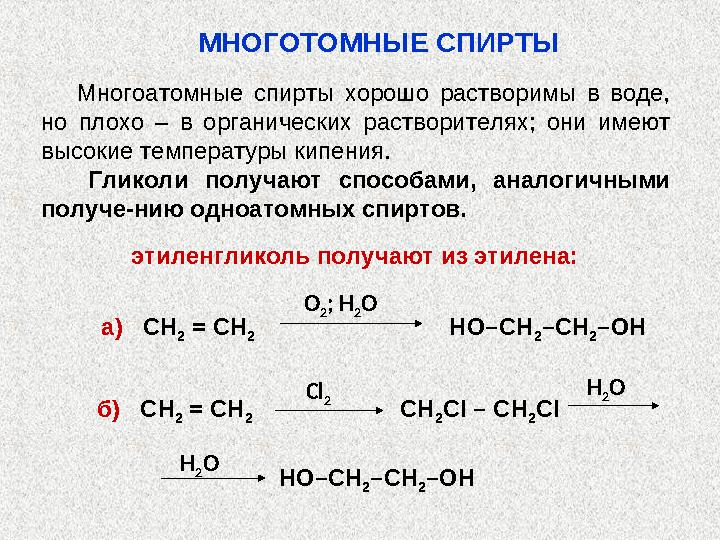
Многоатомные спирты хорошо растворимы в воде,
но плохо – в органических растворителях; они имеют
высокие температуры кипения.
Гликоли получают способами, аналогичными
получе-нию одноатомных спиртов.
этиленгликоль получают из этилена:
а) СН
2 = СН
2 НО–СН
2 –СН
2 –ОНО
2 ; Н
2 О
б) СН
2 = СН
2 СН
2 Cl – СН
2 ClCl
2 Н
2 О
НО–СН
2 –СН
2 –ОНН
2 ОМНОГОТОМНЫЕ СПИРТЫ
44 слайд
Многоатомные спирты хорошо растворимы в воде, но плохо – в органических растворителях; они имеют высокие температуры кипения. Гликоли получают способами, аналогичными получе-нию одноатомных спиртов. этиленгликоль получают из этилена: а) СН 2 = СН 2 НО–СН 2 –СН 2 –ОНО 2 ; Н 2 О б) СН 2 = СН 2 СН 2 Cl – СН 2 ClCl 2 Н 2 О НО–СН 2 –СН 2 –ОНН 2 ОМНОГОТОМНЫЕ СПИРТЫ
#45 слайд
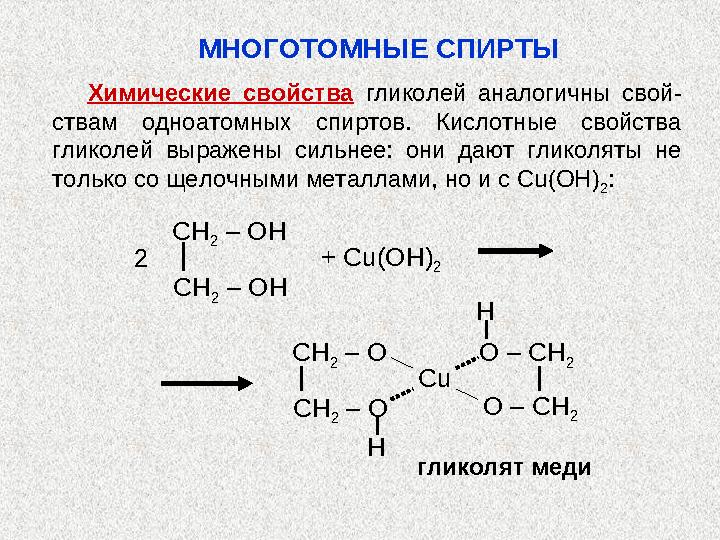
Химические свойства гликолей аналогичны свой-
ствам одноатомных спиртов. Кислотные свойства
гликолей выражены сильнее: они дают гликоляты не
только со щелочными металлами, но и с Cu ( OH )
2 :
2 + Cu ( OH )
2
СН
2 – ОНСН
2 – ОН
гликолят медиH О – СН
2О – СН
2
СН
2 – ОСН
2 – О
CuМНОГОТОМНЫЕ СПИРТЫ
H
45 слайд
Химические свойства гликолей аналогичны свой- ствам одноатомных спиртов. Кислотные свойства гликолей выражены сильнее: они дают гликоляты не только со щелочными металлами, но и с Cu ( OH ) 2 : 2 + Cu ( OH ) 2 СН 2 – ОНСН 2 – ОН гликолят медиH О – СН 2О – СН 2 СН 2 – ОСН 2 – О CuМНОГОТОМНЫЕ СПИРТЫ H
#46 слайд
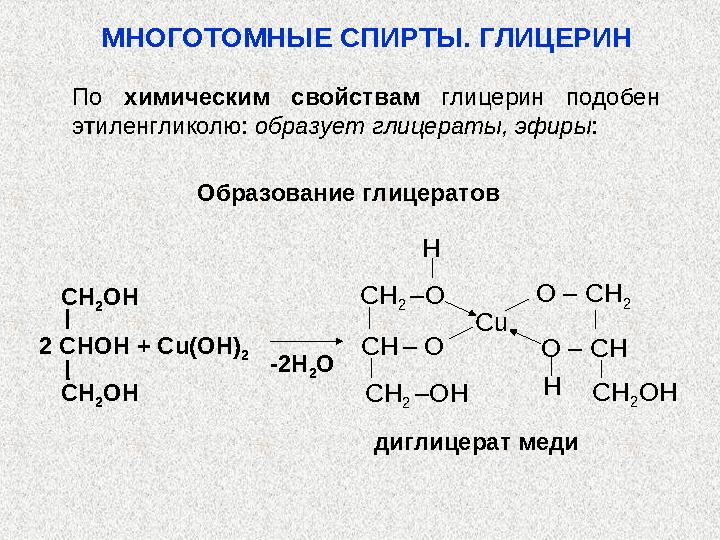
ГЛИЦЕРИНМНОГОТОМНЫЕ СПИРТЫ
Водный 50%-й раствор этиленгликоля используют в
качестве антифриза .
(Т. замерз. -34 СП С); 60%-й (-49 СП С)
Этиленгликоль применяют для синтеза полимерных
материалов ( волокно лавсан ), взрывчатых
веществ . ЭТИЛЕНГЛИКОЛЬ
Вязкая бесцветная жидкость, хорошо смешивается с
водой. Получают глицерин :
а) из жиров;
б) или из пропилена или ацетилена:
46 слайд
ГЛИЦЕРИНМНОГОТОМНЫЕ СПИРТЫ Водный 50%-й раствор этиленгликоля используют в качестве антифриза . (Т. замерз. -34 СП С); 60%-й (-49 СП С) Этиленгликоль применяют для синтеза полимерных материалов ( волокно лавсан ), взрывчатых веществ . ЭТИЛЕНГЛИКОЛЬ Вязкая бесцветная жидкость, хорошо смешивается с водой. Получают глицерин : а) из жиров; б) или из пропилена или ацетилена:
#47 слайд
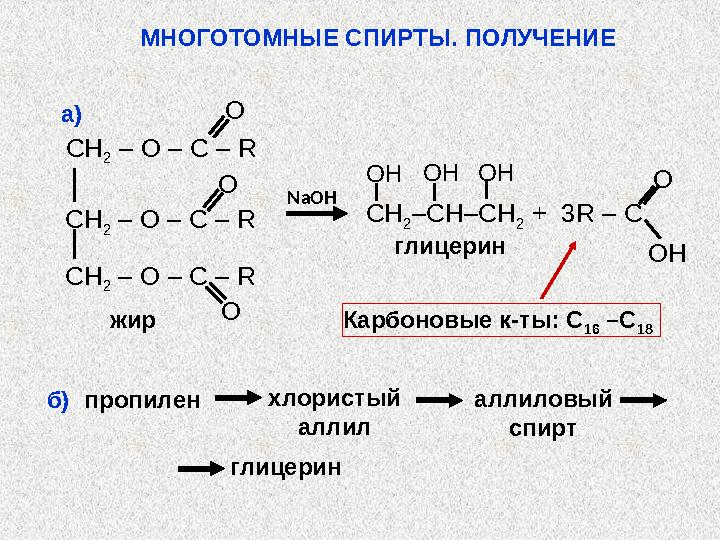
NaOH
Карбоновые к-ты: С
16 –С
18глицерин
OH O
СН
2 –CH–СН
2 + 3 R – C
жир O
С...
47 слайд
NaOH Карбоновые к-ты: С 16 –С 18глицерин OH O СН 2 –CH–СН 2 + 3 R – C жир O С...

шағым қалдыра аласыз
















