«Титриметрический метод анализа»
«Титриметрический метод анализа»


#1 слайд
ГКП на ПХВ ГКП на ПХВ
Талгарский медицинский колледжТалгарский медицинский колледж
Дисциплина: СД 03 Аналитическая химияДисциплина: СД 03 Аналитическая химия
Тема: Тема:
«Титриметрический «Титриметрический
метод анализа»метод анализа»
1 слайд
ГКП на ПХВ ГКП на ПХВ Талгарский медицинский колледжТалгарский медицинский колледж Дисциплина: СД 03 Аналитическая химияДисциплина: СД 03 Аналитическая химия Тема: Тема: «Титриметрический «Титриметрический метод анализа»метод анализа»

#2 слайд
Цель: Цель:
ознакомиться с основами ознакомиться с основами
титриметрического анализа, изучить титриметрического анализа, изучить
основные методы и приемы титрования.основные методы и приемы титрования.
Задачи:Задачи:
Овладеть методикой титрованияОвладеть методикой титрования
Уметь строить кривые титрованияУметь строить кривые титрования
Знать технику безопасности в лаборатории при Знать технику безопасности в лаборатории при
титриметрическом анализетитриметрическом анализе
Знать как выглядит химическая посуда и Знать как выглядит химическая посуда и
приборы для выполнения титриметрического приборы для выполнения титриметрического
анализа.анализа.
2 слайд
Цель: Цель: ознакомиться с основами ознакомиться с основами титриметрического анализа, изучить титриметрического анализа, изучить основные методы и приемы титрования.основные методы и приемы титрования. Задачи:Задачи: Овладеть методикой титрованияОвладеть методикой титрования Уметь строить кривые титрованияУметь строить кривые титрования Знать технику безопасности в лаборатории при Знать технику безопасности в лаборатории при титриметрическом анализетитриметрическом анализе Знать как выглядит химическая посуда и Знать как выглядит химическая посуда и приборы для выполнения титриметрического приборы для выполнения титриметрического анализа.анализа.

#3 слайд
Ожидаемые результаты:Ожидаемые результаты:
Знают: Знают:
-правила техники безопасности, технику титрования, -правила техники безопасности, технику титрования,
взвешивание, определение цены деления мерной посуды, взвешивание, определение цены деления мерной посуды,
правила пользования, принцип работыправила пользования, принцип работы
-классификацию растворов, расчет и техника приготовления -классификацию растворов, расчет и техника приготовления
приблизительных и точных растворов.приблизительных и точных растворов.
Умеют:Умеют:
-соблюдать правила безопасности, приготовить посуды, -соблюдать правила безопасности, приготовить посуды,
приборы и реактивы,приборы и реактивы,
-соблюдать технику хранения реактивов, умеют собирать -соблюдать технику хранения реактивов, умеют собирать
прибор для титрования.прибор для титрования.
3 слайд
Ожидаемые результаты:Ожидаемые результаты: Знают: Знают: -правила техники безопасности, технику титрования, -правила техники безопасности, технику титрования, взвешивание, определение цены деления мерной посуды, взвешивание, определение цены деления мерной посуды, правила пользования, принцип работыправила пользования, принцип работы -классификацию растворов, расчет и техника приготовления -классификацию растворов, расчет и техника приготовления приблизительных и точных растворов.приблизительных и точных растворов. Умеют:Умеют: -соблюдать правила безопасности, приготовить посуды, -соблюдать правила безопасности, приготовить посуды, приборы и реактивы,приборы и реактивы, -соблюдать технику хранения реактивов, умеют собирать -соблюдать технику хранения реактивов, умеют собирать прибор для титрования.прибор для титрования.

#4 слайд
Критерии оценивания Задание Дискриптор
Балл
Знает и применяет
правила техники
безопасности Знать наизусть и
применять правила
техники безопасности в
лаборатории Объясняет и применяет
правила при работе в
лаборатории 20 баллов
Отличает
качественный и
количественный анализ Тестовые задания Отличает гомогенные и
гетерогенные реакции,
владеет основными
законами, умеет делать
расчеты 30 баллов
Умеет решать задачи
согласно алгоритму Решение расчетных
задач Умеет писать
соответствующие
уравнения реакций,
рассчитывает
молярные массы
эквивалента, знает и
умело применяет
формулы при решении
расчетных задач. 50 баллов
4 слайд
Критерии оценивания Задание Дискриптор Балл Знает и применяет правила техники безопасности Знать наизусть и применять правила техники безопасности в лаборатории Объясняет и применяет правила при работе в лаборатории 20 баллов Отличает качественный и количественный анализ Тестовые задания Отличает гомогенные и гетерогенные реакции, владеет основными законами, умеет делать расчеты 30 баллов Умеет решать задачи согласно алгоритму Решение расчетных задач Умеет писать соответствующие уравнения реакций, рассчитывает молярные массы эквивалента, знает и умело применяет формулы при решении расчетных задач. 50 баллов

#5 слайд
Тесты для повторения и контроля домашней Тесты для повторения и контроля домашней
работыработы
1. Качественный анализ - это определение1. Качественный анализ - это определение
1) компонентов вещества (молекул, ионов, элементов) 1) компонентов вещества (молекул, ионов, элементов)
2) количества компонентов вещества2) количества компонентов вещества
3) структуры вещества3) структуры вещества
4) химических связей вещества4) химических связей вещества
5) агрегатного состояния вещества 5) агрегатного состояния вещества
2. Гомогенные реакции – это реакции протекающие2. Гомогенные реакции – это реакции протекающие
1) в одной фазе (агрегатном состоянии)1) в одной фазе (агрегатном состоянии)
2) в разных фазах (агрегатных состояниях)2) в разных фазах (агрегатных состояниях)
3) между твердым и жидким веществами3) между твердым и жидким веществами
4) жидким и газообразным веществами4) жидким и газообразным веществами
5) жидким, твердым и газообразным веществами5) жидким, твердым и газообразным веществами
5 слайд
Тесты для повторения и контроля домашней Тесты для повторения и контроля домашней работыработы 1. Качественный анализ - это определение1. Качественный анализ - это определение 1) компонентов вещества (молекул, ионов, элементов) 1) компонентов вещества (молекул, ионов, элементов) 2) количества компонентов вещества2) количества компонентов вещества 3) структуры вещества3) структуры вещества 4) химических связей вещества4) химических связей вещества 5) агрегатного состояния вещества 5) агрегатного состояния вещества 2. Гомогенные реакции – это реакции протекающие2. Гомогенные реакции – это реакции протекающие 1) в одной фазе (агрегатном состоянии)1) в одной фазе (агрегатном состоянии) 2) в разных фазах (агрегатных состояниях)2) в разных фазах (агрегатных состояниях) 3) между твердым и жидким веществами3) между твердым и жидким веществами 4) жидким и газообразным веществами4) жидким и газообразным веществами 5) жидким, твердым и газообразным веществами5) жидким, твердым и газообразным веществами

#6 слайд
3. Гетерогенные реакции – это реакции протекающие3. Гетерогенные реакции – это реакции протекающие
1) в разных фазах (агрегатных состояниях)1) в разных фазах (агрегатных состояниях)
2) в одной фазе (агрегатном состоянии)2) в одной фазе (агрегатном состоянии)
3) только в твердой фазе3) только в твердой фазе
4) только в жидкой фазе4) только в жидкой фазе
5) только в газообразной фазе5) только в газообразной фазе
4. Степень диссоциации слабого электролита при добавлении 4. Степень диссоциации слабого электролита при добавлении
сильного электролита с одноименным с ним ионом:сильного электролита с одноименным с ним ионом:
1) увеличивается1) увеличивается
2) уменьшается2) уменьшается
3) постоянная3) постоянная
4) не изменяется4) не изменяется
5) сильно увеличивается5) сильно увеличивается
5. Закон действия масс применим к неэлектролитам и к растворам:5. Закон действия масс применим к неэлектролитам и к растворам:
1) сильных электролитов1) сильных электролитов
2) слабых электролитов2) слабых электролитов
3) сильных кислот3) сильных кислот
4) слабых оснований4) слабых оснований
5) кислот и оснований5) кислот и оснований
6 слайд
3. Гетерогенные реакции – это реакции протекающие3. Гетерогенные реакции – это реакции протекающие 1) в разных фазах (агрегатных состояниях)1) в разных фазах (агрегатных состояниях) 2) в одной фазе (агрегатном состоянии)2) в одной фазе (агрегатном состоянии) 3) только в твердой фазе3) только в твердой фазе 4) только в жидкой фазе4) только в жидкой фазе 5) только в газообразной фазе5) только в газообразной фазе 4. Степень диссоциации слабого электролита при добавлении 4. Степень диссоциации слабого электролита при добавлении сильного электролита с одноименным с ним ионом:сильного электролита с одноименным с ним ионом: 1) увеличивается1) увеличивается 2) уменьшается2) уменьшается 3) постоянная3) постоянная 4) не изменяется4) не изменяется 5) сильно увеличивается5) сильно увеличивается 5. Закон действия масс применим к неэлектролитам и к растворам:5. Закон действия масс применим к неэлектролитам и к растворам: 1) сильных электролитов1) сильных электролитов 2) слабых электролитов2) слабых электролитов 3) сильных кислот3) сильных кислот 4) слабых оснований4) слабых оснований 5) кислот и оснований5) кислот и оснований

#7 слайд
6. Не подчинение закону действия масс растворов сильных 6. Не подчинение закону действия масс растворов сильных
электролитов, обусловлено:электролитов, обусловлено:
1) степенью диссоциации1) степенью диссоциации
2) константой диссоциации2) константой диссоциации
3) межионными силами взаимодействия3) межионными силами взаимодействия
4) гидролизом электролита4) гидролизом электролита
5) комплексообразованием5) комплексообразованием
7. Указать выражение произведения растворимости электролита АаВ7. Указать выражение произведения растворимости электролита АаВ
bb
1) ПР1) ПР
АаВАаВ
bb = а[А] = а[А] . .
bb
[В][В]
2) 2)
ПРПР
АаВАаВ
bb = [A] = [A] a. a.
[B][B] bb
3) 3)
ПРПР
АаВАаВ
bb = [A] = [A] bb
- [B]- [B] aa
4) 4)
ПРПР
АаВАаВ
bb = [A] = [A] aa
+[B]+[B] bb
5) 5)
ПРПР
АаВАаВ
bb = [A] = [A] ..
[B][B] abab
8. Растворимость электролита типа 8. Растворимость электролита типа
AaBbAaBb
выражают формулой выражают формулой
1) 1)
PP
AaBbAaBb = √ ПР = √ ПР
АаВАаВ
bb //
abab
2) 2)
PP
AaBbAaBb = = aa
++
bb
√ √
ПРАаВПРАаВ
bb //
aabbaabb
3) 3)
PP
AaBbAaBb = √ ПР = √ ПР
АаВАаВ
bb //
aa
++
bb
4) 4)
PP
AaBbAaBb = √ ПР = √ ПР
АаВАаВ
bb
5) 5)
PP
AaBbAaBb = √ = √
aa
//
bb . .
ПРПР
АаВАаВ
bb
7 слайд
6. Не подчинение закону действия масс растворов сильных 6. Не подчинение закону действия масс растворов сильных электролитов, обусловлено:электролитов, обусловлено: 1) степенью диссоциации1) степенью диссоциации 2) константой диссоциации2) константой диссоциации 3) межионными силами взаимодействия3) межионными силами взаимодействия 4) гидролизом электролита4) гидролизом электролита 5) комплексообразованием5) комплексообразованием 7. Указать выражение произведения растворимости электролита АаВ7. Указать выражение произведения растворимости электролита АаВ bb 1) ПР1) ПР АаВАаВ bb = а[А] = а[А] . . bb [В][В] 2) 2) ПРПР АаВАаВ bb = [A] = [A] a. a. [B][B] bb 3) 3) ПРПР АаВАаВ bb = [A] = [A] bb - [B]- [B] aa 4) 4) ПРПР АаВАаВ bb = [A] = [A] aa +[B]+[B] bb 5) 5) ПРПР АаВАаВ bb = [A] = [A] .. [B][B] abab 8. Растворимость электролита типа 8. Растворимость электролита типа AaBbAaBb выражают формулой выражают формулой 1) 1) PP AaBbAaBb = √ ПР = √ ПР АаВАаВ bb // abab 2) 2) PP AaBbAaBb = = aa ++ bb √ √ ПРАаВПРАаВ bb // aabbaabb 3) 3) PP AaBbAaBb = √ ПР = √ ПР АаВАаВ bb // aa ++ bb 4) 4) PP AaBbAaBb = √ ПР = √ ПР АаВАаВ bb 5) 5) PP AaBbAaBb = √ = √ aa // bb . . ПРПР АаВАаВ bb

#8 слайд
9. Скорость химической реакции – это изменение концентраций веществ9. Скорость химической реакции – это изменение концентраций веществ
1) вединицувремени1) вединицувремени
2) вединицеобъемараствора2) вединицеобъемараствора
3) количества молей веществ3) количества молей веществ
4) единице массы вещества4) единице массы вещества
5) агрегатных состоянии5) агрегатных состоянии
10. Указать гетерогенную реакцию10. Указать гетерогенную реакцию
1) 1)
HClHCl
+ +
NaOHNaOH
2) 3H2) 3H
22 + N + N
22
3) Zn + HCl3) Zn + HCl
4) NaCl + H4) NaCl + H
22 SOSO
44
5) H5) H
22 SOSO
44 + KOH + KOH
11. Указать гомогенную реакцию11. Указать гомогенную реакцию
1) 1)
FeFe
+ +
HH
22 OO
2) 2)
ZnZn
+ +
HClHCl
3) Al3) Al
22 OO
33 + HCl + HCl
4) NaOH + HCl4) NaOH + HCl
5) Mg + O5) Mg + O
22
8 слайд
9. Скорость химической реакции – это изменение концентраций веществ9. Скорость химической реакции – это изменение концентраций веществ 1) вединицувремени1) вединицувремени 2) вединицеобъемараствора2) вединицеобъемараствора 3) количества молей веществ3) количества молей веществ 4) единице массы вещества4) единице массы вещества 5) агрегатных состоянии5) агрегатных состоянии 10. Указать гетерогенную реакцию10. Указать гетерогенную реакцию 1) 1) HClHCl + + NaOHNaOH 2) 3H2) 3H 22 + N + N 22 3) Zn + HCl3) Zn + HCl 4) NaCl + H4) NaCl + H 22 SOSO 44 5) H5) H 22 SOSO 44 + KOH + KOH 11. Указать гомогенную реакцию11. Указать гомогенную реакцию 1) 1) FeFe + + HH 22 OO 2) 2) ZnZn + + HClHCl 3) Al3) Al 22 OO 33 + HCl + HCl 4) NaOH + HCl4) NaOH + HCl 5) Mg + O5) Mg + O 22

#9 слайд
12. Указатьспецифическуюреакциюиона12. Указатьспецифическуюреакциюиона
NHNH
44 ++
аммонияаммония
1) 1)
CdCd
((
NONO
33 ))
2 2 + +
NHNH
33 ..
HH
22
OO
изб.изб.
HH
22
OO
2) 2)
CuSOCuSO
44 + +
NHNH
3 3 изб.изб.
HH
22
OO
3) 3)
NHNH
44 ClCl
+ +
NaOH NaOH tt
→→
4) 4)
MgMg
((
NONO
3)3)
22 + +
NHNH
44 ClCl
5) 5)
HClHCl
+ +
NHNH
44 OHOH
13. Указатькачественную реакцию на ион железа 13. Указатькачественную реакцию на ион железа
FeFe 2+2+
1) Fe(OH)1) Fe(OH)
3 3 + HCl+ HCl
2) FeSO2) FeSO
44 + K + K
33 [Fe(CN)[Fe(CN)
66 ]]
3) FeCl3) FeCl
3 3 + K+ K
44 [Fe(CN)[Fe(CN)
66 ]]
4) Fe(OH)4) Fe(OH)
33 + HCl + HCl
5) 5)
FeClFeCl
33 + +
KOHKOH
14. Указать специфическую реакцию на ион железа 14. Указать специфическую реакцию на ион железа
FeFe 3+3+
1) FeCl1) FeCl
33 + K + K
44 [Fe(CN)[Fe(CN)
66 ]]
2) FeSO2) FeSO
44 + K + K
33 [Fe(CN)[Fe(CN)
66 ]]
3) FeCl3) FeCl
33 + NH + NH
44 SCNSCN
4) CuSO4) CuSO
4 4 + K+ K
44 [Fe(CN)[Fe(CN)
66 ]]
5) 5)
FeClFeCl
33 + +
HH
22 OO
9 слайд
12. Указатьспецифическуюреакциюиона12. Указатьспецифическуюреакциюиона NHNH 44 ++ аммонияаммония 1) 1) CdCd (( NONO 33 )) 2 2 + + NHNH 33 .. HH 22 OO изб.изб. HH 22 OO 2) 2) CuSOCuSO 44 + + NHNH 3 3 изб.изб. HH 22 OO 3) 3) NHNH 44 ClCl + + NaOH NaOH tt →→ 4) 4) MgMg (( NONO 3)3) 22 + + NHNH 44 ClCl 5) 5) HClHCl + + NHNH 44 OHOH 13. Указатькачественную реакцию на ион железа 13. Указатькачественную реакцию на ион железа FeFe 2+2+ 1) Fe(OH)1) Fe(OH) 3 3 + HCl+ HCl 2) FeSO2) FeSO 44 + K + K 33 [Fe(CN)[Fe(CN) 66 ]] 3) FeCl3) FeCl 3 3 + K+ K 44 [Fe(CN)[Fe(CN) 66 ]] 4) Fe(OH)4) Fe(OH) 33 + HCl + HCl 5) 5) FeClFeCl 33 + + KOHKOH 14. Указать специфическую реакцию на ион железа 14. Указать специфическую реакцию на ион железа FeFe 3+3+ 1) FeCl1) FeCl 33 + K + K 44 [Fe(CN)[Fe(CN) 66 ]] 2) FeSO2) FeSO 44 + K + K 33 [Fe(CN)[Fe(CN) 66 ]] 3) FeCl3) FeCl 33 + NH + NH 44 SCNSCN 4) CuSO4) CuSO 4 4 + K+ K 44 [Fe(CN)[Fe(CN) 66 ]] 5) 5) FeClFeCl 33 + + HH 22 OO

#10 слайд
15. Какая реакция подтверждает амфотерность ионов свинца 15. Какая реакция подтверждает амфотерность ионов свинца
PbPb 2+2+
1) Pb(OH)1) Pb(OH)
2 2 + NaOH+ NaOH
избизб
..
2) Pb(NO2) Pb(NO
33 ))
2 2 + HCl+ HCl
3) PbCl3) PbCl
2 2 + H+ H
22 OO
4) Pb(NO4) Pb(NO
33 ))
2 2 + H+ H
22 SOSO
44
5) Pb(NO5) Pb(NO
33 ))
22 + K + K
22 CrOCrO
44
16. Произведение растворимости ПР16. Произведение растворимости ПР
АВАВ – это произведение концентрации – это произведение концентрации
ионов малорастворимого электролита в его:ионов малорастворимого электролита в его:
1) ненасыщенном растворе 1) ненасыщенном растворе ..
HH
22
OO
2) пересыщенном растворе2) пересыщенном растворе
3) насыщенном растворе3) насыщенном растворе
4) окрашенном растворе4) окрашенном растворе
5) коллоидном растворе5) коллоидном растворе
17. Указать условие выпадения осадка АВ17. Указать условие выпадения осадка АВ
1) [A1) [A ++
]] ..
[B[B --
]<]<
ПРПР
ABAB
2) [A2) [A ++
] [B] [B --
] >] >
ПРПР
ABAB
3) [A3) [A ++
] [B] [B --
] = ] =
ПРПР
ABAB
4) [A4) [A ++
] - [B] - [B --
] = ] =
ПРПР
ABAB
5) [A5) [A ++
] + [B] + [B --
] >] >
ПРПР
ABAB
10 слайд
15. Какая реакция подтверждает амфотерность ионов свинца 15. Какая реакция подтверждает амфотерность ионов свинца PbPb 2+2+ 1) Pb(OH)1) Pb(OH) 2 2 + NaOH+ NaOH избизб .. 2) Pb(NO2) Pb(NO 33 )) 2 2 + HCl+ HCl 3) PbCl3) PbCl 2 2 + H+ H 22 OO 4) Pb(NO4) Pb(NO 33 )) 2 2 + H+ H 22 SOSO 44 5) Pb(NO5) Pb(NO 33 )) 22 + K + K 22 CrOCrO 44 16. Произведение растворимости ПР16. Произведение растворимости ПР АВАВ – это произведение концентрации – это произведение концентрации ионов малорастворимого электролита в его:ионов малорастворимого электролита в его: 1) ненасыщенном растворе 1) ненасыщенном растворе .. HH 22 OO 2) пересыщенном растворе2) пересыщенном растворе 3) насыщенном растворе3) насыщенном растворе 4) окрашенном растворе4) окрашенном растворе 5) коллоидном растворе5) коллоидном растворе 17. Указать условие выпадения осадка АВ17. Указать условие выпадения осадка АВ 1) [A1) [A ++ ]] .. [B[B -- ]<]< ПРПР ABAB 2) [A2) [A ++ ] [B] [B -- ] >] > ПРПР ABAB 3) [A3) [A ++ ] [B] [B -- ] = ] = ПРПР ABAB 4) [A4) [A ++ ] - [B] - [B -- ] = ] = ПРПР ABAB 5) [A5) [A ++ ] + [B] + [B -- ] >] > ПРПР ABAB

#11 слайд
18. Раствор электролита 18. Раствор электролита
MetAnMetAn
является насыщенным, если является насыщенным, если
1) [Met1) [Met ++
] [An] [An --
]<]<
ПРПР
MetAnMetAn
2) [Met2) [Met ++
] [An] [An --
] >] >
ПРПР
MetAnMetAn
3) [Met3) [Met ++
] - [An] - [An --
] = ] =
ПРПР
MetAnMetAn
4) [Met4) [Met ++
] [An] [An --
] = ] =
ПРПР
MetAnMetAn
5) [5) [
MetMet ++
] + [] + [
AnAn --
] = ПР] = ПР
MetAnMetAn
19. Качественные аналитические реакции по способу выполнения 19. Качественные аналитические реакции по способу выполнения
делятся наделятся на
1) частные1) частные
2) дробные2) дробные
3) пробирочные3) пробирочные
4) селектиные4) селектиные
5) групповые5) групповые
20. В качественном анализе реакции, сопровождающиеся внешним 20. В качественном анализе реакции, сопровождающиеся внешним
эффектом, изменяютэффектом, изменяют
1) объем раствора1) объем раствора
2) массу раствора2) массу раствора
3) окраску раствора3) окраску раствора
4) давления раствора4) давления раствора
5) температуру раствора5) температуру раствора
11 слайд
18. Раствор электролита 18. Раствор электролита MetAnMetAn является насыщенным, если является насыщенным, если 1) [Met1) [Met ++ ] [An] [An -- ]<]< ПРПР MetAnMetAn 2) [Met2) [Met ++ ] [An] [An -- ] >] > ПРПР MetAnMetAn 3) [Met3) [Met ++ ] - [An] - [An -- ] = ] = ПРПР MetAnMetAn 4) [Met4) [Met ++ ] [An] [An -- ] = ] = ПРПР MetAnMetAn 5) [5) [ MetMet ++ ] + [] + [ AnAn -- ] = ПР] = ПР MetAnMetAn 19. Качественные аналитические реакции по способу выполнения 19. Качественные аналитические реакции по способу выполнения делятся наделятся на 1) частные1) частные 2) дробные2) дробные 3) пробирочные3) пробирочные 4) селектиные4) селектиные 5) групповые5) групповые 20. В качественном анализе реакции, сопровождающиеся внешним 20. В качественном анализе реакции, сопровождающиеся внешним эффектом, изменяютэффектом, изменяют 1) объем раствора1) объем раствора 2) массу раствора2) массу раствора 3) окраску раствора3) окраску раствора 4) давления раствора4) давления раствора 5) температуру раствора5) температуру раствора

#12 слайд
ПланПлан
Титриметрический метод анализа: суть, Титриметрический метод анализа: суть,
основные понятия и классификация.основные понятия и классификация.
Техника титриметрии.Техника титриметрии.
Виды титриметрических определений.Виды титриметрических определений.
Расчеты в титриметрии.Расчеты в титриметрии.
12 слайд
ПланПлан Титриметрический метод анализа: суть, Титриметрический метод анализа: суть, основные понятия и классификация.основные понятия и классификация. Техника титриметрии.Техника титриметрии. Виды титриметрических определений.Виды титриметрических определений. Расчеты в титриметрии.Расчеты в титриметрии.

#13 слайд
Основные понятия и их суть:Основные понятия и их суть:
Титриметрический анализ - Титриметрический анализ -
Титрование - Титрование -
Определяемое вещество -Определяемое вещество -
Титрант -Титрант -
Стандартное вещество -Стандартное вещество -
Стандартизация титранта -Стандартизация титранта -
Аликвота –Аликвота –
Точка эквивалентности – Точка эквивалентности –
Конечная точка титрования - Конечная точка титрования -
13 слайд
Основные понятия и их суть:Основные понятия и их суть: Титриметрический анализ - Титриметрический анализ - Титрование - Титрование - Определяемое вещество -Определяемое вещество - Титрант -Титрант - Стандартное вещество -Стандартное вещество - Стандартизация титранта -Стандартизация титранта - Аликвота –Аликвота – Точка эквивалентности – Точка эквивалентности – Конечная точка титрования - Конечная точка титрования -

#14 слайд
Титриметрические (объемные) методы количественного Титриметрические (объемные) методы количественного
анализаанализа
основаны на точном измерении объема раствора основаны на точном измерении объема раствора
реагента (титранта), вступающего в химическую реакцию с реагента (титранта), вступающего в химическую реакцию с
исследуемым веществом. исследуемым веществом.
14 слайд
Титриметрические (объемные) методы количественного Титриметрические (объемные) методы количественного анализаанализа основаны на точном измерении объема раствора основаны на точном измерении объема раствора реагента (титранта), вступающего в химическую реакцию с реагента (титранта), вступающего в химическую реакцию с исследуемым веществом. исследуемым веществом.
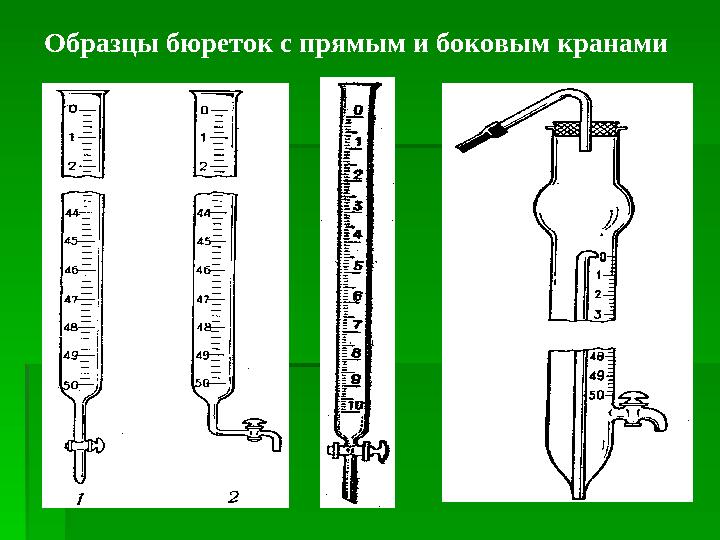
#15 слайд
Классификация титриметрических методов анализа по Классификация титриметрических методов анализа по
типам химических реакцийтипам химических реакций
1.1.
Методы кислотно-основного титрованияМетоды кислотно-основного титрования
Основаны на использовании реакции нейтрализации. Применяют Основаны на использовании реакции нейтрализации. Применяют
для определения кислот, оснований и солей, которые при для определения кислот, оснований и солей, которые при
гидролизе создают кислую и щелочную реакцию среды.гидролизе создают кислую и щелочную реакцию среды.
В сочетании с различными способами пробоподготовки может В сочетании с различными способами пробоподготовки может
быть применено для определения различных параметров.быть применено для определения различных параметров.
15 слайд
Классификация титриметрических методов анализа по Классификация титриметрических методов анализа по типам химических реакцийтипам химических реакций 1.1. Методы кислотно-основного титрованияМетоды кислотно-основного титрования Основаны на использовании реакции нейтрализации. Применяют Основаны на использовании реакции нейтрализации. Применяют для определения кислот, оснований и солей, которые при для определения кислот, оснований и солей, которые при гидролизе создают кислую и щелочную реакцию среды.гидролизе создают кислую и щелочную реакцию среды. В сочетании с различными способами пробоподготовки может В сочетании с различными способами пробоподготовки может быть применено для определения различных параметров.быть применено для определения различных параметров.

#16 слайд
2.2.
Методы осадительного титрованияМетоды осадительного титрования
Исследуемое вещество при взаимодействии с Исследуемое вещество при взаимодействии с
титрантом образует малорастворимые соединения.титрантом образует малорастворимые соединения.
Широко применяемый метод осадительного Широко применяемый метод осадительного
титрования – аргентометрическое титрование, в титрования – аргентометрическое титрование, в
ходе которого определяют концентрацию анионов ходе которого определяют концентрацию анионов
((
CNCN --
, PO, PO
44 3-3-
, CrO, CrO
44 2-2-
и др.), образующих и др.), образующих
малорастворимые соединения или устойчивые малорастворимые соединения или устойчивые
комплексы с ионами комплексы с ионами
AgAg
::
AgAg + +
+ Cl+ Cl --
= AgCl = AgCl
↓↓
16 слайд
2.2. Методы осадительного титрованияМетоды осадительного титрования Исследуемое вещество при взаимодействии с Исследуемое вещество при взаимодействии с титрантом образует малорастворимые соединения.титрантом образует малорастворимые соединения. Широко применяемый метод осадительного Широко применяемый метод осадительного титрования – аргентометрическое титрование, в титрования – аргентометрическое титрование, в ходе которого определяют концентрацию анионов ходе которого определяют концентрацию анионов (( CNCN -- , PO, PO 44 3-3- , CrO, CrO 44 2-2- и др.), образующих и др.), образующих малорастворимые соединения или устойчивые малорастворимые соединения или устойчивые комплексы с ионами комплексы с ионами AgAg :: AgAg + + + Cl+ Cl -- = AgCl = AgCl ↓↓

#17 слайд
3. Методы комплексометрического 3. Методы комплексометрического
титрованиятитрования
Основаны на образовании Основаны на образовании
слабоионизированных комплексов титранта с слабоионизированных комплексов титранта с
исследуемым веществом. исследуемым веществом.
Комплексонометрическое титрование – Комплексонометрическое титрование –
титрование трилоном Б (динатриевой солью титрование трилоном Б (динатриевой солью
этилендиаминтетрауксусной кислотыэтилендиаминтетрауксусной кислоты
17 слайд
3. Методы комплексометрического 3. Методы комплексометрического титрованиятитрования Основаны на образовании Основаны на образовании слабоионизированных комплексов титранта с слабоионизированных комплексов титранта с исследуемым веществом. исследуемым веществом. Комплексонометрическое титрование – Комплексонометрическое титрование – титрование трилоном Б (динатриевой солью титрование трилоном Б (динатриевой солью этилендиаминтетрауксусной кислотыэтилендиаминтетрауксусной кислоты
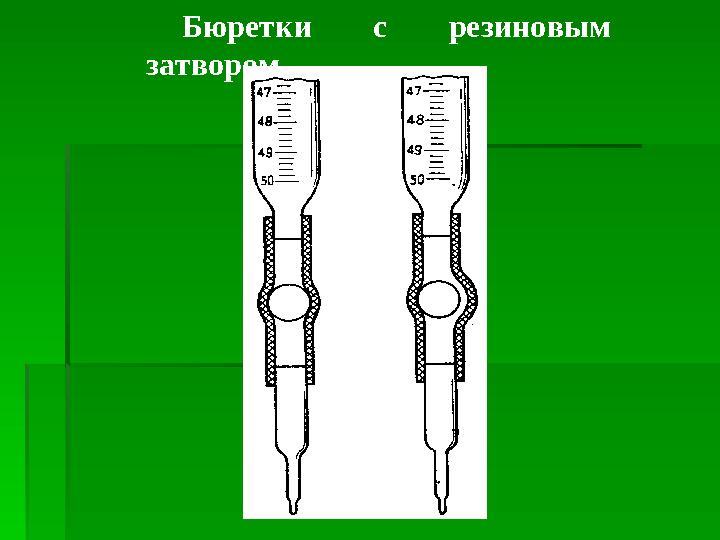
#18 слайд
4. Методы окислительно-восстановительного 4. Методы окислительно-восстановительного
титрованиятитрования
Основаны на окислительно-восстановительных Основаны на окислительно-восстановительных
реакциях, происходящих между определяемым реакциях, происходящих между определяемым
веществом и титрантом. веществом и титрантом.
Перманганатометрия.Перманганатометрия.
Перманганат калия – Перманганат калия –
один из наиболее широко применяемых стандартных один из наиболее широко применяемых стандартных
окислителей. Применяют для определения окислителей. Применяют для определения
восстановителей неорганического и органического восстановителей неорганического и органического
происхожден...
18 слайд
4. Методы окислительно-восстановительного 4. Методы окислительно-восстановительного титрованиятитрования Основаны на окислительно-восстановительных Основаны на окислительно-восстановительных реакциях, происходящих между определяемым реакциях, происходящих между определяемым веществом и титрантом. веществом и титрантом. Перманганатометрия.Перманганатометрия. Перманганат калия – Перманганат калия – один из наиболее широко применяемых стандартных один из наиболее широко применяемых стандартных окислителей. Применяют для определения окислителей. Применяют для определения восстановителей неорганического и органического восстановителей неорганического и органического происхожден...

шағым қалдыра аласыз
















