Зат мөлшері. Авогадро саны
Зат мөлшері. Авогадро саны


#1 слайд
Cабақтың тақырыбы:
Зат мөлшері. Моль. Авогадро саны.
Заттардың молярлық массасы
1 слайд
Cабақтың тақырыбы: Зат мөлшері. Моль. Авогадро саны. Заттардың молярлық массасы

#2 слайд
Оқу мақсаттары
- зат мөлшерінің өлшем бірлігі ретінде –
мольді білу және Авогадро санын білу;
- қосылыстың молярлық массасын есептей
алу.
2 слайд
Оқу мақсаттары - зат мөлшерінің өлшем бірлігі ретінде – мольді білу және Авогадро санын білу; - қосылыстың молярлық массасын есептей алу.
#3 слайд
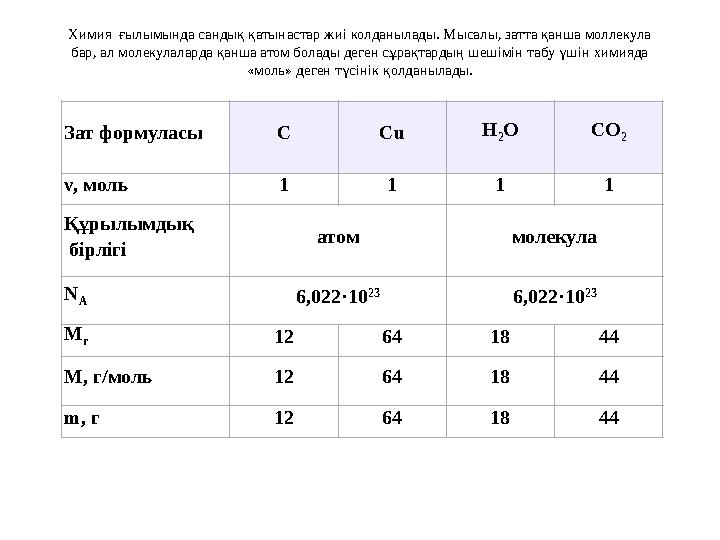
Химия ғылымында сандық қатынастар жиі колданылады. Мысалы, затта қанша моллекула
бар, ал молекулаларда қанша атом болады деген сұрақтардың шешімін табу үшін химияда
«моль» деген түсінік қолданылады.
Зат формуласы C Сu H
2
O CO
2
ν, моль 1 1 1 1
Құрылымдық
бірлігі
атом молекула
N
А 6,022·10
23
6,022·10
23
M
r 12 64 18 44
M, г/моль 12 64 18 44
m, г 12 64 18 44
3 слайд
Химия ғылымында сандық қатынастар жиі колданылады. Мысалы, затта қанша моллекула бар, ал молекулаларда қанша атом болады деген сұрақтардың шешімін табу үшін химияда «моль» деген түсінік қолданылады. Зат формуласы C Сu H 2 O CO 2 ν, моль 1 1 1 1 Құрылымдық бірлігі атом молекула N А 6,022·10 23 6,022·10 23 M r 12 64 18 44 M, г/моль 12 64 18 44 m, г 12 64 18 44
#4 слайд
4 слайд

#5 слайд
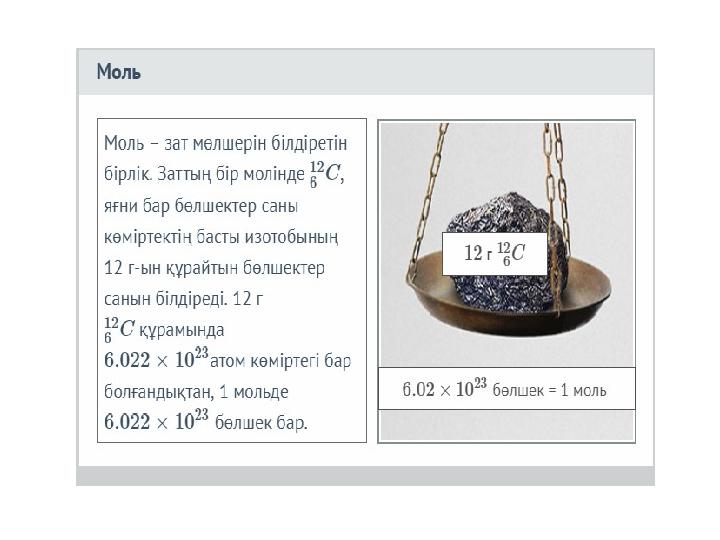
Моль - зат мөлшерінің өлшемі, ол ν ("ню")
грек әрпімен белгіленеді. Сендер физика курсынан
«Авогадро саны» деген түсінікпен таныссыңдар:
N
A
= 6,022 141 29(27)×10
23
моль
−1
Химиктер атомдардың (не өзге бөлшектердің)
нақты бір санын көрсететін арнайы бірлікті
пайдаланады. Бұл бірлік моль деп аталады. «Моль»
түсінігі атомдар мен молекулалардың микроәлемін
және килограмдар мен литрлердің макроәлемін
өзара байланыстырады
5 слайд
Моль - зат мөлшерінің өлшемі, ол ν ("ню") грек әрпімен белгіленеді. Сендер физика курсынан «Авогадро саны» деген түсінікпен таныссыңдар: N A = 6,022 141 29(27)×10 23 моль −1 Химиктер атомдардың (не өзге бөлшектердің) нақты бір санын көрсететін арнайы бірлікті пайдаланады. Бұл бірлік моль деп аталады. «Моль» түсінігі атомдар мен молекулалардың микроәлемін және килограмдар мен литрлердің макроәлемін өзара байланыстырады

#6 слайд
Химиктер үшін «моль» бірлігін пайдалану өте
ыңғайлы, себебі ол бөлшектер санына келгенде әрдайым
бірдей зат мөлшерін көрсетеді.
Моль – 6.022·10
23
бөлшек санында бар зат
мөлшері. Бұл сан Авогадро саны деп аталады, N
A
.
N
A=6.022136736·10
23
Бір мольдегі бөлшектер саны натурал сан болады, әрі ол
математикалық ыңғайлылық үшін ондық бөлшек түрінде
жазылады.
6 слайд
Химиктер үшін «моль» бірлігін пайдалану өте ыңғайлы, себебі ол бөлшектер санына келгенде әрдайым бірдей зат мөлшерін көрсетеді. Моль – 6.022·10 23 бөлшек санында бар зат мөлшері. Бұл сан Авогадро саны деп аталады, N A . N A=6.022136736·10 23 Бір мольдегі бөлшектер саны натурал сан болады, әрі ол математикалық ыңғайлылық үшін ондық бөлшек түрінде жазылады.

#7 слайд
Амедео Авогадро (1776-1856)
1776 жылы 9 тамызда Туринде
дүниеге келген итальяндық физик.
Ол зат құрылысының атомдық
теориясын дамытуға
үлесін қосқан елеулі ғалымдардың
бірі.
Турин Университетінің
математикалық
физика профессоры Авогадро саны
ұғымын алғаш боп енгізді,
Авогадро заңын шығарып,
атомдық және молекулалық
массаны анықтау әдісін ойлап
тапты.
7 слайд
Амедео Авогадро (1776-1856) 1776 жылы 9 тамызда Туринде дүниеге келген итальяндық физик. Ол зат құрылысының атомдық теориясын дамытуға үлесін қосқан елеулі ғалымдардың бірі. Турин Университетінің математикалық физика профессоры Авогадро саны ұғымын алғаш боп енгізді, Авогадро заңын шығарып, атомдық және молекулалық массаны анықтау әдісін ойлап тапты.

#8 слайд
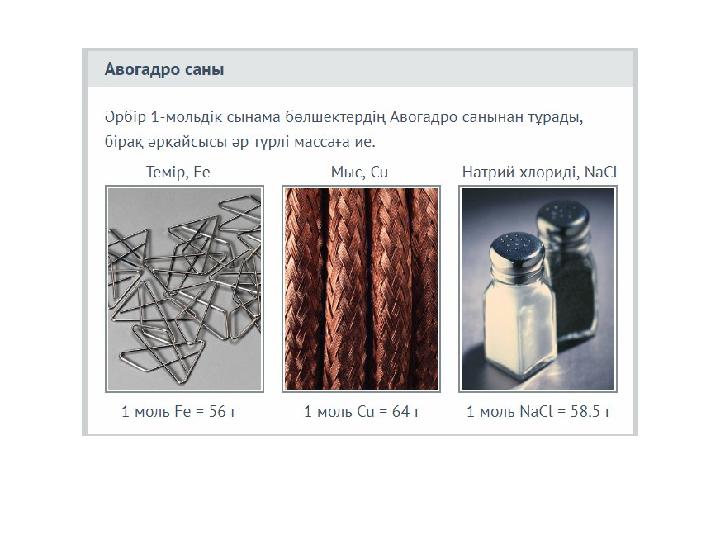
Заттың 1 молінің массасын молярлық
масса деп атайды, ол М әрпімен
белгіленеді, өлшемі г/моль. Оның
сандық мәні салыстырмалы
молекулалық массаға тең.
8 слайд
Заттың 1 молінің массасын молярлық масса деп атайды, ол М әрпімен белгіленеді, өлшемі г/моль. Оның сандық мәні салыстырмалы молекулалық массаға тең.
#9 слайд
9 слайд

#10 слайд
Масса табу
Зат мөлшері
Молярлық масса
Зат мөлшері
Бөлшек саны
n=m/M
10 слайд
Масса табу Зат мөлшері Молярлық масса Зат мөлшері Бөлшек саны n=m/M

#11 слайд
Білімді жаңғырту
1-топ
2-топ
3-топ
11 слайд
Білімді жаңғырту 1-топ 2-топ 3-топ

#12 слайд
Жұптық жұмыс
12 слайд
Жұптық жұмыс

#13 слайд
13 слайд
#14 слайд
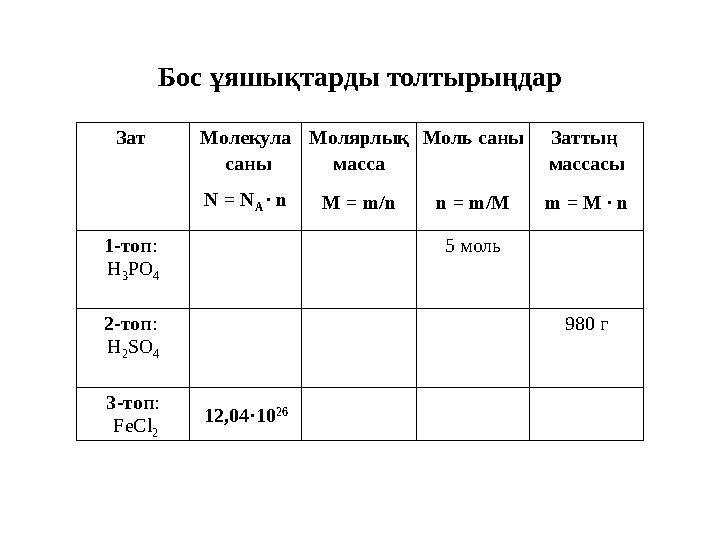
Зат Молекула
саны
N = N
A
∙ n
Молярлық
масса
M = m/n
Моль саны
n = m/M
Заттың
массасы
m = M ∙ n
1-топ:
H
3
PO
4
5 моль
2-топ:
H
2
SO
4
980 г
3-топ:
FeCl
2
12,04·10
26
Бос ұяшықтарды толтырыңдар
14 слайд
Зат Молекула саны N = N A ∙ n Молярлық масса M = m/n Моль саны n = m/M Заттың массасы m = M ∙ n 1-топ: H 3 PO 4 5 моль 2-топ: H 2 SO 4 980 г 3-топ: FeCl 2 12,04·10 26 Бос ұяшықтарды толтырыңдар
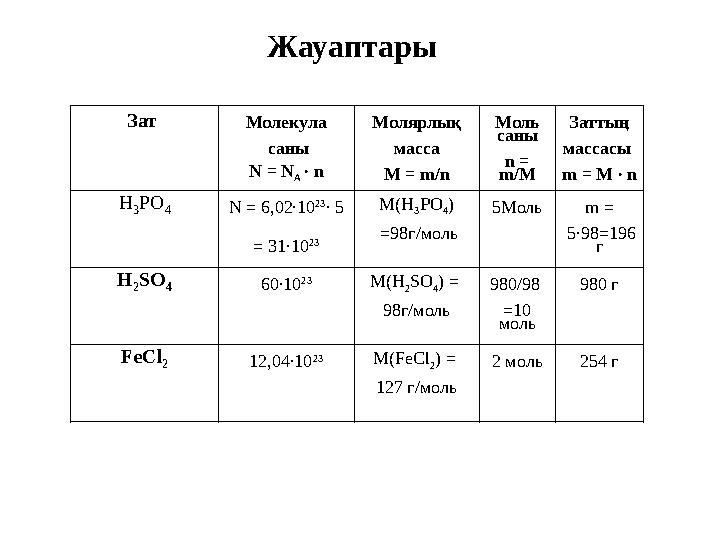
#15 слайд
Зат Молекула
саны
N = N
A
∙ n
Молярлық
масса
M = m/n
Моль
саны
n =
m/M
Заттың
массасы
m = M ∙ n
H
3
PO
4 N = 6,02∙10
23
∙ 5
= 31∙10
23
M(H
3
PO
4
)
=98г/моль
5Моль m =
5∙98=196
г
H
2
SO
4 60∙10
23 M(H
2
SO
4
) =
98г/моль
980/98
=10
моль
980 г
FeCl
2 12,04∙10
23 M(FeCl
2
) =
127 г/моль
2 моль254 г
Жауаптары
15 слайд
Зат Молекула саны N = N A ∙ n Молярлық масса M = m/n Моль саны n = m/M Заттың массасы m = M ∙ n H 3 PO 4 N = 6,02∙10 23 ∙ 5 = 31∙10 23 M(H 3 PO 4 ) =98г/моль 5Моль m = 5∙98=196 г H 2 SO 4 60∙10 23 M(H 2 SO 4 ) = 98г/моль 980/98 =10 моль 980 г FeCl 2 12,04∙10 23 M(FeCl 2 ) = 127 г/моль 2 моль254 г Жауаптары

#16 слайд
Рефлексия
Шығу билеті
•Сізге не ұнады?
•Сізге не ұнамады?
•Сіз әлі де не білгіңіз келеді? (ұсыныс)
16 слайд
Рефлексия Шығу билеті •Сізге не ұнады? •Сізге не ұнамады? •Сіз әлі де не білгіңіз келеді? (ұсыныс)

#17 слайд
•https://bilimland.kz/kk/content/structure/976-
chemistry#lesso n=11294
• https://kk.wikipedia.org/wiki/%
17 слайд
•https://bilimland.kz/kk/content/structure/976- chemistry#lesso n=11294 • https://kk.wikipedia.org/wiki/%

шағым қалдыра аласыз
















