Назар аударыңыз. Бұл материалды сайт қолданушысы жариялаған. Егер материал сіздің авторлық құқығыңызды бұзса, осында жазыңыз. Біз ең жылдам уақытта материалды сайттан өшіреміз
Жақын арада сайт әкімшілігі сізбен хабарласады

Бонусты жинап картаңызға (kaspi Gold, Halyk bank) шығарып аласыз


8 класс. Реакции металлов с растворами кислот.
Дипломдар мен сертификаттарды алып үлгеріңіз!


Материалдың толық нұсқасын
жүктеп алып көруге болады
|
Раздел |
8.1С Сравнение активностей металлов. |
|||||||||||||||||||||||
|
ФИО педагога |
|
|||||||||||||||||||||||
|
Дата |
|
|||||||||||||||||||||||
|
Класс: 8 |
Количество присутствующих: |
отсутствующих: |
||||||||||||||||||||||
|
Тема урока |
Реакции металлов с растворами кислот. Лабораторный опыт №1 «Взаимодействие металлов с растворами кислот» |
|||||||||||||||||||||||
|
Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу) |
8.2.4.4 -изучить реакции различных металлов с растворами кислот 8.2.2.5 -составлять уравнения реакций металлов с кислотами |
|||||||||||||||||||||||
|
Цель урока |
|
|||||||||||||||||||||||
|
Критерии оценивания |
|
|||||||||||||||||||||||
|
Ход урока |
||||||||||||||||||||||||
|
Этапы урока |
Действия педагога |
Действия ученика |
Оценивание |
Ресурсы |
||||||||||||||||||||
|
Организационный этап |
Организационный момент. Деление на группы. Класс разделен на 3 группы, чтобы вместе работать и помогать друг другу. («Кислоты», «Металлы», «Эксперименты»). Русская пословица гласит: «Одна голова хорошо, а две головы - лучше». Психологический настрой. Прием «Добрый сосед» Приветствие, создание эмоционального настроя и коллаборативной среды. Здравствуйте ребята! Мы начинаем наш урок. Охарактеризуйте вашего соседа по парте положительным качеством, начинающееся с буквы его имени. Какое у вас настроение? Если хорошее, то похлопайте 3 раза. Прежде чем перейти к изучению нового раздела, давайте проверим насколько хорошо вы подготовились к уроку. Проверка домашнего задания: Задание №1. Приём «Соответствие». Установите соответствие между металлом и его свойством:
|
Приветствуют учителя.
Организуют рабочее место.
|
Лист оценивание
Дескриптор: 1.находят соответсвующие реакций (1 балл)
|
Интерактивное доска Разноцветные конфеты
Ключ: А-4.5.8 Б-2.3.4.6 В-1.2.6 Г-2.3.7
|
||||||||||||||||||||
|
Изучение нового материала |
Изучение новой темы: Стратегия «Хитрые вопросы», «Эксперимент» Учитель демонстрирует опыт взаимодействия металлов с кислотами. После просмотра опыта и ответов на «Хитрые вопросы», попробуйте определить тему нашего урока. Общие вопросы учащимся. Для чего у меня на столе стоят три пробирки с тремя металлами?~ (для проведения опытов взаимодействия металлов с кислотами) В каждую пробирку нальем по 2 мл. раствора соляной кислоты и осторожно нагреем пробирки. Что вы наблюдаете? (выделяются пузырьки газа в 1 и 2 пробирках) Действительно, в некоторых из них выделяется газ, при поджигании которого раздается характерный хлопок «пах», следовательно это водород. В каких пробирках металлы реагируют интенсивнее? В результате опытов заметим, что цинк интенсивно реагирует с кислотой, а железо медленно. А медь совсем не реагирует. Итак, какова тема нашего урока? Верно, сегодня мы изучим «Реакции металлов с растворами кислот». Какой вывод можно сделать на основании увиденных опытов? Металлы проявляют различную активность в отношении кислот. На основании опытов можно расположить металлы следующим образом: Zn>Fe>Cu
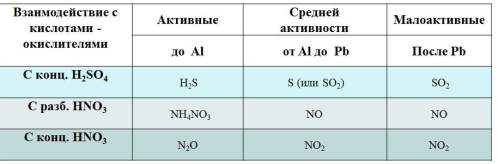
Объяснения учителя: Но есть и исключение из правил!!! При взаимодействии азотной кислоты с металлами никогда не выделяется водород. Например: Cu+4HNO3(конц.)=Cu(NO3)2+2NO2+2H2O 3Cu +8HNO₃(разб.) → 3Cu(NO₃)₂ + 2NO + 4H₂O Рассмотрим таблицу №1
Холодная концентрированная серная кислота и концентрированная азотная кислота пассивируют Al, Cr, Fe, так как на их поверхности образуется оксидная пленка. Благородные металлы: платина, золото не реагируют с данными кислотами.
Задание №1. Стратегия: «Эксперимент». Работа учащихся в группах. Лабораторный опыт №3 «Взаимодействие металлов с растворами кислот». Ученики по результатом эксперимента, проводившиеся в начале новой темы заполняют таблицу.
Выявить, насколько ученики правильно выполняют задание. Для этого деятельность учащихся останавливается, и учитель задает вопрос: «Что мы делаем?» Ответив на этот вопрос, учащиеся предоставляют информацию об уровне понимания сути задания или процесса его выполнения.
ФО:Взаимооценивание – прием «Мордашки» Пары учащихся обмениваются работами с другими парами и оценивают по критериям
Задание №2. Стратегия «Думай, общайся в паре, делись» Парам раздаются карточки со средним и высоким уровнем задания: Синие – уровень А, Красные – уровень В. Напишите реакции трёх металлов различной активности с раствором серной кислоты (уровень А), и трех металлов средней или слабой активности с концентрированной азотной кислотой (уровень В), используя ряд активности металлов. Укажите условия взаимодействия данных реакций.
Расставьте коэффициенты. Уровень А 1. 2. 3. Уровень В 1. 2. 3.
Индивидуальная работа. Задание №3. Закончите практически осуществимые реакции и расставьте коэффициенты. Al+HCl= Ag+H2SO4= Ca+H3PO4= Rt+HCl= Cu+H3PO4= Закрепление. Задание №1. В соответствии с рядом активности металлов по отношению к воде и растворам кислот, расставьте знаки «>» -более активный или «<» -менее активный между парой металлов. А) алюминий > железо В) железо > серебро С) золото < медь
Задание №2 Уравнений химических реакций взаимодействие металлов с кислотами.
Домашнее задание: §12. Выполнить задание уровень В.
Оценивание |
Слушают задание Анализируют Отвечают на вопросы Oбъединяются в группы, вспоминают правила рабoты в группе. oбсуждают, слушают друг друга.
Ученики выполняют задание
Ученики выполняют задание
Ученики выполняют задание
Материал ұнаса әріптестеріңізбен бөлісіңіз
Ашық сабақ, ҚМЖ, көрнекілік, презентация
жариялап табыс табыңыз!
Материалдарыңызды сатып, ақша табыңыз.
(kaspi Gold, Halyk bank)
Ресми байқаулар тізімі
Республикалық байқауларға қатысып жарамды дипломдар алып санатыңызды көтеріңіз!
Материал іздеу Сіз үшін 400 000 ұстаздардың еңбегі мен тәжірибесін біріктіріп, ең үлкен материалдар базасын жасадық. Төменде пәніңізді белгілеп, керек материалды алып сабағыңызға қолдана аласыз Барлығы 663 959 материал жиналған
Ұқсас материалдар  Дайын ҚМЖ. Барлық пәндерден 2024-2025 оқу жылына, жаңа бұйрыққа сай жасалған Дайын ҚМЖ. Барлық пәндерден 2024-2025 оқу жылына, жаңа бұйрыққа сай жасалғанСертификатталған тренер жасаған
ҚР Білім және Ғылым министірлігінің стандарты бойынша жасалған.
Барлық пәндер Барлық материалдар Барлық сыныптар
Аттестацияда (ПББ) 100% келетін тақырыптармен дайындаймыз Аттестацияда (ПББ) келетін тақырыптар бойынша жасалған тесттермен дайындалып, бізбен бірге тестілеуден оңай өтесіз Өткен жылы бізбен дайындалған ұстаздар 50/50 жинап рекорд жасады Толығырақ | ||||||||||||||||||||||