
ЖАЛПЫ ХИМИЯЛЫҚ ТЕХНОЛОГИЯ
4-ші дәріс
Тақырып: Аммиак өндірісі.
ЖОСПАР
-
Атмосфералық азотты байланыстыру әдістері.
-
Азотты-сутекті қоспаны алу және тазарту.
-
Аммиак синтезінің физика-химиялық негіздері.
-
Аммиак синтезінің технологиялық сұлбасы.
1. Атмосфералық азотты байланыстыру әдістері.
Атмосфералық азотты байланыстырудың үш әдісі белгілі:
1. Электродоғалық әдіс (1500К)
N2+O22NO; ΔH=180 кДж
Бұл эндотермиялық процесс, шығымы аз, энергия көп жұмсалады, сондықтан қазіргі кезде плазмалық процесстер кең қолдануда.
2. Цианамидтік әдіс (10000С)
CaC2+N2CaCN2+C; ΔH=302 кДж
CaCN2+3H2O=2NH3+CaCO3;
CaCN2+H2O+CO2=CN-NH2+CaCO3;
CN-NH2+H2O=(NH2)2CO
Бұл процесс катализаторлар қатысында 5000С температурада, 30МПа қысымда жүреді.
3. Аммиактік әдіс:
N2+3H22NH3; ΔH=-112 кДж
Кен таралған аммиакты әдісін дәлірек қарастырайық.
2. Азотты-сутекті қоспаны алу және тазарту
Ауаны сұйылту – ректификациялау.
Тқайнау(N2)=-195,80C;Тқайнау(О2)=-1830C.
Сутегін метан немесе СО газын су буымен конверсиялау арқылы алуға болады (катализатор - Ni/Al2O3, температура - 800-10000С). Одан басқа тағы сутегін судың электролизімен, метанның крекингімен, кокс газынан бөлу арқылы алуға болады.
CH4+0,5O2=CO+2H2; ΔH=-35 кДж;
CH4+H2O=CO+3H2; ΔH=206 кДж;
CO+H2O=CO2+H2; ΔH=41 кДж;
CH4+CO2=2CO+2H2; ΔH=248 кДж.
Cинтез-газ (СО+Н2) құрамында: H2~62%, CO2-0,5%, CO~17%, N2~20%, CH4~0,3%.
Келесі сатыда газ қоспасын СО және СО2 газдардан тазартады, өйткені бұл газдары катализаторды (Feбалқ) уландырады.
Тазартуды монометаноламиннің 20% ертіндісімен 2,5-3,0 МПа жүргізеді. Бұл әдіспен газ 75%-на дейін тазартылады:
![]()
карбонат
![]()
гидрокарбонат
Түзілген карбонат пен гидрокарбонатты қыздыру барысында регенерацияланады.
Осындай тазартудан кейін СО2-нің мөлшері 0,1%-дан аспайды.
СО-дан тазарту үшін газ қоспасы сұйық азотпен жуылады. Осының нәтижесінде СО, СО2, қалдық метан, аргон, оттек сұйыққа айналады.
Әрі қарай СО, СО2 газдардың қалдықтарынан тазарту үшін метандандыруды жүргізеді:
СО+3Н2=CH4+H2O;
CO2+4H2=CH4+2H2O;
O2+2H2=2H2O.
Бұл процесс Ni/Al2O3 катализаторы қатысында, 3000С температурада, 2-3атм қысымда жүргізіледі.
3. Аммиак синтезінің физико-химиялық негіздері
3H2+N2![]() 2NH3
2NH3
Реакцияның тепе-теңдігі қысым мен температураға байланысты өзгеріп отырады. Тепе-теңдікті оң жаққа ауыстыру үшін қысымды көбейту немесе температураны төмендету қажет.
450С температурада және 10атм қысымда газ құрамында 15% аммиак, ал 4500С және 30атм қысымда 35% аммиак болады, бірақ өте үлкен қысым техникалық жағынан қолайсыз.
Температура төмендегенде аммиактың шығымы жоғары болғанымен реакция жылдамдығы құрт төмендеп кетеді.
Көптеген металдар катализдік әсер көрсетеді: Mn, Fe, Ro, Re, Os, Pt, U (d-және f-электрондық қабаттары толтырылған элементтері). Аталған катализаторлардың ең тиімдісі – темір. Балқытылған темір Al2O3, K2O, CaO және SiO2 қоспасына қондырылады. Күкірттің қосылыстары, СО және СО2 катализаторды уландырып, істен шығарады. СО және СО2-мен уланған катализаторды қыздыру арқылы қайтадан алғашқы қалпына келтіруге болады.
Катализдік механизімі бес сатыдан тұрады:
-
Азот пен сутегінің газ көлемінен катализатор бетіндегі белсенді орталықтарға диффузия арқылы жеткізілуі;
-
Азоттың катализатор бетінде белсенді адсорбциялануы;
-
Сутегінің адсорбцияланған азотпен байланысып, аралық қосылыс беруі:
NHKNH2KNH3K
имид амид аммиак
-
Аммиактың катализатор бетінен десорбциялануы;
-
Газ күйіндегі аммиактың катализатордан газды фазаға диффузиясы.
Реакция жылдамдығы екінші сатымен шектеледі.
Көптеген тәжірибелік деректер бойынша процесс жылдамдығы келесі теңдеумен анықталады:

k1 және k2 – тура және кері реакциялардың жылдамдық константалары; Рі – парциалды қысымдар; - (01) катализатор бетінің азоттың толу дәріжесін көрсететін коэффициент; - қысымға байланысты өзгеретін коэффициент.
Егер =0 болса, азот адсорбциясы болмаса, онда реакция кері бағытта жүреді:

Егер =1 болса, онда реакция тура бағытта жүреді:

Практикалық жағдайда 0,5 тең.
-
Аммиак синтезінің технологиялық сұлбасы.
Аммиакты өндіру 3 түрлі қысымда жүреді:
-
10МПа-дан төмен;
-
20-30МПа;
-
75-100МПа.
Олардан ең кең қолданатыны 20-30МПа қысымында аммиакты өндіру желісі.
1-ші суретте аммиак синтезінің орта қысымды түтікті мұнара келтірілген.
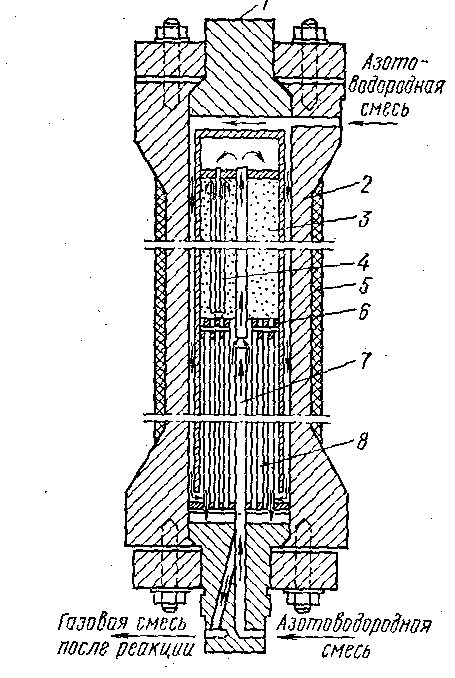
1-ші сурет. Аммиак синтезінің орта қысымды түтікті мұнара:
1- қақпақтар; 2- мұнара сырт пішіні; 3- катализаторлық қорап; 4- жылу алмастырғыш түтіктер; 6- жылуды изоляциялау; 6- тор; 7-орта түтігі; 8-жылуалмастырғыш.
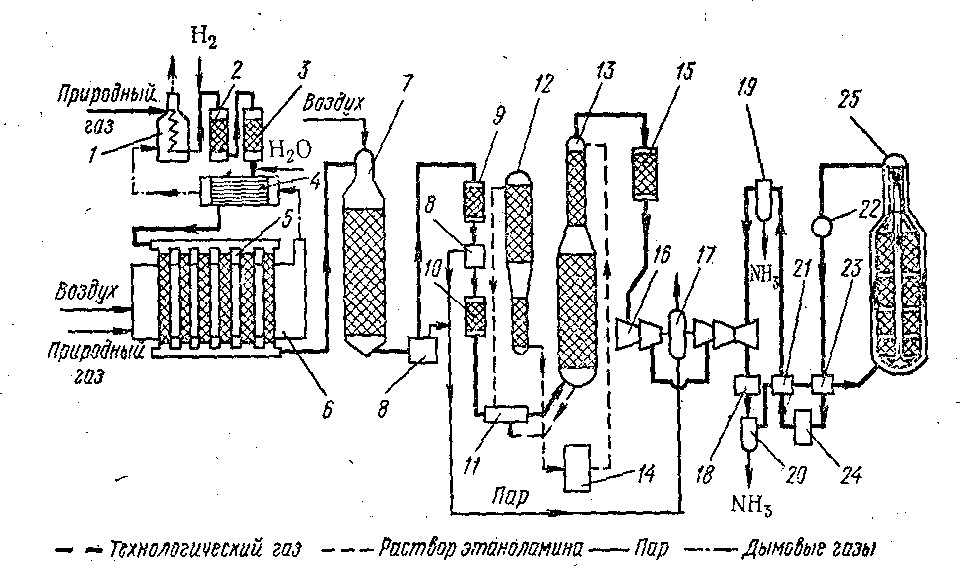
2-ші сурет. Аммиак өндірісінің технологиялық сұлбасы:
1-табиғи газды жылытқыш; 2 –органикалық күкіртті гидрлеу реакторы; 3 -күкірттісутегінің адсорбері; 4 -жылуалмастырғыш; 5 –метанның конверторы – түтікті пеш; 6 -пеш; 7 –метанның шахталық конвертері; 8 –булы қазан; 9 -I-ші сатылы СО конверторы; 10–II-ші сатылы СО конверторы; 11- жылуалмастырғыш; 12-СО2 регенераторы; 13 - СО2 абсорбері; 14, 24–ауалы тоңазытқыш; 15 — метанатор; 16 – газды турбиналы турбокомпрессор; 17 –булы турбина; 18- аммиакты тоңазытқыш; 19 –біріншілік сепаратор; 20 –екіншілік сепаратор; 21 салқын жылуалмастырғыш; 22 - булы қазандарды су жылытқыш; 23 — «ыстық» жылуалмастырғыш; 25 – сатылы синтез мұнарасы.
Әдебиеттер тізімі
негізгі
-
Решетников П.А., Логинов Н.Я., Сборник примеров и задач по основам химической технологии. М:, 1973
-
Общая химическая технология: в 2-х ч.,/под ред. И.П. Мухленова. М:1984.
-
Кутепов А.М. и др. Общая химическая технология. М:1990.
-
Основы химической технологии/под ред. И.П. Мухленова М:1991.
-
Ключников Н.Г. Практические занятия по химической технологии. М:1972.
-
Ключников Н.Г. Практические занятия по химической технологии. М:1978.
-
Аранская О.С. Сборник задач и упражнений по химической технологии и биотехнологии. Минск.1989.
-
Вольфкович С.И. Общая химическая технология. М: 1959
-
Букварева О.Ф. Кинетика и термохимия процессов термодеструкции углеродсодержащих веществ. М:2001.
-
Иванов Г.Н., Лопатинский В.П. Основные методы расчета промышленных реакторов. Томск. 1985.
-
Касаткин А.Г. Основные процессы и аппараты химической технологии.М:1973.
-
Кафоров В.В., Глебов М.Б. Математическое моделирование основных процессов технологических производств. М: 1991.
-
Крашенинников С.А. Технология соды. М: 1988.
-
Лазарев С.Я. и др. Лабораторный практикум по синтетическим каучукам. Л:1986.
-
Лапшеников Г., Полоцкий Л.М. Автоматизация производственных процессов в химической промышленности. М:1988.
-
Левин В.П., Туварджиев Л.В. Химико-технологические поцессы получения промышленных материалов. Калинин, 1989.
-
Методы и средства автоматизированного расчета химико-технологических систем.Л:1987.
-
Одабашян Г.В., Швец В.Ф. Лабораторный практикум по химии и технологии основного органического и нефтехимического синтеза. М: 1992.
-
Позин М.Е. Технология минеральных удобрений. Л: 1983.
-
Процессы и аппараты химической технологии. Минск: 1988.
-
Соколов Р.С. Химическая технология: в 2-х т. М: 2000.
-
Соколов Р.С. Лабораторный практикум по химической технологии М:1985.
-
Суербаев Х.А. Катализ в нефтепереработке ч.3. Алматы, 2002.
-
Суербаев Х.А. Каталитические процессы в нефтеперерабатывающей промышленности. Алматы, 2002.
-
Тимофеев В.С., Серафимов Л.А. Принципы технологии основного органичекого и нефтехимического синтеза. М:1992.
-
Химическая технология /под. ред. А.В. Белоцветова М: 1971.
-
Дытнерский Ю.И. Процессы и аппараты химической технологии. ч.1, М: 2002.
-
Хорошко С.И., Хорошко А.Н. Сборник задач по химии и технологии нефти и газа. Минск. 1989.
-
Павлов К.Ф., Романков П.Г., Носков А.А. Примеры и задачи по курсу процесов и аппаратов химической технологии. Л: 1961.
-
Плановский А.Н., Рамм В.Н., Каган С.З. Процессы и аппараты химической технологии.М: 1962.
-
Оңғарбаев Е.К. Табиғи және мұнайға серік газдарды өңдеу: Оқу құралы. Алматы, 2003.
-
Суербаев Х.А. Мұнай өңдеу және мұнай химиясындағы бос-радикалдық процесстер. Алматы. 2004.
-
Баязит Н.Х. Кенді жер астында қазу және жобалау. Алматы. 1996.
-
Нысанбаев Ғ. Мың құпиялы металдар. Алматы: 1993.
-
Жұмағұлов Н. Сумен жабдықтау. Алматы. 1995.
ҚОСЫМША
-
Евстигнеева Р.П. Тонкий органический синтез. М: 1991.
-
Ахназарова С.Л., Кафаров В.В. Методы оптимизации эксперимента в химической технологии. М: 1985.
-
Бажиров Н.С., Битемиров М.К. Химия и технология шлаковых цементов. Алматы. 1996.
-
Гибкость химических производств. Анализ и оценка. М: 2000.
-
Беляков А.В. Механическая обработка неорганических неметаллических материалов. М: 2001.
-
Беляков А.В. Химические методы получения керамических порошков. М: 2001.
-
Борисов В.В., Плютто В.П. Практикум по теории автоматического управления химико-технологическими процессами. М: 1987.
-
Дитнерский Ю.И. Моделирование процесса фильтрации с помощью керамических мембран. М:2001.
-
Информационные технологии в химии: использование автоматизированной информационно-поисковой системы STN Intepnational для поиска хим. информации. М:2000.
-
Ионообменные методы очистки веществ. Воронеж, 1984.
-
Кафаров В.В., Мешалкин В.П. Анализ и синтез химико-технологических систем. М: 1991.
-
Комарова Т.В. Получение углеродных материалов М: 2001.
-
Лабораторный практикум по синтезу промежуточных подуктов и красителей. Л: 1985.
жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
Аммиак өндірісі
Аммиак өндірісі
ЖАЛПЫ ХИМИЯЛЫҚ ТЕХНОЛОГИЯ
4-ші дәріс
Тақырып: Аммиак өндірісі.
ЖОСПАР
-
Атмосфералық азотты байланыстыру әдістері.
-
Азотты-сутекті қоспаны алу және тазарту.
-
Аммиак синтезінің физика-химиялық негіздері.
-
Аммиак синтезінің технологиялық сұлбасы.
1. Атмосфералық азотты байланыстыру әдістері.
Атмосфералық азотты байланыстырудың үш әдісі белгілі:
1. Электродоғалық әдіс (1500К)
N2+O22NO; ΔH=180 кДж
Бұл эндотермиялық процесс, шығымы аз, энергия көп жұмсалады, сондықтан қазіргі кезде плазмалық процесстер кең қолдануда.
2. Цианамидтік әдіс (10000С)
CaC2+N2CaCN2+C; ΔH=302 кДж
CaCN2+3H2O=2NH3+CaCO3;
CaCN2+H2O+CO2=CN-NH2+CaCO3;
CN-NH2+H2O=(NH2)2CO
Бұл процесс катализаторлар қатысында 5000С температурада, 30МПа қысымда жүреді.
3. Аммиактік әдіс:
N2+3H22NH3; ΔH=-112 кДж
Кен таралған аммиакты әдісін дәлірек қарастырайық.
2. Азотты-сутекті қоспаны алу және тазарту
Ауаны сұйылту – ректификациялау.
Тқайнау(N2)=-195,80C;Тқайнау(О2)=-1830C.
Сутегін метан немесе СО газын су буымен конверсиялау арқылы алуға болады (катализатор - Ni/Al2O3, температура - 800-10000С). Одан басқа тағы сутегін судың электролизімен, метанның крекингімен, кокс газынан бөлу арқылы алуға болады.
CH4+0,5O2=CO+2H2; ΔH=-35 кДж;
CH4+H2O=CO+3H2; ΔH=206 кДж;
CO+H2O=CO2+H2; ΔH=41 кДж;
CH4+CO2=2CO+2H2; ΔH=248 кДж.
Cинтез-газ (СО+Н2) құрамында: H2~62%, CO2-0,5%, CO~17%, N2~20%, CH4~0,3%.
Келесі сатыда газ қоспасын СО және СО2 газдардан тазартады, өйткені бұл газдары катализаторды (Feбалқ) уландырады.
Тазартуды монометаноламиннің 20% ертіндісімен 2,5-3,0 МПа жүргізеді. Бұл әдіспен газ 75%-на дейін тазартылады:
![]()
карбонат
![]()
гидрокарбонат
Түзілген карбонат пен гидрокарбонатты қыздыру барысында регенерацияланады.
Осындай тазартудан кейін СО2-нің мөлшері 0,1%-дан аспайды.
СО-дан тазарту үшін газ қоспасы сұйық азотпен жуылады. Осының нәтижесінде СО, СО2, қалдық метан, аргон, оттек сұйыққа айналады.
Әрі қарай СО, СО2 газдардың қалдықтарынан тазарту үшін метандандыруды жүргізеді:
СО+3Н2=CH4+H2O;
CO2+4H2=CH4+2H2O;
O2+2H2=2H2O.
Бұл процесс Ni/Al2O3 катализаторы қатысында, 3000С температурада, 2-3атм қысымда жүргізіледі.
3. Аммиак синтезінің физико-химиялық негіздері
3H2+N2![]() 2NH3
2NH3
Реакцияның тепе-теңдігі қысым мен температураға байланысты өзгеріп отырады. Тепе-теңдікті оң жаққа ауыстыру үшін қысымды көбейту немесе температураны төмендету қажет.
450С температурада және 10атм қысымда газ құрамында 15% аммиак, ал 4500С және 30атм қысымда 35% аммиак болады, бірақ өте үлкен қысым техникалық жағынан қолайсыз.
Температура төмендегенде аммиактың шығымы жоғары болғанымен реакция жылдамдығы құрт төмендеп кетеді.
Көптеген металдар катализдік әсер көрсетеді: Mn, Fe, Ro, Re, Os, Pt, U (d-және f-электрондық қабаттары толтырылған элементтері). Аталған катализаторлардың ең тиімдісі – темір. Балқытылған темір Al2O3, K2O, CaO және SiO2 қоспасына қондырылады. Күкірттің қосылыстары, СО және СО2 катализаторды уландырып, істен шығарады. СО және СО2-мен уланған катализаторды қыздыру арқылы қайтадан алғашқы қалпына келтіруге болады.
Катализдік механизімі бес сатыдан тұрады:
-
Азот пен сутегінің газ көлемінен катализатор бетіндегі белсенді орталықтарға диффузия арқылы жеткізілуі;
-
Азоттың катализатор бетінде белсенді адсорбциялануы;
-
Сутегінің адсорбцияланған азотпен байланысып, аралық қосылыс беруі:
NHKNH2KNH3K
имид амид аммиак
-
Аммиактың катализатор бетінен десорбциялануы;
-
Газ күйіндегі аммиактың катализатордан газды фазаға диффузиясы.
Реакция жылдамдығы екінші сатымен шектеледі.
Көптеген тәжірибелік деректер бойынша процесс жылдамдығы келесі теңдеумен анықталады:

k1 және k2 – тура және кері реакциялардың жылдамдық константалары; Рі – парциалды қысымдар; - (01) катализатор бетінің азоттың толу дәріжесін көрсететін коэффициент; - қысымға байланысты өзгеретін коэффициент.
Егер =0 болса, азот адсорбциясы болмаса, онда реакция кері бағытта жүреді:

Егер =1 болса, онда реакция тура бағытта жүреді:

Практикалық жағдайда 0,5 тең.
-
Аммиак синтезінің технологиялық сұлбасы.
Аммиакты өндіру 3 түрлі қысымда жүреді:
-
10МПа-дан төмен;
-
20-30МПа;
-
75-100МПа.
Олардан ең кең қолданатыны 20-30МПа қысымында аммиакты өндіру желісі.
1-ші суретте аммиак синтезінің орта қысымды түтікті мұнара келтірілген.

1-ші сурет. Аммиак синтезінің орта қысымды түтікті мұнара:
1- қақпақтар; 2- мұнара сырт пішіні; 3- катализаторлық қорап; 4- жылу алмастырғыш түтіктер; 6- жылуды изоляциялау; 6- тор; 7-орта түтігі; 8-жылуалмастырғыш.

2-ші сурет. Аммиак өндірісінің технологиялық сұлбасы:
1-табиғи газды жылытқыш; 2 –органикалық күкіртті гидрлеу реакторы; 3 -күкірттісутегінің адсорбері; 4 -жылуалмастырғыш; 5 –метанның конверторы – түтікті пеш; 6 -пеш; 7 –метанның шахталық конвертері; 8 –булы қазан; 9 -I-ші сатылы СО конверторы; 10–II-ші сатылы СО конверторы; 11- жылуалмастырғыш; 12-СО2 регенераторы; 13 - СО2 абсорбері; 14, 24–ауалы тоңазытқыш; 15 — метанатор; 16 – газды турбиналы турбокомпрессор; 17 –булы турбина; 18- аммиакты тоңазытқыш; 19 –біріншілік сепаратор; 20 –екіншілік сепаратор; 21 салқын жылуалмастырғыш; 22 - булы қазандарды су жылытқыш; 23 — «ыстық» жылуалмастырғыш; 25 – сатылы синтез мұнарасы.
Әдебиеттер тізімі
негізгі
-
Решетников П.А., Логинов Н.Я., Сборник примеров и задач по основам химической технологии. М:, 1973
-
Общая химическая технология: в 2-х ч.,/под ред. И.П. Мухленова. М:1984.
-
Кутепов А.М. и др. Общая химическая технология. М:1990.
-
Основы химической технологии/под ред. И.П. Мухленова М:1991.
-
Ключников Н.Г. Практические занятия по химической технологии. М:1972.
-
Ключников Н.Г. Практические занятия по химической технологии. М:1978.
-
Аранская О.С. Сборник задач и упражнений по химической технологии и биотехнологии. Минск.1989.
-
Вольфкович С.И. Общая химическая технология. М: 1959
-
Букварева О.Ф. Кинетика и термохимия процессов термодеструкции углеродсодержащих веществ. М:2001.
-
Иванов Г.Н., Лопатинский В.П. Основные методы расчета промышленных реакторов. Томск. 1985.
-
Касаткин А.Г. Основные процессы и аппараты химической технологии.М:1973.
-
Кафоров В.В., Глебов М.Б. Математическое моделирование основных процессов технологических производств. М: 1991.
-
Крашенинников С.А. Технология соды. М: 1988.
-
Лазарев С.Я. и др. Лабораторный практикум по синтетическим каучукам. Л:1986.
-
Лапшеников Г., Полоцкий Л.М. Автоматизация производственных процессов в химической промышленности. М:1988.
-
Левин В.П., Туварджиев Л.В. Химико-технологические поцессы получения промышленных материалов. Калинин, 1989.
-
Методы и средства автоматизированного расчета химико-технологических систем.Л:1987.
-
Одабашян Г.В., Швец В.Ф. Лабораторный практикум по химии и технологии основного органического и нефтехимического синтеза. М: 1992.
-
Позин М.Е. Технология минеральных удобрений. Л: 1983.
-
Процессы и аппараты химической технологии. Минск: 1988.
-
Соколов Р.С. Химическая технология: в 2-х т. М: 2000.
-
Соколов Р.С. Лабораторный практикум по химической технологии М:1985.
-
Суербаев Х.А. Катализ в нефтепереработке ч.3. Алматы, 2002.
-
Суербаев Х.А. Каталитические процессы в нефтеперерабатывающей промышленности. Алматы, 2002.
-
Тимофеев В.С., Серафимов Л.А. Принципы технологии основного органичекого и нефтехимического синтеза. М:1992.
-
Химическая технология /под. ред. А.В. Белоцветова М: 1971.
-
Дытнерский Ю.И. Процессы и аппараты химической технологии. ч.1, М: 2002.
-
Хорошко С.И., Хорошко А.Н. Сборник задач по химии и технологии нефти и газа. Минск. 1989.
-
Павлов К.Ф., Романков П.Г., Носков А.А. Примеры и задачи по курсу процесов и аппаратов химической технологии. Л: 1961.
-
Плановский А.Н., Рамм В.Н., Каган С.З. Процессы и аппараты химической технологии.М: 1962.
-
Оңғарбаев Е.К. Табиғи және мұнайға серік газдарды өңдеу: Оқу құралы. Алматы, 2003.
-
Суербаев Х.А. Мұнай өңдеу және мұнай химиясындағы бос-радикалдық процесстер. Алматы. 2004.
-
Баязит Н.Х. Кенді жер астында қазу және жобалау. Алматы. 1996.
-
Нысанбаев Ғ. Мың құпиялы металдар. Алматы: 1993.
-
Жұмағұлов Н. Сумен жабдықтау. Алматы. 1995.
ҚОСЫМША
-
Евстигнеева Р.П. Тонкий органический синтез. М: 1991.
-
Ахназарова С.Л., Кафаров В.В. Методы оптимизации эксперимента в химической технологии. М: 1985.
-
Бажиров Н.С., Битемиров М.К. Химия и технология шлаковых цементов. Алматы. 1996.
-
Гибкость химических производств. Анализ и оценка. М: 2000.
-
Беляков А.В. Механическая обработка неорганических неметаллических материалов. М: 2001.
-
Беляков А.В. Химические методы получения керамических порошков. М: 2001.
-
Борисов В.В., Плютто В.П. Практикум по теории автоматического управления химико-технологическими процессами. М: 1987.
-
Дитнерский Ю.И. Моделирование процесса фильтрации с помощью керамических мембран. М:2001.
-
Информационные технологии в химии: использование автоматизированной информационно-поисковой системы STN Intepnational для поиска хим. информации. М:2000.
-
Ионообменные методы очистки веществ. Воронеж, 1984.
-
Кафаров В.В., Мешалкин В.П. Анализ и синтез химико-технологических систем. М: 1991.
-
Комарова Т.В. Получение углеродных материалов М: 2001.
-
Лабораторный практикум по синтезу промежуточных подуктов и красителей. Л: 1985.

шағым қалдыра аласыз















