Қысқа мерзімді жоспар
|
Күні: Сынып: 8 |
Пән мұғалімі: Қатысқандар саны: Қатыспағандар саны: |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Сабақтың тақырыбы |
Атомдарда электрондардың таралуы. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Осы сабақта қол жеткізілетін оқу мақсаттары (оқу бағдарламасына сілтеме) |
8.1.3.1 бірінші 20 элементтің электрондар санын анықтау 8.1.3.2 электрондардың қабаттарда орналасуының схемасын салу 8.1.3.3 электрондар атомда ядродан арақашықтықтары артып келе жатқан орбитальдарда біртіндеп орналасатындығын түсіну |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Сабақ мақсаты |
Барлық оқушылар: негізгі топшадағы химиялық элементтердің атом құрылысы мен оның қасиеттерінің өзгеру заңдылығын түсінеді Оқушылардың басым бөлігі: Период бойынша элемент атомындағы электронның орналасу тәртібі мен заңдылығын түсіндіру, білімдерін дамытады Кейбір оқушылар: атомда электрондардың орналасу тәртібі мен заңдылығын және элемент қасиетінің өзгеру себебін түсіне отырып, атом құрылысы туралы білімдерін жетілдіреді |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Жетістік критерийлері |
Оқушылар: Ұсынылған атомдар үлгілерінің сызбаларын
дұрыс салады және дұрыс
көрсетеді; |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Тілдік мақсаты: |
Пәнге қатысты
лексика мен терминология: атом (электрондық), қабат, энергетикалық
деңгей, ядро, жүйелік, топ, қашықтық, жуық, барынша алшақ, ішкі,
сыртқы / atom (electron), shell, energy level, nucleus, series of
shells, group, distance, nearest, furthest, inner,
outer. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Құндылықтарды дарыту |
Жұптық жұмыс жасау барысында айтылған болжам бойынша бір-бірінің пікірлерін тыңдауға жағдай жасау. Функционалдық сауаттылықты дамытуға жағдай жасау. Оқушыларды бір-біріне деген құрмет көрсетуіне тәрбиелеу. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Пәнаралық байланыс |
Негізгі
бөлшектер – протон, нейтрон, электрон
(6.4C). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
АКТ қолдану дағдылары |
Аудиожазба , таныстырылым. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Тілдік құзыреттілік |
Табиғат |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Сабақ барысы |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Сабақтың жоспарланған кезеңдері |
Сабақтағы жоспарланған іс-әрекет |
Ресурстар |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Сабақтың басы Ынтымақтастық атмосферасын қалыптастыру 5 минут |
Ұйымдастыру кезеңі. Амандасу. Психологиялық ахуал туғызу. Мұғалім оқушылардан, олардың көңіл күйдеріне сәйкес келетін смайликті таңдауды ұсынады Миға шабуыл әдісі арқылы сұрақтар қою Қайталауға арналған сұрақтар Атом құрылысының моделін қай ғалым ұсынды? Атом қандай бөлшектерден тұрады? Химиялық элементтің қасиеті немен анықталады? Химиялық элементтердің периодтық жүйесі мен заңды кім құрастырды? Периодтық заң қалай оқылады? Период деген не? Саны қанша? Қалай жіктеледі? Период бойымен элементтердің қасиетттері қалай өзгереді? Топ деген не? Саны қанша? Топ ішінде элементтердің қасиетттері қалай өзгереді? Қызығушылықты ояту–10 мин.
Электрон Протон
Ф) 1 Х) 2 Ц) 3
И) 4 Й) 3 К) 7
--------------------------------------------------------------------------------------------------------------------------------------------------------------
Ж) 5 З) 3 И)2
Э) 12 : 4 Ю)12 : 1 Я) 3:1
|
Шаттық шебері |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Сабақтың ортасы 8 минут |
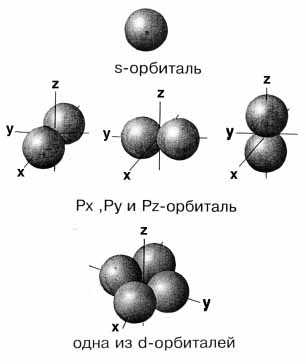
Тақырыпты өз бетімен оқып постер қорғау Атомдағы электрондар ядродан әр түрлі қашықтықта орналаса отырып, электрон қабаттарын түзеді. Электрон қабаттары энергетикалық деңгейлер деп те аталады. Атомдағы энергетикалық деңгейдің саны, осы элемент тұрған периодтың нөміріне сәйкес келеді: 1-период элементтеріне бір энергиялық деңгей немесе бір қабат 2-периодта – екі, 3-периодта – үш т.с.с. Период = деңгей = қабат Энергетикалық деңгейдегі болатын электрондардың максимал саны мына формуламен өрнектеледі: N = 2n2 N-электронның максимал саны п-деңгей саны Осы формулаға сәйкес бірінші энергетикалық деңгей де п=1; N = 2n2= 2∙12=2 электрон, п=2; N = 2n2=2∙22=8 электрон, п=3; N = 2n2=2∙32=18 электрон, п=4; N = 2n2=2∙42=32 электрон. Мысал: ) ) ) ) 1. +1H 1 2. +2H 2 3.+3Li 2 1 ) ) ) ) ) 4. +4Be 2 2 5. +11Na 2 8 1 Электрон бұлты болатын кеңістікті орбиталь деп атаймыз. Орбиталь деп нені атаймыз? Электрондық қауыз: Атомның барлық электрондары жиналып электрондық қауызын құрайды. Электрондық қауызды не құрайды? Өзара энергиясы жуық электрондар атомның электрондық қабатын түзеді. Электрондық қабатты қандай электрондар түзеді? Электрон қабаттар рет нөміріне қарай 1,2,3,4… деп белгіленеді. Әр қабаттағы орбитальдардың өзіндік энергиясы мен пішіндері болады. Электрондарды пішініне қарай жіктеңдер, кестені толтырыңдар. Шар тәрізді электрон бұлтын s-электрондар деп, ал орбитальдарды s-орбиталь д.а. Кейбір электрондар ядро маңында гантель тәрізді бұлт түзіп қозғалады, ондай электрондар p – орбитальдарын береді. Кеңістікте координаттардың 3 осі (x,y,z) бойынша орналасатындықтан рx,рy,рz орбитальдары деп бөлінеді
Электрондық бұлттарды толтыру ережесі келесі: 1. Ең алдымен элемент атомында қанша электрон бар екендігін анықтап алу. Ол үшін сол элементтің ядро зарядын білсек болғаны, ол Д.И. Менделеевтің периодтық жүйедегі элементтің реттік нөміріне тең. Реттік нөмірі (ядродағы протон саны) барлық атомдағы электрон санына тең. 2. Бар электронмен 1s – орбитальдан бастап ұяшықтарды толтырамыз. Әрбір ұяшықта 1 не 2 электрон бола алады. Бір ұяшықта орналасқан екі электронды қарама – қарсы бағдаршамен белгілейді ( Паули принципі) 3. Әрбір квант деңгейінде аттас орбитальдарда бір электроннан орналасады, қалғандары кейін қосылып жұп түзеді (Хунд ережесі)
Түсіндірме видео: https://twig-bilim.kz/film/atom-structure-electron-shells-5627/ Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз Қысқа мерзімді
жоспар
Күні: Сынып:
8
Пән
мұғалімі:
Қатысқандар
саны: Қатыспағандар
саны: Сабақтың
тақырыбы
Атомдарда
электрондардың таралуы. Осы сабақта қол
жеткізілетін оқу мақсаттары (оқу бағдарламасына
сілтеме) 8.1.3.1 бірінші 20 элементтің
электрондар санын анықтау 8.1.3.2 электрондардың қабаттарда
орналасуының схемасын салу
8.1.3.3 электрондар атомда ядродан
арақашықтықтары артып келе жатқан орбитальдарда біртіндеп
орналасатындығын түсіну
Сабақ
мақсаты Барлық
оқушылар:
негізгі топшадағы
химиялық элементтердің атом құрылысы мен оның қасиеттерінің өзгеру
заңдылығын түсінеді Оқушылардың басым
бөлігі:
Период бойынша
элемент атомындағы электронның орналасу тәртібі мен заңдылығын
түсіндіру, білімдерін
дамытады Кейбір
оқушылар:
атомда
электрондардың орналасу тәртібі мен заңдылығын және элемент
қасиетінің өзгеру себебін түсіне отырып, атом құрылысы туралы
білімдерін жетілдіреді Жетістік
критерийлері Оқушылар: Ұсынылған атомдар үлгілерінің сызбаларын
дұрыс салады және дұрыс
көрсетеді;
Тілдік
мақсаты:
Пәнге қатысты
лексика мен терминология: атом (электрондық), қабат, энергетикалық
деңгей, ядро, жүйелік, топ, қашықтық, жуық, барынша алшақ, ішкі,
сыртқы / atom (electron), shell, energy level, nucleus, series of
shells, group, distance, nearest, furthest, inner,
outer. Құндылықтарды
дарыту
Жұптық жұмыс жасау барысында айтылған болжам
бойынша бір-бірінің пікірлерін тыңдауға жағдай жасау. Функционалдық
сауаттылықты дамытуға жағдай
жасау. Оқушыларды бір-біріне деген
құрмет көрсетуіне тәрбиелеу. Пәнаралық
байланыс Негізгі
бөлшектер – протон, нейтрон, электрон
(6.4C). АКТ қолдану
дағдылары Аудиожазба ,
таныстырылым. Тілдік
құзыреттілік Табиғат Сабақ
барысы Сабақтың жоспарланған
кезеңдері Сабақтағы жоспарланған
іс-әрекет Ресурстар
Сабақтың
басы
Ынтымақтастық
атмосферасын қалыптастыру 5
минут
Ұйымдастыру
кезеңі.
Амандасу.
Психологиялық ахуал туғызу.
Мұғалім оқушылардан,
олардың көңіл күйдеріне сәйкес келетін смайликті таңдауды
ұсынады Миға
шабуыл әдісі арқылы сұрақтар
қою Қайталауға арналған
сұрақтар Атом құрылысының моделін қай
ғалым ұсынды? Атом қандай бөлшектерден
тұрады?
Химиялық элементтің
қасиеті немен анықталады?
Химиялық
элементтердің периодтық жүйесі мен заңды кім
құрастырды?
Периодтық заң қалай
оқылады? Период деген не? Саны қанша?
Қалай жіктеледі? Период бойымен элементтердің
қасиетттері қалай өзгереді? Топ деген не? Саны қанша? Топ
ішінде элементтердің қасиетттері қалай
өзгереді?
Қызығушылықты
ояту–10 мин.
Карточкамен
жұмыс
Сұрақ-жауап:
Реттік нөмір нені
білдіреді? Белгіленуі
Атомдар қандай
бөлшектерден тұрады?
Заряды?
Изотоп деген
не?
Химиялық элемент
деген не?
Периодтық система
неше период, неше топтан
тұрады?
Венн диаграммасы:
Электрон мен протонды
салыстыру
Электрон
Протон
Атом құрылысы
тақырыбы бойынша тест: «Сандар
сөйлейді»
Оттектің неше
изотобы бар?
Ф) 1 Х) 2 Ц)
3
Литийдегі нейтрон
саны?
И) 4 Й) 3 К)
7
Алюминийдегі протон
саны?
--------------------------------------------------------------------------------------------------------------------------------------------------------------
Бор нешінші периодта
орналасқан?
Ж) 5 З) 3
И)2
Метанның
СН4
құрамындағы элементтердің
массалық қатынасы
Э) 12 : 4 Ю)12 : 1
Я) 3:1
Шаттық
шебері
Сабақтың
ортасы
8
минут
Тақырыпты өз
бетімен оқып постер
қорғау
Атомдағы электрондар
ядродан әр түрлі қашықтықта орналаса отырып, электрон қабаттарын
түзеді. Электрон қабаттары энергетикалық
деңгейлер деп те
аталады.
Атомдағы
энергетикалық деңгейдің саны, осы элемент тұрған периодтың нөміріне
сәйкес келеді:
1-период
элементтеріне бір энергиялық деңгей немесе бір
қабат
2-периодта –
екі,
3-периодта – үш
т.с.с.
Период
= деңгей =
қабат
Энергетикалық
деңгейдегі болатын электрондардың максимал саны мына формуламен
өрнектеледі: N =
2n2
N-электронның максимал
саны
п-деңгей
саны
Осы формулаға сәйкес
бірінші энергетикалық деңгей
де п=1; N =
2n2= 2∙12=2
электрон, п=2; N =
2n2=2∙22=8
электрон, п=3; N =
2n2=2∙32=18
электрон, п=4; N =
2n2=2∙42=32
электрон.
Мысал:
)
) )
)
1. +1H 1
2. +2H 2
3.+3Li 2
1
) ) ) )
)
4. +4Be 2 2
5. +11Na 2 8
1 Электрон бұлты болатын
кеңістікті орбиталь деп атаймыз. Орбиталь деп нені
атаймыз? Электрондық
қауыз:
Атомның барлық
электрондары жиналып электрондық
қауызын құрайды.
Электрондық
қауызды не құрайды?
Өзара энергиясы жуық
электрондар атомның электрондық қабатын
түзеді.
Электрондық қабатты
қандай электрондар түзеді?
Электрон қабаттар
рет нөміріне қарай 1,2,3,4… деп
белгіленеді. Әр қабаттағы орбитальдардың
өзіндік энергиясы мен пішіндері
болады. Электрондарды пішініне қарай
жіктеңдер, кестені
толтырыңдар.
Шар тәрізді электрон
бұлтын s-электрондар деп, ал
орбитальдарды s-орбиталь д.а. Кейбір электрондар ядро
маңында гантель тәрізді бұлт түзіп қозғалады, ондай
электрондар p –
орбитальдарын береді. Кеңістікте
координаттардың 3 осі (x,y,z) бойынша орналасатындықтан рx,рy,рz
орбитальдары деп бөлінеді Электрондық бұлттарды
толтыру ережесі
келесі:
1. Ең алдымен
элемент атомында қанша электрон бар екендігін анықтап алу. Ол үшін
сол элементтің ядро зарядын білсек болғаны, ол Д.И. Менделеевтің
периодтық жүйедегі элементтің реттік нөміріне тең. Реттік нөмірі
(ядродағы протон саны) барлық атомдағы электрон санына
тең.
2. Бар
электронмен 1s
– орбитальдан бастап ұяшықтарды
толтырамыз. Әрбір ұяшықта 1 не 2 электрон бола алады. Бір ұяшықта
орналасқан екі электронды қарама – қарсы бағдаршамен белгілейді (
Паули принципі)
3. Әрбір квант
деңгейінде аттас орбитальдарда бір электроннан орналасады,
қалғандары кейін қосылып жұп түзеді (Хунд
ережесі) Бір деңгейде бола алатын
электрон саны
Осы деңгейде электронның
сыйымдылығы
1
2
2
8
3
18
4
32
Түсіндірме видео: https://twig-bilim.kz/film/atom-structure-electron-shells-5627/ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||