
Химия пәнінен қоғамдық- гуманитарлық бағыттағы 10 сынып оқушысы -----------------------өзіндік жұмыс жоспары. I тоқсан
Қолданылатын оқулық. М.Қ.Оспанова; Қ.С.Аухадиева; Т.Г.Белоусова, Алматы:.Мектеп, 2019.
10 сынып. 1-бөлім
Сабақтың нөмірі: 1
Сабақтың тақырыбы: Атом құрылысының заманауи теориясы. Атомдағы электрон күйі және қозғалысы. Көрсетілім №1 «Атом құрылысы моделі»
1.Оқу мақсаты:
10.1.2.1 атом құрылысының заманауи теориясын білу
10.1.2.2 s, p, d, f орбитальдарының пішінін ажырату;
2. Конспект
X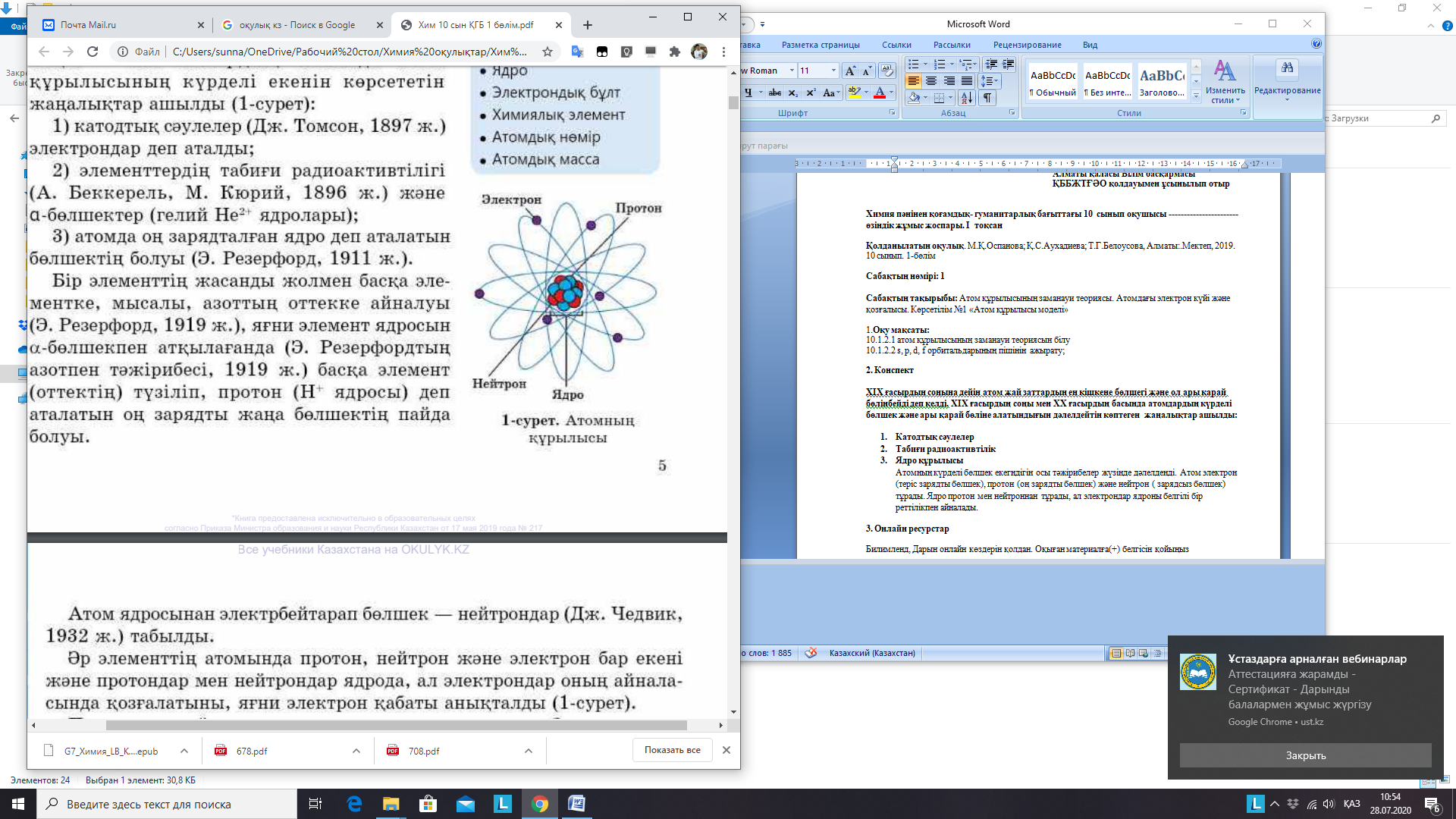 IX ғасырдың соңына дейін атом жай заттардың ең кішкене бөлшегі
және ол ары қарай бөлінбейді деп келді. ХІХ ғасырдың соңы мен ХХ
ғасырдың басында атомдардың күрделі бөлшек және ары қарай бөліне
алатындығын дәлелдейтін көптеген жаңалықтар
ашылды:
IX ғасырдың соңына дейін атом жай заттардың ең кішкене бөлшегі
және ол ары қарай бөлінбейді деп келді. ХІХ ғасырдың соңы мен ХХ
ғасырдың басында атомдардың күрделі бөлшек және ары қарай бөліне
алатындығын дәлелдейтін көптеген жаңалықтар
ашылды:
-
Катодтық сәулелер; 2. Табиғи радиоактивтілік; 3. Ядро құрылысы
Атомның күрделі бөлшек
екендігін осы тәжірибелер жүзінде дәлелденді. Атом электрон (теріс
зарядты бөлшек), протон (оң зарядты бөлшек) және нейтрон ( зарядсыз
бөлшек) тұрады. Ядро протон мен нейтроннан тұрады, ал электрондар
ядроны белгілі бір реттілікпен айналады. Протон, электрон, нейтрон
элементар бөлшек деп аталады, және олардың көлемдері мен массалары
өте кішкентай болғандықтан, атомның көп бөлігі бос кеңістік болып
табылады. Элементар бөлшектердің қасиеттерін оқулықтың 6 бетіндегі
1 кестеден көруге болады. Атом электробейтарап бөлшек, себебі
ядрода қанша оң зарядты протон болса, ядроны сонша теріс зарядты
электрон айналады. Атомдағы протондар Z, нейтрондар N, атомдық
масса (нуклондық сан) А деп белгіленеді. A=N+Z Мысалы, көміртектің
атомдық массасы 12, реттік номері 6, ол атомдағы электрондар мен
протондар санын көрсетеді. Ал, енді нейтрондарды есептейік:
N=A-Z=12-6=6. Осылайша нейтрондарды есептеуге болады.
Электрондардың қозғалысы өте күрделі болып келеді. Ядро маңындағы
электрон қозғалатын кеңістік электрондық бұлт, ал электронның болу
аймағы атомдық орбиталь деп аталады. Атомның электрондық қауызы
қабаттардан тұрады. Әр орбитальға электрондық бұлт сәйкес келеді
және қозбаған күйде 4 түрлі типі бар: s, p, d, f. Бір орбитальда
спиндері әртүрлі электрондар орналасады. Бір орбитальда тек 2
электрон сияды. Әр бір электрон бұлты өзіне тән пішіндерге ие.
Мысалы: s шар тәрізді болса, p гантель тәрізді, ал қалған екеуі өте
күрделі пішінге ие. Оқулықтың 8 бетіндегі 2 суретке қараңыз.
Атомдар электрондарын беріп жіберіп оң ионға, ал электрондарын
қосып алып, теріс зарядқа айналады. Бейтарап атомның зарядты
бөлшекке айналуын иондану үдерісі деп аталады. Изотоп дегеніміз
электрондар мен протондар саны бірдей, ал нейтрондар саны әртүрлі
болатын элементтер. Мысалы көміртектің 12 ( ) және 13 (
) және 13 ( ) деген изотоптары
белгілі.
) деген изотоптары
белгілі.
3. Онлайн ресурстар
1. https://www.youtube.com/watch?v=K-jNgq16jEY (нажмите CTRL и щелкните ссылку) осы сілтеме арқылы электрон бұлттарының 3D көрінісімен танысыңдар.
2. https://bilimland.kz/ немесе https://daryn.online/ сайтындағы видеоларды көріп, өзіңе қажетті материалдарды дәптеріңе көшіріп жаз.
4.Тапсырмалар
1. Атом электрон бергенде оң зарядқа, ал қосып алғанда теріс зарядқа айналады. Неліктен? Себебін түсіндіріңіз және жауабыңызды схемалар күйінде дәлелдеңіз.
2. Табиғи изотоптарға мысал келтіріңіз және олардың қолдану аймақтарын көрсетіңіз.
3. Алғашқы 10 элемент үшін реттік номерінің (х осіне) нейтрон санына (у осіне) тәуелділік графигін тұрғызыңдар. Бұл графиктен қандай қорытындығы келуге болады.
5. Кері байланыс:
тапсырманы орындап, жауабын Whats App, электронды почта арқылы жіберіңіз. Бұл тақырып бойынша сізге берілген мақсаттың қайсысы қиындық туғызды
Химия пәнінен қоғамдық- гуманитарлық бағыттағы 10 сынып оқушысы -----------------------өзіндік жұмыс жоспары. I тоқсан
Қолданылатын оқулық .М.Қ.Оспанова; Қ.С.Аухадиева; Т.Г.Белоусова, Алматы:.Мектеп, 2019.
10 сынып. 1-бөлім
Сабақтың нөмірі: 2
Сабақтың тақырыбы: Квант саны. Паули принципі, Хунд ережесі, Клечковский ережесі.
1.Оқу мақсаты: 10.1.3.1 квант сандарының сипаттамасы мен мәндерін білу;
2. Конспект
Белгілі бір электроннің кеңістікте орналасқандығы туралы ақпараттар жиынтығы атомдағы электронның күйін сипаттайды. Электронның атом кеңістігінде ең көп болуының аймағы атомдық орбиталь деп аталады. Атомдағы әр электронның күйін 4 квант санымен (бас квант саны (n), орбиталь квант саны (l), магниттік квант саны (m), спиндік квант саны (s)) сипаттайды. Бас квант саны электронның энергетикалық деңгейін және атомдық орбиталдың мөлшерін анықтайды, оның мәні бүтін сандарға ие (бас квант саны периодтар санымен анықталды, мысалы екінші периодтың бас квант саны 2 ге тең). Атомдағы энергетикалық деңгейлер саны элемент орналасқан периодд нөміріне тең. Бірдей бас квант санына ие болған электрондардың жиынтығы энергетикалық деңгей деп аталады, сол энергетикалық деңгейдегі электрондардың максималды саны N=2n2 формуласымен анықталады. N- берілген энергетикалық деңгейдегі электрондар саны, n- период нөмері. Орбиталь квант саны (l) атомдық орбитальдың пішінін сипаттайды. Мысалы, n=2 тең болса, l=0,1 деген мәндерді қабылдайды. l саны деңгейшені сипаттайды, және l сипатталатын электрондардың жиынтығы энергетикалық деңгейше деп аталады. l=0 болса, деңгейше s, l=1 болса, ол p, l=2 болса, ол d, l=3 болса, ол f деп белгіленеді. Деңгейдегі энергетикалық деңгейшелер саны бас квант санынан артық болмайды. Кітаптың 12 бетіндегі 3-10 суреттерге, 2-5 кестелерге назар аударыңыз. Деңгейшедегі орбитальдар саны магниттік квант санымен анықталады. Магниттік квант саны ядроның магнит өрісіндегі орбитальдардың таралуын сипаттайды. m=2l+1 формуласымен анықталады. l=0 болса m=0 деген мән қабылдайды, ал l=1 болса, ол -1,0,1 деген мәндерді қабылдайды. Спиндік квант саны электронның өз осінен сағат тілімен бірдей (+1/2) немесе оған қарсы (-1/2) бағытта айналуын көрсетеді. 4 квант саны бірдей 2 электрон болуы мүмкін емес, кем дегенде бір квант саны бойынша айырмашылық болады. Электрондардың қабаттар мен орбитальдарда таралып орналасу сызбанұсқасы атомның электрондық конфигурациясы деп аталады.
3. Онлайн
ресурстар
1. https://www.youtube.com/watch?v=hiSU3AeXV3I (нажмите CTRL и щелкните ссылку) осы сілтеме арқылы квант сандары туралы кейбір мәліметтермен танысыңдар.
2. https://bilimland.kz/ немесе https://daryn.online/ сайтындағы видеоларды көріп, өзіңе қажетті материалдарды дәптеріңе көшіріп жаз.
4.Тапсырмалар
1. Бас квант саны нені сипаттайды және қандай мәндерге ие болады? Қандай әріптермен белгіленеді?
2. Орбиталь квант саны нені сипаттайды? Орбитальдық квант саны қандай мәндерге ие және олардың пішіндері қандай?
3. Магниттік квант мен спиндік квант саны нені сипаттайды және қандай мәндерге ие? Орбиталдардың шартты түрде белгіленуін көрсетіңіз?
4. Не себепті 4 квант саны бірдей 2 электрон кездеспейді? Себебін түсіндіріңіз?
5. Кері байланыс:
тапсырманы орындап, жауабын Whats App, электронды почта арқылы жіберіңіз. Бұл тақырып бойынша сізге берілген мақсаттың қайсысы қиындық туғызды
Химия пәнінен қоғамдық- гуманитарлық бағыттағы 10 сынып оқушысы -----------------------өзіндік жұмыс жоспары. I тоқсан
Қолданылатын оқулық .М.Қ.Оспанова; Қ.С.Аухадиева; Т.Г.Белоусова, Алматы:.Мектеп, 2019.
10 сынып. 1-бөлім
Сабақтың нөмірі: 3
Сабақтың тақырыбы: Квант саны. Паули принципі, Хунд ережесі, Клечковский ережесі.
1.Оқу мақсаты: 10.1.3.2 электрон орбитальдарын толтыру ережелерін: минимальді энергия принципі, Паули принципі, Хунд ережесін қолдану;
10.1.3.3 алғашқы 36 химиялық элементтің электрондық конфигурациясын жазу;
2. Конспект. Атомның негізгі күйіндегі энергетикалық деңгейлер мен деңгейшелердің электрондармен толуы белгілі бір принциптер мен ережелерге бағынады. Паули принципі бойынша бір электрондық ұяшыққа спиндері қарама қарсы екі электрон ғана орналасады. Паули принципі белгілі бас квант санындағы электрондардың максималды саны N=2n2 формуласымен анықталады және бастапқы 4 деңгейдегі электрондар саны 2,8,18,32 ден артық болмауы керек. Гунд ережесі бойынша деңгейшелерде электрондар, алдымен бос орбитальдарды бір-бірден толтырады, содан кейін электрондар жұптасады. Клечковский ережесі:
1. Атомның негізгі күйінде электрондар орбитальдарды энергиялық деңгейінің өсу ретімен толтырады.
2. Алдымен энергиясы төмен орбитальдар толады. Орбитальдардың энергиясы мына қатарда артады: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7 p….
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
Алғашқы 36 химиялық элементтың электрондарының орналасуы:
|
Период |
Элемент |
Электрондық формула |
Период |
Элемент |
Электрондық формула |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
1 |
1H |
|
4 |
19K |
1s22s22p63s23p64s1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
2He |
|
|
20Ca |
1s22s22p63s23p64s2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2 |
3Li |
1s22s1 |
|
21Sc |
1s22s22p63s23p63d14s2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
4Be |
1s22s2 |
|
22Ti |
1s22s22p63s23p63d24s2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
5B |
1s22s22p1 |
|
23V |
1s22s22p63s23p63d34s2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
6C |
1s22s22p2 |
|
24Cr |
1s22s22p63s23p63d54s1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
7N |
1s22s22p3 |
|
25Mn |
1s22s22p63s23p63d54s2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
8O |
1s22s22p4 |
|
26Fe |
1s22s22p63s23p63d64s2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
9F |
1s22s22p5 |
|
27Co |
1s22s22p63s23p63d74s2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
10Ne |
1s22s22p Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
Химия
пәнінен қоғамдық- гуманитарлық бағыттағы 10 сынып оқушысы
-----------------------өзіндік жұмыс жоспары.
I
тоқсан
Қолданылатын оқулық. М.Қ.Оспанова;
Қ.С.Аухадиева; Т.Г.Белоусова, Алматы:.Мектеп,
2019.
10 сынып.
1-бөлім Сабақтың нөмірі:
1 Сабақтың
тақырыбы: Атом құрылысының
заманауи теориясы. Атомдағы электрон күйі және қозғалысы.
Көрсетілім №1 «Атом құрылысы моделі»
1.Оқу
мақсаты:
10.1.2.1
атом құрылысының заманауи теориясын білу
10.1.2.2 s, p, d, f
орбитальдарының пішінін ажырату; 2.
Конспект X Катодтық сәулелер;
2. Табиғи радиоактивтілік; 3. Ядро құрылысы Атомның күрделі бөлшек
екендігін осы тәжірибелер жүзінде дәлелденді. Атом электрон (теріс
зарядты бөлшек), протон (оң зарядты бөлшек) және нейтрон ( зарядсыз
бөлшек) тұрады. Ядро протон мен нейтроннан тұрады, ал электрондар
ядроны белгілі бір реттілікпен айналады. Протон, электрон, нейтрон
элементар бөлшек деп аталады, және олардың көлемдері мен массалары
өте кішкентай болғандықтан, атомның көп бөлігі бос кеңістік болып
табылады. Элементар бөлшектердің қасиеттерін оқулықтың 6 бетіндегі
1 кестеден көруге болады. Атом электробейтарап бөлшек, себебі
ядрода қанша оң зарядты протон болса, ядроны сонша теріс зарядты
электрон айналады. Атомдағы протондар Z, нейтрондар N, атомдық
масса (нуклондық сан) А деп белгіленеді. A=N+Z Мысалы, көміртектің
атомдық массасы 12, реттік номері 6, ол атомдағы электрондар мен
протондар санын көрсетеді. Ал, енді нейтрондарды есептейік:
N=A-Z=12-6=6. Осылайша нейтрондарды есептеуге болады.
Электрондардың қозғалысы өте күрделі болып келеді. Ядро маңындағы
электрон қозғалатын кеңістік электрондық бұлт, ал электронның болу
аймағы атомдық орбиталь деп аталады. Атомның электрондық қауызы
қабаттардан тұрады. Әр орбитальға электрондық бұлт сәйкес келеді
және қозбаған күйде 4 түрлі типі бар: s, p, d, f. Бір орбитальда
спиндері әртүрлі электрондар орналасады. Бір орбитальда тек 2
электрон сияды. Әр бір электрон бұлты өзіне тән пішіндерге ие.
Мысалы: s шар тәрізді болса, p гантель тәрізді, ал қалған екеуі өте
күрделі пішінге ие. Оқулықтың 8 бетіндегі 2 суретке қараңыз.
Атомдар электрондарын беріп жіберіп оң ионға, ал электрондарын
қосып алып, теріс зарядқа айналады. Бейтарап атомның зарядты
бөлшекке айналуын иондану үдерісі деп аталады. Изотоп дегеніміз
электрондар мен протондар саны бірдей, ал нейтрондар саны әртүрлі
болатын элементтер. Мысалы көміртектің 12 ( 3. Онлайн
ресурстар
1. https://www.youtube.com/watch?v=K-jNgq16jEY
(нажмите
CTRL и щелкните ссылку) осы сілтеме арқылы электрон бұлттарының 3D
көрінісімен танысыңдар.
2. https://bilimland.kz/
немесе https://daryn.online/
сайтындағы
видеоларды көріп, өзіңе қажетті материалдарды дәптеріңе көшіріп
жаз. 4.Тапсырмалар
1. Атом
электрон бергенде оң зарядқа, ал қосып алғанда теріс зарядқа
айналады. Неліктен? Себебін түсіндіріңіз және жауабыңызды схемалар
күйінде дәлелдеңіз.
2. Табиғи
изотоптарға мысал келтіріңіз және олардың қолдану аймақтарын
көрсетіңіз.
3. Алғашқы
10 элемент үшін реттік номерінің (х осіне) нейтрон санына (у осіне)
тәуелділік графигін тұрғызыңдар. Бұл графиктен қандай қорытындығы
келуге болады.
5. Кері
байланыс:
тапсырманы
орындап, жауабын Whats App, электронды почта арқылы жіберіңіз. Бұл
тақырып бойынша сізге берілген мақсаттың қайсысы қиындық
туғызды Химия пәнінен
қоғамдық- гуманитарлық бағыттағы 10 сынып оқушысы
-----------------------өзіндік жұмыс жоспары.
I
тоқсан Қолданылатын
оқулық .М.Қ.Оспанова;
Қ.С.Аухадиева; Т.Г.Белоусова, Алматы:.Мектеп,
2019. 10 сынып.
1-бөлім Сабақтың нөмірі:
2 Сабақтың
тақырыбы: Квант
саны. Паули
принципі, Хунд ережесі, Клечковский ережесі. 1.Оқу
мақсаты: 10.1.3.1
квант сандарының
сипаттамасы мен мәндерін білу; 2.
Конспект
Белгілі бір
электроннің кеңістікте орналасқандығы туралы ақпараттар жиынтығы
атомдағы электронның
күйін сипаттайды. Электронның
атом кеңістігінде ең көп болуының аймағы атомдық
орбиталь деп аталады. Атомдағы
әр электронның күйін 4 квант
санымен (бас квант саны (n),
орбиталь квант саны (l), магниттік квант саны (m), спиндік квант
саны (s)) сипаттайды. Бас квант
саны электронның
энергетикалық деңгейін және атомдық орбиталдың мөлшерін анықтайды,
оның мәні бүтін сандарға ие (бас квант саны периодтар санымен
анықталды, мысалы екінші периодтың бас квант саны 2 ге тең).
Атомдағы энергетикалық деңгейлер саны элемент орналасқан периодд
нөміріне тең. Бірдей бас квант санына ие болған электрондардың
жиынтығы энергетикалық деңгей деп аталады, сол энергетикалық
деңгейдегі электрондардың максималды саны
N=2n2
формуласымен
анықталады. N- берілген энергетикалық деңгейдегі электрондар саны,
n- период нөмері. Орбиталь квант
саны (l) атомдық орбитальдың
пішінін сипаттайды. Мысалы, n=2 тең болса, l=0,1 деген мәндерді
қабылдайды. l саны деңгейшені сипаттайды, және l сипатталатын
электрондардың жиынтығы энергетикалық деңгейше деп аталады. l=0
болса, деңгейше s, l=1 болса, ол p, l=2 болса, ол d, l=3 болса, ол
f деп белгіленеді. Деңгейдегі энергетикалық деңгейшелер саны бас
квант санынан артық болмайды. Кітаптың 12 бетіндегі 3-10
суреттерге, 2-5 кестелерге назар аударыңыз. Деңгейшедегі
орбитальдар саны магниттік квант санымен анықталады.
Магниттік
квант саны ядроның магнит
өрісіндегі орбитальдардың таралуын сипаттайды. m=2l+1 формуласымен
анықталады. l=0 болса m=0 деген мән қабылдайды, ал l=1 болса, ол
-1,0,1 деген мәндерді қабылдайды. Спиндік квант
саны электронның өз осінен
сағат тілімен бірдей (+1/2) немесе оған қарсы (-1/2) бағытта
айналуын көрсетеді. 4 квант саны бірдей 2 электрон болуы мүмкін
емес, кем дегенде бір квант саны бойынша айырмашылық болады.
Электрондардың қабаттар мен орбитальдарда таралып орналасу
сызбанұсқасы атомның электрондық
конфигурациясы деп
аталады. 3. Онлайн
ресурстар
1. https://www.youtube.com/watch?v=hiSU3AeXV3I
(нажмите
CTRL и щелкните ссылку) осы сілтеме арқылы квант сандары туралы
кейбір мәліметтермен танысыңдар.
2. https://bilimland.kz/
немесе https://daryn.online/
сайтындағы
видеоларды көріп, өзіңе қажетті материалдарды дәптеріңе көшіріп
жаз. 4.Тапсырмалар
1. Бас квант
саны нені сипаттайды және қандай мәндерге ие болады? Қандай
әріптермен белгіленеді?
2. Орбиталь
квант саны нені сипаттайды? Орбитальдық квант саны қандай мәндерге
ие және олардың пішіндері қандай?
3. Магниттік
квант мен спиндік квант саны нені сипаттайды және қандай мәндерге
ие? Орбиталдардың шартты түрде белгіленуін
көрсетіңіз?
4. Не
себепті 4 квант саны бірдей 2 электрон кездеспейді? Себебін
түсіндіріңіз? 5. Кері
байланыс:
тапсырманы
орындап, жауабын Whats App, электронды почта арқылы жіберіңіз. Бұл
тақырып бойынша сізге берілген мақсаттың қайсысы қиындық
туғызды Химия пәнінен
қоғамдық- гуманитарлық бағыттағы 10 сынып оқушысы
-----------------------өзіндік жұмыс жоспары.
I
тоқсан Қолданылатын
оқулық .М.Қ.Оспанова;
Қ.С.Аухадиева; Т.Г.Белоусова, Алматы:.Мектеп,
2019. 10 сынып.
1-бөлім Сабақтың нөмірі:
3
Сабақтың
тақырыбы: Квант
саны. Паули
принципі, Хунд ережесі, Клечковский ережесі.
1.Оқу
мақсаты: 10.1.3.2
электрон орбитальдарын
толтыру ережелерін: минимальді энергия принципі, Паули принципі,
Хунд ережесін қолдану; 10.1.3.3 алғашқы 36 химиялық элементтің электрондық конфигурациясын
жазу;
2.
Конспект. Атомның негізгі
күйіндегі энергетикалық деңгейлер мен деңгейшелердің электрондармен
толуы белгілі бір принциптер мен ережелерге
бағынады. Паули
принципі бойынша бір электрондық
ұяшыққа спиндері қарама қарсы екі электрон ғана орналасады. Паули
принципі белгілі бас квант санындағы электрондардың максималды саны
N=2n2
формуласымен
анықталады және бастапқы 4 деңгейдегі электрондар саны 2,8,18,32
ден артық болмауы керек. Гунд
ережесі бойынша деңгейшелерде
электрондар, алдымен бос орбитальдарды бір-бірден толтырады, содан
кейін электрондар жұптасады. Клечковский
ережесі:
1. Атомның
негізгі күйінде электрондар орбитальдарды энергиялық деңгейінің өсу
ретімен толтырады.
2. Алдымен
энергиясы төмен орбитальдар толады. Орбитальдардың энергиясы мына
қатарда артады: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f,
5d, 6p, 7s, 5f, 6d, 7 p….
↑↓
↑↓ ↑↓ ↑↓
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ Алғашқы 36 химиялық
элементтың электрондарының орналасуы: Период Элемент Электрондық
формула Период Элемент Электрондық
формула 1 1H ↑
4
19K
1s22s22p63s23p64s1
2He ↑↓
20Ca
1s22s22p63s23p64s2
2
3Li
1s22s1
21Sc
1s22s22p63s23p63d14s2
4Be
1s22s2
22Ti
1s22s22p63s23p63d24s2
5B
1s22s22p1
23V
1s22s22p63s23p63d34s2
6C
1s22s22p2
24Cr
1s22s22p63s23p63d54s1
7N
1s22s22p3
25Mn
1s22s22p63s23p63d54s2
8O
1s22s22p4
26Fe
1s22s22p63s23p63d64s2
9F
1s22s22p5
27Co
1s22s22p63s23p63d74s2
10Ne
1s22s22p |
















