|
Мұғалімнің аты-жөні: |
Таяуова С Ж |
||||||||||||||||||||||||||||||
|
Пән/Сынып: |
Химия, 8 сынып |
||||||||||||||||||||||||||||||
|
Қай аптаның нешінші сабағы |
3 сабақ |
||||||||||||||||||||||||||||||
|
Тарау немесе бөлім атауы: |
1 тарау. Атомдағы электрондардың қозғалысы |
||||||||||||||||||||||||||||||
|
Сабақтың тақырыбы: |
Атомдағы электрондардың қозғалысы |
||||||||||||||||||||||||||||||
|
Оқу мақсаты: |
8.1.3.3 – s және р орбиталдарының пішінін білу 8.1.3.4 – алғашқы 20 химиялық элементтің электрондық конфигурациясын және электронды – графикалық формуларын жаза білу |
||||||||||||||||||||||||||||||
|
Бағалау критериі: |
|
||||||||||||||||||||||||||||||
|
Саралап оқыту тапсырмалары |
|||||||||||||||||||||||||||||||
|
Ұжымдық жұмыс Жаңа тақырыптың түсіндірілуі Сабақ мақсаты мен бағалау критерийлерін таныстыру; Бейнероликті қолдана отырып, бекіту тапсырмаларын орындату |
Бірлескен жұмыс (1,2 тапсырма) Тапсырманы ұсыну және дұрыс жауапты ұсыну арқылы үйрету Бекітуге арналғантапсырмаларды орындату, тапсырмалардың жауаптарын жазу |
Жеке жұмыс Тапсырманы ұсыну, оқушылар өз бетімен орындауы |
|||||||||||||||||||||||||||||
|
Уақыты |
Кезеңдері |
Тапсырма |
Тапсырманың мақсаты |
Мұғалімнің бақылауы мен зерттеуі не? |
Бағалау |
Ресурстар |
|||||||||||||||||||||||||
|
1 минут 00:00 – 03:00 |
Ұйымдастыру |
Сәлеметсіздерме! Бүгінгі қарастыратын тақырыбымыз: Атомдағы электрондардың қозғалысы Бүгінгі сабақта меңгеретініңіз:
|
|
|
|
Презентация Слайд 1-2 |
|||||||||||||||||||||||||
|
8 минут 03:00 – 11:00 11:00-14:00 |
Жаңа сабақ |
Электронның қозғалыс жылдамдығының жоғары болатыны сонша, оның кеңістіктегі белгілі бір орны туралы айту мүмкін емес. Электронның қозғалыс траекториясы қандай да бір бұлтты елестетеді. Әр электрон түзетін электрондық бұлттың тығыздығы арта түседі. Атомдағы электрон қозғалатын кеңістік атомдық орбиталь деп аталады. Бірінші период элементтерінің бұлттары сфера пішінді, олар s-электрондары деп аталады. Екінші период элементтерінде s-электрондардан басқа, пішіні көлемдік сегіздік (гантель) тәрізді p-электрондары болады. Бұл электрондар бір-бірінен өлшемі бойынша ғана емес, кеңістікте орналасуы бойынша да ерекшеленеді; егер p-электрондар түзген бұлттардың осьтері сәйкес келмесе, онда олар бір-біріне перпендикуляр орналасады. Әртүрлі пішінді орбитальдардың жиынтығын энергетикалық деңгейшелер деп атайды. Бір s-орбиталь бір s-деңгейшесін құрайды, үш p-орбитальдары p-деңгейшесін құрайды және т.б. Бір энергетикалық деңгейдің орбитальдары ядроға әртүрлі тартылады. Орбитальдар бірігіп электрондық қабаттар (энергетикалық деңгейлер) түзеді:
4-энергетикалық деңгейде s-, p-, d-деңгейшелерден басқа f-орбиталь пайда болады және т.б. Әр энергетикалық деңгейде электрондардың белгілі бір саны ғана орналаса алады. Деңгейлердегі элекрондардың саны
Ал әр энергетикалық деңгейшеге электрондардың белгілі бір саны сыяды. Деңгейдегі электрондардың саны
Электрондық деңгейлердің құрылысын біле отырып, атомның бүкіл электрондық қабатының құрылымын елестетуге болады. Ол үшін орбитальдардың электрондармен толу ережесімен танысайық. 1. Әр орбитальға екі электрон ғана орналаса алады. Бірінші деңгейдің екі электроны s-орбитальға, екінші деңгейдің сегіз электроны 1s-, 2s-, 2p-орбитальға орналасады. 2. Энергия қоры аз электрондар ядроға жақсы тартылады, энергия қоры өскен сайын электрондар ядроға нашар тартылады, әрі одан қашық орналасады. Осы ережелерді пайдаланып, фтордың электрондық формуласын былай жазуға болады: +9 F 1s22s22p5 Фтордың атомдық нөмірі 9, ол фторда 9 электрон барын көрсетеді. Бұл формула бір-эс-екі, екі-эс-екі, екі-пэ-бес деп оқылады. Орбитальдарды көрсететін әріптердің (s, p) алдындағы коэффициенттер (1, 2 және 2) электрон қабатының санын көрсетеді. Орбитальдағы электрон санын оның оң жақ бұрышындағы сандар көрсетеді (2, 2 және 5). Энергетикалық деңгейлердегі орбитальдар санын шартты түрде сызбанұсқамен бейнелеу қабылданған. Бір орбитальда орналасқан екі электронды қарама-қарсы бағдаршамен бейнелейді. 3. Бір деңгейшедегі электрондар алдымен орбитальдарда жеке-жеке орналасады. Электрондардың саны артқан сайын олар жұптасып, орбитальдарды толтырады. Мысалы, оттек электрондарының орналасуының сызбанұсқа түрінде бейнеленуі немесе оттек атомының электронды-графиктік формуласы: О 1s22s22p4 1 эс орбитальда екі электрон бағдарша түрінде, 2 эс орбитальда екі бағдарша, ал екі пэ орбитальда бір жұптасқан, екі жұптаспаған жалпы 4 бағдарша. Әр орбитальда максималды түрде энергиялары бірдей, бірақ спиндері әртүрлі екі электрон ғана орналаса алады. Алғашқы 10 элемент атомы электрондарының энергетикалық деңгейлерге таралып орналасуын келесі бейнематериалдан тамашалайық.(1-видео) Келесі слайдтан алғашқы 20 элемент атомдарының электрондық құрылысын көруге болады. |
Жаңа тақырыпты меңгеру |
|
|
Презентация Слайд 3 Слайд 4
Слайд 5
Слайд 6
1-видео Слайд 7
|
|||||||||||||||||||||||||
|
10 минут 14:00-23:00 |
Бекіту тапсырмасы |
1-тапсырма. Кестені сәйкестендіріңіз
Жауабы: s орбитальдің пішіні - шар тәрізді p орбитальдің пішіні - гантель тәрізді
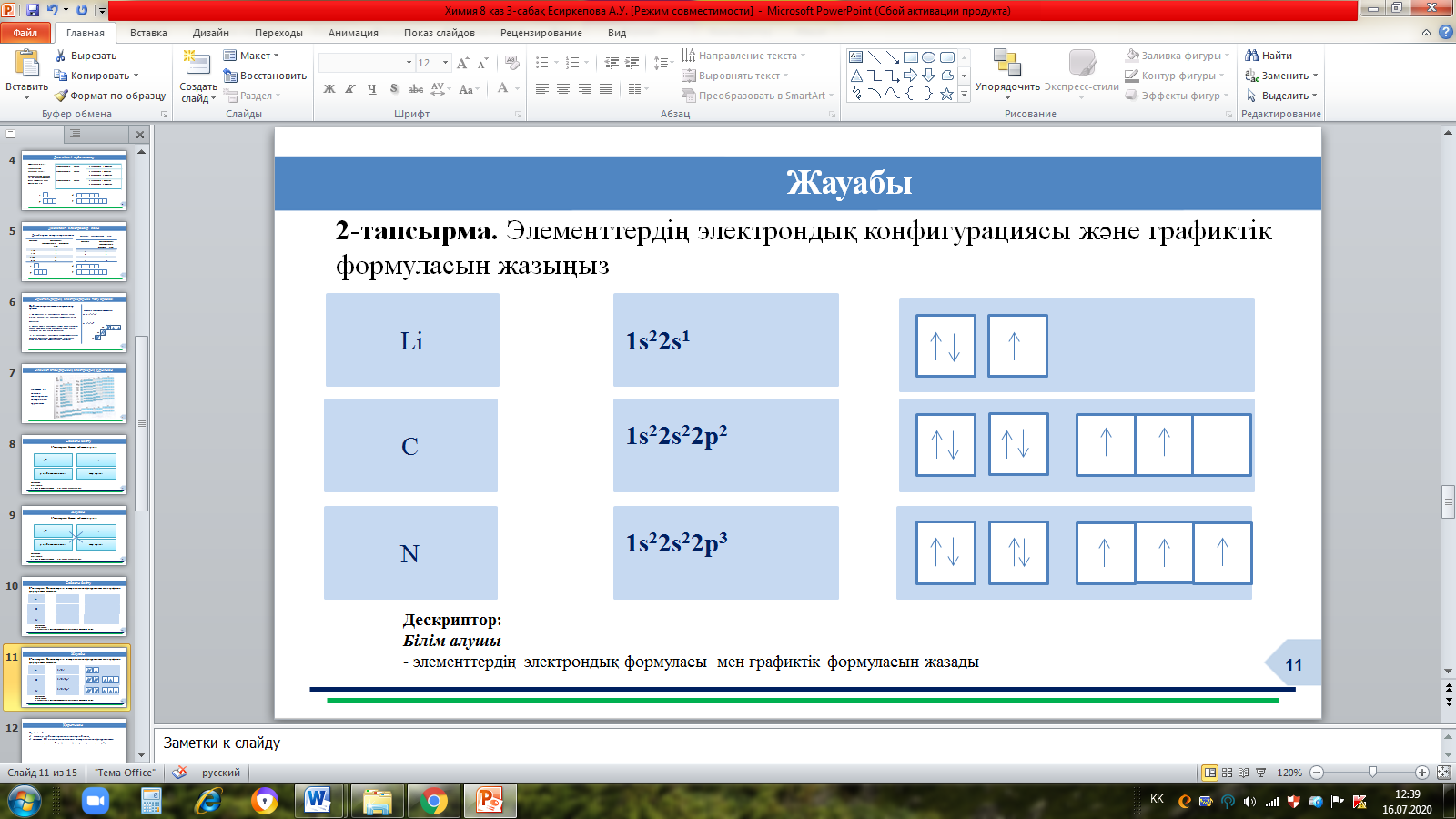
2-тапсырма. Элементтердің электрондық конфигурациясы және графиктік формуласын жазыңыз
Жауабы:
|
Жаңа тақырыпты меңгеруге арналған s және р орбиталдарының пішіндерін білу үшін |
|
Дескриптор: Білім алушы
Дескриптор: Білім алушы - элементтердің электрондық формуласы мен графиктік формуласын жазады
|
Презентация Слайд 8 Слайд 9 Слайд 10 Слайд 11 |
|||||||||||||||||||||||||
|
2 минут 23:00-25:00 |
|
Бүгінгі сабақта:
|
Тақырыпты меңгергенін анықтау |
|
|
Презентация Слайд 12 |
|||||||||||||||||||||||||
жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
Атомдағы электрондардың қозғалысы
Атомдағы электрондардың қозғалысы
|
Мұғалімнің аты-жөні: |
Таяуова С Ж |
||||||||||||||||||||||||||||||
|
Пән/Сынып: |
Химия, 8 сынып |
||||||||||||||||||||||||||||||
|
Қай аптаның нешінші сабағы |
3 сабақ |
||||||||||||||||||||||||||||||
|
Тарау немесе бөлім атауы: |
1 тарау. Атомдағы электрондардың қозғалысы |
||||||||||||||||||||||||||||||
|
Сабақтың тақырыбы: |
Атомдағы электрондардың қозғалысы |
||||||||||||||||||||||||||||||
|
Оқу мақсаты: |
8.1.3.3 – s және р орбиталдарының пішінін білу 8.1.3.4 – алғашқы 20 химиялық элементтің электрондық конфигурациясын және электронды – графикалық формуларын жаза білу |
||||||||||||||||||||||||||||||
|
Бағалау критериі: |
|
||||||||||||||||||||||||||||||
|
Саралап оқыту тапсырмалары |
|||||||||||||||||||||||||||||||
|
Ұжымдық жұмыс Жаңа тақырыптың түсіндірілуі Сабақ мақсаты мен бағалау критерийлерін таныстыру; Бейнероликті қолдана отырып, бекіту тапсырмаларын орындату |
Бірлескен жұмыс (1,2 тапсырма) Тапсырманы ұсыну және дұрыс жауапты ұсыну арқылы үйрету Бекітуге арналғантапсырмаларды орындату, тапсырмалардың жауаптарын жазу |
Жеке жұмыс Тапсырманы ұсыну, оқушылар өз бетімен орындауы |
|||||||||||||||||||||||||||||
|
Уақыты |
Кезеңдері |
Тапсырма |
Тапсырманың мақсаты |
Мұғалімнің бақылауы мен зерттеуі не? |
Бағалау |
Ресурстар |
|||||||||||||||||||||||||
|
1 минут 00:00 – 03:00 |
Ұйымдастыру |
Сәлеметсіздерме! Бүгінгі қарастыратын тақырыбымыз: Атомдағы электрондардың қозғалысы Бүгінгі сабақта меңгеретініңіз:
|
|
|
|
Презентация Слайд 1-2 |
|||||||||||||||||||||||||
|
8 минут 03:00 – 11:00 11:00-14:00 |
Жаңа сабақ |
Электронның қозғалыс жылдамдығының жоғары болатыны сонша, оның кеңістіктегі белгілі бір орны туралы айту мүмкін емес. Электронның қозғалыс траекториясы қандай да бір бұлтты елестетеді. Әр электрон түзетін электрондық бұлттың тығыздығы арта түседі. Атомдағы электрон қозғалатын кеңістік атомдық орбиталь деп аталады. Бірінші период элементтерінің бұлттары сфера пішінді, олар s-электрондары деп аталады. Екінші период элементтерінде s-электрондардан басқа, пішіні көлемдік сегіздік (гантель) тәрізді p-электрондары болады. Бұл электрондар бір-бірінен өлшемі бойынша ғана емес, кеңістікте орналасуы бойынша да ерекшеленеді; егер p-электрондар түзген бұлттардың осьтері сәйкес келмесе, онда олар бір-біріне перпендикуляр орналасады. Әртүрлі пішінді орбитальдардың жиынтығын энергетикалық деңгейшелер деп атайды. Бір s-орбиталь бір s-деңгейшесін құрайды, үш p-орбитальдары p-деңгейшесін құрайды және т.б. Бір энергетикалық деңгейдің орбитальдары ядроға әртүрлі тартылады. Орбитальдар бірігіп электрондық қабаттар (энергетикалық деңгейлер) түзеді:
4-энергетикалық деңгейде s-, p-, d-деңгейшелерден басқа f-орбиталь пайда болады және т.б. Әр энергетикалық деңгейде электрондардың белгілі бір саны ғана орналаса алады. Деңгейлердегі элекрондардың саны
Ал әр энергетикалық деңгейшеге электрондардың белгілі бір саны сыяды. Деңгейдегі электрондардың саны
Электрондық деңгейлердің құрылысын біле отырып, атомның бүкіл электрондық қабатының құрылымын елестетуге болады. Ол үшін орбитальдардың электрондармен толу ережесімен танысайық. 1. Әр орбитальға екі электрон ғана орналаса алады. Бірінші деңгейдің екі электроны s-орбитальға, екінші деңгейдің сегіз электроны 1s-, 2s-, 2p-орбитальға орналасады. 2. Энергия қоры аз электрондар ядроға жақсы тартылады, энергия қоры өскен сайын электрондар ядроға нашар тартылады, әрі одан қашық орналасады. Осы ережелерді пайдаланып, фтордың электрондық формуласын былай жазуға болады: +9 F 1s22s22p5 Фтордың атомдық нөмірі 9, ол фторда 9 электрон барын көрсетеді. Бұл формула бір-эс-екі, екі-эс-екі, екі-пэ-бес деп оқылады. Орбитальдарды көрсететін әріптердің (s, p) алдындағы коэффициенттер (1, 2 және 2) электрон қабатының санын көрсетеді. Орбитальдағы электрон санын оның оң жақ бұрышындағы сандар көрсетеді (2, 2 және 5). Энергетикалық деңгейлердегі орбитальдар санын шартты түрде сызбанұсқамен бейнелеу қабылданған. Бір орбитальда орналасқан екі электронды қарама-қарсы бағдаршамен бейнелейді. 3. Бір деңгейшедегі электрондар алдымен орбитальдарда жеке-жеке орналасады. Электрондардың саны артқан сайын олар жұптасып, орбитальдарды толтырады. Мысалы, оттек электрондарының орналасуының сызбанұсқа түрінде бейнеленуі немесе оттек атомының электронды-графиктік формуласы: О 1s22s22p4 1 эс орбитальда екі электрон бағдарша түрінде, 2 эс орбитальда екі бағдарша, ал екі пэ орбитальда бір жұптасқан, екі жұптаспаған жалпы 4 бағдарша. Әр орбитальда максималды түрде энергиялары бірдей, бірақ спиндері әртүрлі екі электрон ғана орналаса алады. Алғашқы 10 элемент атомы электрондарының энергетикалық деңгейлерге таралып орналасуын келесі бейнематериалдан тамашалайық.(1-видео) Келесі слайдтан алғашқы 20 элемент атомдарының электрондық құрылысын көруге болады. |
Жаңа тақырыпты меңгеру |
|
|
Презентация Слайд 3 Слайд 4
Слайд 5
Слайд 6
1-видео Слайд 7
|
|||||||||||||||||||||||||
|
10 минут 14:00-23:00 |
Бекіту тапсырмасы |
1-тапсырма. Кестені сәйкестендіріңіз
Жауабы: s орбитальдің пішіні - шар тәрізді p орбитальдің пішіні - гантель тәрізді
2-тапсырма. Элементтердің электрондық конфигурациясы және графиктік формуласын жазыңыз
Жауабы:
|
Жаңа тақырыпты меңгеруге арналған s және р орбиталдарының пішіндерін білу үшін |
|
Дескриптор: Білім алушы
Дескриптор: Білім алушы - элементтердің электрондық формуласы мен графиктік формуласын жазады
|
Презентация Слайд 8 Слайд 9 Слайд 10 Слайд 11 |
|||||||||||||||||||||||||
|
2 минут 23:00-25:00 |
|
Бүгінгі сабақта:
|
Тақырыпты меңгергенін анықтау |
|
|
Презентация Слайд 12 |
|||||||||||||||||||||||||

шағым қалдыра аласыз