
1-сабақ.
Сыныбы: 10«а»
Сабақтың тақырыбы: Атом, молекула және олардың сипаттамалары.
Сабақтың мақсаты: оқушыларға атом, молекула ұғымдарын еске түсіріп,
м.а.б., изотоптар, салыстырмалы атомдық
масса, салыстырмалы молекулалық массалары берілген
есептерді шығару әдістерін үйрету.
Сабақтың типі: Жаңа материалды меңгерту сабағы
Көрнекіліктер: интерактивті тақта, оқулықтар, электронды оқулықтар, т.б.
Атом – элементтің химиялық, қасиеттерін сақтайтын ең кіші бөлшегі. Химиялық реакциялар кезіндегі атомдар бөлінбейді, тек басқаша топталады.
Молекула – заттың химиялық қасиеттерін сақтайтын ең кiші бөлшегі.
Атомның негізгі сипаттамалары – ядросының оң заряды мен массасы. Өлшем бірліктерінің халықаралық жүйесінде (SJ) масса бірлігі ретінде килограмм (кг) кабылданган. Практикада онымен қатар тонна (т), грамм (г), миллиграмм (мг) және т.с.с. сияқты туынды бірліктер де кеңінен қолданылады.
Атомдардың массалары тым жеңіл. Мысалы, кейбip цемент атомдарының килограммен алынған орташа массалары мынадай:
m(Н)= 0, 000 000 000 000 000 000 000 000 001 670 кг
m(О)= 0, 000 000 000 000 000 000 000 000 026 670 кг
m(С)= 0, 000 000 000 000 000 000 000 000 019 930 кг
Мұндай кішкене сандармен есептеулер жасаудың өте ыңғайсыз екенін кім де болса тез байкайды. Оларды ережемен өрнектеп, стандарттық күйде былай ықшамдап жазуға болады:
m(H)=l,67·10-27 кг
m(О)=2,667·10-26 кг
m(C)=l,993·10-26 кг
Мұндай сандармен де жұмыс icтey өте ыңғайсыз екеніне ғалымдардың көздері тез ақ жеткен. Сол себептен химиктер көбінесе атомдардың массаларынын абсолюттік мәндерінің орнына олардың салыстырмалы мәндерін қолданады. Теориялық және қолданбалы химияның халықаралық одағының (JUPAC) ұсынысы бойынша салыстырмалы атомдық масса Аr деп белгіленеді. Мұндағы г ағылшынның "relative" -"салыстырмалы" деген сөзінің алғашқы әpiпi.
Аr (атом) = m(атом)/m(м.а.б.) (1.1)
мұндағы m(атом) – элементтің 6ip атомының орташа абсолюттік массасы, m(м.а.б.) – массаның атомдық бірлігінің массасы.
Атомдардың массаларын салыстыру үшін алынатын масса бірлігі массаның атомдық бірлігі (м.а.б.) деп атайды. Массаның атомдық бірлігі ретінде кез келген элемент атомының массасын алуға болады. Химиктер алғашқыда ең жеңіл элемент сутек атомының массасын массаның атомдық бірлігі ретінде алган. Ceбeбi бұл жағдайда салыстырмалы атомдық массаның мәндері бip санынан үлкен болады.
Мысалы: Аr (О) = 2,67·10-26кг/1,67·10-27кг= 15,9880.
Табиғатта әр элемент атомдарының ядро зарядтары бірдей, ал массалары әртүрлі атомдары болады. Оларды изотоптар деп атайды. Кейін сутектің үш изотопы (1Н, 2Н жене 3Н) бар екендігі белгілі болған кезде, ғалымдар оның атомының массасын атомдық масса бірлігі ретінде қолданудан айныған. Ceбeбi әр табиғи қосылыстағы оның әр изотопының мөлшері әрқалай, сондықтан оның орташа мән тұрақты шама болмайды және оны анықтау үшін қосымша сандық анализ мәліметтері қажет болады. Тұрақсыз шаманы масса бірлігі ретінде алуга болмайды.
Бұдан кейін массаның атомдық бірлігі ретінде оттектің атомының 1/16 бөлігін алуға шешім қабылдаған. Ceбeбi атомының массасы массаның атомдық бірлігі ретінде алынатын элемент басқа элементтермен неғұрлым көп қосылыс түзуге тиic. Сонда сандық құрамы белгілі болса, олар арқылы баска элементтердің атомдық массаларын есептеп табуга болады. Бұл талапқа оттек элемент атомдары сәйкес келеді. Ал, оның массасының 1/16 бөлігі массаның атомдық бірлігі ретінде алғанда, элементтердің салыстырмалы атомдық массаларының бұрынғы үйреніп қалган мәндеріне жуық мәндер шығады. Кейінірек, оттек атомдарының да үш изотопы (16О, 17О жэне 18О) бар екендігі және әртүрлі заттардағы оттек атомдарының изотоптық құрамдары тұрақсыз екендігі белгілі болды.
1959 жылы ғалымдардың бip тобы көміртектің 12С изотопының, 1/12 бөлігін массаның атомдық бірлігі ретінде пайдалануды ұсынды. Мұның бірнеше себептері болды. Біріншіден, кеміртек өте көп химиялық қосылыстар түзе алады. Сондықтан ол арқылы баска элементтер мен қосылыстардың салыстырмалы атомдық және салыстырмалы молекулалық массаларын есептеуге болады. Екіншіден, табиғатта таралған заттардағы көміртектің басқа изотоптарының массалық үлecтepi өте аз, сондықтан жаңа шкаладағы элементтердің салыстырмалы атомдық массаларының мәндері көп өзгермейді, тек дәлірек болады. Yшіншіден, осы күндері атомдық массаларды анықтау үшін қолданылатын масс-спектометр атты приборларда басқа элементтерге қарағанда көміртек атомдары мен иондары оңай және дәл анықталады. Сондықтан, Таза және Қолданбалы Химияның Халықаралық Одағы (IUРАС) кеміртектің 12С изотопы массасының 1/12 бөлігін 1961 жылы массаның атомдық бірлігі (көміртекті бірлік) ретінде қабылдады. Кейде көптеген елдерде оны көрнекті ағылшын ғалымы Джон Дальтонның құрметіне дальтон деп атап, D немесе Da деп белгілейді. Сонымен ID = 1,66054х10-27кг. Биохимиктер үлкен молекулалардың, мысалы, белоктар мен нуклеин қышқылдарының, салыстырмалы молекулалық массаларын дальтонмен өрнектейді.
Өлшем бірліктерінің халықаралық жүйесінде салыстырмалы атомдық масса бірлігі ретінде көміртектің 12С изо-топының абсолюттік массасының 1/12 болігі қабылданған:
![]()
Демек, салыстырмалы атомдык, масса элементінің 6ip атомының массасы көміртектің 12С изотопының 6ip атомының массасының 1/12 бөлігінен неше есе ауыр екендігін көpceтeдi.
Мысалы:
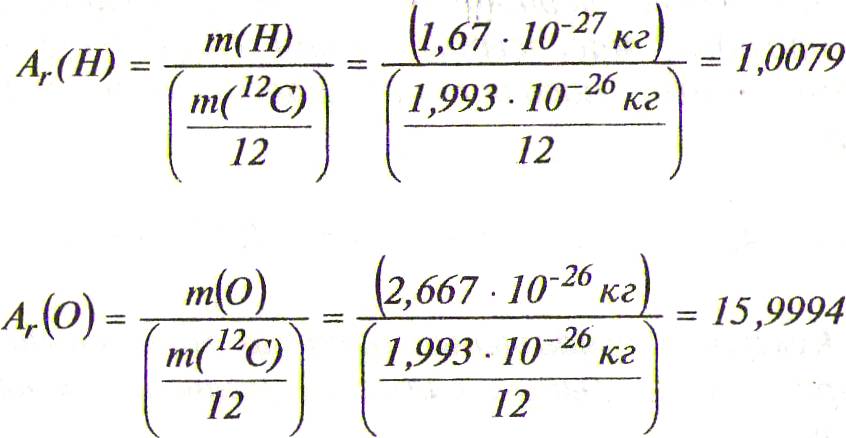 және
т.с.
және
т.с.
Д.И.Менделеевтің периодтық кестесінде элементтердің салыстырмалы атомдық массалары келтіріледі.
Салыстырмалы атомдық масса Аr дегеніміз элементтің табиғатта кездесетін изотоптарының орташа массасының көміртектің 12С изотопы массасының 1/12 бөлігіне қатынасы.
Салыстырмалы молекулалық, масса (Мr) дегеніміз заттың бip молекуласының орташа массасының көміртектің 12С изотопы массасының 1/12 бөлігіне қатынасы.
Мr (молекула) = m(молекула)/m(м.а.б.) (1.2)
Салыстырмалы молекулалық масса заттың молекуласының құрамына кіретін барлық атомдардың салыстырмалы атомдық массаларының қосындысына тек:
Mr = ΣAr (xі), (1.3)
мұндағы i — молекуладағы атомдар саны.
Заттың салыстырмалы молекулалық массасын оның формуласы бойынша есептеуге болады. Мысалы, судың салыстырмалы молекулалық массасын табайық:
Mr(Н2О)=2Ar(Н)+Ar(О)=2·1,00797+1·15,9994=18,01534≈18
Демек, судын 1 молекуласының массасы көміртектің 12С изотоптың 1/12 бөлігінен 18 есе ауыр.
Енді салыстырмалы атомдық массаға және салыстырмалы молекулалық массаға байланысты есептеулерге мысалдар келтірейік.
1 – мысал. Фтордың периодтық кестеде келтірілген салыстырмалы атомдық массасының мәнін (Ar(F)=19) пайдаланып, фтор атомдарының абсолюттік массасының орташа мәнін табыңыздар:
Шешуі:
m(F) = Ar(F) · m(м.а.б.) = 19·1,66·10-27кг ≈ 3,15·10-27 кг.
2 – мысал. Күкірт атомдарының, орташа массасы m(S)=5,31·10-26 кг. Kүкipт атомдарының салыстырмалы атомдық массасын табыңыздар.
Шешуі:
![]()
3 – мысал. Мыстың екі изотопы бар: 63Сu жоне 65Сu. Табиғи мыстағы олардың массалық, үлестері: ω(63Сu)=0,73 ω(65Сu)=0,27. Мыстың орташа салыстырмалы атомдық массасын табыңыздар.
Шешуі: Бұл eceпті былай қысқаша шығаруға болады. Мыс элементінің 100 атомнан тұратын үлесін қарастырайық. Ондағы әр изотоптың саны:
N(63Cu) = 0,73·100 = 73
N(65Cu) = 0,27·100 = 27
Мыстың 100 атомының салыстырмалы массаларының қосындысын табайық:
Mr(Cu)=N(63Cu)Ar(63Cu) + N(65Cu)Ar(65Cu) = 73·63 + 27·65 = 6350
Мыстың 1 атомының салыстырмалық атомдық массасын, демек мыс элементінің салыстырмалық атомдық массасын есептейік.
Үйге:
1. Неонның орташа салыстырмалы атомдық массасы Ar(Ne) =20,2. Неонның табиғи үлесіндегі 20Ne және 22Ne изотоптарының массалық үлестерін табыңыздар.
2. Табиғи бромның екі изотобы бар. Ондағы 79Br изотобының массалық үлесі 0,55. егер бромның салыстырмалы атомдық массасы 79,9 болса, онда табиғатта кездесетін екінші изотоптың қандай болғаны.
жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
атом,молекула сипаттамалары
атом,молекула сипаттамалары
1-сабақ.
Сыныбы: 10«а»
Сабақтың тақырыбы: Атом, молекула және олардың сипаттамалары.
Сабақтың мақсаты: оқушыларға атом, молекула ұғымдарын еске түсіріп,
м.а.б., изотоптар, салыстырмалы атомдық
масса, салыстырмалы молекулалық массалары берілген
есептерді шығару әдістерін үйрету.
Сабақтың типі: Жаңа материалды меңгерту сабағы
Көрнекіліктер: интерактивті тақта, оқулықтар, электронды оқулықтар, т.б.
Атом – элементтің химиялық, қасиеттерін сақтайтын ең кіші бөлшегі. Химиялық реакциялар кезіндегі атомдар бөлінбейді, тек басқаша топталады.
Молекула – заттың химиялық қасиеттерін сақтайтын ең кiші бөлшегі.
Атомның негізгі сипаттамалары – ядросының оң заряды мен массасы. Өлшем бірліктерінің халықаралық жүйесінде (SJ) масса бірлігі ретінде килограмм (кг) кабылданган. Практикада онымен қатар тонна (т), грамм (г), миллиграмм (мг) және т.с.с. сияқты туынды бірліктер де кеңінен қолданылады.
Атомдардың массалары тым жеңіл. Мысалы, кейбip цемент атомдарының килограммен алынған орташа массалары мынадай:
m(Н)= 0, 000 000 000 000 000 000 000 000 001 670 кг
m(О)= 0, 000 000 000 000 000 000 000 000 026 670 кг
m(С)= 0, 000 000 000 000 000 000 000 000 019 930 кг
Мұндай кішкене сандармен есептеулер жасаудың өте ыңғайсыз екенін кім де болса тез байкайды. Оларды ережемен өрнектеп, стандарттық күйде былай ықшамдап жазуға болады:
m(H)=l,67·10-27 кг
m(О)=2,667·10-26 кг
m(C)=l,993·10-26 кг
Мұндай сандармен де жұмыс icтey өте ыңғайсыз екеніне ғалымдардың көздері тез ақ жеткен. Сол себептен химиктер көбінесе атомдардың массаларынын абсолюттік мәндерінің орнына олардың салыстырмалы мәндерін қолданады. Теориялық және қолданбалы химияның халықаралық одағының (JUPAC) ұсынысы бойынша салыстырмалы атомдық масса Аr деп белгіленеді. Мұндағы г ағылшынның "relative" -"салыстырмалы" деген сөзінің алғашқы әpiпi.
Аr (атом) = m(атом)/m(м.а.б.) (1.1)
мұндағы m(атом) – элементтің 6ip атомының орташа абсолюттік массасы, m(м.а.б.) – массаның атомдық бірлігінің массасы.
Атомдардың массаларын салыстыру үшін алынатын масса бірлігі массаның атомдық бірлігі (м.а.б.) деп атайды. Массаның атомдық бірлігі ретінде кез келген элемент атомының массасын алуға болады. Химиктер алғашқыда ең жеңіл элемент сутек атомының массасын массаның атомдық бірлігі ретінде алган. Ceбeбi бұл жағдайда салыстырмалы атомдық массаның мәндері бip санынан үлкен болады.
Мысалы: Аr (О) = 2,67·10-26кг/1,67·10-27кг= 15,9880.
Табиғатта әр элемент атомдарының ядро зарядтары бірдей, ал массалары әртүрлі атомдары болады. Оларды изотоптар деп атайды. Кейін сутектің үш изотопы (1Н, 2Н жене 3Н) бар екендігі белгілі болған кезде, ғалымдар оның атомының массасын атомдық масса бірлігі ретінде қолданудан айныған. Ceбeбi әр табиғи қосылыстағы оның әр изотопының мөлшері әрқалай, сондықтан оның орташа мән тұрақты шама болмайды және оны анықтау үшін қосымша сандық анализ мәліметтері қажет болады. Тұрақсыз шаманы масса бірлігі ретінде алуга болмайды.
Бұдан кейін массаның атомдық бірлігі ретінде оттектің атомының 1/16 бөлігін алуға шешім қабылдаған. Ceбeбi атомының массасы массаның атомдық бірлігі ретінде алынатын элемент басқа элементтермен неғұрлым көп қосылыс түзуге тиic. Сонда сандық құрамы белгілі болса, олар арқылы баска элементтердің атомдық массаларын есептеп табуга болады. Бұл талапқа оттек элемент атомдары сәйкес келеді. Ал, оның массасының 1/16 бөлігі массаның атомдық бірлігі ретінде алғанда, элементтердің салыстырмалы атомдық массаларының бұрынғы үйреніп қалган мәндеріне жуық мәндер шығады. Кейінірек, оттек атомдарының да үш изотопы (16О, 17О жэне 18О) бар екендігі және әртүрлі заттардағы оттек атомдарының изотоптық құрамдары тұрақсыз екендігі белгілі болды.
1959 жылы ғалымдардың бip тобы көміртектің 12С изотопының, 1/12 бөлігін массаның атомдық бірлігі ретінде пайдалануды ұсынды. Мұның бірнеше себептері болды. Біріншіден, кеміртек өте көп химиялық қосылыстар түзе алады. Сондықтан ол арқылы баска элементтер мен қосылыстардың салыстырмалы атомдық және салыстырмалы молекулалық массаларын есептеуге болады. Екіншіден, табиғатта таралған заттардағы көміртектің басқа изотоптарының массалық үлecтepi өте аз, сондықтан жаңа шкаладағы элементтердің салыстырмалы атомдық массаларының мәндері көп өзгермейді, тек дәлірек болады. Yшіншіден, осы күндері атомдық массаларды анықтау үшін қолданылатын масс-спектометр атты приборларда басқа элементтерге қарағанда көміртек атомдары мен иондары оңай және дәл анықталады. Сондықтан, Таза және Қолданбалы Химияның Халықаралық Одағы (IUРАС) кеміртектің 12С изотопы массасының 1/12 бөлігін 1961 жылы массаның атомдық бірлігі (көміртекті бірлік) ретінде қабылдады. Кейде көптеген елдерде оны көрнекті ағылшын ғалымы Джон Дальтонның құрметіне дальтон деп атап, D немесе Da деп белгілейді. Сонымен ID = 1,66054х10-27кг. Биохимиктер үлкен молекулалардың, мысалы, белоктар мен нуклеин қышқылдарының, салыстырмалы молекулалық массаларын дальтонмен өрнектейді.
Өлшем бірліктерінің халықаралық жүйесінде салыстырмалы атомдық масса бірлігі ретінде көміртектің 12С изо-топының абсолюттік массасының 1/12 болігі қабылданған:
![]()
Демек, салыстырмалы атомдык, масса элементінің 6ip атомының массасы көміртектің 12С изотопының 6ip атомының массасының 1/12 бөлігінен неше есе ауыр екендігін көpceтeдi.
Мысалы:
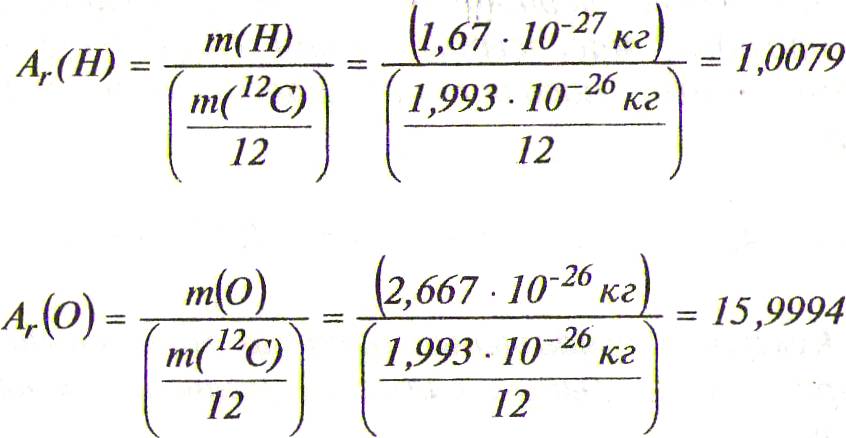 және
т.с.
және
т.с.
Д.И.Менделеевтің периодтық кестесінде элементтердің салыстырмалы атомдық массалары келтіріледі.
Салыстырмалы атомдық масса Аr дегеніміз элементтің табиғатта кездесетін изотоптарының орташа массасының көміртектің 12С изотопы массасының 1/12 бөлігіне қатынасы.
Салыстырмалы молекулалық, масса (Мr) дегеніміз заттың бip молекуласының орташа массасының көміртектің 12С изотопы массасының 1/12 бөлігіне қатынасы.
Мr (молекула) = m(молекула)/m(м.а.б.) (1.2)
Салыстырмалы молекулалық масса заттың молекуласының құрамына кіретін барлық атомдардың салыстырмалы атомдық массаларының қосындысына тек:
Mr = ΣAr (xі), (1.3)
мұндағы i — молекуладағы атомдар саны.
Заттың салыстырмалы молекулалық массасын оның формуласы бойынша есептеуге болады. Мысалы, судың салыстырмалы молекулалық массасын табайық:
Mr(Н2О)=2Ar(Н)+Ar(О)=2·1,00797+1·15,9994=18,01534≈18
Демек, судын 1 молекуласының массасы көміртектің 12С изотоптың 1/12 бөлігінен 18 есе ауыр.
Енді салыстырмалы атомдық массаға және салыстырмалы молекулалық массаға байланысты есептеулерге мысалдар келтірейік.
1 – мысал. Фтордың периодтық кестеде келтірілген салыстырмалы атомдық массасының мәнін (Ar(F)=19) пайдаланып, фтор атомдарының абсолюттік массасының орташа мәнін табыңыздар:
Шешуі:
m(F) = Ar(F) · m(м.а.б.) = 19·1,66·10-27кг ≈ 3,15·10-27 кг.
2 – мысал. Күкірт атомдарының, орташа массасы m(S)=5,31·10-26 кг. Kүкipт атомдарының салыстырмалы атомдық массасын табыңыздар.
Шешуі:
![]()
3 – мысал. Мыстың екі изотопы бар: 63Сu жоне 65Сu. Табиғи мыстағы олардың массалық, үлестері: ω(63Сu)=0,73 ω(65Сu)=0,27. Мыстың орташа салыстырмалы атомдық массасын табыңыздар.
Шешуі: Бұл eceпті былай қысқаша шығаруға болады. Мыс элементінің 100 атомнан тұратын үлесін қарастырайық. Ондағы әр изотоптың саны:
N(63Cu) = 0,73·100 = 73
N(65Cu) = 0,27·100 = 27
Мыстың 100 атомының салыстырмалы массаларының қосындысын табайық:
Mr(Cu)=N(63Cu)Ar(63Cu) + N(65Cu)Ar(65Cu) = 73·63 + 27·65 = 6350
Мыстың 1 атомының салыстырмалық атомдық массасын, демек мыс элементінің салыстырмалық атомдық массасын есептейік.
Үйге:
1. Неонның орташа салыстырмалы атомдық массасы Ar(Ne) =20,2. Неонның табиғи үлесіндегі 20Ne және 22Ne изотоптарының массалық үлестерін табыңыздар.
2. Табиғи бромның екі изотобы бар. Ондағы 79Br изотобының массалық үлесі 0,55. егер бромның салыстырмалы атомдық массасы 79,9 болса, онда табиғатта кездесетін екінші изотоптың қандай болғаны.

шағым қалдыра аласыз















