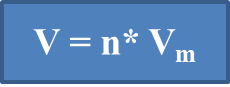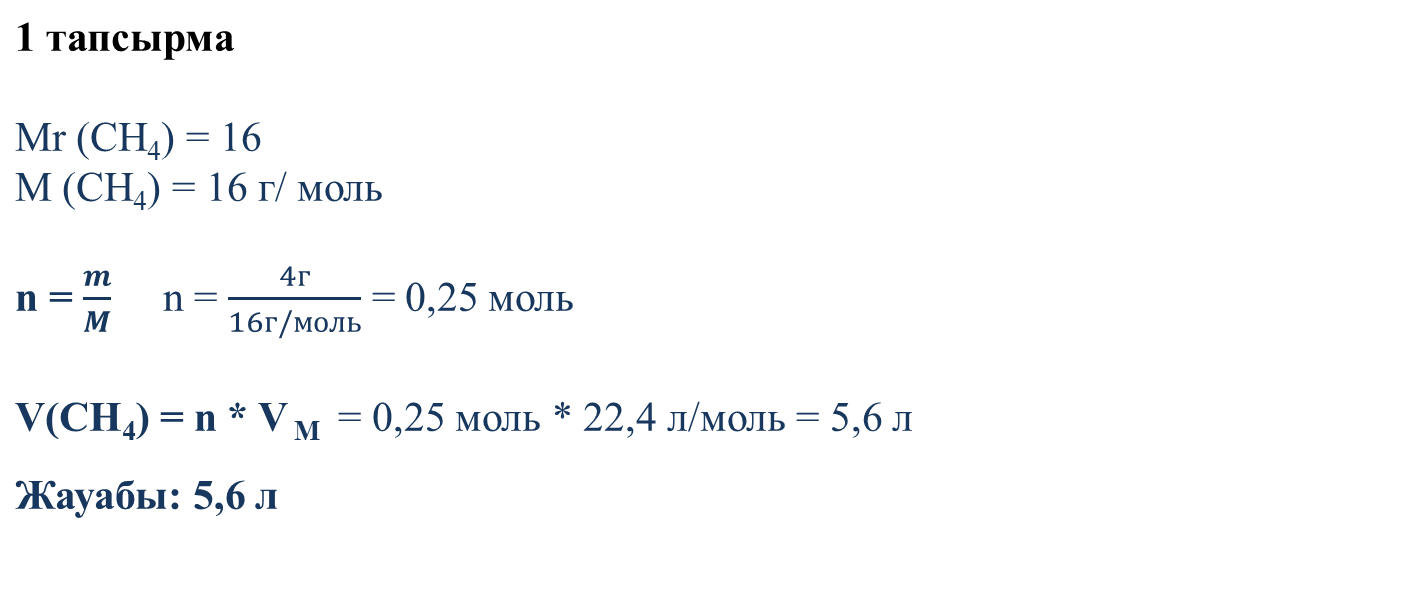|
Мұғалімнің аты-жөні: |
|
||||||||
|
Пән/Сынып: |
Химия, 8-сынып |
||||||||
|
Қай аптаның нешінші сабағы |
20 - сабақ |
||||||||
|
Тарау немесе бөлім атауы: |
V тарау. 8.2Стехиометриялық есептеулер |
||||||||
|
Сабақтың тақырыбы: |
Авогадро заңы, молярлық көлем |
||||||||
|
Оқу мақсаты: |
8.2.3.6 -Авогадро заңын білу және қалыпты және стандартты жағдайлардағы газдар көлемін есептеуде молярлық көлемді қолдану |
||||||||
|
Бағалау критериі: |
|
||||||||
|
Саралап оқыту тапсырмалары |
|||||||||
|
Ұжымдық жұмыс Жаңа тақырыптың түсіндірілуі. Бүгінгі жұмыс мақсатымен таныстыру. Бейнематериалды көре отырып, сабақты түсіндіру. Бекіту тапсырмалары және оқу тапсырмалары беріледі. Сабақты қорытындылау |
Бірлескен жұмыс (1,2 тапсырма) Бекіту тапсырманы ұсыну және дұрыс жауапты ұсыну арқылы үйрету 1 тапсырма Массасы 4 г метан (CH4) газының көлемін қ.ж табыңыз. 2 тапсырма Берілген зат мөлшерін газдың (қ.ж) көлемдерімен сәйкестендіріңіз. 11,2л 22,4л 5.6л 67,2 л 44,8 л
|
Жеке жұмыс Оқу тапсырманы ұсыну, оқушылар өз бетімен орындайды |
|||||||
|
Уақыты |
Кезеңдері |
Тапсырма |
Тапсырманың мақсаты |
Мұғалімнің бақылауы мен зерттеуі не? |
Бағалау |
Ресурстар |
|||
|
1 минут |
Ұйымдастыру |
Сәлеметсіздер ме! Бүгінгі сабағымыздың тақырыбы: Отынның жануы және энергияның бөлінуі Бүгінгі сабақта: Авогадро заңын білу және қалыпты және стандартты жағдайлардағы газдар көлемін есептеуде молярлық көлемді қолданасыздар Сенің білетінің: Молярлық көлемді пайдаланып есептер шығару Сенің меңгеретінің: Авогадро заңын дәлелдеу. |
Сабақтың мақсатымен таныстыру |
|
|
Презентация Слайд 1 Слайд 2 |
|||
|
8 минут |
Жаңа сабақ |
Газ (фр. «gaz», грек «chaos» - бей - берекет) – заттың атомдары мен молекулалары бір- бірімен әлсіз байланысқандықтан, кез келген бағытта еркін қозғалатын және өзіне берілген көлемге толық жайылып орналасатын агрегаттық күйі. Өзінің зерттеулері мен Бойль-Мариотт және Гей-Люссак заңдарына сүйеніп (барлық газдар бірдей сығылады және термиялық ұлғаю коэффициенттері бірдей), итальяндық ғалым Амадео Авогадро 1811 жылы болжам жасап, газдар жайлы заң ұсынды. Бірдей жағдайда (температура мен қысымда) әртүрлі газдардың бірдей көлеміндегі молекулалар саны бірдей болады: 1. Кез келген газдың молекулаларының белгілі саны (бірдей қысым мен температурада) тұрақты көлем алады. 2. Қалыпты жағдайда (қ.ж. Т=2730K, p=101,3 кПа немесе 00 температура, 1 атмосфералық қысым) кез келген газдың 1 молі 22,4 л көлем алады, ол мольдік көлем деп аталып, Vm деп белгіленеді, өлшемі л/моль. Қалыпты жағдайда кез келген газдың 1 молі 22,4 л көлем алады. Мольдік көлемді пайдаланып газдардың көлемін есептеуге болады:
n = V / Vm V - газ көлемі, n - зат мөлшері Есептер шығару: 1 - есеп. Зат мөлшері 2 моль азот (қ.ж) қандай көлем алады?
Б n (N2) = 2 моль V (N2) = n* Vm = 2 моль * Vm = 22,4 л/моль 22,4 л/моль =44,8 л
2 - есеп. Көлемі 112 л (қ.ж) азоттың зат мөлшерін есептеңіз?
Б V (N2) = 112 литр Зат мөлшерін мына
V n (N2) - ? n= V / V m n (N2) = 112 л / 22,4 л/моль = 5 моль Жауабы: n (N2) = 5 моль |
Жаңа тақырыпты меңгеру |
|
|
Презентация Слайд 3
Слайд 4
Слайд 5
Слайд 6
Слайд 7
Слайд 8
Слайд 9
Слайд 10 |
|||
|
9 минут |
|
1 тапсырма Массасы 4 г метан (CH4) газының көлемін қ.ж табыңыз. Жауабы:
2 тапсырма Берілген зат мөлшерін газдың (қ.ж) көлемдерімен сәйкестендіріңіз. 11,2л 22,4л 5,6л 67,2 л 44,8 л
Жауабы: 22,4л, 11,2л, 44,8 л, 67,2 л, 5,6л |
Жаңа тақырыпты меңгеру |
|
|
Слайд 12
Слайд 13
Слайд 14
Слайд 15 |
|||
|
2 минут |
Бекіту |
Сабағымызды қорытындылайық. Оқу тапсырмасы:
стандартты деп аталады?
Бүгінгі сабақта:
стандартты жағдайлардағы газдар көлемін есептеуде молярлық көлемді қолдануды үйрендіңіз. |
Тақырыпты меңгергенін анықтау |
|
|
Слайд 16 Слайд 17 |
|||
жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
Авогадро заңы. Молярлық көлем
Авогадро заңы. Молярлық көлем
|
Мұғалімнің аты-жөні: |
|
||||||||
|
Пән/Сынып: |
Химия, 8-сынып |
||||||||
|
Қай аптаның нешінші сабағы |
20 - сабақ |
||||||||
|
Тарау немесе бөлім атауы: |
V тарау. 8.2Стехиометриялық есептеулер |
||||||||
|
Сабақтың тақырыбы: |
Авогадро заңы, молярлық көлем |
||||||||
|
Оқу мақсаты: |
8.2.3.6 -Авогадро заңын білу және қалыпты және стандартты жағдайлардағы газдар көлемін есептеуде молярлық көлемді қолдану |
||||||||
|
Бағалау критериі: |
|
||||||||
|
Саралап оқыту тапсырмалары |
|||||||||
|
Ұжымдық жұмыс Жаңа тақырыптың түсіндірілуі. Бүгінгі жұмыс мақсатымен таныстыру. Бейнематериалды көре отырып, сабақты түсіндіру. Бекіту тапсырмалары және оқу тапсырмалары беріледі. Сабақты қорытындылау |
Бірлескен жұмыс (1,2 тапсырма) Бекіту тапсырманы ұсыну және дұрыс жауапты ұсыну арқылы үйрету 1 тапсырма Массасы 4 г метан (CH4) газының көлемін қ.ж табыңыз. 2 тапсырма Берілген зат мөлшерін газдың (қ.ж) көлемдерімен сәйкестендіріңіз. 11,2л 22,4л 5.6л 67,2 л 44,8 л
|
Жеке жұмыс Оқу тапсырманы ұсыну, оқушылар өз бетімен орындайды |
|||||||
|
Уақыты |
Кезеңдері |
Тапсырма |
Тапсырманың мақсаты |
Мұғалімнің бақылауы мен зерттеуі не? |
Бағалау |
Ресурстар |
|||
|
1 минут |
Ұйымдастыру |
Сәлеметсіздер ме! Бүгінгі сабағымыздың тақырыбы: Отынның жануы және энергияның бөлінуі Бүгінгі сабақта: Авогадро заңын білу және қалыпты және стандартты жағдайлардағы газдар көлемін есептеуде молярлық көлемді қолданасыздар Сенің білетінің: Молярлық көлемді пайдаланып есептер шығару Сенің меңгеретінің: Авогадро заңын дәлелдеу. |
Сабақтың мақсатымен таныстыру |
|
|
Презентация Слайд 1 Слайд 2 |
|||
|
8 минут |
Жаңа сабақ |
Газ (фр. «gaz», грек «chaos» - бей - берекет) – заттың атомдары мен молекулалары бір- бірімен әлсіз байланысқандықтан, кез келген бағытта еркін қозғалатын және өзіне берілген көлемге толық жайылып орналасатын агрегаттық күйі. Өзінің зерттеулері мен Бойль-Мариотт және Гей-Люссак заңдарына сүйеніп (барлық газдар бірдей сығылады және термиялық ұлғаю коэффициенттері бірдей), итальяндық ғалым Амадео Авогадро 1811 жылы болжам жасап, газдар жайлы заң ұсынды. Бірдей жағдайда (температура мен қысымда) әртүрлі газдардың бірдей көлеміндегі молекулалар саны бірдей болады: 1. Кез келген газдың молекулаларының белгілі саны (бірдей қысым мен температурада) тұрақты көлем алады. 2. Қалыпты жағдайда (қ.ж. Т=2730K, p=101,3 кПа немесе 00 температура, 1 атмосфералық қысым) кез келген газдың 1 молі 22,4 л көлем алады, ол мольдік көлем деп аталып, Vm деп белгіленеді, өлшемі л/моль. Қалыпты жағдайда кез келген газдың 1 молі 22,4 л көлем алады. Мольдік көлемді пайдаланып газдардың көлемін есептеуге болады:
n = V / Vm V - газ көлемі, n - зат мөлшері Есептер шығару: 1 - есеп. Зат мөлшері 2 моль азот (қ.ж) қандай көлем алады?
Б n (N2) = 2 моль V (N2) = n* Vm = 2 моль * Vm = 22,4 л/моль 22,4 л/моль =44,8 л
2 - есеп. Көлемі 112 л (қ.ж) азоттың зат мөлшерін есептеңіз?
Б V (N2) = 112 литр Зат мөлшерін мына
V n (N2) - ? n= V / V m n (N2) = 112 л / 22,4 л/моль = 5 моль Жауабы: n (N2) = 5 моль |
Жаңа тақырыпты меңгеру |
|
|
Презентация Слайд 3
Слайд 4
Слайд 5
Слайд 6
Слайд 7
Слайд 8
Слайд 9
Слайд 10 |
|||
|
9 минут |
|
1 тапсырма Массасы 4 г метан (CH4) газының көлемін қ.ж табыңыз. Жауабы:
2 тапсырма Берілген зат мөлшерін газдың (қ.ж) көлемдерімен сәйкестендіріңіз. 11,2л 22,4л 5,6л 67,2 л 44,8 л
Жауабы: 22,4л, 11,2л, 44,8 л, 67,2 л, 5,6л |
Жаңа тақырыпты меңгеру |
|
|
Слайд 12
Слайд 13
Слайд 14
Слайд 15 |
|||
|
2 минут |
Бекіту |
Сабағымызды қорытындылайық. Оқу тапсырмасы:
стандартты деп аталады?
Бүгінгі сабақта:
стандартты жағдайлардағы газдар көлемін есептеуде молярлық көлемді қолдануды үйрендіңіз. |
Тақырыпты меңгергенін анықтау |
|
|
Слайд 16 Слайд 17 |
|||

шағым қалдыра аласыз