
10-сынып Химия ЖМБ 1-БЖБ 1-НҰСҚА
«Химиялық реакция жылдамдығы» бөлімі бойынша жиынтық бағалау
Оқу мақсаттары:
10.3.2.1
– гомогенді және гетерогенді
реакциялар үшін жылдамдық өрнегін жазады.
10.3.2.2
– қарапайым реакцияның орташа
жылдамдығын есептейді.
10.3.2.3
– қайтымды реакциялар үшін
әрекеттесуші массалар заңының қолданылуын
түсіндіреді.
10.3.2.4
– әрекеттесуші массалар заңы
бойынша есеп шығарады.
10.3.2.5
– қысымның реакция жылдамдығына
әсерін түсіндіреді.
10.3.2.6
– температура мен концентрация
әсерін тәжірибелік деректер бойынша
талдайды.
10.3.2.7
– гомогенді және гетерогенді
катализді ажыратады.
1-тапсырма. (і) Берілген реакция теңдеулерін қараңыз, реакция типін анықтаңдар
а)
H₂(г) + Cl₂(г) →
2HCl(г)
ә) Zn(қ) + 2HCl(с) → ZnCl₂(с)
+ H₂(г)
Гомогенді:----------------
Гетерогенді: ---------
( іі) Әр
реакция үшін жылдамдықтың өрнегін жазыңыз (реагент концентрациялары
бойынша).
іі) Әр
реакция үшін жылдамдықтың өрнегін жазыңыз (реагент концентрациялары
бойынша).
2 -тапсырма. Тәжірибеде A(с) →
өнімдер реакциясы жүреді.
-тапсырма. Тәжірибеде A(с) →
өнімдер реакциясы жүреді.
A затының концентрациясы 80 секунд ішінде
0,40 моль/л-ден 0,16
моль/л-ге дейін
төмендеді. Реакцияның A бойынша орташа
жылдамдығын есептеңіз.
(өлшем бірлігі: моль/(л·с))
3-тапсырма. Қайтымды реакция: N₂(г) + 3H₂(г) ⇌ 2NH₃(г)
1 .Әрекеттесуші массалар заңы бойынша осы реакция
үшін теңдік
күйіндегі тепе-теңдік константасының
өрнегін жазыңыз.
.Әрекеттесуші массалар заңы бойынша осы реакция
үшін теңдік
күйіндегі тепе-теңдік константасының
өрнегін жазыңыз.
2.Концентрацияларды көбейту/азайту жүйенің тепе-теңдік күйіне қалай әсер ететінін қысқаша түсіндіріңіз (мысалы, H₂ концентрациясын арттырса).
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
4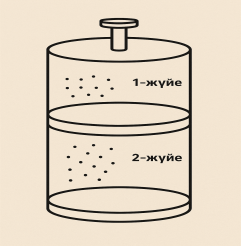 -тапсырма. Суретте көлемі өзгеретін
цилиндрде газдық жүйелер берілген :
-тапсырма. Суретте көлемі өзгеретін
цилиндрде газдық жүйелер берілген :
1-жүйе: 2NO₂(г) ⇌ N₂O₄(г)
2-жүйе: H₂(г) + Cl₂(г) ⇌ 2HCl(г)
Поршеньді төмен басып, жүйенің қысымын арттырсақ:
1.Қай жүйеде қысымның өзгеруі тепе-теңдікке көбірек әсер етеді? Неге?-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
2.Бірінші жүйеде (NO₂/N₂O₄) қысым артқанда қай бағыт басым болады? Түсіндіріңіз.----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
5-тапсырма. Қайтымды реакция: H₂(г) + I₂(г) ⇌ 2HI(г)
Тепе-теңдік кезінде 500 K
температурада концентрациялар:
[H₂] = 0,30 моль/л; [I₂] = 0,30 моль/л; [HI] = 0,90
моль/л.
Әрекеттесуші массалар заңы бойынша Kc тепе-теңдік константасын есептеңіз.
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
6-тапсырма. Күкірт қышқылы мен магний тасындағы сутек бөліну реакциясы үшін келесі тәжірибелер жасалды:
|
Тәжірибе |
Температура |
Қышқыл концентрациясы |
Газ көлемінің жиналу уақыты |
|
1 |
20 °C |
1 моль/л |
60 с |
|
2 |
40 °C |
1 моль/л |
30 с |
|
3 |
40 °C |
2 моль/л |
15 с |
1.Қай фактордың (температура / концентрация) реакция жылдамдығына әсерін 1→2, 2→3 тәжірибелер арқылы түсіндіріңіз.
-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
2.Қай тәжірибеде реакция ең жылдам өтті? Неге?-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
7-тапсырма. Төмендегі сызбаларды қараңыз
а)
2SO₂(г) + O₂(г) →
2SO₃(г) реакциясы V₂O₅(қ) қатты
катализаторының бетінде жүреді.
ә) Этанол(с) → этилен(г) +
су(с) реакциясы концентрлі H₂SO₄(с)
ерітіндісі қатысында жүреді.
1.Әр реакциядағы катализдің түрін анықтаңыз (гомогенді ме, гетерогенді ме?).
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
2.Катализатор реакция жылдамдығына қалай әсер ететінін қысқаша түсіндіріңіз.
-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
|
Бағалау критерийі |
Тапсырма № |
Дескриптор |
Балл |
|
Гомогенді және гетерогенді реакцияларды ажыратады |
1 |
реакцияның фазалық жағдайына қарай гомогенді және гетерогенді екенін анықтайды |
1 |
|
реакция жылдамдығының өрнегін жазады |
1 |
||
|
Қарапайым реакцияның орташа жылдамдығын есептейді |
2 |
концентрация өзгерісі мен уақытқа сүйеніп орташа жылдамдықты есептейді |
2 |
|
Қайтымды реакциялар үшін әрекеттесуші массалар заңын түсіндіреді |
3 |
әрекеттесуші массалар заңының өрнегін жазады |
1 |
|
концентрация өзгергенде тепе-теңдік бағытын түсіндіреді |
1 |
||
|
Қысымның реакция жылдамдығына әсерін түсіндіреді |
4 |
қысымның әсерін салыстырып дұрыс жүйені анықтайды |
1 |
|
|
|
тепе-теңдік қай жаққа ығысатынын түсіндіреді |
1 |
|
Әрекеттесуші массалар заңы бойынша есеп шығарады |
5 |
Кс формуласы бойынша есеп жүргізеді |
2 |
|
Температура және концентрация әсерін тәжірибелік дерек бойынша талдайды |
6 |
кесте нәтижелері бойынша қорытынды жасайды |
2 |
|
температура мен концентрация әсерін ажыратады |
1 |
||
|
Гомогенді және гетерогенді катализді ажыратады |
7 |
катализ түрін анықтайды |
1 |
|
катализатордың рөлін түсіндіреді |
1 |
||
|
Барлығы |
|
|
15 |
10-сынып Химия ЖМБ 1-БЖБ 2-НҰСҚА
«Химиялық реакция жылдамдығы» бөлімі бойынша жиынтық бағалау
Оқу мақсаттары:
10.3.2.1
– гомогенді және гетерогенді
реакциялар үшін жылдамдық өрнегін жазады.
10.3.2.2
– қарапайым реакцияның орташа
жылдамдығын есептейді.
10.3.2.3
– қайтымды реакциялар үшін
әрекеттесуші массалар заңының қолданылуын
түсіндіреді.
10.3.2.4
– әрекеттесуші массалар заңы
бойынша есеп шығарады.
10.3.2.5
– қысымның реакция жылдамдығына
әсерін түсіндіреді.
10.3.2.6
– температура мен концентрация
әсерін тәжірибелік деректер бойынша
талдайды.
10.3.2.7
– гомогенді және гетерогенді
катализді ажыратады.
1-тапсырма. Реакциялар типін анықтаңдар
а)
2H₂O₂(с) → 2H₂O(с) +
O₂(г) (ерітіндіде)
ә) C(қ) + O₂(г) →
CO₂(г)
Гомогенді:--------------------------
Гетерогенді:----------------------------
Реакция жылдамдығының өрнегін жазыңыз (реагент бойынша).

2-тапсырма B(г) → өнімдер реакциясында B затының концентрациясы 50 секунд ішінде 0,25 моль/л-ден 0,10 моль/л-ге азайды.
B бойынша реакцияның орташа жылдамдығын
есептеңіз.
бойынша реакцияның орташа жылдамдығын
есептеңіз.
3-тапсырма. Қайтымды реакция: 2SO₂(г) + O₂(г) ⇌ 2SO₃(г)
1.Тепе-теңдік константасының Kc өрнегін жазыңыз.

2.Егер жүйеге қосымша SO₂ енгізілсе, тепе-теңдік қай жаққа ығысады? Түсіндіріңіз.
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
4-тапсырма. Газдық реакция: N₂(г) + 3H₂(г) ⇌ 2NH₃(г)
1.Реакция қоспасының қысымын арттырғанда тепе-теңдік қай жаққа ығысады? Себебін көрсетіңіз.
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
2.Қысымның өзгеруі реакция жылдамдығына қандай жүйелерде көбірек әсер етеді (газдық па, сұйық па)?
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
5-тапсырма. Реакция: 2NO₂(г) ⇌ N₂O₄(г)
Тепе-теңдік кезінде
концентрациялар:
[NO₂] = 0,20 моль/л; [N₂O₄] = 0,30 моль/л.
Осы реакция үшін Kc мәнін есептеңіз. --------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
6-тапсырма. Натрий сульфиті ерітіндісіне тұз қышқылы қосылғанда газ бөлінеді. Тәжірибе нәтижелері:
|
Тәжірибе |
Температура |
Na₂SO₃ концентрациясы |
Газдың толық бөліну уақыты |
|
1 |
25 °C |
0,5 моль/л |
80 с |
|
2 |
25 °C |
1,0 моль/л |
40 с |
|
3 |
45 °C |
1,0 моль/л |
20 с |
1.Концентрацияны арттырғанда реакция жылдамдығы қалай өзгерді (1→2)?
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
2.Температура артқанда (2→3) қандай өзгеріс байқалды? Қорытынды жасаңыз.
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
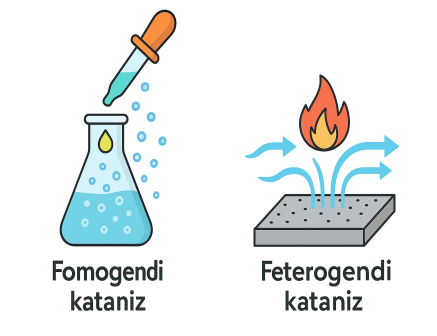 7-тапсырма. Сурет-сызбалы
жағдайлар
7-тапсырма. Сурет-сызбалы
жағдайлар
а)
2H₂O₂(с) →
2H₂O(с) +
O₂(г) реакциясы ерітіндіге калий
йодиді (KI) қосқанда жылдам жүреді.
ә) NH₃(г) + O₂(г) → NO(г) +
H₂O(г) реакциясы платина (Pt) торының
бетінде жүреді.
Әр мысалдағы катализ түрін анықтаңыз (гомогенді/гетерогенді).
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Катализатордың өзі реакция соңында өзгеріссіз қалатынын түсіндіріңіз.
-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
|
Бағалау критерийі |
Тапсырма № |
Дескриптор |
Балл |
|
Гомогенді және гетерогенді реакцияларды ажыратады |
1 |
реакцияның фазалық күйін анықтайды |
1 |
|
жылдамдық өрнегін жазады |
1 |
||
|
Қарапайым реакцияның орташа жылдамдығын есептейді |
2 |
v = Δc/Δt формуламен есептейді |
2 |
|
Қайтымды реакцияда әрекеттесуші массалар заңын қолданады |
3 |
Kc формуласы ретінде өрнек жазады |
1 |
|
концентрация әсерін түсіндіреді |
1 |
||
|
Қысымның реакцияға әсерін түсіндіреді |
4 |
қысым артқанда қай бағытқа ығысатынын анықтайды |
1 |
|
газдық жүйеде қысымның рөлін түсіндіреді |
1 |
||
|
Әрекеттесуші массалар заңы бойынша есеп шығарады |
5 |
тепе-теңдік константасын есептейді |
2 |
|
Температура және концентрацияның тәжірибелік деректерін талдайды |
6 |
тәжірибедегі өзгерісті салыстырады |
1 |
|
қорытынды жасайды |
2 |
||
|
Гомогенді және гетерогенді катализді ажыратады |
7 |
катализ түрін анықтайды |
1 |
|
катализатор әсерін түсіндіреді |
1 |
||
|
Барлығы |
|
|
15 |
Білім алушының аты-жөні: ______________________________________
|
Бағалау критерийі |
Төмен деңгей |
Орта деңгей |
Жоғары деңгей |
|
Гомогенді және гетерогенді реакцияларды ажыратады |
Реакция типін анықтауда қиналады |
Гомогенді/гетерогенді реакцияны ажыратады, бірақ қателіктер жібереді |
|
|
Реакция жылдамдығын есептейді |
Орташа жылдамдықты есептеуде қиналады |
Формуланы қолданады, бірақ есептеуде қателік жібереді |
Реакция жылдамдығын дұрыс формуламен және дұрыс мәнмен есептейді |
|
Әрекеттесуші массалар заңы бойынша есеп шығарады |
Kc өрнегін жазуда және есептеуде қиналады |
Әрекеттесуші массалар заңын қолданады, бірақ қателік жібереді |
Kc формуланы дұрыс құрып, есепті дұрыс орындайды |
|
Реакция жылдамдығына факторлардың әсерін түсіндіреді (қысым, температура, концентрация) |
Факторлардың әсерін түсіндіруде қиналады |
Әсерін түсіндіреді, бірақ толық емес немесе дәлелсіз |
Фактор әсерін ғылыми тұрғыда дәл және толық түсіндіреді |
|
Катализ түрлерін ажыратады (гомогенді/гетерогенді) |
Катализатор рөлін түсінуде қиналады |
Катализ түрін ажыратады, бірақ дәлелсіз |
Катализ түрін correctly анықтайды және әсерін түсіндіреді |
1-нұсқа Жауап кілті
1-тапсырма
H₂ + Cl₂ → гомогенді; Zn + HCl
→ гетерогенді
v = k[H₂][Cl₂] және v = k[HCl]²
2-тапсырма
v = (0,40 – 0,16) / 80 = 0,003 моль/(л·с)
3-тапсырма
Kc = [NH₃]² / ([N₂][H₂]³)
H₂↑ → тепе-теңдік оңға ығысады
4-тапсырма
1-жүйе көбірек әсер етеді
Қысым ↑ → N₂O₄ бағытында ығысады
5-тапсырма
Kc = (0,90²) / (0,30×0,30) = 9
6-тапсырма
Температура мен концентрация
артқанда жылдамдық ↑
Ең жылдам – 3-тәжірибе
7-тапсырма
а) гомогенді
ә) гетерогенді
Катализатор әрекет жылдамдығын арттырады, бірақ өзі
өзгермейді
2-нұсқа Жауап кілті
1-тапсырма
H₂O₂ → гомогенді
C + O₂ → гетерогенді
2-тапсырма
v = (0,25 – 0,10) / 50 = 0,003 моль/(л·с)
3-тапсырма
Kc = [SO₃]² / ([SO₂]²[O₂])
SO₂↑ → тепе-теңдік оңға ығысады
4-тапсырма
N₂ + H₂ → NH₃
Қысым ↑ → өнім бағытына (оңға) ығысады
Газ жүйесінде әсер күштірек
5-тапсырма
Kc = [N₂O₄] / [NO₂]² = 0,30 / (0,20²) = 7,5
6-тапсырма
Концентрация ↑ → реакция
жылдамдайды
Температура ↑ → реакция жылдамдайды
Ең жылдам – 3-тәжірибе
7-тапсырма
а) гомогенді
ә) гетерогенді
Катализатор реакцияны тездетеді, өзі
өзгермейді
жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
БЖБ. Химиялық реакция жылдамдығы
БЖБ. Химиялық реакция жылдамдығы
10-сынып Химия ЖМБ 1-БЖБ 1-НҰСҚА
«Химиялық реакция жылдамдығы» бөлімі бойынша жиынтық бағалау
Оқу мақсаттары:
10.3.2.1
– гомогенді және гетерогенді
реакциялар үшін жылдамдық өрнегін жазады.
10.3.2.2
– қарапайым реакцияның орташа
жылдамдығын есептейді.
10.3.2.3
– қайтымды реакциялар үшін
әрекеттесуші массалар заңының қолданылуын
түсіндіреді.
10.3.2.4
– әрекеттесуші массалар заңы
бойынша есеп шығарады.
10.3.2.5
– қысымның реакция жылдамдығына
әсерін түсіндіреді.
10.3.2.6
– температура мен концентрация
әсерін тәжірибелік деректер бойынша
талдайды.
10.3.2.7
– гомогенді және гетерогенді
катализді ажыратады.
1-тапсырма. (і) Берілген реакция теңдеулерін қараңыз, реакция типін анықтаңдар
а)
H₂(г) + Cl₂(г) →
2HCl(г)
ә) Zn(қ) + 2HCl(с) → ZnCl₂(с)
+ H₂(г)
Гомогенді:----------------
Гетерогенді: ---------
( іі) Әр
реакция үшін жылдамдықтың өрнегін жазыңыз (реагент концентрациялары
бойынша).
іі) Әр
реакция үшін жылдамдықтың өрнегін жазыңыз (реагент концентрациялары
бойынша).
2 -тапсырма. Тәжірибеде A(с) →
өнімдер реакциясы жүреді.
-тапсырма. Тәжірибеде A(с) →
өнімдер реакциясы жүреді.
A затының концентрациясы 80 секунд ішінде
0,40 моль/л-ден 0,16
моль/л-ге дейін
төмендеді. Реакцияның A бойынша орташа
жылдамдығын есептеңіз.
(өлшем бірлігі: моль/(л·с))
3-тапсырма. Қайтымды реакция: N₂(г) + 3H₂(г) ⇌ 2NH₃(г)
1 .Әрекеттесуші массалар заңы бойынша осы реакция
үшін теңдік
күйіндегі тепе-теңдік константасының
өрнегін жазыңыз.
.Әрекеттесуші массалар заңы бойынша осы реакция
үшін теңдік
күйіндегі тепе-теңдік константасының
өрнегін жазыңыз.
2.Концентрацияларды көбейту/азайту жүйенің тепе-теңдік күйіне қалай әсер ететінін қысқаша түсіндіріңіз (мысалы, H₂ концентрациясын арттырса).
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
4 -тапсырма. Суретте көлемі өзгеретін
цилиндрде газдық жүйелер берілген :
-тапсырма. Суретте көлемі өзгеретін
цилиндрде газдық жүйелер берілген :
1-жүйе: 2NO₂(г) ⇌ N₂O₄(г)
2-жүйе: H₂(г) + Cl₂(г) ⇌ 2HCl(г)
Поршеньді төмен басып, жүйенің қысымын арттырсақ:
1.Қай жүйеде қысымның өзгеруі тепе-теңдікке көбірек әсер етеді? Неге?-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
2.Бірінші жүйеде (NO₂/N₂O₄) қысым артқанда қай бағыт басым болады? Түсіндіріңіз.----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
5-тапсырма. Қайтымды реакция: H₂(г) + I₂(г) ⇌ 2HI(г)
Тепе-теңдік кезінде 500 K
температурада концентрациялар:
[H₂] = 0,30 моль/л; [I₂] = 0,30 моль/л; [HI] = 0,90
моль/л.
Әрекеттесуші массалар заңы бойынша Kc тепе-теңдік константасын есептеңіз.
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
6-тапсырма. Күкірт қышқылы мен магний тасындағы сутек бөліну реакциясы үшін келесі тәжірибелер жасалды:
|
Тәжірибе |
Температура |
Қышқыл концентрациясы |
Газ көлемінің жиналу уақыты |
|
1 |
20 °C |
1 моль/л |
60 с |
|
2 |
40 °C |
1 моль/л |
30 с |
|
3 |
40 °C |
2 моль/л |
15 с |
1.Қай фактордың (температура / концентрация) реакция жылдамдығына әсерін 1→2, 2→3 тәжірибелер арқылы түсіндіріңіз.
-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
2.Қай тәжірибеде реакция ең жылдам өтті? Неге?-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
7-тапсырма. Төмендегі сызбаларды қараңыз
а)
2SO₂(г) + O₂(г) →
2SO₃(г) реакциясы V₂O₅(қ) қатты
катализаторының бетінде жүреді.
ә) Этанол(с) → этилен(г) +
су(с) реакциясы концентрлі H₂SO₄(с)
ерітіндісі қатысында жүреді.
1.Әр реакциядағы катализдің түрін анықтаңыз (гомогенді ме, гетерогенді ме?).
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
2.Катализатор реакция жылдамдығына қалай әсер ететінін қысқаша түсіндіріңіз.
-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
|
Бағалау критерийі |
Тапсырма № |
Дескриптор |
Балл |
|
Гомогенді және гетерогенді реакцияларды ажыратады |
1 |
реакцияның фазалық жағдайына қарай гомогенді және гетерогенді екенін анықтайды |
1 |
|
реакция жылдамдығының өрнегін жазады |
1 |
||
|
Қарапайым реакцияның орташа жылдамдығын есептейді |
2 |
концентрация өзгерісі мен уақытқа сүйеніп орташа жылдамдықты есептейді |
2 |
|
Қайтымды реакциялар үшін әрекеттесуші массалар заңын түсіндіреді |
3 |
әрекеттесуші массалар заңының өрнегін жазады |
1 |
|
концентрация өзгергенде тепе-теңдік бағытын түсіндіреді |
1 |
||
|
Қысымның реакция жылдамдығына әсерін түсіндіреді |
4 |
қысымның әсерін салыстырып дұрыс жүйені анықтайды |
1 |
|
|
|
тепе-теңдік қай жаққа ығысатынын түсіндіреді |
1 |
|
Әрекеттесуші массалар заңы бойынша есеп шығарады |
5 |
Кс формуласы бойынша есеп жүргізеді |
2 |
|
Температура және концентрация әсерін тәжірибелік дерек бойынша талдайды |
6 |
кесте нәтижелері бойынша қорытынды жасайды |
2 |
|
температура мен концентрация әсерін ажыратады |
1 |
||
|
Гомогенді және гетерогенді катализді ажыратады |
7 |
катализ түрін анықтайды |
1 |
|
катализатордың рөлін түсіндіреді |
1 |
||
|
Барлығы |
|
|
15 |
10-сынып Химия ЖМБ 1-БЖБ 2-НҰСҚА
«Химиялық реакция жылдамдығы» бөлімі бойынша жиынтық бағалау
Оқу мақсаттары:
10.3.2.1
– гомогенді және гетерогенді
реакциялар үшін жылдамдық өрнегін жазады.
10.3.2.2
– қарапайым реакцияның орташа
жылдамдығын есептейді.
10.3.2.3
– қайтымды реакциялар үшін
әрекеттесуші массалар заңының қолданылуын
түсіндіреді.
10.3.2.4
– әрекеттесуші массалар заңы
бойынша есеп шығарады.
10.3.2.5
– қысымның реакция жылдамдығына
әсерін түсіндіреді.
10.3.2.6
– температура мен концентрация
әсерін тәжірибелік деректер бойынша
талдайды.
10.3.2.7
– гомогенді және гетерогенді
катализді ажыратады.
1-тапсырма. Реакциялар типін анықтаңдар
а)
2H₂O₂(с) → 2H₂O(с) +
O₂(г) (ерітіндіде)
ә) C(қ) + O₂(г) →
CO₂(г)
Гомогенді:--------------------------
Гетерогенді:----------------------------
Реакция жылдамдығының өрнегін жазыңыз (реагент бойынша).

2-тапсырма B(г) → өнімдер реакциясында B затының концентрациясы 50 секунд ішінде 0,25 моль/л-ден 0,10 моль/л-ге азайды.
B бойынша реакцияның орташа жылдамдығын
есептеңіз.
бойынша реакцияның орташа жылдамдығын
есептеңіз.
3-тапсырма. Қайтымды реакция: 2SO₂(г) + O₂(г) ⇌ 2SO₃(г)
1.Тепе-теңдік константасының Kc өрнегін жазыңыз.

2.Егер жүйеге қосымша SO₂ енгізілсе, тепе-теңдік қай жаққа ығысады? Түсіндіріңіз.
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
4-тапсырма. Газдық реакция: N₂(г) + 3H₂(г) ⇌ 2NH₃(г)
1.Реакция қоспасының қысымын арттырғанда тепе-теңдік қай жаққа ығысады? Себебін көрсетіңіз.
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
2.Қысымның өзгеруі реакция жылдамдығына қандай жүйелерде көбірек әсер етеді (газдық па, сұйық па)?
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
5-тапсырма. Реакция: 2NO₂(г) ⇌ N₂O₄(г)
Тепе-теңдік кезінде
концентрациялар:
[NO₂] = 0,20 моль/л; [N₂O₄] = 0,30 моль/л.
Осы реакция үшін Kc мәнін есептеңіз. --------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
6-тапсырма. Натрий сульфиті ерітіндісіне тұз қышқылы қосылғанда газ бөлінеді. Тәжірибе нәтижелері:
|
Тәжірибе |
Температура |
Na₂SO₃ концентрациясы |
Газдың толық бөліну уақыты |
|
1 |
25 °C |
0,5 моль/л |
80 с |
|
2 |
25 °C |
1,0 моль/л |
40 с |
|
3 |
45 °C |
1,0 моль/л |
20 с |
1.Концентрацияны арттырғанда реакция жылдамдығы қалай өзгерді (1→2)?
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
2.Температура артқанда (2→3) қандай өзгеріс байқалды? Қорытынды жасаңыз.
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
 7-тапсырма. Сурет-сызбалы
жағдайлар
7-тапсырма. Сурет-сызбалы
жағдайлар
а)
2H₂O₂(с) →
2H₂O(с) +
O₂(г) реакциясы ерітіндіге калий
йодиді (KI) қосқанда жылдам жүреді.
ә) NH₃(г) + O₂(г) → NO(г) +
H₂O(г) реакциясы платина (Pt) торының
бетінде жүреді.
Әр мысалдағы катализ түрін анықтаңыз (гомогенді/гетерогенді).
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Катализатордың өзі реакция соңында өзгеріссіз қалатынын түсіндіріңіз.
-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
|
Бағалау критерийі |
Тапсырма № |
Дескриптор |
Балл |
|
Гомогенді және гетерогенді реакцияларды ажыратады |
1 |
реакцияның фазалық күйін анықтайды |
1 |
|
жылдамдық өрнегін жазады |
1 |
||
|
Қарапайым реакцияның орташа жылдамдығын есептейді |
2 |
v = Δc/Δt формуламен есептейді |
2 |
|
Қайтымды реакцияда әрекеттесуші массалар заңын қолданады |
3 |
Kc формуласы ретінде өрнек жазады |
1 |
|
концентрация әсерін түсіндіреді |
1 |
||
|
Қысымның реакцияға әсерін түсіндіреді |
4 |
қысым артқанда қай бағытқа ығысатынын анықтайды |
1 |
|
газдық жүйеде қысымның рөлін түсіндіреді |
1 |
||
|
Әрекеттесуші массалар заңы бойынша есеп шығарады |
5 |
тепе-теңдік константасын есептейді |
2 |
|
Температура және концентрацияның тәжірибелік деректерін талдайды |
6 |
тәжірибедегі өзгерісті салыстырады |
1 |
|
қорытынды жасайды |
2 |
||
|
Гомогенді және гетерогенді катализді ажыратады |
7 |
катализ түрін анықтайды |
1 |
|
катализатор әсерін түсіндіреді |
1 |
||
|
Барлығы |
|
|
15 |
Білім алушының аты-жөні: ______________________________________
|
Бағалау критерийі |
Төмен деңгей |
Орта деңгей |
Жоғары деңгей |
|
Гомогенді және гетерогенді реакцияларды ажыратады |
Реакция типін анықтауда қиналады |
Гомогенді/гетерогенді реакцияны ажыратады, бірақ қателіктер жібереді |
|
|
Реакция жылдамдығын есептейді |
Орташа жылдамдықты есептеуде қиналады |
Формуланы қолданады, бірақ есептеуде қателік жібереді |
Реакция жылдамдығын дұрыс формуламен және дұрыс мәнмен есептейді |
|
Әрекеттесуші массалар заңы бойынша есеп шығарады |
Kc өрнегін жазуда және есептеуде қиналады |
Әрекеттесуші массалар заңын қолданады, бірақ қателік жібереді |
Kc формуланы дұрыс құрып, есепті дұрыс орындайды |
|
Реакция жылдамдығына факторлардың әсерін түсіндіреді (қысым, температура, концентрация) |
Факторлардың әсерін түсіндіруде қиналады |
Әсерін түсіндіреді, бірақ толық емес немесе дәлелсіз |
Фактор әсерін ғылыми тұрғыда дәл және толық түсіндіреді |
|
Катализ түрлерін ажыратады (гомогенді/гетерогенді) |
Катализатор рөлін түсінуде қиналады |
Катализ түрін ажыратады, бірақ дәлелсіз |
Катализ түрін correctly анықтайды және әсерін түсіндіреді |
1-нұсқа Жауап кілті
1-тапсырма
H₂ + Cl₂ → гомогенді; Zn + HCl
→ гетерогенді
v = k[H₂][Cl₂] және v = k[HCl]²
2-тапсырма
v = (0,40 – 0,16) / 80 = 0,003 моль/(л·с)
3-тапсырма
Kc = [NH₃]² / ([N₂][H₂]³)
H₂↑ → тепе-теңдік оңға ығысады
4-тапсырма
1-жүйе көбірек әсер етеді
Қысым ↑ → N₂O₄ бағытында ығысады
5-тапсырма
Kc = (0,90²) / (0,30×0,30) = 9
6-тапсырма
Температура мен концентрация
артқанда жылдамдық ↑
Ең жылдам – 3-тәжірибе
7-тапсырма
а) гомогенді
ә) гетерогенді
Катализатор әрекет жылдамдығын арттырады, бірақ өзі
өзгермейді
2-нұсқа Жауап кілті
1-тапсырма
H₂O₂ → гомогенді
C + O₂ → гетерогенді
2-тапсырма
v = (0,25 – 0,10) / 50 = 0,003 моль/(л·с)
3-тапсырма
Kc = [SO₃]² / ([SO₂]²[O₂])
SO₂↑ → тепе-теңдік оңға ығысады
4-тапсырма
N₂ + H₂ → NH₃
Қысым ↑ → өнім бағытына (оңға) ығысады
Газ жүйесінде әсер күштірек
5-тапсырма
Kc = [N₂O₄] / [NO₂]² = 0,30 / (0,20²) = 7,5
6-тапсырма
Концентрация ↑ → реакция
жылдамдайды
Температура ↑ → реакция жылдамдайды
Ең жылдам – 3-тәжірибе
7-тапсырма
а) гомогенді
ә) гетерогенді
Катализатор реакцияны тездетеді, өзі
өзгермейді

шағым қалдыра аласыз















