Шукирова Мадина НурмаханбетовнаПортфолиослушателяРаздел А и В
Филиал ЧУ «ЦПМпертиза» г Тараз Курсы «Разработка и экспертиза заданий
дляоценивания»
Раздел А
Задания по суммативному оцениванию за IVчетверть
Суммативное оценивание за раздел 8.4С «Вода»
Цель обучения:
8.4.2.6Объяснять широкое распространение, уникальные свойства воды и ее значение для жизни
8.4.2.7Объяснять круговорот воды в природе
8.4.2.9Определять жесткость воды и объяснять
способы ее
устранения
Критерии оценивания:
Обучающийся
-
Описывает физические свойства воды;
-
Определяет строение молекулы и свойства воды;
-
Характеризует виды жесткости воды и способы ее устранения;
-
Описывает процесс очистки воды;
-
Описывает круговорот воды в природе.
Уровень мыслительных навыков: знание,понимание иприменение
Время выполнения: 20 минут
Задания
-
Вставьтепропущенныеслова в данныепредложения:
Вода является универсальным ........................................
Агрегатные состояние воды: ............................................
Температура кипения воды ..............................................
Температура замерзания воды ..........................................
Плотность воды ..................................................................
Природная вода всегда содержит .....................................
-
Укажите истинные и ложные утверждения:
|
Утверждения |
Правда |
Ложь |
|
Молекула водынелинейная |
|
|
|
Человекна 70%состоитводы |
|
|
|
CuSO4* 5 H2Oизвестныйподназваниеммедный купорос имеетголубойцвет |
|
|
|
Вода не взаимодействует с активнымиметаллами иихоксидами |
|
|
|
Содержаниеводы в костяхдостигает 31% |
|
|
-
Заполните таблицу «Виды жесткост и воды»:
|
Виды жеcткости |
Способы устранения (уравнения реакций) |
|
Временная(карбонатная)жесткостьводыобусловленаналичием в ней. __________________________ |
_________________________________________________ |
|
Постояннаяжесткостьводыобусловленаналичием в ней
__________________________ |
_________________________________________________ |
4![]()
![]() . а
)Укажите этапы
водоочистки
. а
)Укажите этапы
водоочистки
![]()
![]()
![]()
б )Укажите формулу вещества, используемого для дезинфекции воды
А) Cl2
Б) I2
В) F2
С) P
5. В схеме круговорота воды в природе заполните пробелы

![]()
![]()
![]() https://infourok.ru/prezentaciya-k-otkritomu-uroku-krugovorot-vodi-v-prirode-1721776.html
https://infourok.ru/prezentaciya-k-otkritomu-uroku-krugovorot-vodi-v-prirode-1721776.html
|
Критерии оценивания |
№ |
Дескрипторы |
Баллы |
|
Обучающийся |
|
|
|
|
Описывает физические свойства воды |
1 |
Правильно указывает агрегатные состояния воды Правильно записывает температуры кипения и замерзания Описывает особенности воды |
1 1 1 |
|
Определяет строение молекулы и свойства воды |
1 |
Верно определяет истинные и ложные утверждения, характеризующие свойства воды |
2 |
|
Характеризует виды жесткости воды и способы ее устранения |
1 |
Записывает уравнение реакции разложения гидрокарбоната кипячением воды Записывает уравнение реакции действия соды на гидрокарбонат Записывает уравнение реакции действия известкового молока Записывает уравнение реакции действия соды на сульфат |
1 1 1 1 |
|
Описывает процесс очистки воды |
2 |
Правильно записывает этапы очистки воды Выбирает формулу вещества, используемого для дезинфекции воды |
1 1 |
|
Описывает круговорот воды в природе |
1 |
Записывает этап испарения воды Записывает этап образования облаков |
1 1 |
|
Всего баллов |
13 |
|
|
Раздел В
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 4 ЧЕТВЕРТЬ
Обзор суммативного оценивания за 4
четверть
Продолжительность - 40 минут
Количество баллов
–25
Типы заданий:
МВО –
задания с множественным выбором ответов;
КО– задания, требующие краткого
ответа;
РО – задания, требующие развернутого
ответа.
Структура суммативного оценивания
Данный вариант состоит из 15 заданий,
включающих задания с множественнымвыбором ответов, с кратким и
развёрнутым ответами.
В вопросах, требующих краткого ответа, обучающийся записывает ответ
в виде
численного значения, слова или короткого предложения.
В вопросах, требующих развёрнутого ответа, обучающийся должен
показать всюпоследовательность действий в решении заданий для
получения максимального балла.Задание может содержать несколько
структурных частей/подвопросов.
Характеристика заданий суммативного оценивания за 4 четверть
|
раздел |
проверяемыецели |
уровеньмыслительныхнавыков |
количествозаданий |
№ заданий |
тип задания |
времявыполнения, мин |
балл |
балл зараздел |
|
8.4А Основные классы неорганических соединений. Генетическаясвязь |
8.3.4.7 – знать классификацию и свойства оксидов и составлять уравнения реакций характеризующиеих химические свойства |
Применение |
2 |
1 2 |
КО РО |
3 4 |
1 3 |
10 |
|
8.3.4.8 – знать и понимать классификацию, свойства кислот и составлять уравнения реакций характеризующиеих химические свойства |
Применение |
2 |
3 8 |
КО |
4 |
1 2 |
||
|
8.3.4.9 – знать и понимать лассификацию, свойства оснований и составлять уравнения реакций характеризующиеих химические свойства |
Применение |
1 |
6 5 |
КО |
3 |
1 1 |
||
|
8.3.4.12 – исследовать генетическую связь между основными классами неорганических соединений |
Навыкивысокогопорядка |
1 |
9 |
РО |
4 |
1 |
||
|
8.4 В Углерод и егосоединения |
8.4.3.1 –объяснять, почему в большинстве соединений углерод образует четыре связи |
Применение |
1 |
4 |
КО |
2 |
1 |
8 |
|
8.4.3.3 – сравнивать строение и свойства аллотропных видоизменений углерода |
Знание и понимание |
2 |
12 15 |
КО РО |
4 2 |
1 2 |
||
|
8.4.3.6 – описывать условия образования диоксида и монооксида углерода присжигании глерода и объяснять физиологические действия угарного газа наживые организмы |
Применение |
1 |
13 |
КО |
3 |
2 |
||
|
8.4.3.7 – уметь получать углекислый газ, доказывать его наличие и изучать свойства |
Применение |
1 |
14 |
РО |
3 |
2 |
||
|
8.4.С Вода |
8.4.2.8 – определить опасность и причины загрязнения воды, объяснить способы очистки воды |
Применение |
1 |
10 |
КО РО |
3 |
3 |
7 |
|
|
8.4.2.9 – определить жесткость воды и объяснить способые устранения |
применение |
3 |
11 |
РКО |
5 |
4 |
|
|
|
Всего баллов |
|
|
|
|
|
|
25 |
Задания суммативного оценивания за 4 четверть по предмету «Химия»
1.Выпишите из предложенного перечня веществ формулы оксидов : HCI, Mn2O7 SO3,Ca(OH)2, FeO,Н2СО3, KOH, Р2О ,Li2O CO2, FeCl3, Fe2O3, H2 SO4, CrO3 Na2O, CO, ВеО, Al2O3, ZnO
-
Оксиды
Кислотные
Основные
Амфотерные
[1]
2. Закончите уравнения возможных реакций:
Na2O + Н2О ----
ZnO + H2O ------- [3]
CaO+CO2 ----
NaOH + SO3 -----
CuO + H2SO4 ------
3.Вставтье пропущенные формулы веществ в предложенных уравнениях реакций:
Ca+ ...... ------ CaO
.........+BaO..------СaSO4 + ........
NaOH +....... ------- Na2СО3 + ............
CaСl2 + ........ --------Ca(NO3)2 + .......... [1]
4. Вычислитем количество вещества угекислого газа объемом 112л(н.у) :
А) 5моль
Б) 12моль
В) 11,5моль
Г) 12,5 моль[1]
Д) 11моль
5. Запишите уравнение реакций нейтрализации между гидроксидом натрия и серной кислотой.
_____________________________________________________________[1]
6. Составьте генетический ряд металла, используя следующие формулы веществ.
BaO, C, Ba, Ba(OH)2, CO2, H2CO3, MgO, Mg(OH)2, BаСO3
_____________________________________________________________[1]
7.Приведите примеры уравнений реакций получения солей:
|
реагенты |
Уравнения химических реакций |
|
Металл + неметалл |
|
|
Основной оксид + кислота |
|
|
Кислотный оксид + щелочь |
|
8. Запишите название и формулу соли, которая получится в результате взаймодействия соответствующих кислот и оснований
-
Азотная кислота
Соляная кислота
Серная кислота
Гидроксид лития
Гидроксид меди
[2]
9. Установите соответствие между реагентами и продуктами реакций
|
1.Cu(OH)2 → |
KCl+Fe(OH)2 |
|
2.NaOH+SO3→ |
MgCl2+H2O |
|
3.KOH+FeCl2 → |
CuO+H2O |
|
4.Mg(OH)2+HCl→ |
Na2SO4+ H2O |
[1]
10. Определите по рисунку вид загрязнения воды и способее очистки:
10 а.
|
рисунок |
Видзагрязнения |
Способыочистки |
|
|
|
|
http://www.vedcmalang.com/pppptkboemlg/images/gbartikeldep30/harytarno/
10 б.
-
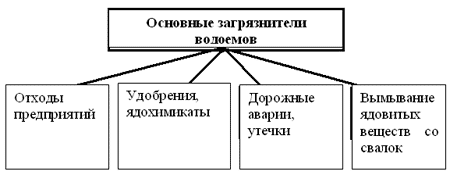
Основные загрязнители водоемов
![]()
![]()
![]()
![]()
[3]
11.Установите соответствие основных характеристик жесткости воды
|
Вид жесткости |
Формула соли |
Способы устранения |
|
Временная жесткость Посоянная жесткость |
1.Ca(HCO3)2 2. Na2CO3 3.MgSO4 4.Сa(HCO3 ) |
А. Кипячение В. Действие соды(Na2CO3) С. Действие известкового молока Ca( OH)2 |
1.Временная жесткость…................................................................
2. Постоянная жесткость..................................................................
[2]
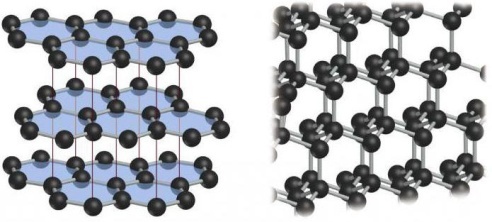
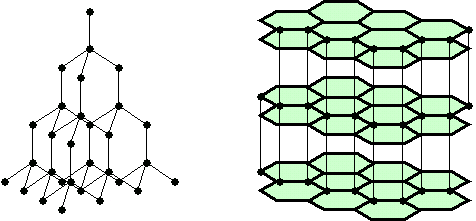
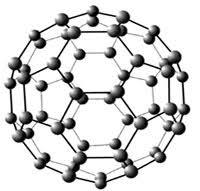
12.Из данных видоизменений углерода выберите форму кристаллической решётки фуллерена:
![]() а) б) в)
г) [1]
а) б) в)
г) [1]
http://ru.solverbook.com/spravochnik/formuly-po-ximii/formula-ugleroda/
13. Докажите валентные возможности атома углерода, используя электронную формулу: ..........................................................................................................................[2]
14. а) По рисунку опишите процесс получения углекислого газа в лаборатории
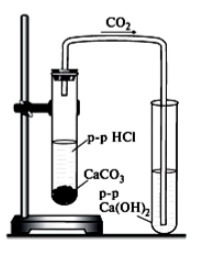
https://www.yaklass.ru/p/himija/89-klass/metody-issledovaniia-v-khimii-232923
..................................................................................................................................................................................................................................................................................
14 б)занапишите уравнения химических реакции, протекающих при получении и качественном определении углекислого газа в лаборатории.
……………………………………………………………………………………………………………………………………………………………………………………
[2]
15.По предложенному рисунку опишите один из факторов вредного воздействия на организм человека

http://otravleniya.info/gazami/otravlenie-uglekislym-gazom.html
......................................................................................................................................
....................................................................................................................................[2]
Схема выставления баллов
|
№ |
Ответ |
балл |
Дополнительная информация |
|||||||||
|
1 |
|
1 |
|
|||||||||
|
2 |
Na2O + Н2О = NaOH ZnO + H2O ≠ CaO+CO2 = CaCO3 2NaOH + SO3 = Na2SO4+H2O CuO + H2SO4 = CuSO4+H2O |
3 |
|
|||||||||
|
3 |
2Ca+ O2= 2CaO H2SO4 +BaO..=BaSO4 +H2O 2NaOH +H2CO3= Na2СО3 +2H2O CaСl2 +2 HNO3= Ca(NO3)2 + 2HCL
|
1 |
|
|||||||||
|
4 |
5моль |
1 |
|
|||||||||
|
5 |
NaOH+H2SO4→Na2SO4 |
1 |
|
|||||||||
|
6 |
Ba→BaO → Ba(OH)2→ BaCO3
|
1 |
|
|||||||||
|
7 |
2Na+Cl2 →2NaCl CaO+H2SO4→CaSO4+H2O SO3+ 2KOH→K2SO4+H2O |
3 |
|
|||||||||
|
8 |
Cu(OH)2+ 2HNO3→Cu(NO3)2+2H2O Cu(OH)2+2HCL→CuCL2+2H2O Cu(OH)2+H2SO4→CuSO4+2H2O LiOH+HNO3→LiNO3+H2O LiOH+HCL→LiCL+H2O 2LiOH+H2SO4→Li2SO4+2H2O
|
2 |
|
|||||||||
|
9 |
|
1 |
|
|||||||||
|
10 |
|
3 |
|
|||||||||
|
11 |
Ca(OH)2→CaCO3↓+H2O+CO2 Mg(HCO3)2+Na2CO3=MgCO3↓+NaHCO3 |
4 |
|
|||||||||
|
12 |
Ответ: г) |
1 |
|
|||||||||
|
13 |
|
2 |
|
|||||||||
|
14 |
CaCO3 + 2HCl = CaCl2 + H2O + CO2 CO2 + Ca(OH)2 = CaCO3 + H2O |
3 |
|
|||||||||
|
15 |
|
1 |
|
|||||||||
|
|
|
|
|
|||||||||
жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
БЖБ және ТЖБ
БЖБ және ТЖБ
Шукирова Мадина НурмаханбетовнаПортфолиослушателяРаздел А и В
Филиал ЧУ «ЦПМпертиза» г Тараз Курсы «Разработка и экспертиза заданий
дляоценивания»
Раздел А
Задания по суммативному оцениванию за IVчетверть
Суммативное оценивание за раздел 8.4С «Вода»
Цель обучения:
8.4.2.6Объяснять широкое распространение, уникальные свойства воды и ее значение для жизни
8.4.2.7Объяснять круговорот воды в природе
8.4.2.9Определять жесткость воды и объяснять
способы ее
устранения
Критерии оценивания:
Обучающийся
-
Описывает физические свойства воды;
-
Определяет строение молекулы и свойства воды;
-
Характеризует виды жесткости воды и способы ее устранения;
-
Описывает процесс очистки воды;
-
Описывает круговорот воды в природе.
Уровень мыслительных навыков: знание,понимание иприменение
Время выполнения: 20 минут
Задания
-
Вставьтепропущенныеслова в данныепредложения:
Вода является универсальным ........................................
Агрегатные состояние воды: ............................................
Температура кипения воды ..............................................
Температура замерзания воды ..........................................
Плотность воды ..................................................................
Природная вода всегда содержит .....................................
-
Укажите истинные и ложные утверждения:
|
Утверждения |
Правда |
Ложь |
|
Молекула водынелинейная |
|
|
|
Человекна 70%состоитводы |
|
|
|
CuSO4* 5 H2Oизвестныйподназваниеммедный купорос имеетголубойцвет |
|
|
|
Вода не взаимодействует с активнымиметаллами иихоксидами |
|
|
|
Содержаниеводы в костяхдостигает 31% |
|
|
-
Заполните таблицу «Виды жесткост и воды»:
|
Виды жеcткости |
Способы устранения (уравнения реакций) |
|
Временная(карбонатная)жесткостьводыобусловленаналичием в ней. __________________________ |
_________________________________________________ |
|
Постояннаяжесткостьводыобусловленаналичием в ней
__________________________ |
_________________________________________________ |
4![]()
![]() . а
)Укажите этапы
водоочистки
. а
)Укажите этапы
водоочистки
![]()
![]()
![]()
б )Укажите формулу вещества, используемого для дезинфекции воды
А) Cl2
Б) I2
В) F2
С) P
5. В схеме круговорота воды в природе заполните пробелы

![]()
![]()
![]() https://infourok.ru/prezentaciya-k-otkritomu-uroku-krugovorot-vodi-v-prirode-1721776.html
https://infourok.ru/prezentaciya-k-otkritomu-uroku-krugovorot-vodi-v-prirode-1721776.html
|
Критерии оценивания |
№ |
Дескрипторы |
Баллы |
|
Обучающийся |
|
|
|
|
Описывает физические свойства воды |
1 |
Правильно указывает агрегатные состояния воды Правильно записывает температуры кипения и замерзания Описывает особенности воды |
1 1 1 |
|
Определяет строение молекулы и свойства воды |
1 |
Верно определяет истинные и ложные утверждения, характеризующие свойства воды |
2 |
|
Характеризует виды жесткости воды и способы ее устранения |
1 |
Записывает уравнение реакции разложения гидрокарбоната кипячением воды Записывает уравнение реакции действия соды на гидрокарбонат Записывает уравнение реакции действия известкового молока Записывает уравнение реакции действия соды на сульфат |
1 1 1 1 |
|
Описывает процесс очистки воды |
2 |
Правильно записывает этапы очистки воды Выбирает формулу вещества, используемого для дезинфекции воды |
1 1 |
|
Описывает круговорот воды в природе |
1 |
Записывает этап испарения воды Записывает этап образования облаков |
1 1 |
|
Всего баллов |
13 |
|
|
Раздел В
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 4 ЧЕТВЕРТЬ
Обзор суммативного оценивания за 4
четверть
Продолжительность - 40 минут
Количество баллов
–25
Типы заданий:
МВО –
задания с множественным выбором ответов;
КО– задания, требующие краткого
ответа;
РО – задания, требующие развернутого
ответа.
Структура суммативного оценивания
Данный вариант состоит из 15 заданий,
включающих задания с множественнымвыбором ответов, с кратким и
развёрнутым ответами.
В вопросах, требующих краткого ответа, обучающийся записывает ответ
в виде
численного значения, слова или короткого предложения.
В вопросах, требующих развёрнутого ответа, обучающийся должен
показать всюпоследовательность действий в решении заданий для
получения максимального балла.Задание может содержать несколько
структурных частей/подвопросов.
Характеристика заданий суммативного оценивания за 4 четверть
|
раздел |
проверяемыецели |
уровеньмыслительныхнавыков |
количествозаданий |
№ заданий |
тип задания |
времявыполнения, мин |
балл |
балл зараздел |
|
8.4А Основные классы неорганических соединений. Генетическаясвязь |
8.3.4.7 – знать классификацию и свойства оксидов и составлять уравнения реакций характеризующиеих химические свойства |
Применение |
2 |
1 2 |
КО РО |
3 4 |
1 3 |
10 |
|
8.3.4.8 – знать и понимать классификацию, свойства кислот и составлять уравнения реакций характеризующиеих химические свойства |
Применение |
2 |
3 8 |
КО |
4 |
1 2 |
||
|
8.3.4.9 – знать и понимать лассификацию, свойства оснований и составлять уравнения реакций характеризующиеих химические свойства |
Применение |
1 |
6 5 |
КО |
3 |
1 1 |
||
|
8.3.4.12 – исследовать генетическую связь между основными классами неорганических соединений |
Навыкивысокогопорядка |
1 |
9 |
РО |
4 |
1 |
||
|
8.4 В Углерод и егосоединения |
8.4.3.1 –объяснять, почему в большинстве соединений углерод образует четыре связи |
Применение |
1 |
4 |
КО |
2 |
1 |
8 |
|
8.4.3.3 – сравнивать строение и свойства аллотропных видоизменений углерода |
Знание и понимание |
2 |
12 15 |
КО РО |
4 2 |
1 2 |
||
|
8.4.3.6 – описывать условия образования диоксида и монооксида углерода присжигании глерода и объяснять физиологические действия угарного газа наживые организмы |
Применение |
1 |
13 |
КО |
3 |
2 |
||
|
8.4.3.7 – уметь получать углекислый газ, доказывать его наличие и изучать свойства |
Применение |
1 |
14 |
РО |
3 |
2 |
||
|
8.4.С Вода |
8.4.2.8 – определить опасность и причины загрязнения воды, объяснить способы очистки воды |
Применение |
1 |
10 |
КО РО |
3 |
3 |
7 |
|
|
8.4.2.9 – определить жесткость воды и объяснить способые устранения |
применение |
3 |
11 |
РКО |
5 |
4 |
|
|
|
Всего баллов |
|
|
|
|
|
|
25 |
Задания суммативного оценивания за 4 четверть по предмету «Химия»
1.Выпишите из предложенного перечня веществ формулы оксидов : HCI, Mn2O7 SO3,Ca(OH)2, FeO,Н2СО3, KOH, Р2О ,Li2O CO2, FeCl3, Fe2O3, H2 SO4, CrO3 Na2O, CO, ВеО, Al2O3, ZnO
-
Оксиды
Кислотные
Основные
Амфотерные
[1]
2. Закончите уравнения возможных реакций:
Na2O + Н2О ----
ZnO + H2O ------- [3]
CaO+CO2 ----
NaOH + SO3 -----
CuO + H2SO4 ------
3.Вставтье пропущенные формулы веществ в предложенных уравнениях реакций:
Ca+ ...... ------ CaO
.........+BaO..------СaSO4 + ........
NaOH +....... ------- Na2СО3 + ............
CaСl2 + ........ --------Ca(NO3)2 + .......... [1]
4. Вычислитем количество вещества угекислого газа объемом 112л(н.у) :
А) 5моль
Б) 12моль
В) 11,5моль
Г) 12,5 моль[1]
Д) 11моль
5. Запишите уравнение реакций нейтрализации между гидроксидом натрия и серной кислотой.
_____________________________________________________________[1]
6. Составьте генетический ряд металла, используя следующие формулы веществ.
BaO, C, Ba, Ba(OH)2, CO2, H2CO3, MgO, Mg(OH)2, BаСO3
_____________________________________________________________[1]
7.Приведите примеры уравнений реакций получения солей:
|
реагенты |
Уравнения химических реакций |
|
Металл + неметалл |
|
|
Основной оксид + кислота |
|
|
Кислотный оксид + щелочь |
|
8. Запишите название и формулу соли, которая получится в результате взаймодействия соответствующих кислот и оснований
-
Азотная кислота
Соляная кислота
Серная кислота
Гидроксид лития
Гидроксид меди
[2]
9. Установите соответствие между реагентами и продуктами реакций
|
1.Cu(OH)2 → |
KCl+Fe(OH)2 |
|
2.NaOH+SO3→ |
MgCl2+H2O |
|
3.KOH+FeCl2 → |
CuO+H2O |
|
4.Mg(OH)2+HCl→ |
Na2SO4+ H2O |
[1]
10. Определите по рисунку вид загрязнения воды и способее очистки:
10 а.
|
рисунок |
Видзагрязнения |
Способыочистки |
|
|
|
|
http://www.vedcmalang.com/pppptkboemlg/images/gbartikeldep30/harytarno/
10 б.
-
Основные загрязнители водоемов
![]()
![]()
![]()
![]()
[3]
11.Установите соответствие основных характеристик жесткости воды
|
Вид жесткости |
Формула соли |
Способы устранения |
|
Временная жесткость Посоянная жесткость |
1.Ca(HCO3)2 2. Na2CO3 3.MgSO4 4.Сa(HCO3 ) |
А. Кипячение В. Действие соды(Na2CO3) С. Действие известкового молока Ca( OH)2 |
1.Временная жесткость…................................................................
2. Постоянная жесткость..................................................................
[2]
12.Из данных видоизменений углерода выберите форму кристаллической решётки фуллерена:



![]() а) б) в)
г) [1]
а) б) в)
г) [1]
http://ru.solverbook.com/spravochnik/formuly-po-ximii/formula-ugleroda/
13. Докажите валентные возможности атома углерода, используя электронную формулу: ..........................................................................................................................[2]
14. а) По рисунку опишите процесс получения углекислого газа в лаборатории

https://www.yaklass.ru/p/himija/89-klass/metody-issledovaniia-v-khimii-232923
..................................................................................................................................................................................................................................................................................
14 б)занапишите уравнения химических реакции, протекающих при получении и качественном определении углекислого газа в лаборатории.
……………………………………………………………………………………………………………………………………………………………………………………
[2]
15.По предложенному рисунку опишите один из факторов вредного воздействия на организм человека

http://otravleniya.info/gazami/otravlenie-uglekislym-gazom.html
......................................................................................................................................
....................................................................................................................................[2]
Схема выставления баллов
|
№ |
Ответ |
балл |
Дополнительная информация |
|||||||||
|
1 |
|
1 |
|
|||||||||
|
2 |
Na2O + Н2О = NaOH ZnO + H2O ≠ CaO+CO2 = CaCO3 2NaOH + SO3 = Na2SO4+H2O CuO + H2SO4 = CuSO4+H2O |
3 |
|
|||||||||
|
3 |
2Ca+ O2= 2CaO H2SO4 +BaO..=BaSO4 +H2O 2NaOH +H2CO3= Na2СО3 +2H2O CaСl2 +2 HNO3= Ca(NO3)2 + 2HCL
|
1 |
|
|||||||||
|
4 |
5моль |
1 |
|
|||||||||
|
5 |
NaOH+H2SO4→Na2SO4 |
1 |
|
|||||||||
|
6 |
Ba→BaO → Ba(OH)2→ BaCO3
|
1 |
|
|||||||||
|
7 |
2Na+Cl2 →2NaCl CaO+H2SO4→CaSO4+H2O SO3+ 2KOH→K2SO4+H2O |
3 |
|
|||||||||
|
8 |
Cu(OH)2+ 2HNO3→Cu(NO3)2+2H2O Cu(OH)2+2HCL→CuCL2+2H2O Cu(OH)2+H2SO4→CuSO4+2H2O LiOH+HNO3→LiNO3+H2O LiOH+HCL→LiCL+H2O 2LiOH+H2SO4→Li2SO4+2H2O
|
2 |
|
|||||||||
|
9 |
|
1 |
|
|||||||||
|
10 |
|
3 |
|
|||||||||
|
11 |
Ca(OH)2→CaCO3↓+H2O+CO2 Mg(HCO3)2+Na2CO3=MgCO3↓+NaHCO3 |
4 |
|
|||||||||
|
12 |
Ответ: г) |
1 |
|
|||||||||
|
13 |
|
2 |
|
|||||||||
|
14 |
CaCO3 + 2HCl = CaCl2 + H2O + CO2 CO2 + Ca(OH)2 = CaCO3 + H2O |
3 |
|
|||||||||
|
15 |
|
1 |
|
|||||||||
|
|
|
|
|
|||||||||

шағым қалдыра аласыз