Пояснительная записка
Данная авторская программа "Эффективность PISA заданий в обучении химии" разработана для учащихся 8 класса с целью развития функциональной грамотности в области естественных наук, в частности химии, в соответствии с международными стандартами оценки PISA (Programme for International Student Assessment). Программа направлена на формирование у учащихся навыков применения химических знаний в реальных жизненных ситуациях, развитие критического мышления и способности анализировать комплексные проблемы.
Особенностью программы является ее практико-ориентированный характер, позволяющий связать теоретические знания по химии с повседневной жизнью и глобальными вызовами современности. Значительное внимание уделяется развитию умений интерпретировать научные данные, формулировать гипотезы и планировать исследования.
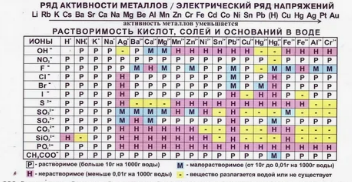
Программа предусматривает использование интерактивных методов обучения, включая работу с текстами научно-популярного характера, анализ графиков и диаграмм, проведение виртуальных экспериментов. Это способствует развитию критического мышления, навыков работы с информацией и умения применять знания в нестандартных ситуациях.
Структура курса выстроена с учетом основных содержательных линий PISA по естественнонаучной грамотности и включает темы, связанные с физическими системами, живыми системами, а также науками о Земле и Вселенной в контексте химических знаний. Особое внимание уделяется экологическим аспектам и вопросам устойчивого развития.
Программа направлена не только на подготовку к успешному выполнению заданий PISA, но и на формирование у учащихся целостной научной картины мира, развитие их исследовательских навыков и мотивации к изучению естественных наук.
Цель программы:
Развитие естественнонаучной грамотности учащихся 8 класса через формирование навыков решения практико-ориентированных заданий по химии в формате PISA, с акцентом на применение химических знаний в реальных жизненных ситуациях и развитие критического мышления.
Задачи программы:
1. Сформировать у учащихся понимание ключевых химических концепций и их связи с повседневной жизнью и глобальными проблемами.
2. Развить навыки анализа и интерпретации научных данных, представленных в различных форматах (текст, график, таблица, диаграмма).
3. Научить учащихся формулировать научные гипотезы и планировать эксперименты для их проверки.
4. Развить умение применять химические знания для объяснения природных явлений и технологических процессов.
5. Сформировать навыки критической оценки достоверности научной информации и аргументации своей позиции.
6. Развить способность решать междисциплинарные задачи, связанные с химическими аспектами экологии и устойчивого развития.
7. Сформировать умение работать с заданиями различных типов, характерных для формата PISA.
8. Развить мотивацию к изучению химии и понимание ее роли в решении глобальных проблем человечества.
Межпредметная связь:
- Физика: изучение физических свойств веществ, энергетических преобразований в химических реакциях.
- Биология: рассмотрение биохимических процессов, влияния химических веществ на живые организмы.
- Математика: анализ графиков и диаграмм, статистическая обработка данных химических экспериментов.
- Экология: рассмотрение влияния химических веществ на окружающую среду, проблемы загрязнения и очистки.
Методы, используемые на уроке:
1. Анализ комплексных текстов научно-популярного характера.
2. Работа с графиками, диаграммами и таблицами данных.
3. Проведение виртуальных лабораторных экспериментов.
4. Групповые дискуссии и дебаты по проблемным вопросам.
5. Метод кейсов: анализ реальных ситуаций, связанных с применением химических знаний.
8. Использование онлайн-симуляторов для моделирования химических процессов.
Критерии, которые должны знать ученики:
1. Понимание основных химических концепций и их применение в реальных ситуациях.
2. Умение интерпретировать научные данные, представленные в различных форматах.
3. Навыки формулирования научных вопросов и гипотез.
4. Способность планировать и оценивать научные исследования.
5. Умение делать выводы на основе имеющихся данных и аргументировать свою позицию.
6. Понимание взаимосвязи между химическими, биологическими и физическими процессами.
7. Навыки критического анализа достоверности научной информации.
8. Умение применять химические знания для решения экологических проблем.
Направление авторской программы:
Программа направлена на развитие функциональной естественнонаучной грамотности учащихся 8 класса через решение практико-ориентированных заданий по химии в формате PISA. Особое внимание уделяется формированию навыков применения химических знаний в реальных жизненных ситуациях, развитию критического мышления и способности анализировать комплексные проблемы на стыке различных научных дисциплин.
Новизна авторской программы:
Новизна программы заключается в интеграции содержания школьного курса химии 8 класса с форматом заданий PISA и актуальными проблемами современности.
Актуальность авторской программы:
Актуальность программы обусловлена необходимостью повышения уровня естественнонаучной грамотности учащихся в соответствии с международными стандартами PISA. Программа отвечает на вызовы современного образования, связанные с подготовкой учащихся к жизни в быстро меняющемся мире, где критическое мышление и способность применять научные знания для решения реальных проблем становятся ключевыми компетенциями. Особое внимание уделяется экологическим аспектам химии и вопросам устойчивого развития, что соответствует глобальной повестке и формирует у учащихся ответственное отношение к окружающей среде.
Ожидаемые результаты:
1. Учащиеся демонстрируют понимание ключевых химических концепций и способны применять их для объяснения явлений повседневной жизни.
2. Учащиеся успешно анализируют и интерпретируют научные данные, представленные в виде текстов, графиков, таблиц и диаграмм.
3. Учащиеся умеют формулировать научные вопросы и гипотезы, а также предлагать методы их проверки.
4. Учащиеся способны планировать и оценивать простые научные исследования, учитывая факторы достоверности и погрешности.
5. Учащиеся демонстрируют навыки критического мышления при оценке научной информации из различных источников.
6. Учащиеся умеют применять химические знания для анализа и решения экологических проблем на локальном и глобальном уровнях.
7. Учащиеся успешно решают междисциплинарные задачи, связывая знания из области химии, физики, биологии и географии.
8. Учащиеся проявляют повышенный интерес к изучению химии и понимание ее роли в современном мире и будущей профессиональной деятельности.
Инновационные педагогические особенности: Актуальность данного опыта связана с необходимостью развития функциональной грамотности учащихся в соответствии с современными требованиями образования. Обучение химии через задания в формате PISA позволяет развивать практические навыки, критическое мышление и способность применять полученные знания в жизни.
Научно-методический уровень содержания: Программа основана на современных научных представлениях и учитывает возрастные особенности учащихся 8 класса. Обеспечена гармоничная интеграция теоретических знаний и практических навыков, что способствует более эффективному усвоению материала.
Степень новизны содержания: Программа включает актуальные экологические проблемы, современные технологические примеры и последние достижения в области химии. Используется инновационный подход к представлению традиционного материала, что делает обучение более интересным и актуальным для учащихся.
Научность содержания: Корректно используется химическая терминология, точно описываются химические процессы. Материал представлен в логической последовательности в соответствии с современной научной картиной мира, что обеспечивает системное понимание предмета.
Исследование PISA и компоненты функциональной грамотности: Программа направлена на развитие естественнонаучной грамотности, критического мышления и формирование способности применять знания в реальных ситуациях. Особое внимание уделяется развитию аналитических навыков и умению интерпретировать научные данные.
Практическая значимость: Программа имеет тесную связь с повседневной жизнью учащихся, направлена на развитие навыков проведения химических экспериментов, формирование экологического мышления и подготовку к решению практических жизненных задач. Особый акцент делается на применении полученных знаний в реальных ситуациях.
Содержательный раздел
Раздел 1: Химия в повседневной жизни
-
Химические вещества вокруг нас: от кухни до космоса
-
Вода и ее уникальные свойства
-
Кислоты и основания в быту
-
Химия пищи: питательные вещества и добавки
-
Лекарства и их воздействие на организм
-
Косметические средства: состав и безопасность
-
Бытовая химия: эффективность и экологичность
Раздел 2: Химия и окружающая среда
-
Воздух: состав, загрязнение и очистка
-
Парниковый эффект и изменение климата
-
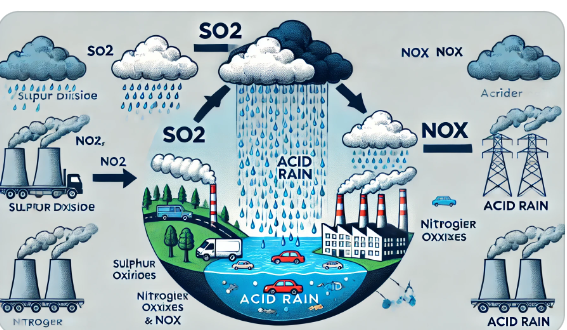
Кислотные дожди: причины и последствия
-
Пластиковое загрязнение: проблемы и решения
-
Тяжелые металлы в окружающей среде
-
Химические удобрения: польза и вред
-
Альтернативные источники энергии и химия
Раздел 3: Основные классы химических соединении
-
Оксиды и их свойства
-
Свойства кислот
-
Щелочи
-
Соли. Образование ионных связей
-
Амфотерные соединения и их свойства
-
Практические задании на основные классы неорганических соединении
-
Лабораторные работы
Раздел 4: Химия и технологии
-
Нанотехнологии в повседневной жизни
-
Современные материалы: от керамики до графена
-
Химия в сельском хозяйстве: повышение урожайности
-
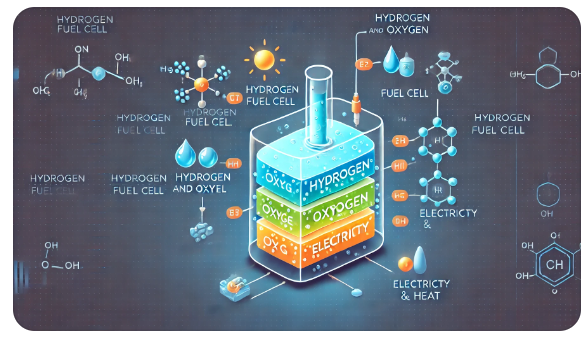
Топливные элементы и водородная энергетика
-
3D-печать: химия новой эры производства
-
Химические источники света: от свечи до OLED
-
Химия в криминалистике: раскрытие преступлений
Раздел 5: Практические аспекты химии
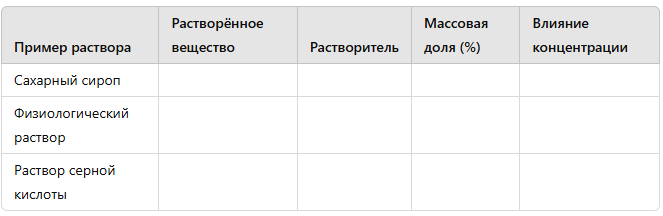
-
Растворы и их концентрация
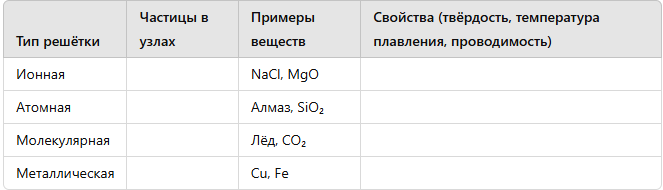
-
Кристаллы и кристаллические решетки
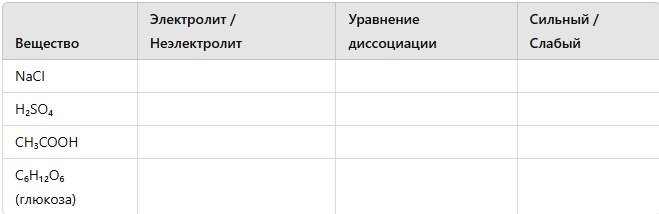
-
Электролитическая диссоциация
-
Окислительно-восстановительные реакции в природе и технике
-
Скорость химических реакций и факторы, влияющие на нее
-
Химическое равновесие и принцип Ле Шателье
Нормативный раздел
|
Р/c |
Раздел Отделение Тема |
Цель обучения |
Количество часов |
Учебный результат |
||
|
Всего |
Теория |
Практика |
||||
|
Раздел 1: Химия в повседневной жизни |
||||||
|
1. |
Химические вещества вокруг нас: от кухни до космоса |
Ознакомить учащихся с разнообразием химических веществ в повседневной жизни и их свойствами. |
1 |
|
1 |
Учащиеся умеют идентифицировать химические вещества в бытовых предметах и объяснять их свойства. |
|
2. |
Вода и ее уникальные свойства |
Изучить особые свойства воды и их значение для жизни на Земле. |
1 |
|
1 |
Учащиеся могут объяснить аномальные свойства воды и их роль в природных процессах. |
|
3. |
Кислоты и основания в быту |
Познакомить с кислотами и основаниями, встречающимися в повседневной жизни. |
1 |
|
1 |
Учащиеся умеют определять кислоты и основания в бытовых веществах и объяснять их действие. |
|
4. |
Химия пищи: питательные вещества и добавки |
Рассмотреть химический состав пищевых продуктов и роль пищевых добавок. |
1 |
|
1 |
Учащиеся способны анализировать состав продуктов питания и оценивать влияние пищевых добавок на организм. |
|
5. |
Лекарства и их воздействие на организм |
Изучить химические основы действия лекарственных препаратов. |
1 |
|
1 |
Учащиеся понимают механизмы действия основных групп лекарств и могут объяснить их эффекты. |
|
6. |
Косметические средства: состав и безопасность |
Рассмотреть химический состав косметических средств и вопросы их безопасности. |
1 |
|
1 |
Учащиеся умеют анализировать состав косметических средств и оценивать их потенциальное влияние на здоровье. |
|
7. |
Бытовая химия: эффективность и экологичность |
Изучить химический состав бытовых чистящих средств и их влияние на окружающую среду. |
1 |
|
1 |
Учащиеся способны выбирать эффективные и экологичные бытовые химические средства. |
|
Раздел 2: Химия и окружающая среда |
||||||
|
8. |
Воздух: состав, загрязнение и очистка |
Изучить состав воздуха, источники его загрязнения и методы очистки. |
1 |
|
1 |
Учащиеся умеют анализировать данные о загрязнении воздуха и предлагать методы его очистки. |
|
9. |
Парниковый эффект и изменение климата |
Рассмотреть химические аспекты парникового эффекта и его влияние на климат. |
1 |
|
1 |
Учащиеся могут объяснить механизм парникового эффекта и предложить меры по снижению выбросов парниковых газов. |
|
10. |
Кислотные дожди: причины и последствия |
Изучить химические процессы образования кислотных дождей и их воздействие на окружающую среду. |
1 |
|
1 |
Учащиеся умеют объяснять причины образования кислотных дождей и оценивать их последствия для экосистем. |
|
11. |
Пластиковое загрязнение: проблемы и решения |
Рассмотреть химические свойства пластиков и проблемы их утилизации. |
1 |
|
1 |
Учащиеся способны предложить решения проблемы пластикового загрязнения на основе химических знаний. |
|
12. |
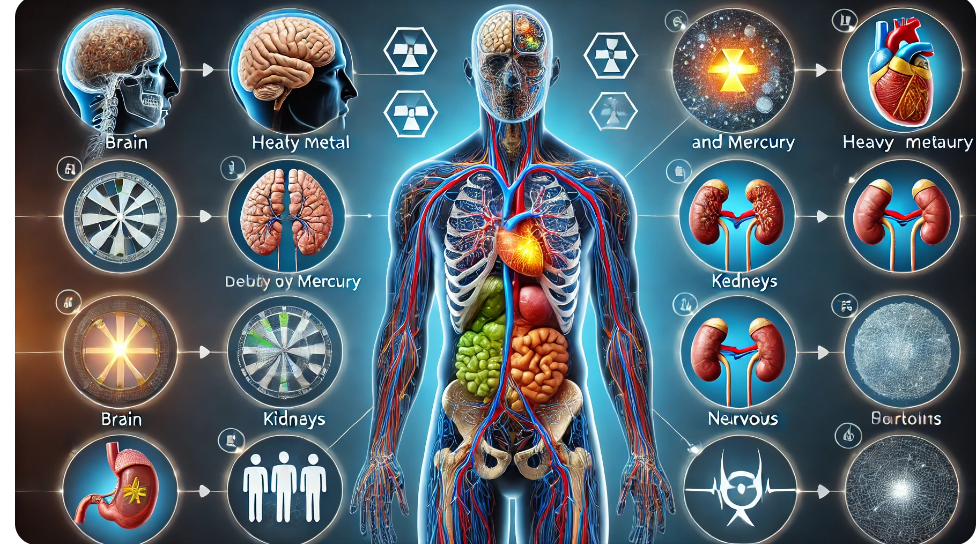
Тяжелые металлы в окружающей среде |
Изучить источники поступления тяжелых металлов в окружающую среду и их влияние на живые организмы. |
1 |
|
1 |
Учащиеся умеют оценивать риски, связанные с загрязнением тяжелыми металлами, и предлагать методы очистки. |
|
13. |
Химические удобрения: польза и вред |
Рассмотреть химический состав удобрений, их влияние на урожайность и экологические последствия их применения. |
1 |
|
1 |
Учащиеся способны анализировать преимущества и недостатки использования химических удобрений. |
|
14. |
Альтернативные источники энергии и химия |
Изучить химические аспекты различных альтернативных источников энергии. |
1 |
|
1 |
Учащиеся умеют сравнивать различные источники энергии с точки зрения их химических свойств и экологичности. |
|
Раздел 3: Основные классы химических соединении |
||||||
|
15. |
Оксиды и их свойства |
Изучить классификацию оксидов, их физические и химические свойства. |
1 |
|
1 |
Учащиеся смогут классифицировать оксиды и описывать их основные химические свойства. |
|
16. |
Свойства кислот |
Исследовать химические свойства кислот и их взаимодействие с различными веществами. |
1 |
|
1 |
Учащиеся смогут объяснить основные свойства кислот и записывать уравнения их химических реакций. |
|
17. |
Щелочи |
Изучить химические свойства щелочей и их применение в повседневной жизни. |
1 |
|
1 |
Учащиеся смогут характеризовать щелочи и описывать их взаимодействие с другими веществами. |
|
18. |
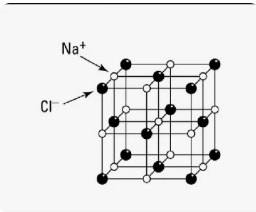
Соли. Образование ионных связей |
Исследовать механизм образования ионных связей и способы получения солей. |
1 |
|
1 |
Учащиеся смогут объяснить процесс образования ионных связей и различные способы получения солей. |
|
19. |
Амфотерные соединения и их свойства |
Изучить особенности амфотерных соединений и их двойственную природу. |
1 |
|
1 |
Учащиеся смогут определять амфотерные соединения и объяснять их способность проявлять кислотные и основные свойства. |
|
20. |
Практические задании на основные классы неорганических соединении |
Закрепить знания о химических свойствах основных классов неорганических соединений через решение практических задач. |
1 |
|
1 |
Учащиеся смогут решать расчетные задачи, составлять уравнения реакций и определять продукты химических превращений для основных классов неорганических соединений. |
|
21. |
Лабораторные работы |
Сформировать практические навыки работы с различными классами неорганических веществ в лабораторных условиях. |
1 |
|
1 |
Учащиеся освоят технику безопасности, научатся проводить химические эксперименты, наблюдать и описывать их результаты, делать выводы на основе наблюдений. |
|
Раздел 4: Химия и технологии |
||||||
|
22. |
Нанотехнологии в повседневной жизни |
Ознакомить с принципами нанотехнологий и их применением в повседневной жизни. |
1 |
|
1 |
Учащиеся могут привести примеры использования нанотехнологий в быту и объяснить их преимущества. |
|
23. |
Современные материалы: от керамики до графена |
Изучить химические свойства и применение современных материалов. |
1 |
1 |
|
Учащиеся умеют сравнивать свойства различных современных материалов и объяснять их применение. |
|
24. |
Химия в сельском хозяйстве: повышение урожайности |
Рассмотреть химические методы повышения урожайности в сельском хозяйстве. |
1 |
|
1 |
Учащиеся способны оценивать эффективность и экологичность различных химических методов в сельском хозяйстве. |
|
25. |
Топливные элементы и водородная энергетика |
Изучить принципы работы топливных элементов и перспективы водородной энергетики. |
1 |
|
1 |
Учащиеся умеют объяснять химические процессы в топливных элементах и оценивать перспективы водородной энергетики |
|
26. |
3D-печать: химия новой эры производства |
Рассмотреть химические аспекты технологии 3D-печати. |
1 |
1 |
|
Учащиеся могут объяснить химические принципы 3D-печати и ее применение в различных областях. |
|
27. |
Химические источники света: от свечи до OLED |
Изучить химические процессы, лежащие в основе различных источников света. |
1 |
1 |
|
Учащиеся умеют сравнивать различные источники света с точки зрения их химического принципа действия и эффективности. |
|
28. |
Химия в криминалистике: раскрытие преступлений |
Ознакомить с химическими методами, используемыми в криминалистике. |
1 |
1 |
|
Учащиеся способны объяснить принципы основных химических методов, применяемых в криминалистике. |
|
Раздел 5: Практические аспекты химии |
||||||
|
29. |
Растворы и их концентрация |
Изучить способы выражения концентрации растворов и их практическое применение. |
1 |
1 |
|
Учащиеся умеют рассчитывать концентрации растворов и готовить растворы заданной концентрации. |
|
30. |
Кристаллы и кристаллические решетки |
Рассмотреть типы кристаллических решеток и их влияние на свойства веществ. |
1 |
1 |
|
Учащиеся способны определять тип кристаллической решетки вещества и предсказывать его свойства. |
|
31. |
Электролитическая диссоциация |
Изучить процесс электролитической диссоциации и его роль в химических реакциях. |
1 |
1 |
|
Учащиеся умеют составлять уравнения диссоциации и объяснять свойства электролитов. |
|
32. |
Окислительно-восстановительные реакции в природе и технике |
Рассмотреть механизмы окислительно-восстановительных реакций и их значение. |
1 |
|
1 |
Учащиеся могут определять окислитель и восстановитель в реакциях и приводить примеры ОВР в природе и технике. |
|
33. |
Скорость химических реакций и факторы, влияющие на нее |
Изучить понятие скорости химической реакции и факторы, влияющие на нее. |
1 |
|
1 |
Учащиеся умеют объяснять влияние различных факторов на скорость химических реакций и применять эти знания на практике. |
|
34. |
Химическое равновесие и принцип Ле Шателье |
Рассмотреть понятие химического равновесия и принцип Ле Шателье. |
1 |
1 |
|
Учащиеся способны предсказывать смещение химического равновесия при изменении условий реакции. |
|
Всего 34 часов |
||||||
Информационно-методический раздел
Целевая аудитория и предназначение
Авторская программа "Эффективность PISA заданий в обучении химии" создана для учеников 8 класса. Она направлена на развитие навыков применения химических знаний в повседневных ситуациях, что соответствует формату заданий PISA. Программа способствует формированию естественнонаучной грамотности и критического мышления.
Оценка успехов учащихся
При оценке достижений учеников особое внимание уделяется:
-
Умению связывать химические концепции с реальными жизненными ситуациями
-
Способности анализировать и интерпретировать данные экспериментов
-
Навыкам формулирования выводов на основе научных фактов
-
Умению объяснять химические явления простым и понятным языком
Современные методы обучения
-
Метод кейсов: решение реальных проблем, связанных с химией в повседневной жизни
-
Игровое обучение: использование химических викторин и настольных игр для закрепления знаний
-
Проектное обучение: выполнение мини-исследований по актуальным экологическим проблемам
Подходы к решению PISA заданий
-
Внимательное чтение и анализ контекста задания
-
Выделение ключевой информации из текста, графиков и таблиц
-
Применение базовых химических знаний для объяснения наблюдаемых явлений
-
Формулирование аргументированных ответов с использованием научной терминологии
Учебные материалы
-
Сборник PISA-подобных заданий по химии с пошаговыми решениями
-
Виртуальная лаборатория для проведения безопасных химических экспериментов
-
Интерактивные карты и схемы для визуализации химических процессов в природе
-
Онлайн-форум для обсуждения сложных вопросов и обмена идеями между учениками
Критерии оценивания
1-2 балла (Начальный уровень): Ученик демонстрирует базовое знакомство с химическими понятиями. Может узнавать простейшие химические формулы и названия веществ. Затрудняется в интерпретации данных из текста задания PISA и не может применить знания в контексте реальных ситуаций.
3-4 балла (Элементарный уровень): Учащийся понимает основные химические концепции. Способен извлекать простую информацию из текста и графиков PISA заданий. Может дать краткие ответы на вопросы, но испытывает трудности с аргументацией своей позиции.
5-6 баллов (Базовый уровень): Ученик демонстрирует твердое знание ключевых тем по химии. Умеет анализировать несложные данные из PISA заданий и делать простые выводы. Способен применять знания в знакомых контекстах, но может испытывать трудности в новых ситуациях.
7-8 баллов (Продвинутый уровень): Учащийся показывает глубокое понимание химических процессов. Успешно анализирует комплексную информацию из PISA заданий, включая графики и таблицы. Способен применять знания в различных контекстах и предлагать обоснованные решения проблем.
9-10 баллов (Исследовательский уровень): Ученик демонстрирует исключительное понимание химии и ее роли в реальном мире. Способен критически анализировать сложные данные, выдвигать гипотезы и предлагать креативные решения в контексте PISA заданий. Умеет аргументированно объяснять химические явления, связывая их с глобальными проблемами.
Рекомендуемая литература
Для учителей:
-
Нурахметов Н.Н., Мансуров З.А., Рыскалиева Р.Г. "Химия: Учебник для 8 класса общеобразовательных школ" - Алматы: Мектеп, 2020.
-
OECD "PISA 2018 Assessment and Analytical Framework" - Paris: OECD Publishing, 2019.
-
Тюменева Ю.А., Александрова Е.И. "Естественнонаучная грамотность и ее оценка в международном исследовании PISA" - Москва: Институт образования НИУ ВШЭ, 2018.
-
Абылкасымова А.Е. "Формирование функциональной грамотности учащихся в контексте международных исследований" - Алматы: Қазақ университеті, 2019.
-
Ковалева Г.С., Пентин А.Ю., Никифоров Г.Г. "Естественнонаучная грамотность. Сборник эталонных заданий" - Москва: Просвещение, 2020.
Для учеников:
-
Нурахметов Н.Н., Мансуров З.А., Рыскалиева Р.Г. "Химия: Учебник для 8 класса общеобразовательных школ" - Алматы: Мектеп, 2020.
-
Аширов А.М. "Занимательная химия для школьников" - Алматы: Атамұра, 2019.
-
Әлімқұлова Р.Д. "Химия есептері мен жаттығулары: 8-9 сыныптар" - Алматы: Мектеп, 2021.
-
Темирбулатова А.Е. "Сборник задач по химии с решениями. 8-9 классы" - Астана: Арман-ПВ, 2020.
-
Габриелян О.С., Остроумов И.Г. "Химия в тестах, задачах и упражнениях. 8 класс" - Москва: Дрофа, 2019.
Для родителей:
-
Курамшин А.И. "Жизнь замечательных веществ" - Москва: АСТ, 2020.
-
Леенсон И.А. "Занимательная химия для детей и взрослых" - Москва: Аст-Пресс Книга, 2019.
-
Акимушкин И.И. "Невидимые нити природы" - Москва: АСТ, 2018.
-
Стрельникова Л.Н. "Из чего всё сделано? Рассказы о веществе" - Москва: Яуза, 2019.
-
Мансуров З.А. "Химия вокруг нас: занимательные опыты для школьников" - Алматы: Қазақ университеті, 2021.
Модель краткосрочного планирования
Урок №1
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Химические вещества вокруг нас: от кухни до космоса |
|||||
|
Цели обучения согласно программе |
Ознакомить учащихся с разнообразием химических веществ в повседневной жизни и их свойствами. |
|||||
|
Цель урока |
Учащиеся умеют идентифицировать химические вещества в бытовых предметах и объяснять их свойства. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: “Собери
открытку” Раздаёт фрагменты изображений бытовых предметов. Учащиеся собирают открытку и объединяются в группы. |
Формируют группы, собирая целое изображение. |
|
Картинки, разрезанные на части по количеству участников в группе. |
||
|
Середина урока 35 минут |
Контекст 1: Химические вещества на кухне Вы помогаете своей маме готовить пирог на кухне. Для теста она использует рецепт, в котором необходимо добавить соду (гидрокарбонат натрия) и уксус (раствор уксусной кислоты). Когда вы добавляете уксус к соде, вы замечаете, что смесь начинает пениться и выделять пузырьки. Вам стало интересно, что за процесс происходит и почему он сопровождается шипением и выделением газа. Вы захотели выяснить, что стоит за этой химической реакцией и какое вещество образуется. Задание: Опишите химическую реакцию, которая происходит при смешивании соды и уксуса. Объясните, почему выделяются пузырьки и какое вещество их образует. Приведите химическое уравнение этой реакции. Контекст 2: Вода как универсальный растворитель В школьной лаборатории вы проводите эксперимент по растворению разных веществ в воде. Вы заметили, что сахар и соль быстро растворяются в воде, а масло, наоборот, остаётся на поверхности. Ваш учитель объяснил, что вода называется "универсальным растворителем", но не все вещества в ней растворяются одинаково. Вы решили разобраться, почему вода растворяет некоторые вещества лучше, чем другие, и как это связано с её химическими свойствами. Задание: Объясните, почему вода способна растворять такие вещества, как сахар и соль, но не растворяет масло. Какие свойства воды делают её универсальным растворителем? Приведите примеры, как эти свойства воды используются в повседневной жизни. Контекст 3: Химические вещества в космосе Ситуация: Вы смотрите научную программу о космосе и узнаёте, что в атмосфере Марса содержится углекислый газ, а на других планетах, таких как Юпитер и Сатурн, присутствуют гелий и водород. Вас заинтересовало, как эти химические вещества влияют на условия жизни на планетах и почему атмосферы этих планет так сильно отличаются от земной. Задание: Объясните, почему атмосфера Земли отличается по составу от атмосфер Марса и Юпитера. Как химический состав атмосферы влияет на возможность существования жизни? Приведите примеры того, как наличие различных химических веществ в атмосфере может повлиять на температуру и климат планеты. |
Ученик проводит кухонный эксперимент, смешивая соду и уксус и наблюдая за выделением газа. Дескрипторы: 1.Определяет вещества (сода и уксус); 2. Объясняет выделение газа; 3. Записывает уравнение реакции. Ученик проводит лабораторный эксперимент, растворяя сахар, соль и масло в воде, и наблюдает, как эти вещества по-разному растворяются. Дескрипторы: - Сравнивает соль, сахар, масло; - Объясняет полярность воды; - Приводит примеры использования воды. Дескрипторы: - Называет газы на планетах; - Анализирует пригодность для жизни; - Делает выводы по климату. Ученик смотрит видео о химии космоса, изучая состав атмосферы Марса и Юпитера. |
Комментарий учителя Верно-неверно Самооценка по критериям Комментарий учителя Верно-неверно Комментарий учителя Верно-неверно |
Стакан, пищевая сода, уксус
Карточка с инструкцией, лабораторный набор (соль, сахар, масло, вода).
|
||
|
Конец урока 5 минут |
"Дерево успеха" Размещает на доске изображение дерева без листьев, раздает стикеры в форме листьев. |
Прикрепляют листья на дерево, где: Верхняя часть – всё получилось отлично Середина – есть вопросы Нижняя часть – требуется помощь |
|
|||
Урок №2
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Вода и ее уникальные свойства |
|||||
|
Цели обучения согласно программе |
Изучить особые свойства воды и их значение для жизни на Земле. |
|||||
|
Цель урока |
Учащиеся могут объяснить аномальные свойства воды и их роль в природных процессах. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: «Расчёт» – деление на 3 группы Действия учителя: - Приветствует учащихся. - Кратко объясняет цель урока: «Сегодня мы разберём, чем вода отличается от других веществ и почему она так важна для жизни на Земле». - Делит учащихся на 3 группы с помощью счёта «первый – второй – третий». - Объясняет, что каждая группа будет исследовать одно из уникальных свойств воды. |
|
|
Цветные жетоны или устный счёт. |
||
|
Середина урока 35 минут |
Контекст 2: Вода и её уникальные свойства Ситуация: Вы проводите эксперимент по растворению веществ в воде на уроке химии. Когда вы добавляете сахар и соль, они растворяются, но когда добавляете масло, оно остаётся на поверхности. Вас заинтересовало, почему некоторые вещества растворяются в воде, а другие нет. Задание в группах:
Контекст 2: Замерзание воды и её расширение Ситуация: Вы оставили бутылку с водой в морозильной камере, и на следующий день обнаружили, что она лопнула. Вас удивило, что вода увеличилась в объёме, когда замёрзла, ведь многие другие вещества уменьшаются при охлаждении. Задание:
Контекст 3: Вода как теплоноситель Ситуация: Вы заметили, что вода долго нагревается и остывает. Учитель объяснил, что это связано с её высокой теплоёмкостью. Вам стало интересно, как это свойство воды помогает регулировать температуру на Земле. Задание:
|
Отвечают на теоретические вопросы. Дескрипторы: - Проводит эксперимент; - Объясняет разницу растворимости; - Делает вывод о природе воды Ученик кладёт бутылку с водой в морозильник, а затем наблюдает, как она расширилась и лопнула. Дескрипторы: - Приводит примеры; - Указывает изменение объёма; - Связывает со структурой льда. Ученик нагревает воду в лаборатории и сравнивает её температуру с другими веществами, наблюдая, как медленно она меняется. |
. Комментарий учителя Верно-неверно Взаимооценивание |
Лабораторные материалы (сахар, соль, масло, вода, пробирки); Дополнение с QR-кодом видео - лаборатория:
Модель молекулы воды (бумажные или 3D)
Дополнительная викторина:
|
||
|
Конец урока 5 минут |
"Рюкзак знаний" Рисует на доске рюкзак, предлагает его "собрать". |
Записывают на стикерах и прикрепляют:
Что оказалось сложным |
|
|||
Урок №3
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Кислоты и основания в быту |
|||||
|
Цели обучения согласно программе |
Познакомить с кислотами и основаниями, встречающимися в повседневной жизни. |
|||||
|
Цель урока |
Учащиеся умеют определять кислоты и основания в бытовых веществах и объяснять их действие. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: «Колесо цифр» – деление на 2 группы 1. Приветствует
учащихся, кратко озвучивает тему и цель урока: 2. Включает "Колесо цифр", чтобы разделить класс на 2 команды. 3. Объясняет правила групповой работы. |
1. Слушают тему и цель. 2. Делятся на группы с помощью цифрового колеса. 3. Получают карточки-задания на группу и готовятся к практической части. |
|
https://nameonwheel.com/ru/?ysclid=lvdoeka7lt153182971&clckid=c63d2d67
|
||
|
Середина урока 35 минут |
Контекст 1: Чистка кухонных поверхностей с помощью кислоты
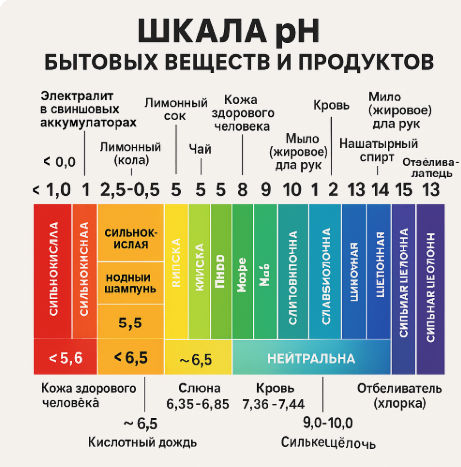
Ситуация: Вы заметили, что лимонная кислота часто используется для чистки на кухне. В инструкции указано, что она помогает избавиться от известкового налёта. Вы задумались, почему кислоты эффективны для удаления таких загрязнений. Задание:
Контекст 2: Тестирование кислотности воды с помощью индикаторов
Ситуация: В лаборатории вы изучаете свойства различных жидкостей. Учитель предлагает вам проверить кислотность воды и других растворов с помощью индикаторов, таких как лакмусовая бумага или фенолфталеин. Задание:
Контекст 3: Средства для уборки и их pH
Ситуация: Вы дома убираетесь с помощью различных чистящих средств. На упаковке написано, что некоторые средства имеют щелочной характер, а другие — кислотный. Вы заинтересовались, почему для разных загрязнений используются различные по pH средства. Задание:
|
Ученик использует лимонную кислоту для очистки чайника от известкового налёта и наблюдает, как налёт растворяется. Ученик окунает лакмусовую бумагу в несколько растворов и записывает изменения цвета для определения кислотности. Ученик использует щелочное средство для удаления жира с плиты, а кислотное средство — для удаления налёта в ванной. Дескрипторы: - Анализирует состав средств; - Подбирает по назначению; - Аргументирует выбор. |
Дескрипторы: - Узнаёт вещество – кислота; - Объясняет взаимодействие; - Записывает уравнение реакции. Дескрипторы: - Работает с индикаторами; - Записывает наблюдения; - Делает вывод по кислотности/щелочности. |
Работа с карточкой + просмотр видео опыта:
Мини-эксперимент с индикаторами. Инструменты: лакмус, фенолфталеин, растворы Таблица с pH бытовых средств.
|
||
|
Конец урока 5 минут |
"Острова настроения" Изображает на доске три острова: "Радости", "Сомнения", "Непонимания". |
Размещают свои магниты/фишки на соответствующем острове. |
|
|||
Урок №4
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Химия пищи: питательные вещества и добавки |
|||||
|
Цели обучения согласно программе |
Рассмотреть химический состав пищевых продуктов и роль пищевых добавок. |
|||||
|
Цель урока |
Учащиеся способны анализировать состав продуктов питания и оценивать влияние пищевых добавок на организм. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: «Стрельба глазами» – деление на 2 группы. 1. Приветствует учащихся. 2. Объявляет тему
и цель урока: 3. Организует деление на пары методом «Стрельба глазами»: учащиеся стоят в кругу, по сигналу ищут глазами партнёра, и образуют пары, затем объединяются в 2 группы. 4. Раздаёт карточки с заданиями и обозначает зоны для работы групп. |
|
|
Стикеры для разминки (по цветам и по продуктам);
|
||
|
Середина урока 35 минут |
Контекст 1: Питательные вещества в продуктах питания Ситуация: На уроке химии вы изучаете состав различных продуктов питания и выясняете, что все продукты содержат питательные вещества: углеводы, белки, жиры, витамины и минералы. Вас заинтересовало, как определить, какие вещества содержатся в вашей повседневной пище. Задание:
Контекст 2: Пищевые добавки Ситуация: Вы покупаете в супермаркете напиток, на упаковке которого указаны различные пищевые добавки, такие как консерванты, красители и ароматизаторы. Вас заинтересовало, как эти добавки влияют на качество продуктов и почему они используются. Задание:
Контекст 3: Энергетическая ценность пищи Ситуация: На уроке биологии вы обсуждали, как еда даёт организму энергию, измеряемую в калориях. Вас заинтересовало, как различные виды пищи обеспечивают разное количество энергии и почему это важно для сбалансированного питания. Задание:
|
Ученик проводит химические тесты на определение углеводов, белков и жиров в продуктах, используя лабораторные реактивы и наблюдая за изменением цвета. Дескрипторы:
Ученик читает состав на упаковке напитка и записывает названия добавок, затем исследует их влияние на организм. Дескрипторы:
Ученик изучает энергетическую ценность продуктов по этикеткам и рассчитывает количество калорий в своём ежедневном рационе. |
Комментарий учителя Верно-неверно |
Инструменты: Йод, раствор медного купороса, фильтровальная бумага, продукты (хлеб, масло, молоко и др.) Брошюра с расшифровкой пищевых добавок
Дополнительная викторина:
|
||
|
Конец урока 5 минут |
"Лесенка достижений" Чертит на доске лестницу с пятью ступенями, объясняет критерии каждой. |
Отмечают свою позицию, объясняют выбор. |
|
|||
Урок №5
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Лекарства и их воздействие на организм |
|||||
|
Цели обучения согласно программе |
Изучить химические основы действия лекарственных препаратов. |
|||||
|
Цель урока |
Учащиеся понимают механизмы действия основных групп лекарств и могут объяснить их эффекты. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: «Колесо фортуны» – деление на 2 группы 1. Приветствует учащихся, предлагает начать день с позитивного настроя через метод «Время добрых пожеланий» — ученики желают друг другу что-то хорошее. 2. Объявляет тему
и цель: 3. Делит учеников на 2 группы с помощью "Колеса фортуны". 4. Раздаёт карточки с вводными ситуациями для обсуждения в группах. |
|
Комментарий учителя Верно-неверно |
https://ru.piliapp.com/random/wheel/
Мини-видео-вставка Что происходит, когда принимаешь лекарство:
|
||
|
Середина урока 35 минут |
Контекст 1: Принципы работы лекарств Ситуация: Во время изучения темы «Здоровье» в школе вы узнали, что лекарства могут воздействовать на организм по-разному. Одни устраняют симптомы болезни, другие борются с самой причиной заболевания. Вы захотели узнать, как лекарства работают в организме и чем отличаются их типы. Задание:
Контекст 2: Антибиотики и устойчивость бактерий Ситуация: На уроке биологии учитель рассказал о том, что антибиотики убивают бактерии, но их чрезмерное использование может привести к тому, что бактерии станут устойчивыми. Вы заинтересовались, почему это происходит и как можно избежать развития устойчивости к антибиотикам. Задание:
3. Химический аптечный квест Формат игры: Интерактивное командное соревнование Подготовка:
Этапы игры 1. Теоретический блок "Химическая аптечка" Задание: Расшифровать химические формулы распространенных лекарств
2. Практический блок "Правильная доза" Задание: Рассчитать дозировку препарата в зависимости от веса и возраста 3. Блок "Безопасность и последствия" Задание: Определить потенциальные побочные эффекты и взаимодействие препаратов |
Ученик изучает упаковку лекарств в аптечке дома, определяя, какие из них снимают симптомы, а какие борются с причиной заболевания. Дескрипторы:
Ученик создаёт памятку для одноклассников с правилами правильного использования антибиотиков, чтобы предотвратить устойчивость бактерий. Дескрипторы:
Ученик последовательно проходит игровые станции, расшифровывает химические формулы лекарств, рассчитывает дозировки и анализирует побочные эффекты препаратов, работая в команде и используя логическое мышление Командная химико-медицинская квест-игра с элементами научно-познавательного исследования для формирования компетенций в области фармацевтической грамотности |
Комментарий учителя Взаимооценивание . |
Демонстрационные таблицы химических формул. Карточки с заданиями. Раздаточные.методические материалы. Защитные очки и перчатки (для практической части). Образцы упаковок лекарств (муляжи). Плакаты с информацией о строении молекул. |
||
|
Конец урока 5 минут |
"Светофор" Раздает карточки трех цветов. |
Показывают карточки |
Карточки для светофора |
|||
Урок №6
|
Фамилия имя педагога |
|
|||||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||||
|
Тема урока: |
Косметические средства: состав и безопасность |
|||||||
|
Цели обучения согласно программе |
Рассмотреть химический состав косметических средств и вопросы их безопасности. |
|||||||
|
Цель урока |
Учащиеся умеют анализировать состав косметических средств и оценивать их потенциальное влияние на здоровье. |
|||||||
|
Процесс урока: |
||||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||||
|
Начало урока 5 минут |
Метод: «Косметическая лотерея» – деление на 3 группы Формат: На столе 15 карточек с названиями разных косметических средств (шампунь, крем, тушь, лосьон и т.д.) разных цветов (по 3 цвета – красный, синий, зелёный). Учащие вытягивают по одной карточке и делятся на группы по цветам. |
1. Активно участвуют в беседе. 2. Вытягивают карточки. 3. Делятся на команды по цвету. 4. Озвучивают продукт своей группы и его назначение. |
Словесная оценка учителя |
Карточки «Косметическая лотерея» (по 5 на каждый цвет); Стикеры для команд; Короткое видео-заставка:
|
||||
|
Середина урока 35 минут |
Контекст 1: Основные компоненты косметических средств Ситуация: Вы купили новый шампунь, и на его упаковке написан список ингредиентов, таких как вода, сульфаты, консерванты и ароматизаторы. Вас заинтересовало, зачем нужны все эти компоненты и как они влияют на ваши волосы. Задание:
Контекст 2: Аллергические реакции на косметику Ситуация: После использования нового крема для лица у вас появилось раздражение на коже. Вы задумались, может ли это быть связано с каким-то компонентом в креме, и как избежать подобных реакций в будущем. Задание:
3. Химия красоты: состав и безопасность Этапы игры 1. Теоретический блок "Химический состав"
2. Практический блок "Лаборатория красоты"
3. Блок "Безопасность и экспертиза"
|
Ученик читает состав шампуня, который он использует, и выясняет, какие компоненты там присутствуют и как они воздействуют на волосы. Дескрипторы:
Ученик проверяет состав крема и проводит тест на аллергию, нанеся небольшое количество продукта на руку, чтобы убедиться в отсутствии реакции. Ученик исследует составы косметических средств, идентифицирует химические компоненты, оценивает их безопасность, проводит эксперименты по определению pH, изучает влияние ингредиентов на кожу и создает информационный продукт о безопасном выборе косметики. |
Комментарий учителя |
Ресурс: Распечатка этикеток ? Видео: Как выбрать безопасную косметику
Необходимые ресурсы Образцы косметических средств (безопасные) pH-метры Микроскопы Защитные перчатки и очки Справочные материалы по химическому составу Таблицы растворимости Реактивы для базовых химических тестов Бланки для заполнения результатов |
||||
|
Конец урока 5 минут |
"Корзина отзывов" Ставит на стол три корзины с надписями "Важно", "Интересно", "Сложно". |
Пишут на листочках свои мысли и распределяют по корзинам. |
Корзины с надписями "Важно", "Интересно", "Сложно". |
|||||
Урок №7
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Бытовая химия: эффективность и экологичность |
|||||
|
Цели обучения согласно программе |
Изучить химический состав бытовых чистящих средств и их влияние на окружающую среду. |
|||||
|
Цель урока |
Учащиеся способны выбирать эффективные и экологичные бытовые химические средства. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? Ассоциации с бытом Описание: На доске — 6
бытовых предметов (в виде картинок): губка, перчатки, флакон с
моющим средством, уксус, сода, маска. Учитель предлагает ученикам
выбрать любой предмет и ответить на вопрос: Так происходит мягкое вхождение в тему + активизация личного опыта. |
1. Слушают и рассматривают изображения. 2. Выбирают один из предметов. 3. Высказывают ассоциации и личный опыт. 4. Делятся впечатлениями в парах или всей группой. 5. Настраиваются на урок. |
|
Слайд/распечатка с изображениями бытовых предметов (6 шт.); Маркеры/стикеры |
||
|
Середина урока 35 минут |
Контекст 1: Эффективность чистящих средств Ситуация: На кухне у вас скопился жир на плите, и вы решили использовать чистящее средство для удаления загрязнений. Вам стало интересно, как химические вещества в составе средства помогают очищать поверхности. Задание:
Контекст 2: Влияние бытовой химии на окружающую среду Ситуация: Вы заметили, что некоторые чистящие средства имеют пометку "экологически безопасное". Вы заинтересовались, что делает средства экологичными и как они влияют на окружающую среду по сравнению с обычными. Задание:
3. Химия дома: эффективность и экология Структура игры 1. Теоретический блок "Химический анализ"
2. Лабораторный блок "Эффективность и безопасность"
3. Экологический блок "Зеленая химия"
|
Ученик использует чистящее средство на плите, наблюдая, как оно эффективно удаляет жир. Дескрипторы:
Научно-практический квест по изучению бытовой химии с позиций эффективности, безопасности и экологической ответственности. Ученик сравнивает составы обычного и экологически чистого чистящих средств и делает выводы о их влиянии на окружающую среду. Ученик исследует составы бытовых химических средств, проводит эксперименты по оценке их эффективности, изучает экологический след производства и потребления, разрабатывает экологически безопасные альтернативные решения для домашней уборки. |
Комментарий учителя Комментарий учителя |
? Карточка: Таблица «Состав – Назначение – Эффективность» ? Видео: Экология и бытовая химия
Образцы бытовой химии pH-метры Защитные очки и перчатки Лабораторное оборудование Справочные материалы Микроскопы Расходные материалы для экспериментов Таблицы химической совместимости Демонстрационные стенды |
||
|
Конец урока 5минут |
"Координаты успеха" Рисует систему координат с осями "Понимание" и "Интерес". |
Ставят точку на графике, отражающую их состояние. |
|
|||
Урок №8
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Воздух: состав, загрязнение и очистка |
|||||
|
Цели обучения согласно программе |
Изучить состав воздуха, источники его загрязнения и методы очистки. |
|||||
|
Цель урока |
Учащиеся умеют анализировать данные о загрязнении воздуха и предлагать методы его очистки. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Что в воздухе?» Формат: Учитель показывает ученикам три запечатанных прозрачных контейнера с надписями:
Ученики по очереди вытягивают карточку с вопросом, обсуждают его с соседом, а затем кратко делятся своими мыслями с классом. |
1. Активно участвуют в обсуждении вопросов. 2. Обмениваются нениями в парах. 3. Настраиваются на исследование темы. |
Комментарий учителя |
1. Карточки с вопросами 2. Прозрачные контейнеры или конверты |
||
|
Середина 35 урока |
1.Задание на
знание состава воздуха: Приведите процентное содержание основных газов, входящих в состав воздуха (азот, кислород, углекислый газ, аргон). Объясните, какую роль играет каждый из этих газов в атмосфере. Ответ:
2.Задание на анализ причин загрязнения воздуха: - Назовите основные загрязнители воздуха. - Откуда они появляются? - Разделите источники на природные и антропогенные. - Обсудите последствия загрязнения. 3.Задание на решение проблемы очистки воздуха:
Ответ: Использование энергоэффективных приборов и переход на общественный транспорт или велосипеды поможет сократить выбросы вредных веществ в атмосферу, снижая загрязнение воздуха. |
Обьясняют роль газов в атмосфере. Дескрипторы:
Анализируют причины загрязнения воздуха. Дескрипторы: - Называет загрязнители; - Разделяет источники по происхождению; - Делает вывод о последствиях. Предлагают способы решения проблем с очисткой воздуха. Дескрипторы:
|
«Устная похвала» Взаимооценивание Взаимооценивание |
? Ресурс: Диаграмма состава воздуха ? Видео:
? Ресурс: Инфографика о способах очистки |
||
|
Конец урока 5 минут |
"Открытый микрофон" Передает символический микрофон. |
По очереди заканчивают фразы:
"Я смог..." |
|
|||
Урок №9
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Парниковый эффект и изменение климата |
|||||
|
Цели обучения согласно программе |
Рассмотреть химические аспекты парникового эффекта и его влияние на климат |
|||||
|
Цель урока |
Учащиеся могут объяснить механизм парникового эффекта и предложить меры по снижению выбросов парниковых газов. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Термин – объяснение» Формат: На доске размещены 4 термина:
Учащиеся делятся на 3 группы, каждая тянет карточку с одним из терминов и в течение 2 минут обсуждает в группе, как бы они объяснили это понятие простыми словами. Затем каждая группа озвучивает свою версию. |
1. Делятся на группы. 2. Получают термин и обсуждают его значение. 3. Представляют свои версии определения. 4. Формируют интерес к теме. |
Словесная оценка учителя |
1. Карточки с терминами 2. Цветные стикеры для групп 3. Презентация с темой |
||
|
Середина урока 35 минут |
1.Задание на
анализ графика: Температурные изменения
Ситуация: Вы получили график, показывающий среднегодовые температуры в вашем городе за последние 50 лет. На графике виден постепенный рост температуры. Задание для группы: 1. Проанализируйте
график: 2. Обсудите и
сделайте вывод: 3. Разработайте 2
предложения: 2.Задание на принятие решений: Устойчивое потребление Ситуация: Ваша семья собирается купить новый холодильник. В магазине есть два варианта: один дешевле, но потребляет больше электроэнергии, а другой дороже, но энергосберегающий. Задание для группы:
3.Задание на рассуждение: Выбор транспорта Ситуация: Вы хотите сократить свой углеродный след и рассматриваете два варианта поездок на работу: на автомобиле или на велосипеде. Расстояние до работы — 5 км. Задание для группы: 1. Обсудите, какой вариант транспорта экологичнее. 2. Перечислите дополнительные плюсы езды на велосипеде: здоровье, экономия, настроение и др. 3. Подготовьте групповое обоснование, которое защитите перед другими. |
Ученик анализирует график изменения температуры за 50 лет и делает выводы о возможных причинах повышения температуры в городе. Затем предлагает меры для замедления этого процесса. Дескрипторы: - Определяет основные тенденции изменения температуры на графике; - Объясняет возможные причины повышения температуры; - Предлагает обоснованные меры по замедлению процесса изменения климата. Ученик в магазине сравнивает два холодильника — один энергоэффективный, другой дешевле, но менее эффективный. Ученик выбирает холодильник и объясняет свой выбор с точки зрения долгосрочной экономии и экологичности Ученик размышляет о выборе транспорта — автомобиль или велосипед. Он рассматривает экологические преимущества велосипеда и другие положительные аспекты для здоровья и экономики. |
Взаимооценивание Взаимооценивание работы групп |
? Ресурс: График температурных изменений + карточка с вопросами анализа ? Ресурс: Таблица сравнения + карточка с подсказками (пример расчёта затрат) ? Ресурс: Карточки с данными (выбросы CO₂, затраты, калории и т.д.) |
||
|
Конец урока 5 минут |
"Погода в душе" Рисует условные обозначения погоды. |
Выбирают символ, соответствующий их настроению и успехам на уроке. |
|
|||
Урок №10
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Кислотные дожди: причины и последствия |
|||||
|
Цели обучения согласно программе |
Изучить химические процессы образования кислотных дождей и их воздействие на окружающую среду. |
|||||
|
Цель урока |
Учащиеся умеют объяснять причины образования кислотных дождей и оценивать их последствия для экосистем. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ☔ «Пятно на памятнике» Формат: Учитель показывает
фотографию известного здания (например, памятника, колонны или
храма) с повреждениями на поверхности. Действия учителя: - Приветствует учащихся. - Демонстрирует фото и задаёт наводящие вопросы. - Делит учащихся на 3 группы. - Объявляет тему и цель урока: |
1. Активно обсуждают возможные причины разрушений. 2. Делятся на группы. 3. Настраиваются на исследовательскую часть урока. |
Словесная оценка учителя |
1. Фото повреждённого памятника (до/после) 2. Презентация с темой урока 3. Видео-заставка:
|
||
|
Середина урока 35 минут |
1.Задание на объяснение причин кислотных
дождей: Задание для
группы: Образец ответа:
2.Задание на анализ последствий кислотных
дождей:
Задание для
группы: 1. На экосистему (леса, озёра, почвы); 2. На здания и памятники. . 3.Задание на решение проблемы кислотных
дождей: 1. Один – на государственном уровне (например, фильтры, законы); 2. Один – в повседневной жизни (например,
использование транспорта, энергосбережение). Образец ответа:
|
Ученик изучает схему, показывающую выбросы вредных веществ в атмосферу, и составляет пояснение, как они способствуют образованию кислотных дождей. Дескрипторы: - Называет основные загрязняющие вещества; - Объясняет процесс образования кислотных осадков; - Указывает источники выбросов. Дескрипторы:
Ученик находит примеры разрушенных кислотными дождями памятников или строений, а также изучает данные о влиянии кислотных дождей на озёра и леса. Ученик составляет список возможных действий, которые он и его семья могут предпринять для сокращения выбросов, и обсуждает его с одноклассниками. |
Самооценка Взаимооценивание групп Комментарий учителя |
? Ресурс: карточка-шаблон + слайд со схемой процесса ? Ресурс: карточки с изображениями последствий + шаблон схемы ? Ресурс: лист для мозгового штурма + шаблон для плаката |
||
|
Конец урока 5 минут |
"Чемодан, мясорубка, корзина" Размещает три изображения. |
Распределяют информацию: Чемодан – что возьму с собой Мясорубка – над чем нужно поработать Корзина – что не пригодится |
|
|||
Урок №11
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Пластиковое загрязнение: проблемы и решения |
|||||
|
Цели обучения согласно программе |
Рассмотреть химические свойства пластиков и проблемы их утилизации. |
|||||
|
Цель урока |
Учащиеся способны предложить решения проблемы пластикового загрязнения на основе химических знаний. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Где спрятан пластик?» Формат: На партах или
доске размещены изображения/предметы, содержащие пластик (упаковка,
зубная щётка, бутылка, ручка, скотч и т.п.). |
1. Делятся на группы. 2. Определяют предметы из пластика и возможные замены. 3. Настраиваются на исследование проблемы. |
|
1. Предметы/картинки с пластиком 2. Слайд с темой урока 3. Видеозаставка (4 мин): https://www.youtube.com/watch?v=IDsAUcqQKnQ |
||
|
Середина урока 35 минут |
1.Задание на
понимание проблемы пластикового загрязнения: Пластиковые отходы
— одна из главных экологических проблем. Задание для группы: 2.Задание на анализ решений проблемы пластикового загрязнения: Некоторые страны
ввели запрет на использование пластиковых пакетов.
адание для группы: 1. Почему отказ от пакетов уменьшает загрязнение? 2. Какие
альтернативы существуют (бумажные, тканевые и др.)? 3. Планета без пластика Этапы игры 1. Теоретический блок "Химия пластика"
2. Лабораторный блок "Экспериментариум"
3. Аналитический блок "Глобальный след"
|
Ученик изучает фотографии или видеоматериалы о загрязнении океанов пластиком и описывает, как это влияет на морских животных. Дескрипторы:
Ученик исследует, какие альтернативы пластиковым пакетам можно использовать в повседневной жизни, и составляет список экологичных вариантов для своей семьи. Дескрипторы:
Ученик исследует жизненный цикл пластика, анализирует химический состав различных видов пластмасс, проводит эксперименты по разложению материалов, оценивает экологический след. |
Взаимооценивание Комментарий учителя |
? Ресурс: карточки с фактами + шаблон схемы ? Ресурс: карточки с вариантами упаковки + таблица Образцы различных типов пластика Химические реактивы Микроскопы Весы Секундомеры Демонстрационное оборудование Материалы для макетирования |
||
|
Конец урока 5 минут |
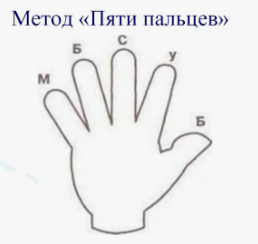
"Пять пальцев" Показывает ладонь с заданиями для каждого пальца. |
Анализируют урок по пунктам: Большой – что понравилось Указательный – что узнал нового Средний – что было трудно Безымянный – психологическая атмосфера Мизинец – чего не хватило |
|
|||
Урок №12
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Тяжелые металлы в окружающей среде |
|||||
|
Цели обучения согласно программе |
Изучить источники поступления тяжелых металлов в окружающую среду и их влияние на живые организмы. |
|||||
|
Цель урока |
Учащиеся умеют оценивать риски, связанные с загрязнением тяжелыми металлами, и предлагать методы очистки. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ⚠️ «Ядовитый след» Формат: Учитель показывает
изображение знака биологической опасности и задаёт
вопрос: После краткого обсуждения делит класс
на 3 группы (по стикерам/цветам) и вводит тему урока: |
1. Участвуют в обсуждении; 2. Делятся на группы; 3. Формируют ожидания от темы. |
|
1. Изображение символа опасности 2. Картинки с примерами металлов (ртуть, свинец, кадмий) |
||
|
Середина урока 35 минут |
1.Задание на
понимание: Источники тяжелых металлов в окружающей
среде
Задание для
группы: 2.Задание на
анализ последствий: Влияние тяжелых металлов на
здоровье
Задание для
группы: 3. Невидимая угроза: тяжелые металлы Структура игры 1. Теоретический блок "Химическая карта металлов"
2. Лабораторный блок "Следственный эксперимент"
3. Экологический блок "Миграция и трансформация"
|
Ученик составляет таблицу с перечислением основных источников тяжелых металлов и объяснением их воздействия на окружающую среду Дескрипторы:
Ученики в группе обсуждают т реальные примеры случаев отравления тяжелыми металлами и делают краткий доклад об их последствиях для здоровья. Дескрипторы:
Ученик исследует источники и миграционные пути тяжелых металлов, проводит эксперименты по их обнаружению, анализирует влияние на экосистемы и организм человека, разрабатывает стратегии минимизации рисков и защиты окружающей среды. |
«Устная похвала» Обмен мнениями, взаимооценка |
Видеовступление: Что такое тяжелые металлы https://www.youtube.com/watch?v=XOsq-r97jmA? Ресурс: карточки с подсказками + шаблон схемы ? Ресурс: карточки металлов + шаблон карточки риска Химические реактивы Спектрометр Микроскопы Пробоотборники Защитное оборудование Индикаторные полоски Образцы почвы и воды Справочные материалы Демонстрационное оборудование |
||
|
Конец урока 5 минут |
"Телеграмма" Раздает бланки "телеграмм". |
Пишут короткое послание следующему классу о главном на уроке. |
|
|||
Урок №13
|
Фамилия имя педагога |
|
|||||||||||||||||||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||||||||||||||||||
|
Тема урока: |
Химические удобрения: польза и вред |
|||||||||||||||||||||
|
Цели обучения согласно программе |
Рассмотреть химический состав удобрений, их влияние на урожайность и экологические последствия их применения. |
|||||||||||||||||||||
|
Цель урока |
Учащиеся способны анализировать преимущества и недостатки использования химических удобрений. |
|||||||||||||||||||||
|
Процесс урока: |
||||||||||||||||||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||||||||||||||||||
|
Начало урока 5 минут |
Метод: ? «Зелёная загадка» Формат: Учитель показывает 3 изображения:
Вопрос
классу: |
1. Делятся на группы. 2. Высказывают гипотезы. 3. Готовятся к выполнению заданий. |
Устная похвала |
1. Презентация с изображениями 2. Стикеры для деления на группы |
||||||||||||||||||
|
Середина урока 35 минут |
Контекст: Химические удобрения: польза и вред
Задание 1:
Заполнение таблицы составов химических
удобрений
Задание 2: Составление схемы "Путь химических удобрений в природе"
Задание 3: Обсуждение плюсов и минусов химических
удобрений |
Ученики заполняют таблицу на основе материалов из учебника, объясняя роль каждого элемента и возможные последствия его недостатка или избытка.
Ученик создаёт схему, начиная с внесения удобрений в почву, их поглощения растениями и вымывания дождями, заканчивая загрязнением рек и атмосферы.
Ученик формирует два списка, анализируя информацию о положительном влиянии удобрений на урожайность и их вреде для окружающей среды |
|
Карточки с пиктограммами:
Иллюстрации каждого этапа (в виде стрелок/иконок): Заготовка схемы (пустой путь с подписями)
Стикеры с иконками (? — плюс, ? — вред, ♻️ — решение) Постер "Плюсы – Минусы – Предложения"
|
||||||||||||||||||
|
Конец урока 5 минут |
"Цветик-семицветик" Рисует цветок с разноцветными лепестками. |
Отрывают лепесток того цвета, который соответствует их настроению.
|
|
|||||||||||||||||||
Урок №14
|
Фамилия имя педагога |
|
||||||||||||||||||||||||||||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
|||||||||||||||||||||||||||||
|
Тема урока: |
Альтернативные источники энергии и химия |
||||||||||||||||||||||||||||||
|
Цели обучения согласно программе |
Изучить химические аспекты различных альтернативных источников энергии. |
||||||||||||||||||||||||||||||
|
Цель урока |
Учащиеся умеют сравнивать различные источники энергии с точки зрения их химических свойств и экологичности. |
||||||||||||||||||||||||||||||
|
Процесс урока: |
|||||||||||||||||||||||||||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
|||||||||||||||||||||||||||
|
Начало урока 5 минут |
Метод: ☀️ «Что питает наш дом?» Формат: Учитель показывает
изображения дома, освещённого ночью, солнечной панели, ветряка,
электростанции и автомобиля. |
1. Рассматривают предложенные изображения. 2. В группах
обсуждают: 3. Делают предположения о типах источников (традиционные и альтернативные). 4. Делятся мыслями с классом (представитель группы озвучивает). |
Комментарий учителя |
?️ Интерактивный слайд с изображениями объектов: - Дом, электромобиль, солнечная батарея, завод, лампочка, ветряк ? Карточки с цветами (деление на группы) ? Мини-карточки-подсказки: - «Не выбрасывает CO₂» - «Работает от солнца» - «Истощает природу» |
|||||||||||||||||||||||||||
|
Середина урока 35 минут |
Контекст: Альтернативные источники энергии и их химия
Задание
1: Сравнение традиционных и альтернативных источников
энергии
Задание 2: Создание схемы работы солнечной батареи
Задание 3: Обсуждение использования водородного топлива
|
Ученик заполняет таблицу на основе полученной информации, сравнивая уголь и нефть с альтернативными источниками энергии, такими как солнечная и ветровая.
Дескриптор: Сравнивает традиционные и альтернативные источники энергии по ключевым характеристикам.
Ученик рисует схему солнечной панели, объясняя, как фотоны солнечного света воздействуют на кремний, вызывая движение электронов и создание электрического тока.
Ученик описывает реакцию, происходящую в топливных элементах (2H₂ + O₂ → 2H₂O + энергия), и составляет список плюсов (экологическая чистота, высокая эффективность) и минусов (сложность хранения, стоимость) водородного топлива. Дескриптор: Объясняет химические процессы, происходящие в солнечных батареях, создаёт схему их работы.
|
взаимооценивнаие
|
1. Карточки с данными по каждому источнику 2. Иконки для визуального заполнения таблицы (? выбросы, ♻️ устойчивость, ⚡ мощность)
1. Карточки: фото солнечной панели, структура кремниевого слоя 2. Заготовка схемы + наклейки «фотон», «электрон», «контакт»
1. Карточки: модель топливного элемента, реакция 2. Таблица плюсов и минусов 3. Мини-видео:Водородное топливо |
|||||||||||||||||||||||||||
|
Конец урока 5 минут |
"Экран эмоций" Вывешивает таблицу с различными эмоциями. |
Отмечают свои эмоции в начале и конце урока.
|
|
||||||||||||||||||||||||||||
Урок №15
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Оксиды и их свойства |
|||||
|
Цели обучения согласно программе |
Изучить классификацию оксидов, их физические и химические свойства. |
|||||
|
Цель урока |
Учащиеся смогут классифицировать оксиды и описывать их основные химические свойства. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Угадай по формуле» Формат: На экране 4
формулы оксидов: CO₂, CaO, Al₂O₃, NO. Мини-викторина «Это кислотный или основной?»
|
1. В парах обсуждают, какие из веществ могут реагировать с водой. 2. Делятся на группы. 3. Формируют гипотезы. 4. Настраиваются на работу с текстом и реакциями. |
«Устная похвала» |
1. Слайд с формулами оксидов 2. Цветные карточки для деления на группы
|
||
|
Середина урока 35 минут |
Текст:
Задание
1
Задание
2
Задание 3 |
Распределяют оксиды по их химическим свойствам. Дескриптор: Правильно распределил вещества по группам оксидов (4/4 – отлично, 3/4 – хорошо, 2/4 – пересмотр). 2.Определяет продукты реакций на основе свойств оксидов. Формулирует объяснение, используя теоретические знания. |
|
Таблица свойств оксидов Карточки с названиями и формулами Цветные маркеры для группировки на доске/флипчарт 1. Карточки с незавершёнными уравнениями 2.Фломастеры 1. Отрывок из учебника/поясняющий текст 2. Карточки с вопросами на размышление |
||
|
Конец урока 5 минут |
"Дорожные знаки" Показывает карточки с дорожными знаками. |
Выбирают знак, отражающий их путь познания на уроке. |
|
|||
Урок №16
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Свойства кислот |
|||||
|
Цели обучения согласно программе |
Исследовать химические свойства кислот и их взаимодействие с различными веществами. |
|||||
|
Цель урока |
Учащиеся смогут объяснить основные свойства кислот и записывать уравнения их химических реакций. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Что это за вещество?» Формат: Учитель показывает три изображения: |
1. Отвечают на вопрос, что общего между предметами. 2. Делятся ассоциациями. 3. Формулируют ожидания от темы урока. |
Словесная оценка учителя |
Презентация с изображениями лимона, аккумулятора и HCl Стикеры для деления на группы Карточка с темой и целью урока |
||
|
Середина урока 35 минут |
Текст:
Задание
1 Задание:
? Укажите, какие
свойства кислот проявляются: Задание
2 Задание: Задание
3
|
Классифицирует реакции, связывая их с химическими свойствами кислот. Дескриптор: правильно определил свойства кислот для каждой реакции 2.Формулируют объяснение на основе разницы в диссоциации кислот. 3.Определяют вещества, участвующие в реакции,
используя знания о химических свойствах кислот. |
Словесная оценка учителя «Устная похвала» |
Таблица «Свойства кислот» Карточки с уравнениями Стикеры для группировки реакций по типам 1. Схема диссоциации кислот 2. Таблица электропроводности 3. Карточки с понятиями: «Сильная», «Слабая», «Электролит» 4Набор карточек с веществами |
||
|
Конец урока 5 минут |
"Письмо себе" Раздает конверты и листы бумаги. |
Пишут письмо себе о том, что поняли на уроке, что хотят запомнить. |
|
|||
Урок №17
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока |
Щелочи |
|||||
|
Цели обучения согласно программе |
Изучить химические свойства щелочей и их применение в повседневной жизни. |
|||||
|
Цель урока |
Учащиеся смогут характеризовать щелочи и описывать их взаимодействие с другими веществами. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Скрытая опасность» Формат: Учитель показывает три предмета:
Вопрос: |
1. Обсуждают, что это за вещества и как они связаны с химией. 2. Делятся в группах мнениями о безопасном и опасном применении. 3. Формулируют предположения о теме урока. |
«Устная похвала» |
Мыло, Бутылку с чистящим средством (NaOH), Стеклянную колбу с известковой водой. Карточки для групп Презентация Стикеры «Щелочь / Основание / Неизвестно» |
||
|
Середина урока 35 минут |
Текст:
Задание
1: Задание
2
Определите, какой тип реакции происходит: нейтрализация, образование осадка и др. Задание 3 |
Разделяют вещества
на группы по их растворимости. Дескриптор: правильно определил щелочи и основания 2.Определяют вещества на основе химических свойств щелочей. Дескриптор: правильно заполнил все пропуски в уравнениях 3.Формулируют объяснение на основе взаимодействия щелочей со стеклом. |
«Устная похвала» Взваимооценивание |
1. Таблица растворимости 2. Карточки с формулами + маркеры для доски 3. Заготовка таблицы на A3 Карточки с недостающими уравнениями Таблица растворимости Цветные стикеры для записей 1. Карточка с текстом-подсказкой 2. Таблица «Материалы и химическая стойкость» 3. Лист для группового вывода |
||
|
Конец урока 5 минут |
"Волшебная шляпа" Приносит шляпу с разноцветными листочками-вопросами. |
Достают вопросы и отвечают на них о процессе обучения. |
|
|||
Урок №18
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Соли. Образование ионных связей |
|||||
|
Цели обучения согласно программе |
Исследовать механизм образования ионных связей и способы получения солей. |
|||||
|
Цель урока |
Учащиеся смогут объяснить процесс образования ионных связей и различные способы получения солей. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Разделение по ионам» Формат: Учащиеся должны найти свою «пару» и образовать соль. Те, кто собрался в пару, формируют группу. |
Ищут соответствующий ион (в паре). Объединяются в группы на основе созданной соли. Обсуждают, как получилась их пара, и формулируют гипотезу о теме. |
«Устная похвала» |
Карточки с ионами Презентация с темой и целями Мини-видео 1 мин: ▶️ https://www.youtube.com/watch?v=CGC4bI3oZBo |
||
|
Середина урока 35 минут |
Текст:
Задание
1 Задание
2
Дополнительно: определите, к какому типу реакции относится каждая. ✅ Задание 3
(индивидуально или обсуждение в группе): Объяснение электропроводности NaCl. ? Подумай: |
1.Распределяют соли по их видам на основе знаний о составе. Дескриптор: правильно классифицировали соли 2.Дополняют
уравнения реакций веществами, используя химические
свойства. 3.Формулируют объяснение, связывая физические свойства с ионной структурой. |
Словесная оценка учителя Взаимоценивание |
Таблица «Типы солей» Карточки с названиями и формулами Шаблон для группировки: 3 колонки (средние / кислые / основные) Модель кристаллической решётки NaCl
Карточка «Ионная связь и электропроводность» |
||
|
Конец урока 5 минут |
"Карта впечатлений" Рисует карту с разными "территориями" (интерес, сложность, польза). |
Отмечают флажками свое местоположение на карте. |
|
|||
Урок №19
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Амфотерные соединения и их свойства |
|||||
|
Цели обучения согласно программе |
Изучить особенности амфотерных соединений и их двойственную природу. |
|||||
|
Цель урока |
Учащиеся смогут определять амфотерные соединения и объяснять их способность проявлять кислотные и основные свойства. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ⚖️ «Двойное поведение» Формат: Учитель показывает две реакции:
Вопрос: |
1. Анализируют реакции. 2. Высказывают предположения: что общего у Al₂O₃ и Zn(OH)₂. 3. Делятся на группы и формулируют ожидания. |
Комментарий учителя |
Доска с двумя уравнениями Кубики/фишки трёх цветов (для групп) |
||
|
Середина 35 урока |
Текст:
Задание 1:
Групповая работа Задание
2
Определите, в какой реакции соединение проявляет кислотные свойства, а в какой — основные. Задание 3 |
1 Классифицируют вещества на основе их химических свойств. Дескриптор: правильно определил амфотерные соединения 2.Дополняют
уравнения веществами, опираясь на свойства амфотерных
соединений. 3.Формулируют объяснение на основе амфотерных свойств соединений. |
Словесная оценка учителя |
Таблица: классификация оксидов и гидроксидов Карточки с химическими формулами и картинками (ZnO – порошок, Cr(OH)₃ – осадок и т.д.) Таблица растворимости
Таблица «Сравнение кислотных, основных и амфотерных соединений» Индивидуальная карточка с вопросами |
||
|
Конец урока 5 минут |
"Мишень успеха" Рисует мишень с четырьмя секторами (понимание, интерес, активность, польза). |
Ставят точки на мишени, оценивая каждый параметр. |
|
|||
Урок №20
|
Фамилия имя педагога |
|
||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
|||
|
Тема урока: |
Практические задания на основные классы неорганических соединений |
||||
|
Цели обучения согласно программе |
Закрепить знания о химических свойствах основных классов неорганических соединений через решение практических задач. |
||||
|
Цель урока |
Учащиеся смогут решать расчетные задачи, составлять уравнения реакций и определять продукты химических превращений для основных классов неорганических соединений. |
||||
|
Процесс урока: |
|||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
|
|
Начало урока 5 минут |
Метод: ? «Химический мозговой штурм» Формат: На доске — таблица с незаполненными колонками: | Формула | Название | Класс соединения | Учащиеся (в группах) получают карточки с формулами (HCl, NaOH, SO₂, NaCl, CaO) и за 2 минуты должны заполнить как можно больше строк. |
1. Участвуют в «мозговом штурме». 2. Делятся на группы. 3. Обсуждают, чем соединения одного класса могут отличаться по свойствам и реакциям. |
«Устная похвала» |
Карточки с формулами веществ Пустая таблица на флипчарте/экране Цветные фишки для деления на группы |
|
|
Середина урока 35 минут |
Задание 1: Анализ состава соединений Условие: Задание 2: Построение цепочки превращений Условие: Задание 3: Выявление ошибок в уравнениях реакций Условие:
|
1.Анализируют
состав соединений и относят их к конкретному классу. 2.Составляют логическую последовательность превращений, записывает уравнения реакций. Дескриптор: 1)правильно составил цепочку 2)записал уравнения 3Анализируют уравнения реакций, находят ошибки и исправляют их. |
Самооценка (5/5 – отлично, 4/5 – хорошо, 3 и менее – доработка). Взаимопроверка по шаблону (3/3 – отлично, 2/3 – хорошо, 1/3 – доработка). Взаимооценивание |
1. Карточки с цветными схемами соединений 2. Интерактивная таблица Менделеева 3. Шаблон таблицы: «Формула – Элементы – Класс» 1. Карточки с веществами 2. Шаблон схемы «→» 3. Подсказки с примерами типов реакций
1. Карточки с неправильными уравнениями 2. Таблица растворимости |
|
|
Конец урока 5 минут |
"Три М" Записывает на доске: Мне было Момент Могу. |
Продолжают фразы: Мне было... (интересно/скучно) Момент урока... (самый важный) Могу... (применить в жизни) |
|
||
Урок №21
|
Фамилия имя педагога |
|
||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
|||
|
Тема урока: |
Лабораторные работы |
||||
|
Цели обучения согласно программе |
Сформировать практические навыки работы с различными классами неорганических веществ в лабораторных условиях. |
||||
|
Цель урока |
Учащиеся освоят технику безопасности, научатся проводить химические эксперименты, наблюдать и описывать их результаты, делат |
||||
|
Процесс урока: |
|||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
|
|
Начало урока 5 минут |
1. Демонстрирует цветовые переходы (или слайды). 2. Делит учащихся
на 3 лабораторные группы
по цветным карточкам: 3. Объявляет цели
лабораторной работы: |
1. Участвуют в обсуждении. 2. Делятся на группы. 3. Получают лабораторные карточки и готовятся к работе. |
|
Видео – материал: Правила техники безопасности в химической лаборатории https://www.youtube.com/watch?v=GnkLgUktA2w цветные карточки для деления на группы |
|
|
Середина урока 35 минут |
Вариант №1
Вариант №2
Вариант №3
|
1Проводят реакции
кислот и оснований с индикаторами и записывают
наблюдения. 1)корректно определил изменение цвета индикаторов для кислот и оснований 2) заполнил таблицу наблюдений 2.Определяют свойства кислотных и основных оксидов через проведение реакций. Дескрипторы 1)правильно описал результаты всех реакций 2) сделал выводы о свойствах оксидов 3Проводят реакцию нейтрализации и наблюдают
за её результатами. |
Самооценка по шаблону (3/3 – отлично, 2/3 – хорошо, 1/3 – пересмотр). Комментарий учителя |
1. Растворы HCl, NaOH 2. Индикаторы: лакмус, фенолфталеин, метилоранж 3. Таблица наблюдений 4. Перчатки, пипетки, пробирки Газированная вода (CO₂), CaO Растворы Ca(OH)₂, HCl Индикаторы, пробирки Лист для выводов по опыту 1. Растворы HCl и NaOH 2. Индикатор фенолфталеин 3. Мерные цилиндры, пробирки 4. Шаблон реакции и бланк для вывода. |
|
|
Конец урока 5 минут |
"Дерево решений" Рисует дерево с тремя ветвями (знаю, сомневаюсь, не знаю). |
Прикрепляют листочки к соответствующим ветвям. |
|
||
Урок №22
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Нанотехнологии в повседневной жизни |
|||||
|
Цели обучения согласно программе |
Ознакомить с принципами нанотехнологий и их применением в повседневной жизни. |
|||||
|
Цель урока |
Учащиеся могут привести примеры использования нанотехнологий в быту и объяснить их преимущества. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Увеличь это!» Формат: Учитель показывает
изображения обычных объектов, увеличенных в десятки тысяч раз с
помощью наноскопа (ткань, металл, пыльца, кремний в
процессоре). |
1. Делятся ассоциациями с увиденными изображениями. 2. Объединяются в группы. 3. Озвучивают, где, по их мнению, применяются нанотехнологии. |
«Устная похвала» |
Презентация «Мир под наноскопом» Изображения в увеличении (наноструктуры, материалы, кожа, чипы) Стикеры/карточки для групп |
||
|
Середина урока 35 минут |
Контекст 1: Нанотехнологии в медицине Нанотехнологии активно применяются в медицине для диагностики и лечения заболеваний. Наночастицы используются для доставки лекарств к определённым клеткам организма, что делает лечение более точным и эффективным. Благодаря этому нанотехнологии помогают уменьшить побочные эффекты и повысить результативность лечения. Задание: Объясните, как наночастицы могут быть использованы для целевой доставки лекарств в организме. Какие преимущества даёт эта технология по сравнению с традиционными методами лечения? Контекст 2: Нанотехнологии в электронике Нанотехнологии применяются для создания более компактных и мощных электронных устройств. Например, современные процессоры, благодаря использованию нанометровых технологий, стали гораздо быстрее и энергоэффективнее. Это позволяет создавать мобильные устройства с высокой производительностью и длительным временем работы. Задание: Объясните, как нанотехнологии изменили современную электронику. Как уменьшение размеров процессоров влияет на скорость работы и энергопотребление устройств? Контекст 3: Наноматериалы в повседневной жизни Наноматериалы, такие как нановолокна и нанопокрытия, используются в повседневной жизни для создания прочных и лёгких материалов. Эти материалы применяются в одежде, строительстве, косметике и даже в автомобильной промышленности. Нанопокрытия делают поверхности более устойчивыми к повреждениям и грязи, а нановолокна — более прочными и долговечными. Задание: Приведите примеры, где наноматериалы используются в повседневной жизни. Какие преимущества дают наноматериалы по сравнению с обычными? |
1.Ученики исследуют пример использования наночастиц в медицинских препаратах и делают краткий доклад о том, как они помогают доставить лекарства к поражённым клеткам, минимизируя влияние на здоровые ткани. Дескрипторы: 1)Правильно называет три примера применения нанотехнологий 2)объясняет их преимущества. 2.Ученики находят примеры современных устройств, созданных с применением нанотехнологий (например, смартфоны или ноутбуки), и делают сравнительный анализ их характеристик с более старыми моделями. Дескриптор: Чётко описывает влияние наноматериалов на свойства предметов, используя конкретные примеры. 3.Ученики составляют список предметов, которые они используют в быту и которые сделаны с применением нанотехнологий (например, спортивная одежда с нановолокнами, смартфоны с нанопокрытием), и объясняют их преимущества. |
Взаимооценивание Словесная оценка учителя «Устная похвала учиеля» |
Карточка с текстом и изображением "Наноробот в крови" Видеофрагмент (30 сек) с визуализацией доставки лекарства Схема: «Традиционное vs Нано-лечение» Карточка с текстом и инфографикой «Эволюция процессоров» Модель чипа (3D-схема или картинка) Сравнительная таблица: 90 нм vs 7 нм процессоры Карточка с примерами: одежда, косметика, авто Фото: нанопокрытие, водоотталкивающая ткань Шаблон таблицы: «Предмет – Нанотехнология – Эффект» |
||
|
Конец урока 5 минут |
"Чемоданчик знаний" Изображает чемодан на доске. |
Записывают самое важное, что "возьмут с собой". |
|
|||
Урок №23
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Современные материалы: от керамики до графена |
|||||
|
Цели обучения согласно программе |
Изучить химические свойства и применение современных материалов. |
|||||
|
Цель урока |
Учащиеся умеют сравнивать свойства различных современных материалов и объяснять их применение. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Что объединяет эти материалы?» Формат: Учитель показывает 3 предмета: алюминиевая банка, стеклянная колба, изображение гибкого экрана. Вопрос к классу: |
1. Высказывают идеи о свойствах материалов. 2. Делятся на тематические группы. 3. Определяют направление исследования по карточке. |
«Устная похвала» |
Реальные предметы: алюминиевая банка, стекло, фото графенового экрана Карточки для деления на группы |
||
|
Середина урока 35 минут |
Контекст 1: Химические свойства и применение алюминия Алюминий — это лёгкий, гибкий и устойчивый к коррозии металл, который широко используется в строительстве, упаковке продуктов, автомобилестроении и электронике. Его низкая плотность и способность к переработке делают алюминий экологически выгодным материалом. Задание: Объясните, какие химические свойства алюминия делают его популярным для использования в строительстве и производстве упаковки. Как переработка алюминия помогает снизить нагрузку на окружающую среду? Контекст 2: Химические свойства стекла и его применение Стекло — это химически инертный, прозрачный материал, который используется в строительстве, оптике, производстве бытовых приборов и упаковке. Оно производится из кремнезёма и обладает высокой устойчивостью к химическим веществам, что делает его незаменимым в химической промышленности и медицине. Задание: Объясните, как химические свойства стекла (прозрачность, химическая инертность) делают его полезным в разных сферах, таких как медицина и строительство. Приведите примеры его применения. Контекст 3: Применение графена в электронике Графен — это материал, состоящий из одного слоя атомов углерода, который обладает невероятной прочностью и высокой электрической проводимостью. Благодаря своим уникальным свойствам, графен применяется в электронике, аккумуляторах, сенсорах и гибких дисплеях. Задание: Объясните, почему графен считается перспективным материалом для электроники. Какие его химические свойства делают его полезным для создания гибких экранов и мощных аккумуляторов? |
1.Ученик составляет таблицу с химическими свойствами алюминия (легкость, устойчивость к коррозии, проводимость тепла) и приводит примеры его использования. Ученик также исследует преимущества переработки алюминия и составляет краткий отчёт о её экологической важности.. Дескриптор: Успешно сравнивает свойства керамики и графена, объясняя их применение. 2.Ученик заполняет таблицу, где описывает основные химические свойства стекла и примеры его применения в повседневной жизни. 3.Ученик исследует, почему стекло используется в оптике и медицине, и делает схему процесса его производства. 4.Ученик создаёт схему, объясняющую структуру графена и его свойства (прочность, проводимость). Он исследует примеры использования графена в современных устройствах, таких как сенсоры или гибкие экраны, и делает доклад для класса о его потенциале в будущем. |
Словесная оценка учителя Самооценивание Словесная оценка учителя |
Карточка с описанием алюминия Инфографика «Жизненный цикл алюминиевой банки» Фото: применение алюминия в зданиях и упаковке Таблица: свойства – применение – экологический эффект Карточка с текстом о стекле Фото: лабораторное стекло, стеклопакеты, оптическое волокно Таблица: свойства – примеры применения – преимущества Иллюстрация структуры графена (гексагональная решётка) Карточка с фактами о графене Фото: гибкий экран, сенсор, батарея |
||
|
Конец урока 5 минут |
"Солнышко и тучка" Размещает два символа на доске. |
Крепят стикеры:
К тучке – что огорчило |
|
|||
Урок №24
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Химия в сельском хозяйстве: повышение урожайности |
|||||
|
Цели обучения согласно программе |
Рассмотреть химические методы повышения урожайности в сельском хозяйстве. |
|||||
|
Цель урока |
Учащиеся способны оценивать эффективность и экологичность различных химических методов в сельском хозяйстве. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
1. Демонстрирует 3 изображения. 2. Делит учащихся
на 3 группы по карточкам: 3. Объявляет тему
и цель: |
1. Делятся наблюдениями по фото. 2. Объединяются в группы. 3. Формулируют первое предположение: "Что даёт химия растениям?" |
Устная похвала |
1. Слайды/фото: поле, техника, упаковки 2. Карточки для распределения по темам |
||
|
Середина урока 35 минут |
Контекст 1: Использование удобрений для повышения урожайности
В сельском хозяйстве удобрения используются для обогащения почвы необходимыми питательными веществами, такими как азот, фосфор и калий. Эти элементы ускоряют рост растений, увеличивая их урожайность. Однако неправильное или избыточное использование удобрений может привести к загрязнению почвы и водоёмов, что отрицательно сказывается на окружающей среде. Задание: Объясните, как азот, фосфор и калий влияют на рост растений. Какие риски связаны с чрезмерным использованием удобрений? Контекст 2: Пестициды и их влияние на урожай
Пестициды используются в сельском хозяйстве для борьбы с вредителями и болезнями растений, что позволяет сохранять урожай. Однако химические вещества, содержащиеся в пестицидах, могут оставаться в почве и попадать в пищевые продукты, вызывая загрязнение окружающей среды и оказывая негативное воздействие на здоровье человека. Задание: Составьте список положительных и отрицательных сторон использования пестицидов. Как можно уменьшить вредное воздействие пестицидов на окружающую среду? Контекст 3: Применение биотехнологий для повышения урожайности
Биотехнологии, такие как генетически модифицированные организмы (ГМО), позволяют создать растения, устойчивые к вредителям и неблагоприятным условиям. Такие растения требуют меньшего количества пестицидов и удобрений, что может сократить негативное влияние на окружающую среду и повысить урожайность. Задание: Объясните, как ГМО помогают увеличить урожайность и снизить использование химических средств. Какие существуют мнения «за» и «против» использования ГМО? |
1 Ученик составляет таблицу с функциями азота, фосфора и калия, объясняя их влияние на рост растений. Затем ученик анализирует, какие экологические проблемы могут возникнуть при чрезмерном использовании удобрений, и предлагает способы их решения. Дескриптор: 1)Определяет основные компоненты удобрений 2)объясняет их роль в росте растений. 2.Ученик составляет два списка — плюсы и минусы использования пестицидов. Затем он исследует экологически безопасные альтернативы пестицидам (например, биопестициды или естественные хищники) и составляет краткое предложение по снижению вредного воздействия химических пестицидов. Дескриптор: Указывает минимум два экологических последствия использования химии в сельском хозяйстве. 3.Ученик исследует примеры ГМО-растений, устойчивых к вредителям и засухе, и составляет таблицу с аргументами «за» и «против» их использования. Он делает презентацию для класса, объясняя, как ГМО могут помочь уменьшить экологический ущерб, связанный с химическими удобрениями и пестицидами. Дескриптор: Предлагает минимум два альтернативных подхода для повышения урожайности. |
Словесная оценка учителя Самооценивание |
1. Таблица: Элемент – Функция – Риск 2. Фото загрязнённой воды и водорослевого цветения 3. Карточка с данными по удобрениям 1. Карточка: что такое пестициды 2. Фото: опрыскивание растений, предупреждающие знаки 3. Таблица для заполнения Карточки: аргументы «за» / «против» (для обсуждения) Фото: кукуруза ГМО, упаковка продуктов Таблица: ГМО – Преимущество – Риск – Мнение |
||
|
Конец урока 5 минут |
"Лестница успеха" Изображает лестницу с пятью ступенями. |
Отмечают свой уровень достижений на определенной ступени. |
|
|||
Урок №25
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Топливные элементы и водородная энергетика |
|||||
|
Цели обучения согласно программе |
Изучить принципы работы топливных элементов и перспективы водородной энергетики. |
|||||
|
Цель урока |
Учащиеся умеют объяснять химические процессы в топливных элементах и оценивать перспективы водородной энергетики |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Что идёт вперёд — вода или бензин?» Формат: Учитель показывает
изображение двух автомобилей: один с выхлопной трубой, другой с
каплей воды. |
1. Обсуждают отличия транспорта. 2. Делятся на группы. 3. Формулируют предположения: «Чем водород лучше бензина?» |
Устная похвала |
Презентация: сравнение машин (бензин / водород) - Стикеры для групп -Видеофрагмент: https://www.youtube.com/watch?v=7PvPz0TuyZ8 |
||
|
Середина урока 35 минут |
Контекст 1: Принцип работы топливных элементов
Топливные элементы — это устройства, которые преобразуют химическую энергию водорода и кислорода в электрическую энергию с минимальными выбросами загрязняющих веществ. Водород поступает в топливный элемент, где в результате реакции с кислородом образуются вода и электричество. Это делает топливные элементы экологически чистым источником энергии для автомобилей и других устройств. Задание: Объясните, как работает топливный элемент на водороде. Какие химические реакции происходят внутри, и какие вещества образуются в результате? Контекст 2: Водородные автомобили
Современные автомобили на водородных топливных элементах предлагают экологичную альтернативу традиционным машинам с двигателем внутреннего сгорания. Эти автомобили не выделяют углекислого газа, так как их «топливом» является водород, а единственным продуктом реакции — вода. Тем не менее, остаются вопросы относительно стоимости и инфраструктуры для заправки водородом. Задание: Сравните автомобили на водородных топливных элементах с традиционными автомобилями на бензине. Какие преимущества и недостатки имеет каждая технология? Контекст 3: Водород как будущее энергетики
Водородная энергетика рассматривается как один из ключевых способов перехода на возобновляемые источники энергии. Водород можно получать из воды с помощью электролиза, а затем использовать его для генерации электричества, не выделяя углекислого газа. Однако процесс получения водорода требует значительных затрат энергии, и обсуждаются различные способы его производства. Задание: Объясните, как можно получать водород с помощью электролиза воды. Какие проблемы существуют при использовании водорода в качестве массового источника энергии? |
1Ученик рисует схему топливного элемента, показывает путь водорода и кислорода, и объясняет, как в результате реакции образуются вода и электричество. Дескриптор: Чётко объясняет принцип работы топливных элементов, используя правильные термины. 2.Ученик составляет таблицу с плюсами и минусами водородных и бензиновых автомобилей, анализируя выбросы, стоимость и инфраструктуру заправки. Дескриптор: Сравнивает водородную энергетику с традиционными источниками топлива, указывая преимущества и недостатки. 3.Ученик описывает процесс электролиза воды и рисует схему, показывающую расщепление воды на водород и кислород. Он также приводит список трудностей, таких как высокая стоимость и энергетические затраты при производстве водорода. Дескриптор: Приводит минимум два примера экологической пользы водородной энергетики. |
Словесная оценка учителя «Верно-неверно» Взаимооценивание Взаимооценивание |
Инфографика: «Как работает водородный топливный элемент»
Уравнение: Анимация реакции Карточка: электрод – ион – вода Таблица-сравнение Фото: Toyota Mirai, заправка H₂, бензоколонка Карточки с фактами (затраты, экологичность) Схема электролиза воды Карточка: «Зелёный водород против серого» Инфографика: Проблемы и плюсы H₂ Таблица: Метод – Энергозатраты – Экологичность |
||
|
Конец урока 5 минут |
"Поезд достижений" Рисует поезд с тремя вагонами (знаю, умею, хочу узнать). |
Заполняют вагоны своими достижениями. |
|
|||
Урок №26
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
3D-печать: химия новой эры производства |
|||||
|
Цели обучения согласно программе |
Рассмотреть химические аспекты технологии 3D-печати. |
|||||
|
Цель урока |
Учащиеся могут объяснить химические принципы 3D-печати и ее применение в различных областях. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ?️ «Что можно напечатать?» Формат: Учитель показывает фотографии 3D-печатных объектов:
Вопрос: |
1. Высказывают предположения. 2. Делятся на группы. 3. Обсуждают возможные области применения 3D-печати. |
Устная похвала |
Фото: 3D-ключ, протез, пластик Карточки для деления по темам |
||
|
Середина урока 35 минут |
Контекст 1: Материалы для 3D-печати 3D-печать — это технология, которая позволяет создавать объекты послойно, используя различные материалы, такие как пластики, металлы и даже биоматериалы. Химические свойства материалов играют ключевую роль в процессе 3D-печати, определяя прочность, гибкость и устойчивость объектов. Задание: Исследуйте, какие материалы используются для 3D-печати и как их химические свойства влияют на конечный продукт. Приведите примеры использования пластиков и металлов в 3D-печати. Контекст 2: Применение 3D-печати в медицине 3D-печать активно используется в медицине для создания протезов, имплантов и даже тканей. С помощью этой технологии можно напечатать детали, идеально подходящие по размеру и форме для каждого пациента. Биологические материалы, применяемые для таких целей, должны обладать специальными химическими свойствами, чтобы быть совместимыми с человеческим телом. Задание: Объясните, как 3D-печать используется в медицине для создания имплантов и протезов. Какие химические и биологические свойства материалов важны для этого процесса? Контекст 3: Экологические аспекты 3D-печати 3D-печать может стать экологически более безопасной альтернативой традиционному производству, поскольку она снижает количество отходов и позволяет использовать переработанные материалы. Однако производство пластиковых объектов может привести к загрязнению, если не соблюдать меры по переработке материалов. Задание: Проанализируйте, как 3D-печать может помочь уменьшить экологическое воздействие производства. Какие меры можно предпринять для использования переработанных материалов в 3D-печати? |
1.Ученик составляет таблицу, где описывает основные материалы для 3D-печати (например, PLA, ABS, металлы) и их химические свойства. Он приводит примеры, как пластики используются для создания прототипов, а металлы — для производства деталей в авиации. Дескриптор: Правильно объясняет химические процессы, обеспечивающие работу 3D-принтеров. 2.Ученик создает схему применения 3D-печати в медицине, показывая, как импланты создаются по индивидуальным параметрам, и описывает, почему биосовместимость и прочность материалов критически важны для их использования в организме. Дескриптор: 1)Приводит минимум два примера материалов, используемых в 3D-печати 2) описывает их свойства. 3.Ученик исследует способы переработки материалов для 3D-печати и составляет предложение для класса о том, как можно использовать переработанные пластиковые материалы для создания новых объектов с помощью 3D-принтера. |
Словесная оценка учителя Самооценивание взаимопроверка |
Инфографика: «Пластики и металлы для 3D-печати» Таблица: «Материал – Свойство – Применение» Фото: объекты из PLA, ABS, металла Карточка: 3D-печать в хирургии и стоматологии Фото: протез, челюсть, имплант Схема: «Материал – Химическое свойство – Биосовместимость» Инфографика: «3D-печать и окружающая среда» Карточки: переработка PLA, экологические проекты Таблица: «Плюсы – Минусы – Решения» |
||
|
Конец урока 5 минут |
"Яблоня отзывов" Крепит на доску дерево. |
Прикрепляют яблоки разных цветов: Красные – отлично понял Желтые – есть вопросы Зеленые – нужна помощь |
|
|||
Урок №27
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Химические источники света: от свечи до OLED |
|||||
|
Цели обучения согласно программе |
Изучить химические процессы, лежащие в основе различных источников света. |
|||||
|
Цель урока |
Учащиеся умеют сравнивать различные источники света с точки зрения их химического принципа действия и эффективности. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Что даёт свет — огонь или электроны?» Формат: На
экране — свеча, лампа накаливания, OLED-экран. |
1. Обсуждают, откуда берётся свет в каждом примере. 2. Делятся на группы. 3. Формулируют гипотезы: что выделяет свет и как? |
«Устная похвала» |
Слайды/изображения: свеча, лампа, OLED Карточки для групп |
||
|
Середина урока 35 минут |
Контекст 1: Свечи как химический источник света
Свеча — это один из древнейших химических источников света. При сгорании воска или парафина происходит химическая реакция, при которой высвобождается энергия в виде тепла и света. В этой реакции участвуют кислород, углерод и водород, а побочные продукты включают углекислый газ и водяной пар. Свечи долго использовались до изобретения электрического освещения, и процесс горения является важным примером экзотермической реакции. Задание: Объясните, какие химические реакции происходят при горении свечи. Почему свеча выделяет тепло и свет? Контекст 2: Лампы накаливания и флуоресцентные лампы
Лампы накаливания и флуоресцентные лампы — это два типа источников света, которые работают по разным химическим и физическим принципам. Лампы накаливания производят свет за счёт нагрева металлической нити, тогда как флуоресцентные лампы используют химические вещества, такие как ртуть, для создания ультрафиолетового излучения, которое преобразуется в видимый свет с помощью люминофора. Задание: Сравните лампы накаливания и флуоресцентные лампы. Какие химические процессы происходят в каждой лампе и как они влияют на энергоэффективность и срок службы ламп? Контекст 3: OLED — органические светодиоды
Органические светодиоды (OLED) — это современная технология, которая использует органические соединения для создания света. При пропускании электрического тока через органический материал, происходит возбуждение молекул, которые излучают свет. OLED широко используются в экранах смартфонов, телевизоров и других устройств благодаря их яркости, гибкости и экономичности. Задание: Объясните, как работает OLED и чем он отличается от обычных светодиодов (LED). Какие преимущества дают органические светодиоды для создания современных дисплеев? |
1.Ученик рисует схему горения свечи, показывая, как кислород взаимодействует с углеводородами воска или парафина, и объясняет, почему в результате высвобождаются свет и тепло. Дескриптор: Чётко описывает принцип работы светодиодов и OLED на уровне химических реакций. 2.Ученик составляет таблицу, где сравнивает химические и физические процессы в лампах накаливания и флуоресцентных лампах, и делает выводы о том, какая лампа более энергоэффективна и долговечна. Дескриптор: Сравнивает эффективность различных источников света по ключевым параметрам. 3.Ученик рисует схему устройства OLED, объясняя, как происходит излучение света на молекулярном уровне, и сравнивает их с обычными светодиодами, исследуя преимущества в яркости и гибкости дисплеев. Дескриптор: Приводит минимум два примера использования источников света в бытовых и промышленных условиях. |
Словесная оценка учителя Самооценивиание Взаимопроверка |
Инфографика: «Горение свечи» Уравнение: Фото: пламя + фаза сажи + теплообмен Таблица: «Вещество – Функция в процессе» Схема: «Как работает каждая лампа» Карточки: ртуть, вольфрам, люминофор Инфографика: «Сравнение световых технологий» Сравнение: LED vs OLED (таблица) Фото: гибкий экран, подсветка в одежде Карточка: «Электрон – Органика – Свет» |
||
|
Конец урока 5 минут |
"Синквейн" Объясняет структуру синквейна. |
Составляют пятистрочное стихотворение об уроке. |
|
|||
Урок №28
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Химия в криминалистике: раскрытие преступлений |
|||||
|
Цели обучения согласно программе |
Ознакомить с химическими методами, используемыми в криминалистике. |
|||||
|
Цель урока |
Учащиеся способны объяснить принципы основных химических методов, применяемых в криминалистике. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод:«Сцена преступления» (мини-квест) Формат: На
доске — изображение сцены преступления: след крови, порошок, стекло
с отпечатком. |
1. Анализируют изображение. 2. Делятся по темам. 3. Формируют версии: как можно "увидеть" невидимое? |
Комментарий учителя |
1. Слайд: «CSI: Химический детектив» 2. Фото сцены преступления |
||
|
Середина урока 35 минут |
Контекст 1: Использование химических реактивов для выявления следов крови
В криминалистике химические реактивы, такие как люминол, используются для обнаружения следов крови на месте преступления, даже если их пытались смыть. Люминол вступает в реакцию с железом в гемоглобине крови, вызывая свечение, которое помогает экспертам обнаружить незаметные глазу следы. Задание: Объясните, как работает люминол для выявления следов крови. Почему его свечение помогает криминалистам? Контекст 2: Анализ наркотических веществ
Химический анализ играет важную роль в идентификации наркотических веществ на месте преступления. Криминалисты используют методы, такие как хроматография и спектроскопия, чтобы определить химический состав образцов и выявить присутствие запрещённых веществ. Задание: Опишите процесс хроматографии и как он помогает в идентификации наркотиков. Какие химические принципы лежат в основе этого метода? Контекст 3: Дактилоскопия и химические методы выявления отпечатков пальцев
Отпечатки пальцев — это важное доказательство на месте преступления. Для их выявления применяются химические методы, такие как использование цианакрилата (суперклея), который вступает в реакцию с жирами и потожировыми выделениями, делая отпечатки видимыми на различных поверхностях. Задание: Объясните, как работает метод выявления отпечатков пальцев с использованием цианакрилата. Какие химические реакции позволяют сделать отпечатки видимыми? |
1.Ученик рисует схему реакции люминола с железом в крови, объясняя, как образуется свечение, и приводит примеры его применения в реальных расследованиях. Дескриптор: 1)Объясняет использование химических методов в криминалистике 2)приводит два примера. 2.Ученик изучает принцип работы хроматографии, рисует схему процесса и объясняет, как разделение веществ помогает криминалистам идентифицировать наркотические вещества. Дескриптор: Правильно записывает реакцию, используемую для анализа химических следов. 3.Ученик изучает процесс взаимодействия цианакрилата с жировыми выделениями, рисует схему процесса и объясняет, почему этот метод широко используется в криминалистике для выявления отпечатков пальцев. Дескриптор: Анализирует преимущества и ограничения химических методов в криминалистике. |
Словесная оценка учителя взаимооценивание Комментарий учителя |
Уравнение: Фото: люминол в действии Карточка: преимущества метода Видео-анимация:
Фото: отпечатки до и после обработки Карточка: «Что такое цианакрилат?» Пошаговая схема реакции |
||
|
Конец урока 5 минут |
"Рефлексивный ринг" Организует пространство для быстрых ответов. |
По очереди высказываются о главном на уроке. |
|
|||
Урок №29
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Растворы и их концентрация |
|||||
|
Цели обучения согласно программе |
Изучить способы выражения концентрации растворов и их практическое применение. |
|||||
|
Цель урока |
Учащиеся умеют рассчитывать концентрации растворов и готовить растворы заданной концентрации. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: «Сколько сахара в напитке?» Формат: Учитель показывает три стакана с растворами сахара (разной
концентрации). |
1. Обсуждают, что такое раствор и концентрация. 2. Сравнивают свойства разных растворов. 3. Делятся идеями: как измерить «насыщенность» раствора. |
Комментарий учителя |
Карточки с формулами концентрации (Cm = mв-ва / mр-ра · 100%) Мини-викторина:
|
||
|
Середина урока 35 минут |
✅ Задание 1: Заполнение таблицы "Концентрация растворов" Заполните таблицу, определяя, какой компонент является растворителем, а какой — растворённым веществом. Укажите возможную массовую долю и влияние концентрации.
✅ Задание 2: Составление схемы "Как приготовить раствор?" Составьте пошаговую схему приготовления раствора с заданной концентрацией (например, 10% NaCl):
Формат: Работа в парах с шаблоном, калькулятором и карточками ✅ Задание 3: Обсуждение "Где концентрация имеет значение?" Составьте два списка: |
Определяет компоненты раствора, применяет формулу массовой доли. Дескриптор: Учащийся заполняет таблицу, указывая растворённые вещества и влияние концентрации. 2.Рассчитывает массу компонентов и строит визуальную схему приготовления раствора. Дескриптор: Учащийся составляет схему приготовления раствора с нужной концентрацией. 3. Приводит примеры последствий ошибки в концентрации и способы контроля. Дескриптор: Учащийся обосновывает важность концентрации в реальной жизни. |
Словесная оценка учителя Взаимооценка Самооценка |
1. Формула массовой доли вещества:
2. Раздаточные
карточки с «подсказками»: Раздаточные
карточки с заданиями: Кейс-карточки «Опасность
концентрации»: |
||
|
Конец урока 5минут |
"Цветовая гамма" Раскладывает цветные карточки. |
Выбирают цвет, соответствующий их настроению и успехам. |
Цветные карточки для рефлексии |
|||
Урок №30
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Кристаллы и кристаллические решетки |
|||||
|
Цели обучения согласно программе |
Рассмотреть типы кристаллических решеток и их влияние на свойства веществ. |
|||||
|
Цель урока |
Учащиеся способны определять тип кристаллической решетки вещества и предсказывать его свойства. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Что объединяет лёд, соль и графит?» Формат: Учитель показывает
изображения (или реальные образцы): кристаллы соли, лёд, графит
(грифель), золото. |
1. Разглядывают и сравнивают материалы. 2. Делятся ассоциациями. 3. Объединяются в тематические группы. |
Устный комментарий учителя |
Изображения или образцы: соль, лёд, кварц, графит, медь Мини-викторина:
|
||
|
Середина урока 35 минут |
✅ Задание 1: Заполнение таблицы «Типы кристаллических решёток» Заполните таблицу:
✅ Задание 2: Схема «Как строится кристалл?» Составьте схему формирования кристаллической решётки (на примере NaCl):
✅ Задание 3: Обсуждение «Кристаллы в повседневной жизни» Составьте 2
списка: |
1.Определяет тип решётки по частицам и заполняет свойства. Дескриптор: Учащийся правильно определяет тип решётки, приводит примеры и описывает свойства. 2.Визуализирует процесс образования кристаллов.
Дескриптор: Учащийся создаёт схему с этапами образования кристаллической решётки. 3.Связывает свойства кристаллов с их применением. Дескриптор: Учащийся объясняет практическое применение веществ с разными типами кристаллической решётки. |
Взаимооценивание по критериям Взаимооценка Комментарий учителя |
1. Таблица с подсказками 2. Модельные изображения решёток Карточки с этапами (перемешаны) Плакат «Как строится решётка» Фото кристаллов в увеличении 1.Фото: кристаллы сахара, соли, алмаза, кремния 2. Таблица: «Кристалл – Свойство – Применение» |
||
|
Конец урока 5 минут |
"Газета успеха" Крепит на доску лист ватмана. |
Пишут заголовки новостей об уроке. |
|
|||
Урок №31
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Электролитическая диссоциация |
|||||
|
Цели обучения согласно программе |
Изучить процесс электролитической диссоциации и его роль в химических реакциях. |
|||||
|
Цель урока |
Учащиеся умеют составлять уравнения диссоциации и объяснять свойства электролитов. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Что происходит с солью в воде?» Формат: Учитель показывает два стакана: один с водой и солью,
другой с водой и сахаром. |
1. Сравнивают растворы. 2. Делают предположения о причинах проводимости. 3. Определяют тему и цели урока. |
Устный комментарий учителя |
Презентация: «Растворы и проводимость» Фото: глюкоза и NaCl в растворе
|
||
|
Середина урока 35 минут |
✅ Задание 1: Заполнение таблицы «Кто диссоциирует?» Заполните таблицу:
✅ Задание 2: Схема «Как распадается вещество?» Создайте схему или комикс из 4 шагов:
✅ Задание 3: Обсуждение «Зачем нужны электролиты?» Составьте два
списка: |
1Ученик классифицирует вещества и записывает уравнения диссоциации. Дескриптор: Учащийся правильно определяет тип вещества и уравнение его диссоциации
2Ученик визуализирует пошаговый процесс диссоциации на примере NaCl или HCl.
Дескриптор: Учащийся строит логичную схему процесса с указанием частиц. 3.Находит связь между диссоциацией и её ролью в жизни. Дескриптор: Учащийся объясняет значение электролитов в быту и биологии. |
. Взаимооценивание Верно-неверно Самооценка Комментарий учителя «Отлично», «Прекрасно» Все верно» «Умничка» |
Таблица растворимости Примеры уравнений: HCl → H⁺ + Cl⁻ Карточки: «Электролит или нет?» Шаблон схемы «до и после» Модель ионного распада Карточки с ионами Na⁺, Cl⁻, H⁺, OH⁻ Фото: электролит в аккумуляторе, спортивный напиток, плазма крови Инфографика: «Электролиты в организме» Таблица: «Соль – Ионы – Значение» |
||
|
Конец урока 5 минут |
"Рюкзак пожеланий" Рисует рюкзак на доске. |
Пишут пожелания себе и одноклассникам. |
|
|||
Урок №32
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Окислительно-восстановительные реакции в природе и технике |
|||||
|
Цели обучения согласно программе |
Рассмотреть механизмы окислительно-восстановительных реакций и их значение. |
|||||
|
Цель урока |
Учащиеся могут определять окислитель и восстановитель в реакциях и приводить примеры ОВР в природе и технике. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ?️ «Где вы встречали ржавчину?» Формат: Учитель показывает
фото: ржавый гвоздь, горение дров, дыхание, аккумулятор. |
|
Комменатрий учителя |
Фото: ржавчина, костёр, выхлоп, дыхание Видео: ОВР в жизни https://www.youtube.com/watch?v=dSwyspWbQKU |
||
|
Середина урока 35 минут |
Задание 1 (ГРУППОВОЕ): Проект «ОВР в природе» Инструкция: Постер должен включать: ⚙️ Задание 2 (ПАРНОЕ): Разбор «ОВР в технике» Инструкция: Ваша задача: Задание 3 (ИНДИВИДУАЛЬНОЕ): Картотека реакций Инструкция: Пример
уравнения: |
1.Исследует природное явление, определяет участников ОВР и визуализирует процесс.. Дескриптор: Учащийся объясняет суть ОВР, указывает реагенты, и оформляет материал в виде постера
2 В паре анализирует описание, выделяет участников реакции и объясняет её роль. Дескриптор: Учащийся определяет элементы-донора и акцептора электронов, делает логический вывод. 3Самостоятельно работает с химическими уравнениями, выявляя ОВР по степеням окисления.
Дескриптор: Учащийся корректно определяет степени окисления и указывает окислитель/восстановитель. |
. Взаимооценивание по критериям Самооцениванаие |
Таблица ОВР-примеров Карточки: "Окислитель", "Восстановитель", "Природный контекст" Бумага, маркеры, схемы, шаблон постера Таблица ОВР-признаков Подсказки-символы: ? (окисл.) ? (восст.) Бланк с уравнениями Таблица степеней окисления Цветные маркеры или иконки |
||
|
Конец урока 5 минут |
"Термометр знаний" |
Отмечают уровень своего понимания темы. |
Термометр знаний |
|||
Урок №33
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Скорость химических реакций и факторы, влияющие на нее |
|||||
|
Цели обучения согласно программе |
Изучить понятие скорости химической реакции и факторы, влияющие на нее. |
|||||
|
Цель урока |
Учащиеся умеют объяснять влияние различных факторов на скорость химических реакций и применять эти знания на практике. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Реакция — быстро или медленно?» Формат: Учитель показывает короткое видео:
Вопрос: |
1. Делятся предположениями. 2. Делятся на форматы работы. 3. Обсуждают: какие реакции они видели в жизни.
|
Устный комментарий учителя |
Мини-тест:
|
||
|
Середина урока 35 минут |
Задание 1 (ГРУППОВОЕ): Постер-фактор «Ускорь или замедли» Инструкция:
Включите: ⚗ Задание 2 (ПАРНОЕ): Моделируем реакцию Инструкция: ? Ситуации: –
Увеличили температуру при реакции с цинком Выполните: Задание 3 (ИНДИВИДУАЛЬНОЕ): Квиз + мини-анализ Инструкция: 1. Пройди мини-квиз из 5 вопросов (мгновенная проверка знаний по факторам).
2. Выбери 1
реакцию (из 3 предложенных) и напиши: Реакция
1:
Реакция
2:
Реакция
3:
|
1 Выбирает фактор, исследует его и оформляет постер с визуализацией. Дескриптор: Учащийся объясняет влияние одного из факторов на скорость реакции и приводит пример.
2 В паре анализирует ситуацию, обсуждает, делает прогноз.
Дескриптор: Учащийся объясняет, как изменение условий влияет на скорость, с научным обоснованием.
3Отвечает на вопросы и применяет знания в мини-анализе. Дескриптор: Учащийся демонстрирует знание факторов и умеет применять их к конкретной реакции.
|
Взаимооценивание групп Устная похвала учителя «Отлично», «Прекрасно» Все верно» «Умничка» Самооценивание Верно-неверно |
Карточки: «Фактор», «Пример», «Схема» Таблицы с данными Графики скорости Бумага, маркеры, фломастеры Карточки-сценарии Таблица «Фактор – Последствие» Подсказки: кинетика, энергия активации Google-форма/бумажный квиз Лист с реакциями Краткий справочник по факторам Иконки: ? температура, ? концентрация, площадь |
||
|
Конец урока 5 минут |
"Дневник успеха" Раздает мини-дневники. |
Записывают свои достижения и трудности. |
|
|||
Урок №34
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Химическое равновесие и принцип Ле Шателье |
|||||
|
Цели обучения согласно программе |
Рассмотреть понятие химического равновесия и принцип Ле Шателье. |
|||||
|
Цель урока |
Учащиеся способны предсказывать смещение химического равновесия при изменении условий реакции. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ⚖ «Качели химии» Формат: Учитель
демонстрирует рисунок или анимацию: равновесие как качели. |
Действия учащихся:
|
Комменатрий учителя Верно-неверно |
Слайд/анимация: качели/весы Викторина:
|
||
|
Середина урока 35 минут |
✅ Задание 1 (ГРУППОВОЕ): «Сценарии смещения» Инструкция: ? Пример:
✅ Задание 2 (ПАРНОЕ): «Вопрос по уравнению» Инструкция:
? Пример:
✅ Задание 3 (ИНДИВИДУАЛЬНОЕ): «Разбор равновесия» Инструкция:
? Пример:
|
1 Анализирует реакцию, интерпретирует смещение равновесия и визуализирует его.
Дескриптор: Учащийся объясняет смещение равновесия при изменении условий, используя принцип Ле Шателье. 2Задаёт и отвечает на содержательные вопросы по конкретным условиям реакции. Дескриптор: Учащийся аргументированно отвечает на вопросы, демонстрируя понимание принципа Ле Шателье. 3 Применяет знания для анализа конкретной реакции и условий.
Дескриптор: Учащийся прогнозирует направление смещения равновесия при изменении условий. |
Взаимоооценивнаие парами Верно-неверно Самооценка по шаблону |
Карточки с уравнениями и сценариями Постер/схема «Как реагирует система» Иконки: ? T, ? P, ↑ концентрация Бумага, фломастеры, шаблоны комикса Карточки с реакциями Список возможных воздействий Таблица: «Что влияет — Как меняется» Таймер на 5 мин
Бланк ответа Таблица: экзо-/эндотермические реакции Краткий алгоритм «3 шага для анализа» |
||
|
Конец урока 5 минут |
"Поляна мнений" Создает пространство для высказываний. |
Размещают цветы-отзывы на поляне: Красные – полное понимание Синие – частичное понимание Белые – нужна помощь |
Цветы для отзывов Красные, синие, белые |
|||
38
жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
Эффективность PISA заданий в обучении химии"
Эффективность PISA заданий в обучении химии"
Пояснительная записка
Данная авторская программа "Эффективность PISA заданий в обучении химии" разработана для учащихся 8 класса с целью развития функциональной грамотности в области естественных наук, в частности химии, в соответствии с международными стандартами оценки PISA (Programme for International Student Assessment). Программа направлена на формирование у учащихся навыков применения химических знаний в реальных жизненных ситуациях, развитие критического мышления и способности анализировать комплексные проблемы.
Особенностью программы является ее практико-ориентированный характер, позволяющий связать теоретические знания по химии с повседневной жизнью и глобальными вызовами современности. Значительное внимание уделяется развитию умений интерпретировать научные данные, формулировать гипотезы и планировать исследования.
Программа предусматривает использование интерактивных методов обучения, включая работу с текстами научно-популярного характера, анализ графиков и диаграмм, проведение виртуальных экспериментов. Это способствует развитию критического мышления, навыков работы с информацией и умения применять знания в нестандартных ситуациях.
Структура курса выстроена с учетом основных содержательных линий PISA по естественнонаучной грамотности и включает темы, связанные с физическими системами, живыми системами, а также науками о Земле и Вселенной в контексте химических знаний. Особое внимание уделяется экологическим аспектам и вопросам устойчивого развития.
Программа направлена не только на подготовку к успешному выполнению заданий PISA, но и на формирование у учащихся целостной научной картины мира, развитие их исследовательских навыков и мотивации к изучению естественных наук.
Цель программы:
Развитие естественнонаучной грамотности учащихся 8 класса через формирование навыков решения практико-ориентированных заданий по химии в формате PISA, с акцентом на применение химических знаний в реальных жизненных ситуациях и развитие критического мышления.
Задачи программы:
1. Сформировать у учащихся понимание ключевых химических концепций и их связи с повседневной жизнью и глобальными проблемами.
2. Развить навыки анализа и интерпретации научных данных, представленных в различных форматах (текст, график, таблица, диаграмма).
3. Научить учащихся формулировать научные гипотезы и планировать эксперименты для их проверки.
4. Развить умение применять химические знания для объяснения природных явлений и технологических процессов.
5. Сформировать навыки критической оценки достоверности научной информации и аргументации своей позиции.
6. Развить способность решать междисциплинарные задачи, связанные с химическими аспектами экологии и устойчивого развития.
7. Сформировать умение работать с заданиями различных типов, характерных для формата PISA.
8. Развить мотивацию к изучению химии и понимание ее роли в решении глобальных проблем человечества.
Межпредметная связь:
- Физика: изучение физических свойств веществ, энергетических преобразований в химических реакциях.
- Биология: рассмотрение биохимических процессов, влияния химических веществ на живые организмы.
- Математика: анализ графиков и диаграмм, статистическая обработка данных химических экспериментов.
- Экология: рассмотрение влияния химических веществ на окружающую среду, проблемы загрязнения и очистки.
Методы, используемые на уроке:
1. Анализ комплексных текстов научно-популярного характера.
2. Работа с графиками, диаграммами и таблицами данных.
3. Проведение виртуальных лабораторных экспериментов.
4. Групповые дискуссии и дебаты по проблемным вопросам.
5. Метод кейсов: анализ реальных ситуаций, связанных с применением химических знаний.
8. Использование онлайн-симуляторов для моделирования химических процессов.
Критерии, которые должны знать ученики:
1. Понимание основных химических концепций и их применение в реальных ситуациях.
2. Умение интерпретировать научные данные, представленные в различных форматах.
3. Навыки формулирования научных вопросов и гипотез.
4. Способность планировать и оценивать научные исследования.
5. Умение делать выводы на основе имеющихся данных и аргументировать свою позицию.
6. Понимание взаимосвязи между химическими, биологическими и физическими процессами.
7. Навыки критического анализа достоверности научной информации.
8. Умение применять химические знания для решения экологических проблем.
Направление авторской программы:
Программа направлена на развитие функциональной естественнонаучной грамотности учащихся 8 класса через решение практико-ориентированных заданий по химии в формате PISA. Особое внимание уделяется формированию навыков применения химических знаний в реальных жизненных ситуациях, развитию критического мышления и способности анализировать комплексные проблемы на стыке различных научных дисциплин.
Новизна авторской программы:
Новизна программы заключается в интеграции содержания школьного курса химии 8 класса с форматом заданий PISA и актуальными проблемами современности.
Актуальность авторской программы:
Актуальность программы обусловлена необходимостью повышения уровня естественнонаучной грамотности учащихся в соответствии с международными стандартами PISA. Программа отвечает на вызовы современного образования, связанные с подготовкой учащихся к жизни в быстро меняющемся мире, где критическое мышление и способность применять научные знания для решения реальных проблем становятся ключевыми компетенциями. Особое внимание уделяется экологическим аспектам химии и вопросам устойчивого развития, что соответствует глобальной повестке и формирует у учащихся ответственное отношение к окружающей среде.
Ожидаемые результаты:
1. Учащиеся демонстрируют понимание ключевых химических концепций и способны применять их для объяснения явлений повседневной жизни.
2. Учащиеся успешно анализируют и интерпретируют научные данные, представленные в виде текстов, графиков, таблиц и диаграмм.
3. Учащиеся умеют формулировать научные вопросы и гипотезы, а также предлагать методы их проверки.
4. Учащиеся способны планировать и оценивать простые научные исследования, учитывая факторы достоверности и погрешности.
5. Учащиеся демонстрируют навыки критического мышления при оценке научной информации из различных источников.
6. Учащиеся умеют применять химические знания для анализа и решения экологических проблем на локальном и глобальном уровнях.
7. Учащиеся успешно решают междисциплинарные задачи, связывая знания из области химии, физики, биологии и географии.
8. Учащиеся проявляют повышенный интерес к изучению химии и понимание ее роли в современном мире и будущей профессиональной деятельности.
Инновационные педагогические особенности: Актуальность данного опыта связана с необходимостью развития функциональной грамотности учащихся в соответствии с современными требованиями образования. Обучение химии через задания в формате PISA позволяет развивать практические навыки, критическое мышление и способность применять полученные знания в жизни.
Научно-методический уровень содержания: Программа основана на современных научных представлениях и учитывает возрастные особенности учащихся 8 класса. Обеспечена гармоничная интеграция теоретических знаний и практических навыков, что способствует более эффективному усвоению материала.
Степень новизны содержания: Программа включает актуальные экологические проблемы, современные технологические примеры и последние достижения в области химии. Используется инновационный подход к представлению традиционного материала, что делает обучение более интересным и актуальным для учащихся.
Научность содержания: Корректно используется химическая терминология, точно описываются химические процессы. Материал представлен в логической последовательности в соответствии с современной научной картиной мира, что обеспечивает системное понимание предмета.
Исследование PISA и компоненты функциональной грамотности: Программа направлена на развитие естественнонаучной грамотности, критического мышления и формирование способности применять знания в реальных ситуациях. Особое внимание уделяется развитию аналитических навыков и умению интерпретировать научные данные.
Практическая значимость: Программа имеет тесную связь с повседневной жизнью учащихся, направлена на развитие навыков проведения химических экспериментов, формирование экологического мышления и подготовку к решению практических жизненных задач. Особый акцент делается на применении полученных знаний в реальных ситуациях.
Содержательный раздел
Раздел 1: Химия в повседневной жизни
-
Химические вещества вокруг нас: от кухни до космоса
-
Вода и ее уникальные свойства
-
Кислоты и основания в быту
-
Химия пищи: питательные вещества и добавки
-
Лекарства и их воздействие на организм
-
Косметические средства: состав и безопасность
-
Бытовая химия: эффективность и экологичность
Раздел 2: Химия и окружающая среда
-
Воздух: состав, загрязнение и очистка
-
Парниковый эффект и изменение климата
-
Кислотные дожди: причины и последствия
-
Пластиковое загрязнение: проблемы и решения
-
Тяжелые металлы в окружающей среде
-
Химические удобрения: польза и вред
-
Альтернативные источники энергии и химия
Раздел 3: Основные классы химических соединении
-
Оксиды и их свойства
-
Свойства кислот
-
Щелочи
-
Соли. Образование ионных связей
-
Амфотерные соединения и их свойства
-
Практические задании на основные классы неорганических соединении
-
Лабораторные работы
Раздел 4: Химия и технологии
-
Нанотехнологии в повседневной жизни
-
Современные материалы: от керамики до графена
-
Химия в сельском хозяйстве: повышение урожайности
-
Топливные элементы и водородная энергетика
-
3D-печать: химия новой эры производства
-
Химические источники света: от свечи до OLED
-
Химия в криминалистике: раскрытие преступлений
Раздел 5: Практические аспекты химии
-
Растворы и их концентрация
-
Кристаллы и кристаллические решетки
-
Электролитическая диссоциация
-
Окислительно-восстановительные реакции в природе и технике
-
Скорость химических реакций и факторы, влияющие на нее
-
Химическое равновесие и принцип Ле Шателье
Нормативный раздел
|
Р/c |
Раздел Отделение Тема |
Цель обучения |
Количество часов |
Учебный результат |
||
|
Всего |
Теория |
Практика |
||||
|
Раздел 1: Химия в повседневной жизни |
||||||
|
1. |
Химические вещества вокруг нас: от кухни до космоса |
Ознакомить учащихся с разнообразием химических веществ в повседневной жизни и их свойствами. |
1 |
|
1 |
Учащиеся умеют идентифицировать химические вещества в бытовых предметах и объяснять их свойства. |
|
2. |
Вода и ее уникальные свойства |
Изучить особые свойства воды и их значение для жизни на Земле. |
1 |
|
1 |
Учащиеся могут объяснить аномальные свойства воды и их роль в природных процессах. |
|
3. |
Кислоты и основания в быту |
Познакомить с кислотами и основаниями, встречающимися в повседневной жизни. |
1 |
|
1 |
Учащиеся умеют определять кислоты и основания в бытовых веществах и объяснять их действие. |
|
4. |
Химия пищи: питательные вещества и добавки |
Рассмотреть химический состав пищевых продуктов и роль пищевых добавок. |
1 |
|
1 |
Учащиеся способны анализировать состав продуктов питания и оценивать влияние пищевых добавок на организм. |
|
5. |
Лекарства и их воздействие на организм |
Изучить химические основы действия лекарственных препаратов. |
1 |
|
1 |
Учащиеся понимают механизмы действия основных групп лекарств и могут объяснить их эффекты. |
|
6. |
Косметические средства: состав и безопасность |
Рассмотреть химический состав косметических средств и вопросы их безопасности. |
1 |
|
1 |
Учащиеся умеют анализировать состав косметических средств и оценивать их потенциальное влияние на здоровье. |
|
7. |
Бытовая химия: эффективность и экологичность |
Изучить химический состав бытовых чистящих средств и их влияние на окружающую среду. |
1 |
|
1 |
Учащиеся способны выбирать эффективные и экологичные бытовые химические средства. |
|
Раздел 2: Химия и окружающая среда |
||||||
|
8. |
Воздух: состав, загрязнение и очистка |
Изучить состав воздуха, источники его загрязнения и методы очистки. |
1 |
|
1 |
Учащиеся умеют анализировать данные о загрязнении воздуха и предлагать методы его очистки. |
|
9. |
Парниковый эффект и изменение климата |
Рассмотреть химические аспекты парникового эффекта и его влияние на климат. |
1 |
|
1 |
Учащиеся могут объяснить механизм парникового эффекта и предложить меры по снижению выбросов парниковых газов. |
|
10. |
Кислотные дожди: причины и последствия |
Изучить химические процессы образования кислотных дождей и их воздействие на окружающую среду. |
1 |
|
1 |
Учащиеся умеют объяснять причины образования кислотных дождей и оценивать их последствия для экосистем. |
|
11. |
Пластиковое загрязнение: проблемы и решения |
Рассмотреть химические свойства пластиков и проблемы их утилизации. |
1 |
|
1 |
Учащиеся способны предложить решения проблемы пластикового загрязнения на основе химических знаний. |
|
12. |
Тяжелые металлы в окружающей среде |
Изучить источники поступления тяжелых металлов в окружающую среду и их влияние на живые организмы. |
1 |
|
1 |
Учащиеся умеют оценивать риски, связанные с загрязнением тяжелыми металлами, и предлагать методы очистки. |
|
13. |
Химические удобрения: польза и вред |
Рассмотреть химический состав удобрений, их влияние на урожайность и экологические последствия их применения. |
1 |
|
1 |
Учащиеся способны анализировать преимущества и недостатки использования химических удобрений. |
|
14. |
Альтернативные источники энергии и химия |
Изучить химические аспекты различных альтернативных источников энергии. |
1 |
|
1 |
Учащиеся умеют сравнивать различные источники энергии с точки зрения их химических свойств и экологичности. |
|
Раздел 3: Основные классы химических соединении |
||||||
|
15. |
Оксиды и их свойства |
Изучить классификацию оксидов, их физические и химические свойства. |
1 |
|
1 |
Учащиеся смогут классифицировать оксиды и описывать их основные химические свойства. |
|
16. |
Свойства кислот |
Исследовать химические свойства кислот и их взаимодействие с различными веществами. |
1 |
|
1 |
Учащиеся смогут объяснить основные свойства кислот и записывать уравнения их химических реакций. |
|
17. |
Щелочи |
Изучить химические свойства щелочей и их применение в повседневной жизни. |
1 |
|
1 |
Учащиеся смогут характеризовать щелочи и описывать их взаимодействие с другими веществами. |
|
18. |
Соли. Образование ионных связей |
Исследовать механизм образования ионных связей и способы получения солей. |
1 |
|
1 |
Учащиеся смогут объяснить процесс образования ионных связей и различные способы получения солей. |
|
19. |
Амфотерные соединения и их свойства |
Изучить особенности амфотерных соединений и их двойственную природу. |
1 |
|
1 |
Учащиеся смогут определять амфотерные соединения и объяснять их способность проявлять кислотные и основные свойства. |
|
20. |
Практические задании на основные классы неорганических соединении |
Закрепить знания о химических свойствах основных классов неорганических соединений через решение практических задач. |
1 |
|
1 |
Учащиеся смогут решать расчетные задачи, составлять уравнения реакций и определять продукты химических превращений для основных классов неорганических соединений. |
|
21. |
Лабораторные работы |
Сформировать практические навыки работы с различными классами неорганических веществ в лабораторных условиях. |
1 |
|
1 |
Учащиеся освоят технику безопасности, научатся проводить химические эксперименты, наблюдать и описывать их результаты, делать выводы на основе наблюдений. |
|
Раздел 4: Химия и технологии |
||||||
|
22. |
Нанотехнологии в повседневной жизни |
Ознакомить с принципами нанотехнологий и их применением в повседневной жизни. |
1 |
|
1 |
Учащиеся могут привести примеры использования нанотехнологий в быту и объяснить их преимущества. |
|
23. |
Современные материалы: от керамики до графена |
Изучить химические свойства и применение современных материалов. |
1 |
1 |
|
Учащиеся умеют сравнивать свойства различных современных материалов и объяснять их применение. |
|
24. |
Химия в сельском хозяйстве: повышение урожайности |
Рассмотреть химические методы повышения урожайности в сельском хозяйстве. |
1 |
|
1 |
Учащиеся способны оценивать эффективность и экологичность различных химических методов в сельском хозяйстве. |
|
25. |
Топливные элементы и водородная энергетика |
Изучить принципы работы топливных элементов и перспективы водородной энергетики. |
1 |
|
1 |
Учащиеся умеют объяснять химические процессы в топливных элементах и оценивать перспективы водородной энергетики |
|
26. |
3D-печать: химия новой эры производства |
Рассмотреть химические аспекты технологии 3D-печати. |
1 |
1 |
|
Учащиеся могут объяснить химические принципы 3D-печати и ее применение в различных областях. |
|
27. |
Химические источники света: от свечи до OLED |
Изучить химические процессы, лежащие в основе различных источников света. |
1 |
1 |
|
Учащиеся умеют сравнивать различные источники света с точки зрения их химического принципа действия и эффективности. |
|
28. |
Химия в криминалистике: раскрытие преступлений |
Ознакомить с химическими методами, используемыми в криминалистике. |
1 |
1 |
|
Учащиеся способны объяснить принципы основных химических методов, применяемых в криминалистике. |
|
Раздел 5: Практические аспекты химии |
||||||
|
29. |
Растворы и их концентрация |
Изучить способы выражения концентрации растворов и их практическое применение. |
1 |
1 |
|
Учащиеся умеют рассчитывать концентрации растворов и готовить растворы заданной концентрации. |
|
30. |
Кристаллы и кристаллические решетки |
Рассмотреть типы кристаллических решеток и их влияние на свойства веществ. |
1 |
1 |
|
Учащиеся способны определять тип кристаллической решетки вещества и предсказывать его свойства. |
|
31. |
Электролитическая диссоциация |
Изучить процесс электролитической диссоциации и его роль в химических реакциях. |
1 |
1 |
|
Учащиеся умеют составлять уравнения диссоциации и объяснять свойства электролитов. |
|
32. |
Окислительно-восстановительные реакции в природе и технике |
Рассмотреть механизмы окислительно-восстановительных реакций и их значение. |
1 |
|
1 |
Учащиеся могут определять окислитель и восстановитель в реакциях и приводить примеры ОВР в природе и технике. |
|
33. |
Скорость химических реакций и факторы, влияющие на нее |
Изучить понятие скорости химической реакции и факторы, влияющие на нее. |
1 |
|
1 |
Учащиеся умеют объяснять влияние различных факторов на скорость химических реакций и применять эти знания на практике. |
|
34. |
Химическое равновесие и принцип Ле Шателье |
Рассмотреть понятие химического равновесия и принцип Ле Шателье. |
1 |
1 |
|
Учащиеся способны предсказывать смещение химического равновесия при изменении условий реакции. |
|
Всего 34 часов |
||||||
Информационно-методический раздел
Целевая аудитория и предназначение
Авторская программа "Эффективность PISA заданий в обучении химии" создана для учеников 8 класса. Она направлена на развитие навыков применения химических знаний в повседневных ситуациях, что соответствует формату заданий PISA. Программа способствует формированию естественнонаучной грамотности и критического мышления.
Оценка успехов учащихся
При оценке достижений учеников особое внимание уделяется:
-
Умению связывать химические концепции с реальными жизненными ситуациями
-
Способности анализировать и интерпретировать данные экспериментов
-
Навыкам формулирования выводов на основе научных фактов
-
Умению объяснять химические явления простым и понятным языком
Современные методы обучения
-
Метод кейсов: решение реальных проблем, связанных с химией в повседневной жизни
-
Игровое обучение: использование химических викторин и настольных игр для закрепления знаний
-
Проектное обучение: выполнение мини-исследований по актуальным экологическим проблемам
Подходы к решению PISA заданий
-
Внимательное чтение и анализ контекста задания
-
Выделение ключевой информации из текста, графиков и таблиц
-
Применение базовых химических знаний для объяснения наблюдаемых явлений
-
Формулирование аргументированных ответов с использованием научной терминологии
Учебные материалы
-
Сборник PISA-подобных заданий по химии с пошаговыми решениями
-
Виртуальная лаборатория для проведения безопасных химических экспериментов
-
Интерактивные карты и схемы для визуализации химических процессов в природе
-
Онлайн-форум для обсуждения сложных вопросов и обмена идеями между учениками
Критерии оценивания
1-2 балла (Начальный уровень): Ученик демонстрирует базовое знакомство с химическими понятиями. Может узнавать простейшие химические формулы и названия веществ. Затрудняется в интерпретации данных из текста задания PISA и не может применить знания в контексте реальных ситуаций.
3-4 балла (Элементарный уровень): Учащийся понимает основные химические концепции. Способен извлекать простую информацию из текста и графиков PISA заданий. Может дать краткие ответы на вопросы, но испытывает трудности с аргументацией своей позиции.
5-6 баллов (Базовый уровень): Ученик демонстрирует твердое знание ключевых тем по химии. Умеет анализировать несложные данные из PISA заданий и делать простые выводы. Способен применять знания в знакомых контекстах, но может испытывать трудности в новых ситуациях.
7-8 баллов (Продвинутый уровень): Учащийся показывает глубокое понимание химических процессов. Успешно анализирует комплексную информацию из PISA заданий, включая графики и таблицы. Способен применять знания в различных контекстах и предлагать обоснованные решения проблем.
9-10 баллов (Исследовательский уровень): Ученик демонстрирует исключительное понимание химии и ее роли в реальном мире. Способен критически анализировать сложные данные, выдвигать гипотезы и предлагать креативные решения в контексте PISA заданий. Умеет аргументированно объяснять химические явления, связывая их с глобальными проблемами.
Рекомендуемая литература
Для учителей:
-
Нурахметов Н.Н., Мансуров З.А., Рыскалиева Р.Г. "Химия: Учебник для 8 класса общеобразовательных школ" - Алматы: Мектеп, 2020.
-
OECD "PISA 2018 Assessment and Analytical Framework" - Paris: OECD Publishing, 2019.
-
Тюменева Ю.А., Александрова Е.И. "Естественнонаучная грамотность и ее оценка в международном исследовании PISA" - Москва: Институт образования НИУ ВШЭ, 2018.
-
Абылкасымова А.Е. "Формирование функциональной грамотности учащихся в контексте международных исследований" - Алматы: Қазақ университеті, 2019.
-
Ковалева Г.С., Пентин А.Ю., Никифоров Г.Г. "Естественнонаучная грамотность. Сборник эталонных заданий" - Москва: Просвещение, 2020.
Для учеников:
-
Нурахметов Н.Н., Мансуров З.А., Рыскалиева Р.Г. "Химия: Учебник для 8 класса общеобразовательных школ" - Алматы: Мектеп, 2020.
-
Аширов А.М. "Занимательная химия для школьников" - Алматы: Атамұра, 2019.
-
Әлімқұлова Р.Д. "Химия есептері мен жаттығулары: 8-9 сыныптар" - Алматы: Мектеп, 2021.
-
Темирбулатова А.Е. "Сборник задач по химии с решениями. 8-9 классы" - Астана: Арман-ПВ, 2020.
-
Габриелян О.С., Остроумов И.Г. "Химия в тестах, задачах и упражнениях. 8 класс" - Москва: Дрофа, 2019.
Для родителей:
-
Курамшин А.И. "Жизнь замечательных веществ" - Москва: АСТ, 2020.
-
Леенсон И.А. "Занимательная химия для детей и взрослых" - Москва: Аст-Пресс Книга, 2019.
-
Акимушкин И.И. "Невидимые нити природы" - Москва: АСТ, 2018.
-
Стрельникова Л.Н. "Из чего всё сделано? Рассказы о веществе" - Москва: Яуза, 2019.
-
Мансуров З.А. "Химия вокруг нас: занимательные опыты для школьников" - Алматы: Қазақ университеті, 2021.
Модель краткосрочного планирования
Урок №1
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Химические вещества вокруг нас: от кухни до космоса |
|||||
|
Цели обучения согласно программе |
Ознакомить учащихся с разнообразием химических веществ в повседневной жизни и их свойствами. |
|||||
|
Цель урока |
Учащиеся умеют идентифицировать химические вещества в бытовых предметах и объяснять их свойства. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: “Собери
открытку” Раздаёт фрагменты изображений бытовых предметов. Учащиеся собирают открытку и объединяются в группы. |
Формируют группы, собирая целое изображение. |
|
Картинки, разрезанные на части по количеству участников в группе. |
||
|
Середина урока 35 минут |
Контекст 1: Химические вещества на кухне Вы помогаете своей маме готовить пирог на кухне. Для теста она использует рецепт, в котором необходимо добавить соду (гидрокарбонат натрия) и уксус (раствор уксусной кислоты). Когда вы добавляете уксус к соде, вы замечаете, что смесь начинает пениться и выделять пузырьки. Вам стало интересно, что за процесс происходит и почему он сопровождается шипением и выделением газа. Вы захотели выяснить, что стоит за этой химической реакцией и какое вещество образуется. Задание: Опишите химическую реакцию, которая происходит при смешивании соды и уксуса. Объясните, почему выделяются пузырьки и какое вещество их образует. Приведите химическое уравнение этой реакции. Контекст 2: Вода как универсальный растворитель В школьной лаборатории вы проводите эксперимент по растворению разных веществ в воде. Вы заметили, что сахар и соль быстро растворяются в воде, а масло, наоборот, остаётся на поверхности. Ваш учитель объяснил, что вода называется "универсальным растворителем", но не все вещества в ней растворяются одинаково. Вы решили разобраться, почему вода растворяет некоторые вещества лучше, чем другие, и как это связано с её химическими свойствами. Задание: Объясните, почему вода способна растворять такие вещества, как сахар и соль, но не растворяет масло. Какие свойства воды делают её универсальным растворителем? Приведите примеры, как эти свойства воды используются в повседневной жизни. Контекст 3: Химические вещества в космосе Ситуация: Вы смотрите научную программу о космосе и узнаёте, что в атмосфере Марса содержится углекислый газ, а на других планетах, таких как Юпитер и Сатурн, присутствуют гелий и водород. Вас заинтересовало, как эти химические вещества влияют на условия жизни на планетах и почему атмосферы этих планет так сильно отличаются от земной. Задание: Объясните, почему атмосфера Земли отличается по составу от атмосфер Марса и Юпитера. Как химический состав атмосферы влияет на возможность существования жизни? Приведите примеры того, как наличие различных химических веществ в атмосфере может повлиять на температуру и климат планеты. |
Ученик проводит кухонный эксперимент, смешивая соду и уксус и наблюдая за выделением газа. Дескрипторы: 1.Определяет вещества (сода и уксус); 2. Объясняет выделение газа; 3. Записывает уравнение реакции. Ученик проводит лабораторный эксперимент, растворяя сахар, соль и масло в воде, и наблюдает, как эти вещества по-разному растворяются. Дескрипторы: - Сравнивает соль, сахар, масло; - Объясняет полярность воды; - Приводит примеры использования воды. Дескрипторы: - Называет газы на планетах; - Анализирует пригодность для жизни; - Делает выводы по климату. Ученик смотрит видео о химии космоса, изучая состав атмосферы Марса и Юпитера. |
Комментарий учителя Верно-неверно Самооценка по критериям Комментарий учителя Верно-неверно Комментарий учителя Верно-неверно |
Стакан, пищевая сода, уксус
Карточка с инструкцией, лабораторный набор (соль, сахар, масло, вода).
|
||
|
Конец урока 5 минут |
"Дерево успеха" Размещает на доске изображение дерева без листьев, раздает стикеры в форме листьев. |
Прикрепляют листья на дерево, где: Верхняя часть – всё получилось отлично Середина – есть вопросы Нижняя часть – требуется помощь |
|
|||
Урок №2
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Вода и ее уникальные свойства |
|||||
|
Цели обучения согласно программе |
Изучить особые свойства воды и их значение для жизни на Земле. |
|||||
|
Цель урока |
Учащиеся могут объяснить аномальные свойства воды и их роль в природных процессах. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: «Расчёт» – деление на 3 группы Действия учителя: - Приветствует учащихся. - Кратко объясняет цель урока: «Сегодня мы разберём, чем вода отличается от других веществ и почему она так важна для жизни на Земле». - Делит учащихся на 3 группы с помощью счёта «первый – второй – третий». - Объясняет, что каждая группа будет исследовать одно из уникальных свойств воды. |
|
|
Цветные жетоны или устный счёт. |
||
|
Середина урока 35 минут |
Контекст 2: Вода и её уникальные свойства Ситуация: Вы проводите эксперимент по растворению веществ в воде на уроке химии. Когда вы добавляете сахар и соль, они растворяются, но когда добавляете масло, оно остаётся на поверхности. Вас заинтересовало, почему некоторые вещества растворяются в воде, а другие нет. Задание в группах:
Контекст 2: Замерзание воды и её расширение Ситуация: Вы оставили бутылку с водой в морозильной камере, и на следующий день обнаружили, что она лопнула. Вас удивило, что вода увеличилась в объёме, когда замёрзла, ведь многие другие вещества уменьшаются при охлаждении. Задание:
Контекст 3: Вода как теплоноситель Ситуация: Вы заметили, что вода долго нагревается и остывает. Учитель объяснил, что это связано с её высокой теплоёмкостью. Вам стало интересно, как это свойство воды помогает регулировать температуру на Земле. Задание:
|
Отвечают на теоретические вопросы. Дескрипторы: - Проводит эксперимент; - Объясняет разницу растворимости; - Делает вывод о природе воды Ученик кладёт бутылку с водой в морозильник, а затем наблюдает, как она расширилась и лопнула. Дескрипторы: - Приводит примеры; - Указывает изменение объёма; - Связывает со структурой льда. Ученик нагревает воду в лаборатории и сравнивает её температуру с другими веществами, наблюдая, как медленно она меняется. |
. Комментарий учителя Верно-неверно Взаимооценивание |
Лабораторные материалы (сахар, соль, масло, вода, пробирки); Дополнение с QR-кодом видео - лаборатория:
Модель молекулы воды (бумажные или 3D)
Дополнительная викторина:
|
||
|
Конец урока 5 минут |
"Рюкзак знаний" Рисует на доске рюкзак, предлагает его "собрать". |
Записывают на стикерах и прикрепляют:
Что оказалось сложным |
|
|||
Урок №3
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Кислоты и основания в быту |
|||||
|
Цели обучения согласно программе |
Познакомить с кислотами и основаниями, встречающимися в повседневной жизни. |
|||||
|
Цель урока |
Учащиеся умеют определять кислоты и основания в бытовых веществах и объяснять их действие. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: «Колесо цифр» – деление на 2 группы 1. Приветствует
учащихся, кратко озвучивает тему и цель урока: 2. Включает "Колесо цифр", чтобы разделить класс на 2 команды. 3. Объясняет правила групповой работы. |
1. Слушают тему и цель. 2. Делятся на группы с помощью цифрового колеса. 3. Получают карточки-задания на группу и готовятся к практической части. |
|
https://nameonwheel.com/ru/?ysclid=lvdoeka7lt153182971&clckid=c63d2d67
|
||
|
Середина урока 35 минут |
Контекст 1: Чистка кухонных поверхностей с помощью кислоты
Ситуация: Вы заметили, что лимонная кислота часто используется для чистки на кухне. В инструкции указано, что она помогает избавиться от известкового налёта. Вы задумались, почему кислоты эффективны для удаления таких загрязнений. Задание:
Контекст 2: Тестирование кислотности воды с помощью индикаторов
Ситуация: В лаборатории вы изучаете свойства различных жидкостей. Учитель предлагает вам проверить кислотность воды и других растворов с помощью индикаторов, таких как лакмусовая бумага или фенолфталеин. Задание:
Контекст 3: Средства для уборки и их pH
Ситуация: Вы дома убираетесь с помощью различных чистящих средств. На упаковке написано, что некоторые средства имеют щелочной характер, а другие — кислотный. Вы заинтересовались, почему для разных загрязнений используются различные по pH средства. Задание:
|
Ученик использует лимонную кислоту для очистки чайника от известкового налёта и наблюдает, как налёт растворяется. Ученик окунает лакмусовую бумагу в несколько растворов и записывает изменения цвета для определения кислотности. Ученик использует щелочное средство для удаления жира с плиты, а кислотное средство — для удаления налёта в ванной. Дескрипторы: - Анализирует состав средств; - Подбирает по назначению; - Аргументирует выбор. |
Дескрипторы: - Узнаёт вещество – кислота; - Объясняет взаимодействие; - Записывает уравнение реакции. Дескрипторы: - Работает с индикаторами; - Записывает наблюдения; - Делает вывод по кислотности/щелочности. |
Работа с карточкой + просмотр видео опыта:
Мини-эксперимент с индикаторами. Инструменты: лакмус, фенолфталеин, растворы Таблица с pH бытовых средств.
|
||
|
Конец урока 5 минут |
"Острова настроения" Изображает на доске три острова: "Радости", "Сомнения", "Непонимания". |
Размещают свои магниты/фишки на соответствующем острове. |
|
|||
Урок №4
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Химия пищи: питательные вещества и добавки |
|||||
|
Цели обучения согласно программе |
Рассмотреть химический состав пищевых продуктов и роль пищевых добавок. |
|||||
|
Цель урока |
Учащиеся способны анализировать состав продуктов питания и оценивать влияние пищевых добавок на организм. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: «Стрельба глазами» – деление на 2 группы. 1. Приветствует учащихся. 2. Объявляет тему
и цель урока: 3. Организует деление на пары методом «Стрельба глазами»: учащиеся стоят в кругу, по сигналу ищут глазами партнёра, и образуют пары, затем объединяются в 2 группы. 4. Раздаёт карточки с заданиями и обозначает зоны для работы групп. |
|
|
Стикеры для разминки (по цветам и по продуктам);
|
||
|
Середина урока 35 минут |
Контекст 1: Питательные вещества в продуктах питания Ситуация: На уроке химии вы изучаете состав различных продуктов питания и выясняете, что все продукты содержат питательные вещества: углеводы, белки, жиры, витамины и минералы. Вас заинтересовало, как определить, какие вещества содержатся в вашей повседневной пище. Задание:
Контекст 2: Пищевые добавки Ситуация: Вы покупаете в супермаркете напиток, на упаковке которого указаны различные пищевые добавки, такие как консерванты, красители и ароматизаторы. Вас заинтересовало, как эти добавки влияют на качество продуктов и почему они используются. Задание:
Контекст 3: Энергетическая ценность пищи Ситуация: На уроке биологии вы обсуждали, как еда даёт организму энергию, измеряемую в калориях. Вас заинтересовало, как различные виды пищи обеспечивают разное количество энергии и почему это важно для сбалансированного питания. Задание:
|
Ученик проводит химические тесты на определение углеводов, белков и жиров в продуктах, используя лабораторные реактивы и наблюдая за изменением цвета. Дескрипторы:
Ученик читает состав на упаковке напитка и записывает названия добавок, затем исследует их влияние на организм. Дескрипторы:
Ученик изучает энергетическую ценность продуктов по этикеткам и рассчитывает количество калорий в своём ежедневном рационе. |
Комментарий учителя Верно-неверно |
Инструменты: Йод, раствор медного купороса, фильтровальная бумага, продукты (хлеб, масло, молоко и др.) Брошюра с расшифровкой пищевых добавок
Дополнительная викторина:
|
||
|
Конец урока 5 минут |
"Лесенка достижений" Чертит на доске лестницу с пятью ступенями, объясняет критерии каждой. |
Отмечают свою позицию, объясняют выбор. |
|
|||
Урок №5
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Лекарства и их воздействие на организм |
|||||
|
Цели обучения согласно программе |
Изучить химические основы действия лекарственных препаратов. |
|||||
|
Цель урока |
Учащиеся понимают механизмы действия основных групп лекарств и могут объяснить их эффекты. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: «Колесо фортуны» – деление на 2 группы 1. Приветствует учащихся, предлагает начать день с позитивного настроя через метод «Время добрых пожеланий» — ученики желают друг другу что-то хорошее. 2. Объявляет тему
и цель: 3. Делит учеников на 2 группы с помощью "Колеса фортуны". 4. Раздаёт карточки с вводными ситуациями для обсуждения в группах. |
|
Комментарий учителя Верно-неверно |
https://ru.piliapp.com/random/wheel/
Мини-видео-вставка Что происходит, когда принимаешь лекарство:
|
||
|
Середина урока 35 минут |
Контекст 1: Принципы работы лекарств Ситуация: Во время изучения темы «Здоровье» в школе вы узнали, что лекарства могут воздействовать на организм по-разному. Одни устраняют симптомы болезни, другие борются с самой причиной заболевания. Вы захотели узнать, как лекарства работают в организме и чем отличаются их типы. Задание:
Контекст 2: Антибиотики и устойчивость бактерий Ситуация: На уроке биологии учитель рассказал о том, что антибиотики убивают бактерии, но их чрезмерное использование может привести к тому, что бактерии станут устойчивыми. Вы заинтересовались, почему это происходит и как можно избежать развития устойчивости к антибиотикам. Задание:
3. Химический аптечный квест Формат игры: Интерактивное командное соревнование Подготовка:
Этапы игры 1. Теоретический блок "Химическая аптечка" Задание: Расшифровать химические формулы распространенных лекарств
2. Практический блок "Правильная доза" Задание: Рассчитать дозировку препарата в зависимости от веса и возраста 3. Блок "Безопасность и последствия" Задание: Определить потенциальные побочные эффекты и взаимодействие препаратов |
Ученик изучает упаковку лекарств в аптечке дома, определяя, какие из них снимают симптомы, а какие борются с причиной заболевания. Дескрипторы:
Ученик создаёт памятку для одноклассников с правилами правильного использования антибиотиков, чтобы предотвратить устойчивость бактерий. Дескрипторы:
Ученик последовательно проходит игровые станции, расшифровывает химические формулы лекарств, рассчитывает дозировки и анализирует побочные эффекты препаратов, работая в команде и используя логическое мышление Командная химико-медицинская квест-игра с элементами научно-познавательного исследования для формирования компетенций в области фармацевтической грамотности |
Комментарий учителя Взаимооценивание . |
Демонстрационные таблицы химических формул. Карточки с заданиями. Раздаточные.методические материалы. Защитные очки и перчатки (для практической части). Образцы упаковок лекарств (муляжи). Плакаты с информацией о строении молекул. |
||
|
Конец урока 5 минут |
"Светофор" Раздает карточки трех цветов. |
Показывают карточки |
Карточки для светофора |
|||
Урок №6
|
Фамилия имя педагога |
|
|||||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||||
|
Тема урока: |
Косметические средства: состав и безопасность |
|||||||
|
Цели обучения согласно программе |
Рассмотреть химический состав косметических средств и вопросы их безопасности. |
|||||||
|
Цель урока |
Учащиеся умеют анализировать состав косметических средств и оценивать их потенциальное влияние на здоровье. |
|||||||
|
Процесс урока: |
||||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||||
|
Начало урока 5 минут |
Метод: «Косметическая лотерея» – деление на 3 группы Формат: На столе 15 карточек с названиями разных косметических средств (шампунь, крем, тушь, лосьон и т.д.) разных цветов (по 3 цвета – красный, синий, зелёный). Учащие вытягивают по одной карточке и делятся на группы по цветам. |
1. Активно участвуют в беседе. 2. Вытягивают карточки. 3. Делятся на команды по цвету. 4. Озвучивают продукт своей группы и его назначение. |
Словесная оценка учителя |
Карточки «Косметическая лотерея» (по 5 на каждый цвет); Стикеры для команд; Короткое видео-заставка:
|
||||
|
Середина урока 35 минут |
Контекст 1: Основные компоненты косметических средств Ситуация: Вы купили новый шампунь, и на его упаковке написан список ингредиентов, таких как вода, сульфаты, консерванты и ароматизаторы. Вас заинтересовало, зачем нужны все эти компоненты и как они влияют на ваши волосы. Задание:
Контекст 2: Аллергические реакции на косметику Ситуация: После использования нового крема для лица у вас появилось раздражение на коже. Вы задумались, может ли это быть связано с каким-то компонентом в креме, и как избежать подобных реакций в будущем. Задание:
3. Химия красоты: состав и безопасность Этапы игры 1. Теоретический блок "Химический состав"
2. Практический блок "Лаборатория красоты"
3. Блок "Безопасность и экспертиза"
|
Ученик читает состав шампуня, который он использует, и выясняет, какие компоненты там присутствуют и как они воздействуют на волосы. Дескрипторы:
Ученик проверяет состав крема и проводит тест на аллергию, нанеся небольшое количество продукта на руку, чтобы убедиться в отсутствии реакции. Ученик исследует составы косметических средств, идентифицирует химические компоненты, оценивает их безопасность, проводит эксперименты по определению pH, изучает влияние ингредиентов на кожу и создает информационный продукт о безопасном выборе косметики. |
Комментарий учителя |
Ресурс: Распечатка этикеток ? Видео: Как выбрать безопасную косметику
Необходимые ресурсы Образцы косметических средств (безопасные) pH-метры Микроскопы Защитные перчатки и очки Справочные материалы по химическому составу Таблицы растворимости Реактивы для базовых химических тестов Бланки для заполнения результатов |
||||
|
Конец урока 5 минут |
"Корзина отзывов" Ставит на стол три корзины с надписями "Важно", "Интересно", "Сложно". |
Пишут на листочках свои мысли и распределяют по корзинам. |
Корзины с надписями "Важно", "Интересно", "Сложно". |
|||||
Урок №7
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Бытовая химия: эффективность и экологичность |
|||||
|
Цели обучения согласно программе |
Изучить химический состав бытовых чистящих средств и их влияние на окружающую среду. |
|||||
|
Цель урока |
Учащиеся способны выбирать эффективные и экологичные бытовые химические средства. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? Ассоциации с бытом Описание: На доске — 6
бытовых предметов (в виде картинок): губка, перчатки, флакон с
моющим средством, уксус, сода, маска. Учитель предлагает ученикам
выбрать любой предмет и ответить на вопрос: Так происходит мягкое вхождение в тему + активизация личного опыта. |
1. Слушают и рассматривают изображения. 2. Выбирают один из предметов. 3. Высказывают ассоциации и личный опыт. 4. Делятся впечатлениями в парах или всей группой. 5. Настраиваются на урок. |
|
Слайд/распечатка с изображениями бытовых предметов (6 шт.); Маркеры/стикеры |
||
|
Середина урока 35 минут |
Контекст 1: Эффективность чистящих средств Ситуация: На кухне у вас скопился жир на плите, и вы решили использовать чистящее средство для удаления загрязнений. Вам стало интересно, как химические вещества в составе средства помогают очищать поверхности. Задание:
Контекст 2: Влияние бытовой химии на окружающую среду Ситуация: Вы заметили, что некоторые чистящие средства имеют пометку "экологически безопасное". Вы заинтересовались, что делает средства экологичными и как они влияют на окружающую среду по сравнению с обычными. Задание:
3. Химия дома: эффективность и экология Структура игры 1. Теоретический блок "Химический анализ"
2. Лабораторный блок "Эффективность и безопасность"
3. Экологический блок "Зеленая химия"
|
Ученик использует чистящее средство на плите, наблюдая, как оно эффективно удаляет жир. Дескрипторы:
Научно-практический квест по изучению бытовой химии с позиций эффективности, безопасности и экологической ответственности. Ученик сравнивает составы обычного и экологически чистого чистящих средств и делает выводы о их влиянии на окружающую среду. Ученик исследует составы бытовых химических средств, проводит эксперименты по оценке их эффективности, изучает экологический след производства и потребления, разрабатывает экологически безопасные альтернативные решения для домашней уборки. |
Комментарий учителя Комментарий учителя |
? Карточка: Таблица «Состав – Назначение – Эффективность» ? Видео: Экология и бытовая химия
Образцы бытовой химии pH-метры Защитные очки и перчатки Лабораторное оборудование Справочные материалы Микроскопы Расходные материалы для экспериментов Таблицы химической совместимости Демонстрационные стенды |
||
|
Конец урока 5минут |
"Координаты успеха" Рисует систему координат с осями "Понимание" и "Интерес". |
Ставят точку на графике, отражающую их состояние. |
|
|||
Урок №8
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Воздух: состав, загрязнение и очистка |
|||||
|
Цели обучения согласно программе |
Изучить состав воздуха, источники его загрязнения и методы очистки. |
|||||
|
Цель урока |
Учащиеся умеют анализировать данные о загрязнении воздуха и предлагать методы его очистки. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Что в воздухе?» Формат: Учитель показывает ученикам три запечатанных прозрачных контейнера с надписями:
Ученики по очереди вытягивают карточку с вопросом, обсуждают его с соседом, а затем кратко делятся своими мыслями с классом. |
1. Активно участвуют в обсуждении вопросов. 2. Обмениваются нениями в парах. 3. Настраиваются на исследование темы. |
Комментарий учителя |
1. Карточки с вопросами 2. Прозрачные контейнеры или конверты |
||
|
Середина 35 урока |
1.Задание на
знание состава воздуха: Приведите процентное содержание основных газов, входящих в состав воздуха (азот, кислород, углекислый газ, аргон). Объясните, какую роль играет каждый из этих газов в атмосфере. Ответ:
2.Задание на анализ причин загрязнения воздуха: - Назовите основные загрязнители воздуха. - Откуда они появляются? - Разделите источники на природные и антропогенные. - Обсудите последствия загрязнения. 3.Задание на решение проблемы очистки воздуха:
Ответ: Использование энергоэффективных приборов и переход на общественный транспорт или велосипеды поможет сократить выбросы вредных веществ в атмосферу, снижая загрязнение воздуха. |
Обьясняют роль газов в атмосфере. Дескрипторы:
Анализируют причины загрязнения воздуха. Дескрипторы: - Называет загрязнители; - Разделяет источники по происхождению; - Делает вывод о последствиях. Предлагают способы решения проблем с очисткой воздуха. Дескрипторы:
|
«Устная похвала» Взаимооценивание Взаимооценивание |
? Ресурс: Диаграмма состава воздуха ? Видео:
? Ресурс: Инфографика о способах очистки |
||
|
Конец урока 5 минут |
"Открытый микрофон" Передает символический микрофон. |
По очереди заканчивают фразы:
"Я смог..." |
|
|||
Урок №9
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Парниковый эффект и изменение климата |
|||||
|
Цели обучения согласно программе |
Рассмотреть химические аспекты парникового эффекта и его влияние на климат |
|||||
|
Цель урока |
Учащиеся могут объяснить механизм парникового эффекта и предложить меры по снижению выбросов парниковых газов. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Термин – объяснение» Формат: На доске размещены 4 термина:
Учащиеся делятся на 3 группы, каждая тянет карточку с одним из терминов и в течение 2 минут обсуждает в группе, как бы они объяснили это понятие простыми словами. Затем каждая группа озвучивает свою версию. |
1. Делятся на группы. 2. Получают термин и обсуждают его значение. 3. Представляют свои версии определения. 4. Формируют интерес к теме. |
Словесная оценка учителя |
1. Карточки с терминами 2. Цветные стикеры для групп 3. Презентация с темой |
||
|
Середина урока 35 минут |
1.Задание на
анализ графика: Температурные изменения
Ситуация: Вы получили график, показывающий среднегодовые температуры в вашем городе за последние 50 лет. На графике виден постепенный рост температуры. Задание для группы: 1. Проанализируйте
график: 2. Обсудите и
сделайте вывод: 3. Разработайте 2
предложения: 2.Задание на принятие решений: Устойчивое потребление Ситуация: Ваша семья собирается купить новый холодильник. В магазине есть два варианта: один дешевле, но потребляет больше электроэнергии, а другой дороже, но энергосберегающий. Задание для группы:
3.Задание на рассуждение: Выбор транспорта Ситуация: Вы хотите сократить свой углеродный след и рассматриваете два варианта поездок на работу: на автомобиле или на велосипеде. Расстояние до работы — 5 км. Задание для группы: 1. Обсудите, какой вариант транспорта экологичнее. 2. Перечислите дополнительные плюсы езды на велосипеде: здоровье, экономия, настроение и др. 3. Подготовьте групповое обоснование, которое защитите перед другими. |
Ученик анализирует график изменения температуры за 50 лет и делает выводы о возможных причинах повышения температуры в городе. Затем предлагает меры для замедления этого процесса. Дескрипторы: - Определяет основные тенденции изменения температуры на графике; - Объясняет возможные причины повышения температуры; - Предлагает обоснованные меры по замедлению процесса изменения климата. Ученик в магазине сравнивает два холодильника — один энергоэффективный, другой дешевле, но менее эффективный. Ученик выбирает холодильник и объясняет свой выбор с точки зрения долгосрочной экономии и экологичности Ученик размышляет о выборе транспорта — автомобиль или велосипед. Он рассматривает экологические преимущества велосипеда и другие положительные аспекты для здоровья и экономики. |
Взаимооценивание Взаимооценивание работы групп |
? Ресурс: График температурных изменений + карточка с вопросами анализа ? Ресурс: Таблица сравнения + карточка с подсказками (пример расчёта затрат) ? Ресурс: Карточки с данными (выбросы CO₂, затраты, калории и т.д.) |
||
|
Конец урока 5 минут |
"Погода в душе" Рисует условные обозначения погоды. |
Выбирают символ, соответствующий их настроению и успехам на уроке. |
|
|||
Урок №10
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Кислотные дожди: причины и последствия |
|||||
|
Цели обучения согласно программе |
Изучить химические процессы образования кислотных дождей и их воздействие на окружающую среду. |
|||||
|
Цель урока |
Учащиеся умеют объяснять причины образования кислотных дождей и оценивать их последствия для экосистем. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ☔ «Пятно на памятнике» Формат: Учитель показывает
фотографию известного здания (например, памятника, колонны или
храма) с повреждениями на поверхности. Действия учителя: - Приветствует учащихся. - Демонстрирует фото и задаёт наводящие вопросы. - Делит учащихся на 3 группы. - Объявляет тему и цель урока: |
1. Активно обсуждают возможные причины разрушений. 2. Делятся на группы. 3. Настраиваются на исследовательскую часть урока. |
Словесная оценка учителя |
1. Фото повреждённого памятника (до/после) 2. Презентация с темой урока 3. Видео-заставка:
|
||
|
Середина урока 35 минут |
1.Задание на объяснение причин кислотных
дождей: Задание для
группы: Образец ответа:
2.Задание на анализ последствий кислотных
дождей:
Задание для
группы: 1. На экосистему (леса, озёра, почвы); 2. На здания и памятники. . 3.Задание на решение проблемы кислотных
дождей: 1. Один – на государственном уровне (например, фильтры, законы); 2. Один – в повседневной жизни (например,
использование транспорта, энергосбережение). Образец ответа:
|
Ученик изучает схему, показывающую выбросы вредных веществ в атмосферу, и составляет пояснение, как они способствуют образованию кислотных дождей. Дескрипторы: - Называет основные загрязняющие вещества; - Объясняет процесс образования кислотных осадков; - Указывает источники выбросов. Дескрипторы:
Ученик находит примеры разрушенных кислотными дождями памятников или строений, а также изучает данные о влиянии кислотных дождей на озёра и леса. Ученик составляет список возможных действий, которые он и его семья могут предпринять для сокращения выбросов, и обсуждает его с одноклассниками. |
Самооценка Взаимооценивание групп Комментарий учителя |
? Ресурс: карточка-шаблон + слайд со схемой процесса ? Ресурс: карточки с изображениями последствий + шаблон схемы ? Ресурс: лист для мозгового штурма + шаблон для плаката |
||
|
Конец урока 5 минут |
"Чемодан, мясорубка, корзина" Размещает три изображения. |
Распределяют информацию: Чемодан – что возьму с собой Мясорубка – над чем нужно поработать Корзина – что не пригодится |
|
|||
Урок №11
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Пластиковое загрязнение: проблемы и решения |
|||||
|
Цели обучения согласно программе |
Рассмотреть химические свойства пластиков и проблемы их утилизации. |
|||||
|
Цель урока |
Учащиеся способны предложить решения проблемы пластикового загрязнения на основе химических знаний. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Где спрятан пластик?» Формат: На партах или
доске размещены изображения/предметы, содержащие пластик (упаковка,
зубная щётка, бутылка, ручка, скотч и т.п.). |
1. Делятся на группы. 2. Определяют предметы из пластика и возможные замены. 3. Настраиваются на исследование проблемы. |
|
1. Предметы/картинки с пластиком 2. Слайд с темой урока 3. Видеозаставка (4 мин): https://www.youtube.com/watch?v=IDsAUcqQKnQ |
||
|
Середина урока 35 минут |
1.Задание на
понимание проблемы пластикового загрязнения: Пластиковые отходы
— одна из главных экологических проблем. Задание для группы: 2.Задание на анализ решений проблемы пластикового загрязнения: Некоторые страны
ввели запрет на использование пластиковых пакетов.
адание для группы: 1. Почему отказ от пакетов уменьшает загрязнение? 2. Какие
альтернативы существуют (бумажные, тканевые и др.)? 3. Планета без пластика Этапы игры 1. Теоретический блок "Химия пластика"
2. Лабораторный блок "Экспериментариум"
3. Аналитический блок "Глобальный след"
|
Ученик изучает фотографии или видеоматериалы о загрязнении океанов пластиком и описывает, как это влияет на морских животных. Дескрипторы:
Ученик исследует, какие альтернативы пластиковым пакетам можно использовать в повседневной жизни, и составляет список экологичных вариантов для своей семьи. Дескрипторы:
Ученик исследует жизненный цикл пластика, анализирует химический состав различных видов пластмасс, проводит эксперименты по разложению материалов, оценивает экологический след. |
Взаимооценивание Комментарий учителя |
? Ресурс: карточки с фактами + шаблон схемы ? Ресурс: карточки с вариантами упаковки + таблица Образцы различных типов пластика Химические реактивы Микроскопы Весы Секундомеры Демонстрационное оборудование Материалы для макетирования |
||
|
Конец урока 5 минут |
"Пять пальцев" Показывает ладонь с заданиями для каждого пальца. |
Анализируют урок по пунктам: Большой – что понравилось Указательный – что узнал нового Средний – что было трудно Безымянный – психологическая атмосфера Мизинец – чего не хватило |
|
|||
Урок №12
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Тяжелые металлы в окружающей среде |
|||||
|
Цели обучения согласно программе |
Изучить источники поступления тяжелых металлов в окружающую среду и их влияние на живые организмы. |
|||||
|
Цель урока |
Учащиеся умеют оценивать риски, связанные с загрязнением тяжелыми металлами, и предлагать методы очистки. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ⚠️ «Ядовитый след» Формат: Учитель показывает
изображение знака биологической опасности и задаёт
вопрос: После краткого обсуждения делит класс
на 3 группы (по стикерам/цветам) и вводит тему урока: |
1. Участвуют в обсуждении; 2. Делятся на группы; 3. Формируют ожидания от темы. |
|
1. Изображение символа опасности 2. Картинки с примерами металлов (ртуть, свинец, кадмий) |
||
|
Середина урока 35 минут |
1.Задание на
понимание: Источники тяжелых металлов в окружающей
среде
Задание для
группы: 2.Задание на
анализ последствий: Влияние тяжелых металлов на
здоровье
Задание для
группы: 3. Невидимая угроза: тяжелые металлы Структура игры 1. Теоретический блок "Химическая карта металлов"
2. Лабораторный блок "Следственный эксперимент"
3. Экологический блок "Миграция и трансформация"
|
Ученик составляет таблицу с перечислением основных источников тяжелых металлов и объяснением их воздействия на окружающую среду Дескрипторы:
Ученики в группе обсуждают т реальные примеры случаев отравления тяжелыми металлами и делают краткий доклад об их последствиях для здоровья. Дескрипторы:
Ученик исследует источники и миграционные пути тяжелых металлов, проводит эксперименты по их обнаружению, анализирует влияние на экосистемы и организм человека, разрабатывает стратегии минимизации рисков и защиты окружающей среды. |
«Устная похвала» Обмен мнениями, взаимооценка |
Видеовступление: Что такое тяжелые металлы https://www.youtube.com/watch?v=XOsq-r97jmA? Ресурс: карточки с подсказками + шаблон схемы ? Ресурс: карточки металлов + шаблон карточки риска Химические реактивы Спектрометр Микроскопы Пробоотборники Защитное оборудование Индикаторные полоски Образцы почвы и воды Справочные материалы Демонстрационное оборудование |
||
|
Конец урока 5 минут |
"Телеграмма" Раздает бланки "телеграмм". |
Пишут короткое послание следующему классу о главном на уроке. |
|
|||
Урок №13
|
Фамилия имя педагога |
|
|||||||||||||||||||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||||||||||||||||||
|
Тема урока: |
Химические удобрения: польза и вред |
|||||||||||||||||||||
|
Цели обучения согласно программе |
Рассмотреть химический состав удобрений, их влияние на урожайность и экологические последствия их применения. |
|||||||||||||||||||||
|
Цель урока |
Учащиеся способны анализировать преимущества и недостатки использования химических удобрений. |
|||||||||||||||||||||
|
Процесс урока: |
||||||||||||||||||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||||||||||||||||||
|
Начало урока 5 минут |
Метод: ? «Зелёная загадка» Формат: Учитель показывает 3 изображения:
Вопрос
классу: |
1. Делятся на группы. 2. Высказывают гипотезы. 3. Готовятся к выполнению заданий. |
Устная похвала |
1. Презентация с изображениями 2. Стикеры для деления на группы |
||||||||||||||||||
|
Середина урока 35 минут |
Контекст: Химические удобрения: польза и вред
Задание 1:
Заполнение таблицы составов химических
удобрений
Задание 2: Составление схемы "Путь химических удобрений в природе"
Задание 3: Обсуждение плюсов и минусов химических
удобрений |
Ученики заполняют таблицу на основе материалов из учебника, объясняя роль каждого элемента и возможные последствия его недостатка или избытка.
Ученик создаёт схему, начиная с внесения удобрений в почву, их поглощения растениями и вымывания дождями, заканчивая загрязнением рек и атмосферы.
Ученик формирует два списка, анализируя информацию о положительном влиянии удобрений на урожайность и их вреде для окружающей среды |
|
Карточки с пиктограммами:
Иллюстрации каждого этапа (в виде стрелок/иконок): Заготовка схемы (пустой путь с подписями)
Стикеры с иконками (? — плюс, ? — вред, ♻️ — решение) Постер "Плюсы – Минусы – Предложения"
|
||||||||||||||||||
|
Конец урока 5 минут |
"Цветик-семицветик" Рисует цветок с разноцветными лепестками. |
Отрывают лепесток того цвета, который соответствует их настроению.
|
|
|||||||||||||||||||
Урок №14
|
Фамилия имя педагога |
|
||||||||||||||||||||||||||||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
|||||||||||||||||||||||||||||
|
Тема урока: |
Альтернативные источники энергии и химия |
||||||||||||||||||||||||||||||
|
Цели обучения согласно программе |
Изучить химические аспекты различных альтернативных источников энергии. |
||||||||||||||||||||||||||||||
|
Цель урока |
Учащиеся умеют сравнивать различные источники энергии с точки зрения их химических свойств и экологичности. |
||||||||||||||||||||||||||||||
|
Процесс урока: |
|||||||||||||||||||||||||||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
|||||||||||||||||||||||||||
|
Начало урока 5 минут |
Метод: ☀️ «Что питает наш дом?» Формат: Учитель показывает
изображения дома, освещённого ночью, солнечной панели, ветряка,
электростанции и автомобиля. |
1. Рассматривают предложенные изображения. 2. В группах
обсуждают: 3. Делают предположения о типах источников (традиционные и альтернативные). 4. Делятся мыслями с классом (представитель группы озвучивает). |
Комментарий учителя |
?️ Интерактивный слайд с изображениями объектов: - Дом, электромобиль, солнечная батарея, завод, лампочка, ветряк ? Карточки с цветами (деление на группы) ? Мини-карточки-подсказки: - «Не выбрасывает CO₂» - «Работает от солнца» - «Истощает природу» |
|||||||||||||||||||||||||||
|
Середина урока 35 минут |
Контекст: Альтернативные источники энергии и их химия
Задание
1: Сравнение традиционных и альтернативных источников
энергии
Задание 2: Создание схемы работы солнечной батареи
Задание 3: Обсуждение использования водородного топлива
|
Ученик заполняет таблицу на основе полученной информации, сравнивая уголь и нефть с альтернативными источниками энергии, такими как солнечная и ветровая.
Дескриптор: Сравнивает традиционные и альтернативные источники энергии по ключевым характеристикам.
Ученик рисует схему солнечной панели, объясняя, как фотоны солнечного света воздействуют на кремний, вызывая движение электронов и создание электрического тока.
Ученик описывает реакцию, происходящую в топливных элементах (2H₂ + O₂ → 2H₂O + энергия), и составляет список плюсов (экологическая чистота, высокая эффективность) и минусов (сложность хранения, стоимость) водородного топлива. Дескриптор: Объясняет химические процессы, происходящие в солнечных батареях, создаёт схему их работы.
|
взаимооценивнаие
|
1. Карточки с данными по каждому источнику 2. Иконки для визуального заполнения таблицы (? выбросы, ♻️ устойчивость, ⚡ мощность)
1. Карточки: фото солнечной панели, структура кремниевого слоя 2. Заготовка схемы + наклейки «фотон», «электрон», «контакт»
1. Карточки: модель топливного элемента, реакция 2. Таблица плюсов и минусов 3. Мини-видео:Водородное топливо |
|||||||||||||||||||||||||||
|
Конец урока 5 минут |
"Экран эмоций" Вывешивает таблицу с различными эмоциями. |
Отмечают свои эмоции в начале и конце урока.
|
|
||||||||||||||||||||||||||||
Урок №15
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Оксиды и их свойства |
|||||
|
Цели обучения согласно программе |
Изучить классификацию оксидов, их физические и химические свойства. |
|||||
|
Цель урока |
Учащиеся смогут классифицировать оксиды и описывать их основные химические свойства. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Угадай по формуле» Формат: На экране 4
формулы оксидов: CO₂, CaO, Al₂O₃, NO. Мини-викторина «Это кислотный или основной?»
|
1. В парах обсуждают, какие из веществ могут реагировать с водой. 2. Делятся на группы. 3. Формируют гипотезы. 4. Настраиваются на работу с текстом и реакциями. |
«Устная похвала» |
1. Слайд с формулами оксидов 2. Цветные карточки для деления на группы
|
||
|
Середина урока 35 минут |
Текст:
Задание
1
Задание
2
Задание 3 |
Распределяют оксиды по их химическим свойствам. Дескриптор: Правильно распределил вещества по группам оксидов (4/4 – отлично, 3/4 – хорошо, 2/4 – пересмотр). 2.Определяет продукты реакций на основе свойств оксидов. Формулирует объяснение, используя теоретические знания. |
|
Таблица свойств оксидов Карточки с названиями и формулами Цветные маркеры для группировки на доске/флипчарт 1. Карточки с незавершёнными уравнениями 2.Фломастеры 1. Отрывок из учебника/поясняющий текст 2. Карточки с вопросами на размышление |
||
|
Конец урока 5 минут |
"Дорожные знаки" Показывает карточки с дорожными знаками. |
Выбирают знак, отражающий их путь познания на уроке. |
|
|||
Урок №16
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Свойства кислот |
|||||
|
Цели обучения согласно программе |
Исследовать химические свойства кислот и их взаимодействие с различными веществами. |
|||||
|
Цель урока |
Учащиеся смогут объяснить основные свойства кислот и записывать уравнения их химических реакций. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Что это за вещество?» Формат: Учитель показывает три изображения: |
1. Отвечают на вопрос, что общего между предметами. 2. Делятся ассоциациями. 3. Формулируют ожидания от темы урока. |
Словесная оценка учителя |
Презентация с изображениями лимона, аккумулятора и HCl Стикеры для деления на группы Карточка с темой и целью урока |
||
|
Середина урока 35 минут |
Текст:
Задание
1 Задание:
? Укажите, какие
свойства кислот проявляются: Задание
2 Задание: Задание
3
|
Классифицирует реакции, связывая их с химическими свойствами кислот. Дескриптор: правильно определил свойства кислот для каждой реакции 2.Формулируют объяснение на основе разницы в диссоциации кислот. 3.Определяют вещества, участвующие в реакции,
используя знания о химических свойствах кислот. |
Словесная оценка учителя «Устная похвала» |
Таблица «Свойства кислот» Карточки с уравнениями Стикеры для группировки реакций по типам 1. Схема диссоциации кислот 2. Таблица электропроводности 3. Карточки с понятиями: «Сильная», «Слабая», «Электролит» 4Набор карточек с веществами |
||
|
Конец урока 5 минут |
"Письмо себе" Раздает конверты и листы бумаги. |
Пишут письмо себе о том, что поняли на уроке, что хотят запомнить. |
|
|||
Урок №17
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока |
Щелочи |
|||||
|
Цели обучения согласно программе |
Изучить химические свойства щелочей и их применение в повседневной жизни. |
|||||
|
Цель урока |
Учащиеся смогут характеризовать щелочи и описывать их взаимодействие с другими веществами. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Скрытая опасность» Формат: Учитель показывает три предмета:
Вопрос: |
1. Обсуждают, что это за вещества и как они связаны с химией. 2. Делятся в группах мнениями о безопасном и опасном применении. 3. Формулируют предположения о теме урока. |
«Устная похвала» |
Мыло, Бутылку с чистящим средством (NaOH), Стеклянную колбу с известковой водой. Карточки для групп Презентация Стикеры «Щелочь / Основание / Неизвестно» |
||
|
Середина урока 35 минут |
Текст:
Задание
1: Задание
2
Определите, какой тип реакции происходит: нейтрализация, образование осадка и др. Задание 3 |
Разделяют вещества
на группы по их растворимости. Дескриптор: правильно определил щелочи и основания 2.Определяют вещества на основе химических свойств щелочей. Дескриптор: правильно заполнил все пропуски в уравнениях 3.Формулируют объяснение на основе взаимодействия щелочей со стеклом. |
«Устная похвала» Взваимооценивание |
1. Таблица растворимости 2. Карточки с формулами + маркеры для доски 3. Заготовка таблицы на A3 Карточки с недостающими уравнениями Таблица растворимости Цветные стикеры для записей 1. Карточка с текстом-подсказкой 2. Таблица «Материалы и химическая стойкость» 3. Лист для группового вывода |
||
|
Конец урока 5 минут |
"Волшебная шляпа" Приносит шляпу с разноцветными листочками-вопросами. |
Достают вопросы и отвечают на них о процессе обучения. |
|
|||
Урок №18
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Соли. Образование ионных связей |
|||||
|
Цели обучения согласно программе |
Исследовать механизм образования ионных связей и способы получения солей. |
|||||
|
Цель урока |
Учащиеся смогут объяснить процесс образования ионных связей и различные способы получения солей. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Разделение по ионам» Формат: Учащиеся должны найти свою «пару» и образовать соль. Те, кто собрался в пару, формируют группу. |
Ищут соответствующий ион (в паре). Объединяются в группы на основе созданной соли. Обсуждают, как получилась их пара, и формулируют гипотезу о теме. |
«Устная похвала» |
Карточки с ионами Презентация с темой и целями Мини-видео 1 мин: ▶️ https://www.youtube.com/watch?v=CGC4bI3oZBo |
||
|
Середина урока 35 минут |
Текст:
Задание
1 Задание
2
Дополнительно: определите, к какому типу реакции относится каждая. ✅ Задание 3
(индивидуально или обсуждение в группе): Объяснение электропроводности NaCl. ? Подумай: |
1.Распределяют соли по их видам на основе знаний о составе. Дескриптор: правильно классифицировали соли 2.Дополняют
уравнения реакций веществами, используя химические
свойства. 3.Формулируют объяснение, связывая физические свойства с ионной структурой. |
Словесная оценка учителя Взаимоценивание |
Таблица «Типы солей» Карточки с названиями и формулами Шаблон для группировки: 3 колонки (средние / кислые / основные) Модель кристаллической решётки NaCl
Карточка «Ионная связь и электропроводность» |
||
|
Конец урока 5 минут |
"Карта впечатлений" Рисует карту с разными "территориями" (интерес, сложность, польза). |
Отмечают флажками свое местоположение на карте. |
|
|||
Урок №19
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Амфотерные соединения и их свойства |
|||||
|
Цели обучения согласно программе |
Изучить особенности амфотерных соединений и их двойственную природу. |
|||||
|
Цель урока |
Учащиеся смогут определять амфотерные соединения и объяснять их способность проявлять кислотные и основные свойства. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ⚖️ «Двойное поведение» Формат: Учитель показывает две реакции:
Вопрос: |
1. Анализируют реакции. 2. Высказывают предположения: что общего у Al₂O₃ и Zn(OH)₂. 3. Делятся на группы и формулируют ожидания. |
Комментарий учителя |
Доска с двумя уравнениями Кубики/фишки трёх цветов (для групп) |
||
|
Середина 35 урока |
Текст:
Задание 1:
Групповая работа Задание
2
Определите, в какой реакции соединение проявляет кислотные свойства, а в какой — основные. Задание 3 |
1 Классифицируют вещества на основе их химических свойств. Дескриптор: правильно определил амфотерные соединения 2.Дополняют
уравнения веществами, опираясь на свойства амфотерных
соединений. 3.Формулируют объяснение на основе амфотерных свойств соединений. |
Словесная оценка учителя |
Таблица: классификация оксидов и гидроксидов Карточки с химическими формулами и картинками (ZnO – порошок, Cr(OH)₃ – осадок и т.д.) Таблица растворимости
Таблица «Сравнение кислотных, основных и амфотерных соединений» Индивидуальная карточка с вопросами |
||
|
Конец урока 5 минут |
"Мишень успеха" Рисует мишень с четырьмя секторами (понимание, интерес, активность, польза). |
Ставят точки на мишени, оценивая каждый параметр. |
|
|||
Урок №20
|
Фамилия имя педагога |
|
||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
|||
|
Тема урока: |
Практические задания на основные классы неорганических соединений |
||||
|
Цели обучения согласно программе |
Закрепить знания о химических свойствах основных классов неорганических соединений через решение практических задач. |
||||
|
Цель урока |
Учащиеся смогут решать расчетные задачи, составлять уравнения реакций и определять продукты химических превращений для основных классов неорганических соединений. |
||||
|
Процесс урока: |
|||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
|
|
Начало урока 5 минут |
Метод: ? «Химический мозговой штурм» Формат: На доске — таблица с незаполненными колонками: | Формула | Название | Класс соединения | Учащиеся (в группах) получают карточки с формулами (HCl, NaOH, SO₂, NaCl, CaO) и за 2 минуты должны заполнить как можно больше строк. |
1. Участвуют в «мозговом штурме». 2. Делятся на группы. 3. Обсуждают, чем соединения одного класса могут отличаться по свойствам и реакциям. |
«Устная похвала» |
Карточки с формулами веществ Пустая таблица на флипчарте/экране Цветные фишки для деления на группы |
|
|
Середина урока 35 минут |
Задание 1: Анализ состава соединений Условие: Задание 2: Построение цепочки превращений Условие: Задание 3: Выявление ошибок в уравнениях реакций Условие:
|
1.Анализируют
состав соединений и относят их к конкретному классу. 2.Составляют логическую последовательность превращений, записывает уравнения реакций. Дескриптор: 1)правильно составил цепочку 2)записал уравнения 3Анализируют уравнения реакций, находят ошибки и исправляют их. |
Самооценка (5/5 – отлично, 4/5 – хорошо, 3 и менее – доработка). Взаимопроверка по шаблону (3/3 – отлично, 2/3 – хорошо, 1/3 – доработка). Взаимооценивание |
1. Карточки с цветными схемами соединений 2. Интерактивная таблица Менделеева 3. Шаблон таблицы: «Формула – Элементы – Класс» 1. Карточки с веществами 2. Шаблон схемы «→» 3. Подсказки с примерами типов реакций
1. Карточки с неправильными уравнениями 2. Таблица растворимости |
|
|
Конец урока 5 минут |
"Три М" Записывает на доске: Мне было Момент Могу. |
Продолжают фразы: Мне было... (интересно/скучно) Момент урока... (самый важный) Могу... (применить в жизни) |
|
||
Урок №21
|
Фамилия имя педагога |
|
||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
|||
|
Тема урока: |
Лабораторные работы |
||||
|
Цели обучения согласно программе |
Сформировать практические навыки работы с различными классами неорганических веществ в лабораторных условиях. |
||||
|
Цель урока |
Учащиеся освоят технику безопасности, научатся проводить химические эксперименты, наблюдать и описывать их результаты, делат |
||||
|
Процесс урока: |
|||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
|
|
Начало урока 5 минут |
1. Демонстрирует цветовые переходы (или слайды). 2. Делит учащихся
на 3 лабораторные группы
по цветным карточкам: 3. Объявляет цели
лабораторной работы: |
1. Участвуют в обсуждении. 2. Делятся на группы. 3. Получают лабораторные карточки и готовятся к работе. |
|
Видео – материал: Правила техники безопасности в химической лаборатории https://www.youtube.com/watch?v=GnkLgUktA2w цветные карточки для деления на группы |
|
|
Середина урока 35 минут |
Вариант №1
Вариант №2
Вариант №3
|
1Проводят реакции
кислот и оснований с индикаторами и записывают
наблюдения. 1)корректно определил изменение цвета индикаторов для кислот и оснований 2) заполнил таблицу наблюдений 2.Определяют свойства кислотных и основных оксидов через проведение реакций. Дескрипторы 1)правильно описал результаты всех реакций 2) сделал выводы о свойствах оксидов 3Проводят реакцию нейтрализации и наблюдают
за её результатами. |
Самооценка по шаблону (3/3 – отлично, 2/3 – хорошо, 1/3 – пересмотр). Комментарий учителя |
1. Растворы HCl, NaOH 2. Индикаторы: лакмус, фенолфталеин, метилоранж 3. Таблица наблюдений 4. Перчатки, пипетки, пробирки Газированная вода (CO₂), CaO Растворы Ca(OH)₂, HCl Индикаторы, пробирки Лист для выводов по опыту 1. Растворы HCl и NaOH 2. Индикатор фенолфталеин 3. Мерные цилиндры, пробирки 4. Шаблон реакции и бланк для вывода. |
|
|
Конец урока 5 минут |
"Дерево решений" Рисует дерево с тремя ветвями (знаю, сомневаюсь, не знаю). |
Прикрепляют листочки к соответствующим ветвям. |
|
||
Урок №22
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Нанотехнологии в повседневной жизни |
|||||
|
Цели обучения согласно программе |
Ознакомить с принципами нанотехнологий и их применением в повседневной жизни. |
|||||
|
Цель урока |
Учащиеся могут привести примеры использования нанотехнологий в быту и объяснить их преимущества. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Увеличь это!» Формат: Учитель показывает
изображения обычных объектов, увеличенных в десятки тысяч раз с
помощью наноскопа (ткань, металл, пыльца, кремний в
процессоре). |
1. Делятся ассоциациями с увиденными изображениями. 2. Объединяются в группы. 3. Озвучивают, где, по их мнению, применяются нанотехнологии. |
«Устная похвала» |
Презентация «Мир под наноскопом» Изображения в увеличении (наноструктуры, материалы, кожа, чипы) Стикеры/карточки для групп |
||
|
Середина урока 35 минут |
Контекст 1: Нанотехнологии в медицине Нанотехнологии активно применяются в медицине для диагностики и лечения заболеваний. Наночастицы используются для доставки лекарств к определённым клеткам организма, что делает лечение более точным и эффективным. Благодаря этому нанотехнологии помогают уменьшить побочные эффекты и повысить результативность лечения. Задание: Объясните, как наночастицы могут быть использованы для целевой доставки лекарств в организме. Какие преимущества даёт эта технология по сравнению с традиционными методами лечения? Контекст 2: Нанотехнологии в электронике Нанотехнологии применяются для создания более компактных и мощных электронных устройств. Например, современные процессоры, благодаря использованию нанометровых технологий, стали гораздо быстрее и энергоэффективнее. Это позволяет создавать мобильные устройства с высокой производительностью и длительным временем работы. Задание: Объясните, как нанотехнологии изменили современную электронику. Как уменьшение размеров процессоров влияет на скорость работы и энергопотребление устройств? Контекст 3: Наноматериалы в повседневной жизни Наноматериалы, такие как нановолокна и нанопокрытия, используются в повседневной жизни для создания прочных и лёгких материалов. Эти материалы применяются в одежде, строительстве, косметике и даже в автомобильной промышленности. Нанопокрытия делают поверхности более устойчивыми к повреждениям и грязи, а нановолокна — более прочными и долговечными. Задание: Приведите примеры, где наноматериалы используются в повседневной жизни. Какие преимущества дают наноматериалы по сравнению с обычными? |
1.Ученики исследуют пример использования наночастиц в медицинских препаратах и делают краткий доклад о том, как они помогают доставить лекарства к поражённым клеткам, минимизируя влияние на здоровые ткани. Дескрипторы: 1)Правильно называет три примера применения нанотехнологий 2)объясняет их преимущества. 2.Ученики находят примеры современных устройств, созданных с применением нанотехнологий (например, смартфоны или ноутбуки), и делают сравнительный анализ их характеристик с более старыми моделями. Дескриптор: Чётко описывает влияние наноматериалов на свойства предметов, используя конкретные примеры. 3.Ученики составляют список предметов, которые они используют в быту и которые сделаны с применением нанотехнологий (например, спортивная одежда с нановолокнами, смартфоны с нанопокрытием), и объясняют их преимущества. |
Взаимооценивание Словесная оценка учителя «Устная похвала учиеля» |
Карточка с текстом и изображением "Наноробот в крови" Видеофрагмент (30 сек) с визуализацией доставки лекарства Схема: «Традиционное vs Нано-лечение» Карточка с текстом и инфографикой «Эволюция процессоров» Модель чипа (3D-схема или картинка) Сравнительная таблица: 90 нм vs 7 нм процессоры Карточка с примерами: одежда, косметика, авто Фото: нанопокрытие, водоотталкивающая ткань Шаблон таблицы: «Предмет – Нанотехнология – Эффект» |
||
|
Конец урока 5 минут |
"Чемоданчик знаний" Изображает чемодан на доске. |
Записывают самое важное, что "возьмут с собой". |
|
|||
Урок №23
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Современные материалы: от керамики до графена |
|||||
|
Цели обучения согласно программе |
Изучить химические свойства и применение современных материалов. |
|||||
|
Цель урока |
Учащиеся умеют сравнивать свойства различных современных материалов и объяснять их применение. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Что объединяет эти материалы?» Формат: Учитель показывает 3 предмета: алюминиевая банка, стеклянная колба, изображение гибкого экрана. Вопрос к классу: |
1. Высказывают идеи о свойствах материалов. 2. Делятся на тематические группы. 3. Определяют направление исследования по карточке. |
«Устная похвала» |
Реальные предметы: алюминиевая банка, стекло, фото графенового экрана Карточки для деления на группы |
||
|
Середина урока 35 минут |
Контекст 1: Химические свойства и применение алюминия Алюминий — это лёгкий, гибкий и устойчивый к коррозии металл, который широко используется в строительстве, упаковке продуктов, автомобилестроении и электронике. Его низкая плотность и способность к переработке делают алюминий экологически выгодным материалом. Задание: Объясните, какие химические свойства алюминия делают его популярным для использования в строительстве и производстве упаковки. Как переработка алюминия помогает снизить нагрузку на окружающую среду? Контекст 2: Химические свойства стекла и его применение Стекло — это химически инертный, прозрачный материал, который используется в строительстве, оптике, производстве бытовых приборов и упаковке. Оно производится из кремнезёма и обладает высокой устойчивостью к химическим веществам, что делает его незаменимым в химической промышленности и медицине. Задание: Объясните, как химические свойства стекла (прозрачность, химическая инертность) делают его полезным в разных сферах, таких как медицина и строительство. Приведите примеры его применения. Контекст 3: Применение графена в электронике Графен — это материал, состоящий из одного слоя атомов углерода, который обладает невероятной прочностью и высокой электрической проводимостью. Благодаря своим уникальным свойствам, графен применяется в электронике, аккумуляторах, сенсорах и гибких дисплеях. Задание: Объясните, почему графен считается перспективным материалом для электроники. Какие его химические свойства делают его полезным для создания гибких экранов и мощных аккумуляторов? |
1.Ученик составляет таблицу с химическими свойствами алюминия (легкость, устойчивость к коррозии, проводимость тепла) и приводит примеры его использования. Ученик также исследует преимущества переработки алюминия и составляет краткий отчёт о её экологической важности.. Дескриптор: Успешно сравнивает свойства керамики и графена, объясняя их применение. 2.Ученик заполняет таблицу, где описывает основные химические свойства стекла и примеры его применения в повседневной жизни. 3.Ученик исследует, почему стекло используется в оптике и медицине, и делает схему процесса его производства. 4.Ученик создаёт схему, объясняющую структуру графена и его свойства (прочность, проводимость). Он исследует примеры использования графена в современных устройствах, таких как сенсоры или гибкие экраны, и делает доклад для класса о его потенциале в будущем. |
Словесная оценка учителя Самооценивание Словесная оценка учителя |
Карточка с описанием алюминия Инфографика «Жизненный цикл алюминиевой банки» Фото: применение алюминия в зданиях и упаковке Таблица: свойства – применение – экологический эффект Карточка с текстом о стекле Фото: лабораторное стекло, стеклопакеты, оптическое волокно Таблица: свойства – примеры применения – преимущества Иллюстрация структуры графена (гексагональная решётка) Карточка с фактами о графене Фото: гибкий экран, сенсор, батарея |
||
|
Конец урока 5 минут |
"Солнышко и тучка" Размещает два символа на доске. |
Крепят стикеры:
К тучке – что огорчило |
|
|||
Урок №24
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Химия в сельском хозяйстве: повышение урожайности |
|||||
|
Цели обучения согласно программе |
Рассмотреть химические методы повышения урожайности в сельском хозяйстве. |
|||||
|
Цель урока |
Учащиеся способны оценивать эффективность и экологичность различных химических методов в сельском хозяйстве. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
1. Демонстрирует 3 изображения. 2. Делит учащихся
на 3 группы по карточкам: 3. Объявляет тему
и цель: |
1. Делятся наблюдениями по фото. 2. Объединяются в группы. 3. Формулируют первое предположение: "Что даёт химия растениям?" |
Устная похвала |
1. Слайды/фото: поле, техника, упаковки 2. Карточки для распределения по темам |
||
|
Середина урока 35 минут |
Контекст 1: Использование удобрений для повышения урожайности
В сельском хозяйстве удобрения используются для обогащения почвы необходимыми питательными веществами, такими как азот, фосфор и калий. Эти элементы ускоряют рост растений, увеличивая их урожайность. Однако неправильное или избыточное использование удобрений может привести к загрязнению почвы и водоёмов, что отрицательно сказывается на окружающей среде. Задание: Объясните, как азот, фосфор и калий влияют на рост растений. Какие риски связаны с чрезмерным использованием удобрений? Контекст 2: Пестициды и их влияние на урожай
Пестициды используются в сельском хозяйстве для борьбы с вредителями и болезнями растений, что позволяет сохранять урожай. Однако химические вещества, содержащиеся в пестицидах, могут оставаться в почве и попадать в пищевые продукты, вызывая загрязнение окружающей среды и оказывая негативное воздействие на здоровье человека. Задание: Составьте список положительных и отрицательных сторон использования пестицидов. Как можно уменьшить вредное воздействие пестицидов на окружающую среду? Контекст 3: Применение биотехнологий для повышения урожайности
Биотехнологии, такие как генетически модифицированные организмы (ГМО), позволяют создать растения, устойчивые к вредителям и неблагоприятным условиям. Такие растения требуют меньшего количества пестицидов и удобрений, что может сократить негативное влияние на окружающую среду и повысить урожайность. Задание: Объясните, как ГМО помогают увеличить урожайность и снизить использование химических средств. Какие существуют мнения «за» и «против» использования ГМО? |
1 Ученик составляет таблицу с функциями азота, фосфора и калия, объясняя их влияние на рост растений. Затем ученик анализирует, какие экологические проблемы могут возникнуть при чрезмерном использовании удобрений, и предлагает способы их решения. Дескриптор: 1)Определяет основные компоненты удобрений 2)объясняет их роль в росте растений. 2.Ученик составляет два списка — плюсы и минусы использования пестицидов. Затем он исследует экологически безопасные альтернативы пестицидам (например, биопестициды или естественные хищники) и составляет краткое предложение по снижению вредного воздействия химических пестицидов. Дескриптор: Указывает минимум два экологических последствия использования химии в сельском хозяйстве. 3.Ученик исследует примеры ГМО-растений, устойчивых к вредителям и засухе, и составляет таблицу с аргументами «за» и «против» их использования. Он делает презентацию для класса, объясняя, как ГМО могут помочь уменьшить экологический ущерб, связанный с химическими удобрениями и пестицидами. Дескриптор: Предлагает минимум два альтернативных подхода для повышения урожайности. |
Словесная оценка учителя Самооценивание |
1. Таблица: Элемент – Функция – Риск 2. Фото загрязнённой воды и водорослевого цветения 3. Карточка с данными по удобрениям 1. Карточка: что такое пестициды 2. Фото: опрыскивание растений, предупреждающие знаки 3. Таблица для заполнения Карточки: аргументы «за» / «против» (для обсуждения) Фото: кукуруза ГМО, упаковка продуктов Таблица: ГМО – Преимущество – Риск – Мнение |
||
|
Конец урока 5 минут |
"Лестница успеха" Изображает лестницу с пятью ступенями. |
Отмечают свой уровень достижений на определенной ступени. |
|
|||
Урок №25
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Топливные элементы и водородная энергетика |
|||||
|
Цели обучения согласно программе |
Изучить принципы работы топливных элементов и перспективы водородной энергетики. |
|||||
|
Цель урока |
Учащиеся умеют объяснять химические процессы в топливных элементах и оценивать перспективы водородной энергетики |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Что идёт вперёд — вода или бензин?» Формат: Учитель показывает
изображение двух автомобилей: один с выхлопной трубой, другой с
каплей воды. |
1. Обсуждают отличия транспорта. 2. Делятся на группы. 3. Формулируют предположения: «Чем водород лучше бензина?» |
Устная похвала |
Презентация: сравнение машин (бензин / водород) - Стикеры для групп -Видеофрагмент: https://www.youtube.com/watch?v=7PvPz0TuyZ8 |
||
|
Середина урока 35 минут |
Контекст 1: Принцип работы топливных элементов
Топливные элементы — это устройства, которые преобразуют химическую энергию водорода и кислорода в электрическую энергию с минимальными выбросами загрязняющих веществ. Водород поступает в топливный элемент, где в результате реакции с кислородом образуются вода и электричество. Это делает топливные элементы экологически чистым источником энергии для автомобилей и других устройств. Задание: Объясните, как работает топливный элемент на водороде. Какие химические реакции происходят внутри, и какие вещества образуются в результате? Контекст 2: Водородные автомобили
Современные автомобили на водородных топливных элементах предлагают экологичную альтернативу традиционным машинам с двигателем внутреннего сгорания. Эти автомобили не выделяют углекислого газа, так как их «топливом» является водород, а единственным продуктом реакции — вода. Тем не менее, остаются вопросы относительно стоимости и инфраструктуры для заправки водородом. Задание: Сравните автомобили на водородных топливных элементах с традиционными автомобилями на бензине. Какие преимущества и недостатки имеет каждая технология? Контекст 3: Водород как будущее энергетики
Водородная энергетика рассматривается как один из ключевых способов перехода на возобновляемые источники энергии. Водород можно получать из воды с помощью электролиза, а затем использовать его для генерации электричества, не выделяя углекислого газа. Однако процесс получения водорода требует значительных затрат энергии, и обсуждаются различные способы его производства. Задание: Объясните, как можно получать водород с помощью электролиза воды. Какие проблемы существуют при использовании водорода в качестве массового источника энергии? |
1Ученик рисует схему топливного элемента, показывает путь водорода и кислорода, и объясняет, как в результате реакции образуются вода и электричество. Дескриптор: Чётко объясняет принцип работы топливных элементов, используя правильные термины. 2.Ученик составляет таблицу с плюсами и минусами водородных и бензиновых автомобилей, анализируя выбросы, стоимость и инфраструктуру заправки. Дескриптор: Сравнивает водородную энергетику с традиционными источниками топлива, указывая преимущества и недостатки. 3.Ученик описывает процесс электролиза воды и рисует схему, показывающую расщепление воды на водород и кислород. Он также приводит список трудностей, таких как высокая стоимость и энергетические затраты при производстве водорода. Дескриптор: Приводит минимум два примера экологической пользы водородной энергетики. |
Словесная оценка учителя «Верно-неверно» Взаимооценивание Взаимооценивание |
Инфографика: «Как работает водородный топливный элемент»
Уравнение: Анимация реакции Карточка: электрод – ион – вода Таблица-сравнение Фото: Toyota Mirai, заправка H₂, бензоколонка Карточки с фактами (затраты, экологичность) Схема электролиза воды Карточка: «Зелёный водород против серого» Инфографика: Проблемы и плюсы H₂ Таблица: Метод – Энергозатраты – Экологичность |
||
|
Конец урока 5 минут |
"Поезд достижений" Рисует поезд с тремя вагонами (знаю, умею, хочу узнать). |
Заполняют вагоны своими достижениями. |
|
|||
Урок №26
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
3D-печать: химия новой эры производства |
|||||
|
Цели обучения согласно программе |
Рассмотреть химические аспекты технологии 3D-печати. |
|||||
|
Цель урока |
Учащиеся могут объяснить химические принципы 3D-печати и ее применение в различных областях. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ?️ «Что можно напечатать?» Формат: Учитель показывает фотографии 3D-печатных объектов:
Вопрос: |
1. Высказывают предположения. 2. Делятся на группы. 3. Обсуждают возможные области применения 3D-печати. |
Устная похвала |
Фото: 3D-ключ, протез, пластик Карточки для деления по темам |
||
|
Середина урока 35 минут |
Контекст 1: Материалы для 3D-печати 3D-печать — это технология, которая позволяет создавать объекты послойно, используя различные материалы, такие как пластики, металлы и даже биоматериалы. Химические свойства материалов играют ключевую роль в процессе 3D-печати, определяя прочность, гибкость и устойчивость объектов. Задание: Исследуйте, какие материалы используются для 3D-печати и как их химические свойства влияют на конечный продукт. Приведите примеры использования пластиков и металлов в 3D-печати. Контекст 2: Применение 3D-печати в медицине 3D-печать активно используется в медицине для создания протезов, имплантов и даже тканей. С помощью этой технологии можно напечатать детали, идеально подходящие по размеру и форме для каждого пациента. Биологические материалы, применяемые для таких целей, должны обладать специальными химическими свойствами, чтобы быть совместимыми с человеческим телом. Задание: Объясните, как 3D-печать используется в медицине для создания имплантов и протезов. Какие химические и биологические свойства материалов важны для этого процесса? Контекст 3: Экологические аспекты 3D-печати 3D-печать может стать экологически более безопасной альтернативой традиционному производству, поскольку она снижает количество отходов и позволяет использовать переработанные материалы. Однако производство пластиковых объектов может привести к загрязнению, если не соблюдать меры по переработке материалов. Задание: Проанализируйте, как 3D-печать может помочь уменьшить экологическое воздействие производства. Какие меры можно предпринять для использования переработанных материалов в 3D-печати? |
1.Ученик составляет таблицу, где описывает основные материалы для 3D-печати (например, PLA, ABS, металлы) и их химические свойства. Он приводит примеры, как пластики используются для создания прототипов, а металлы — для производства деталей в авиации. Дескриптор: Правильно объясняет химические процессы, обеспечивающие работу 3D-принтеров. 2.Ученик создает схему применения 3D-печати в медицине, показывая, как импланты создаются по индивидуальным параметрам, и описывает, почему биосовместимость и прочность материалов критически важны для их использования в организме. Дескриптор: 1)Приводит минимум два примера материалов, используемых в 3D-печати 2) описывает их свойства. 3.Ученик исследует способы переработки материалов для 3D-печати и составляет предложение для класса о том, как можно использовать переработанные пластиковые материалы для создания новых объектов с помощью 3D-принтера. |
Словесная оценка учителя Самооценивание взаимопроверка |
Инфографика: «Пластики и металлы для 3D-печати» Таблица: «Материал – Свойство – Применение» Фото: объекты из PLA, ABS, металла Карточка: 3D-печать в хирургии и стоматологии Фото: протез, челюсть, имплант Схема: «Материал – Химическое свойство – Биосовместимость» Инфографика: «3D-печать и окружающая среда» Карточки: переработка PLA, экологические проекты Таблица: «Плюсы – Минусы – Решения» |
||
|
Конец урока 5 минут |
"Яблоня отзывов" Крепит на доску дерево. |
Прикрепляют яблоки разных цветов: Красные – отлично понял Желтые – есть вопросы Зеленые – нужна помощь |
|
|||
Урок №27
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Химические источники света: от свечи до OLED |
|||||
|
Цели обучения согласно программе |
Изучить химические процессы, лежащие в основе различных источников света. |
|||||
|
Цель урока |
Учащиеся умеют сравнивать различные источники света с точки зрения их химического принципа действия и эффективности. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Что даёт свет — огонь или электроны?» Формат: На
экране — свеча, лампа накаливания, OLED-экран. |
1. Обсуждают, откуда берётся свет в каждом примере. 2. Делятся на группы. 3. Формулируют гипотезы: что выделяет свет и как? |
«Устная похвала» |
Слайды/изображения: свеча, лампа, OLED Карточки для групп |
||
|
Середина урока 35 минут |
Контекст 1: Свечи как химический источник света
Свеча — это один из древнейших химических источников света. При сгорании воска или парафина происходит химическая реакция, при которой высвобождается энергия в виде тепла и света. В этой реакции участвуют кислород, углерод и водород, а побочные продукты включают углекислый газ и водяной пар. Свечи долго использовались до изобретения электрического освещения, и процесс горения является важным примером экзотермической реакции. Задание: Объясните, какие химические реакции происходят при горении свечи. Почему свеча выделяет тепло и свет? Контекст 2: Лампы накаливания и флуоресцентные лампы
Лампы накаливания и флуоресцентные лампы — это два типа источников света, которые работают по разным химическим и физическим принципам. Лампы накаливания производят свет за счёт нагрева металлической нити, тогда как флуоресцентные лампы используют химические вещества, такие как ртуть, для создания ультрафиолетового излучения, которое преобразуется в видимый свет с помощью люминофора. Задание: Сравните лампы накаливания и флуоресцентные лампы. Какие химические процессы происходят в каждой лампе и как они влияют на энергоэффективность и срок службы ламп? Контекст 3: OLED — органические светодиоды
Органические светодиоды (OLED) — это современная технология, которая использует органические соединения для создания света. При пропускании электрического тока через органический материал, происходит возбуждение молекул, которые излучают свет. OLED широко используются в экранах смартфонов, телевизоров и других устройств благодаря их яркости, гибкости и экономичности. Задание: Объясните, как работает OLED и чем он отличается от обычных светодиодов (LED). Какие преимущества дают органические светодиоды для создания современных дисплеев? |
1.Ученик рисует схему горения свечи, показывая, как кислород взаимодействует с углеводородами воска или парафина, и объясняет, почему в результате высвобождаются свет и тепло. Дескриптор: Чётко описывает принцип работы светодиодов и OLED на уровне химических реакций. 2.Ученик составляет таблицу, где сравнивает химические и физические процессы в лампах накаливания и флуоресцентных лампах, и делает выводы о том, какая лампа более энергоэффективна и долговечна. Дескриптор: Сравнивает эффективность различных источников света по ключевым параметрам. 3.Ученик рисует схему устройства OLED, объясняя, как происходит излучение света на молекулярном уровне, и сравнивает их с обычными светодиодами, исследуя преимущества в яркости и гибкости дисплеев. Дескриптор: Приводит минимум два примера использования источников света в бытовых и промышленных условиях. |
Словесная оценка учителя Самооценивиание Взаимопроверка |
Инфографика: «Горение свечи» Уравнение: Фото: пламя + фаза сажи + теплообмен Таблица: «Вещество – Функция в процессе» Схема: «Как работает каждая лампа» Карточки: ртуть, вольфрам, люминофор Инфографика: «Сравнение световых технологий» Сравнение: LED vs OLED (таблица) Фото: гибкий экран, подсветка в одежде Карточка: «Электрон – Органика – Свет» |
||
|
Конец урока 5 минут |
"Синквейн" Объясняет структуру синквейна. |
Составляют пятистрочное стихотворение об уроке. |
|
|||
Урок №28
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Химия в криминалистике: раскрытие преступлений |
|||||
|
Цели обучения согласно программе |
Ознакомить с химическими методами, используемыми в криминалистике. |
|||||
|
Цель урока |
Учащиеся способны объяснить принципы основных химических методов, применяемых в криминалистике. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод:«Сцена преступления» (мини-квест) Формат: На
доске — изображение сцены преступления: след крови, порошок, стекло
с отпечатком. |
1. Анализируют изображение. 2. Делятся по темам. 3. Формируют версии: как можно "увидеть" невидимое? |
Комментарий учителя |
1. Слайд: «CSI: Химический детектив» 2. Фото сцены преступления |
||
|
Середина урока 35 минут |
Контекст 1: Использование химических реактивов для выявления следов крови
В криминалистике химические реактивы, такие как люминол, используются для обнаружения следов крови на месте преступления, даже если их пытались смыть. Люминол вступает в реакцию с железом в гемоглобине крови, вызывая свечение, которое помогает экспертам обнаружить незаметные глазу следы. Задание: Объясните, как работает люминол для выявления следов крови. Почему его свечение помогает криминалистам? Контекст 2: Анализ наркотических веществ
Химический анализ играет важную роль в идентификации наркотических веществ на месте преступления. Криминалисты используют методы, такие как хроматография и спектроскопия, чтобы определить химический состав образцов и выявить присутствие запрещённых веществ. Задание: Опишите процесс хроматографии и как он помогает в идентификации наркотиков. Какие химические принципы лежат в основе этого метода? Контекст 3: Дактилоскопия и химические методы выявления отпечатков пальцев
Отпечатки пальцев — это важное доказательство на месте преступления. Для их выявления применяются химические методы, такие как использование цианакрилата (суперклея), который вступает в реакцию с жирами и потожировыми выделениями, делая отпечатки видимыми на различных поверхностях. Задание: Объясните, как работает метод выявления отпечатков пальцев с использованием цианакрилата. Какие химические реакции позволяют сделать отпечатки видимыми? |
1.Ученик рисует схему реакции люминола с железом в крови, объясняя, как образуется свечение, и приводит примеры его применения в реальных расследованиях. Дескриптор: 1)Объясняет использование химических методов в криминалистике 2)приводит два примера. 2.Ученик изучает принцип работы хроматографии, рисует схему процесса и объясняет, как разделение веществ помогает криминалистам идентифицировать наркотические вещества. Дескриптор: Правильно записывает реакцию, используемую для анализа химических следов. 3.Ученик изучает процесс взаимодействия цианакрилата с жировыми выделениями, рисует схему процесса и объясняет, почему этот метод широко используется в криминалистике для выявления отпечатков пальцев. Дескриптор: Анализирует преимущества и ограничения химических методов в криминалистике. |
Словесная оценка учителя взаимооценивание Комментарий учителя |
Уравнение: Фото: люминол в действии Карточка: преимущества метода Видео-анимация:
Фото: отпечатки до и после обработки Карточка: «Что такое цианакрилат?» Пошаговая схема реакции |
||
|
Конец урока 5 минут |
"Рефлексивный ринг" Организует пространство для быстрых ответов. |
По очереди высказываются о главном на уроке. |
|
|||
Урок №29
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Растворы и их концентрация |
|||||
|
Цели обучения согласно программе |
Изучить способы выражения концентрации растворов и их практическое применение. |
|||||
|
Цель урока |
Учащиеся умеют рассчитывать концентрации растворов и готовить растворы заданной концентрации. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: «Сколько сахара в напитке?» Формат: Учитель показывает три стакана с растворами сахара (разной
концентрации). |
1. Обсуждают, что такое раствор и концентрация. 2. Сравнивают свойства разных растворов. 3. Делятся идеями: как измерить «насыщенность» раствора. |
Комментарий учителя |
Карточки с формулами концентрации (Cm = mв-ва / mр-ра · 100%) Мини-викторина:
|
||
|
Середина урока 35 минут |
✅ Задание 1: Заполнение таблицы "Концентрация растворов" Заполните таблицу, определяя, какой компонент является растворителем, а какой — растворённым веществом. Укажите возможную массовую долю и влияние концентрации.
✅ Задание 2: Составление схемы "Как приготовить раствор?" Составьте пошаговую схему приготовления раствора с заданной концентрацией (например, 10% NaCl):
Формат: Работа в парах с шаблоном, калькулятором и карточками ✅ Задание 3: Обсуждение "Где концентрация имеет значение?" Составьте два списка: |
Определяет компоненты раствора, применяет формулу массовой доли. Дескриптор: Учащийся заполняет таблицу, указывая растворённые вещества и влияние концентрации. 2.Рассчитывает массу компонентов и строит визуальную схему приготовления раствора. Дескриптор: Учащийся составляет схему приготовления раствора с нужной концентрацией. 3. Приводит примеры последствий ошибки в концентрации и способы контроля. Дескриптор: Учащийся обосновывает важность концентрации в реальной жизни. |
Словесная оценка учителя Взаимооценка Самооценка |
1. Формула массовой доли вещества:
2. Раздаточные
карточки с «подсказками»: Раздаточные
карточки с заданиями: Кейс-карточки «Опасность
концентрации»: |
||
|
Конец урока 5минут |
"Цветовая гамма" Раскладывает цветные карточки. |
Выбирают цвет, соответствующий их настроению и успехам. |
Цветные карточки для рефлексии |
|||
Урок №30
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Кристаллы и кристаллические решетки |
|||||
|
Цели обучения согласно программе |
Рассмотреть типы кристаллических решеток и их влияние на свойства веществ. |
|||||
|
Цель урока |
Учащиеся способны определять тип кристаллической решетки вещества и предсказывать его свойства. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Что объединяет лёд, соль и графит?» Формат: Учитель показывает
изображения (или реальные образцы): кристаллы соли, лёд, графит
(грифель), золото. |
1. Разглядывают и сравнивают материалы. 2. Делятся ассоциациями. 3. Объединяются в тематические группы. |
Устный комментарий учителя |
Изображения или образцы: соль, лёд, кварц, графит, медь Мини-викторина:
|
||
|
Середина урока 35 минут |
✅ Задание 1: Заполнение таблицы «Типы кристаллических решёток» Заполните таблицу:
✅ Задание 2: Схема «Как строится кристалл?» Составьте схему формирования кристаллической решётки (на примере NaCl):
✅ Задание 3: Обсуждение «Кристаллы в повседневной жизни» Составьте 2
списка: |
1.Определяет тип решётки по частицам и заполняет свойства. Дескриптор: Учащийся правильно определяет тип решётки, приводит примеры и описывает свойства. 2.Визуализирует процесс образования кристаллов.
Дескриптор: Учащийся создаёт схему с этапами образования кристаллической решётки. 3.Связывает свойства кристаллов с их применением. Дескриптор: Учащийся объясняет практическое применение веществ с разными типами кристаллической решётки. |
Взаимооценивание по критериям Взаимооценка Комментарий учителя |
1. Таблица с подсказками 2. Модельные изображения решёток Карточки с этапами (перемешаны) Плакат «Как строится решётка» Фото кристаллов в увеличении 1.Фото: кристаллы сахара, соли, алмаза, кремния 2. Таблица: «Кристалл – Свойство – Применение» |
||
|
Конец урока 5 минут |
"Газета успеха" Крепит на доску лист ватмана. |
Пишут заголовки новостей об уроке. |
|
|||
Урок №31
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Электролитическая диссоциация |
|||||
|
Цели обучения согласно программе |
Изучить процесс электролитической диссоциации и его роль в химических реакциях. |
|||||
|
Цель урока |
Учащиеся умеют составлять уравнения диссоциации и объяснять свойства электролитов. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Что происходит с солью в воде?» Формат: Учитель показывает два стакана: один с водой и солью,
другой с водой и сахаром. |
1. Сравнивают растворы. 2. Делают предположения о причинах проводимости. 3. Определяют тему и цели урока. |
Устный комментарий учителя |
Презентация: «Растворы и проводимость» Фото: глюкоза и NaCl в растворе
|
||
|
Середина урока 35 минут |
✅ Задание 1: Заполнение таблицы «Кто диссоциирует?» Заполните таблицу:
✅ Задание 2: Схема «Как распадается вещество?» Создайте схему или комикс из 4 шагов:
✅ Задание 3: Обсуждение «Зачем нужны электролиты?» Составьте два
списка: |
1Ученик классифицирует вещества и записывает уравнения диссоциации. Дескриптор: Учащийся правильно определяет тип вещества и уравнение его диссоциации
2Ученик визуализирует пошаговый процесс диссоциации на примере NaCl или HCl.
Дескриптор: Учащийся строит логичную схему процесса с указанием частиц. 3.Находит связь между диссоциацией и её ролью в жизни. Дескриптор: Учащийся объясняет значение электролитов в быту и биологии. |
. Взаимооценивание Верно-неверно Самооценка Комментарий учителя «Отлично», «Прекрасно» Все верно» «Умничка» |
Таблица растворимости Примеры уравнений: HCl → H⁺ + Cl⁻ Карточки: «Электролит или нет?» Шаблон схемы «до и после» Модель ионного распада Карточки с ионами Na⁺, Cl⁻, H⁺, OH⁻ Фото: электролит в аккумуляторе, спортивный напиток, плазма крови Инфографика: «Электролиты в организме» Таблица: «Соль – Ионы – Значение» |
||
|
Конец урока 5 минут |
"Рюкзак пожеланий" Рисует рюкзак на доске. |
Пишут пожелания себе и одноклассникам. |
|
|||
Урок №32
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Окислительно-восстановительные реакции в природе и технике |
|||||
|
Цели обучения согласно программе |
Рассмотреть механизмы окислительно-восстановительных реакций и их значение. |
|||||
|
Цель урока |
Учащиеся могут определять окислитель и восстановитель в реакциях и приводить примеры ОВР в природе и технике. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ?️ «Где вы встречали ржавчину?» Формат: Учитель показывает
фото: ржавый гвоздь, горение дров, дыхание, аккумулятор. |
|
Комменатрий учителя |
Фото: ржавчина, костёр, выхлоп, дыхание Видео: ОВР в жизни https://www.youtube.com/watch?v=dSwyspWbQKU |
||
|
Середина урока 35 минут |
Задание 1 (ГРУППОВОЕ): Проект «ОВР в природе» Инструкция: Постер должен включать: ⚙️ Задание 2 (ПАРНОЕ): Разбор «ОВР в технике» Инструкция: Ваша задача: Задание 3 (ИНДИВИДУАЛЬНОЕ): Картотека реакций Инструкция: Пример
уравнения: |
1.Исследует природное явление, определяет участников ОВР и визуализирует процесс.. Дескриптор: Учащийся объясняет суть ОВР, указывает реагенты, и оформляет материал в виде постера
2 В паре анализирует описание, выделяет участников реакции и объясняет её роль. Дескриптор: Учащийся определяет элементы-донора и акцептора электронов, делает логический вывод. 3Самостоятельно работает с химическими уравнениями, выявляя ОВР по степеням окисления.
Дескриптор: Учащийся корректно определяет степени окисления и указывает окислитель/восстановитель. |
. Взаимооценивание по критериям Самооцениванаие |
Таблица ОВР-примеров Карточки: "Окислитель", "Восстановитель", "Природный контекст" Бумага, маркеры, схемы, шаблон постера Таблица ОВР-признаков Подсказки-символы: ? (окисл.) ? (восст.) Бланк с уравнениями Таблица степеней окисления Цветные маркеры или иконки |
||
|
Конец урока 5 минут |
"Термометр знаний" |
Отмечают уровень своего понимания темы. |
Термометр знаний |
|||
Урок №33
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Скорость химических реакций и факторы, влияющие на нее |
|||||
|
Цели обучения согласно программе |
Изучить понятие скорости химической реакции и факторы, влияющие на нее. |
|||||
|
Цель урока |
Учащиеся умеют объяснять влияние различных факторов на скорость химических реакций и применять эти знания на практике. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ? «Реакция — быстро или медленно?» Формат: Учитель показывает короткое видео:
Вопрос: |
1. Делятся предположениями. 2. Делятся на форматы работы. 3. Обсуждают: какие реакции они видели в жизни.
|
Устный комментарий учителя |
Мини-тест:
|
||
|
Середина урока 35 минут |
Задание 1 (ГРУППОВОЕ): Постер-фактор «Ускорь или замедли» Инструкция:
Включите: ⚗ Задание 2 (ПАРНОЕ): Моделируем реакцию Инструкция: ? Ситуации: –
Увеличили температуру при реакции с цинком Выполните: Задание 3 (ИНДИВИДУАЛЬНОЕ): Квиз + мини-анализ Инструкция: 1. Пройди мини-квиз из 5 вопросов (мгновенная проверка знаний по факторам).
2. Выбери 1
реакцию (из 3 предложенных) и напиши: Реакция
1:
Реакция
2:
Реакция
3:
|
1 Выбирает фактор, исследует его и оформляет постер с визуализацией. Дескриптор: Учащийся объясняет влияние одного из факторов на скорость реакции и приводит пример.
2 В паре анализирует ситуацию, обсуждает, делает прогноз.
Дескриптор: Учащийся объясняет, как изменение условий влияет на скорость, с научным обоснованием.
3Отвечает на вопросы и применяет знания в мини-анализе. Дескриптор: Учащийся демонстрирует знание факторов и умеет применять их к конкретной реакции.
|
Взаимооценивание групп Устная похвала учителя «Отлично», «Прекрасно» Все верно» «Умничка» Самооценивание Верно-неверно |
Карточки: «Фактор», «Пример», «Схема» Таблицы с данными Графики скорости Бумага, маркеры, фломастеры Карточки-сценарии Таблица «Фактор – Последствие» Подсказки: кинетика, энергия активации Google-форма/бумажный квиз Лист с реакциями Краткий справочник по факторам Иконки: ? температура, ? концентрация, площадь |
||
|
Конец урока 5 минут |
"Дневник успеха" Раздает мини-дневники. |
Записывают свои достижения и трудности. |
|
|||
Урок №34
|
Фамилия имя педагога |
|
|||||
|
Класс: |
Количество участников: |
Количество отсутствующих: |
||||
|
Тема урока: |
Химическое равновесие и принцип Ле Шателье |
|||||
|
Цели обучения согласно программе |
Рассмотреть понятие химического равновесия и принцип Ле Шателье. |
|||||
|
Цель урока |
Учащиеся способны предсказывать смещение химического равновесия при изменении условий реакции. |
|||||
|
Процесс урока: |
||||||
|
Часть/время урока |
Действия преподавателя |
Действия ученика |
Оценка |
Ресурсы |
||
|
Начало урока 5 минут |
Метод: ⚖ «Качели химии» Формат: Учитель
демонстрирует рисунок или анимацию: равновесие как качели. |
Действия учащихся:
|
Комменатрий учителя Верно-неверно |
Слайд/анимация: качели/весы Викторина:
|
||
|
Середина урока 35 минут |
✅ Задание 1 (ГРУППОВОЕ): «Сценарии смещения» Инструкция: ? Пример:
✅ Задание 2 (ПАРНОЕ): «Вопрос по уравнению» Инструкция:
? Пример:
✅ Задание 3 (ИНДИВИДУАЛЬНОЕ): «Разбор равновесия» Инструкция:
? Пример:
|
1 Анализирует реакцию, интерпретирует смещение равновесия и визуализирует его.
Дескриптор: Учащийся объясняет смещение равновесия при изменении условий, используя принцип Ле Шателье. 2Задаёт и отвечает на содержательные вопросы по конкретным условиям реакции. Дескриптор: Учащийся аргументированно отвечает на вопросы, демонстрируя понимание принципа Ле Шателье. 3 Применяет знания для анализа конкретной реакции и условий.
Дескриптор: Учащийся прогнозирует направление смещения равновесия при изменении условий. |
Взаимоооценивнаие парами Верно-неверно Самооценка по шаблону |
Карточки с уравнениями и сценариями Постер/схема «Как реагирует система» Иконки: ? T, ? P, ↑ концентрация Бумага, фломастеры, шаблоны комикса Карточки с реакциями Список возможных воздействий Таблица: «Что влияет — Как меняется» Таймер на 5 мин
Бланк ответа Таблица: экзо-/эндотермические реакции Краткий алгоритм «3 шага для анализа» |
||
|
Конец урока 5 минут |
"Поляна мнений" Создает пространство для высказываний. |
Размещают цветы-отзывы на поляне: Красные – полное понимание Синие – частичное понимание Белые – нужна помощь |
Цветы для отзывов Красные, синие, белые |
|||
38

шағым қалдыра аласыз