
КРАТКОСРОЧНЫЙ ПЛАН
|
Раздел долгосрочного планирования: 8.3В. Виды химических связей |
Школа: КГУ СОШ №25 |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Дата:
|
Ф.И.О. учителя: Запрометова Анастасия Викторовна
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Класс:7
|
Участвовали:
|
Отсутствовали:
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Тема урока: |
Электроотрицательность |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Цели обучения, которые достигаются на данном уроке |
8.1.4.1 -объяснять образование ковалентной связи между атомами на основе электроотрицательности |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Цель урока
|
-Называют понятия «химическая связь», «электроотрицательность», причину и природу химической связи, ее виды. Могут сравнивать элементы по ЭО. Могут объяснять причину образования химической связи. |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Критерий оценки
|
Учащиеся знают понятия «электроотрицательность», «химическая связь» и виды химической связи. Могут сравнивать химические элементы по ЭО. |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Языковые цели
|
Учащиеся будут использовать в речи ключевые термины и понятия по описанию электроотрицательности; сравнивать элементы по ЭО; объяснять причину образования химической связи. |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Привитие ценностей
|
Коммуникативные навыки и ответственность за проделанную работу. Развитие эстетических ценностей при выполнении творческих заданий и оформлении записей в тетради. |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Межпредметные связи |
физика |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Предшествующие знания |
8.1А Движение электрона в атомах
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Ход урока |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Запланированные этапы урока |
Виды упражнений, запланированных на уроке
|
Ресурсы
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
Начало урока 2 мин
|
Здравствуйте, ребята! Я предлагаю Вам посмотреть на слайд. На нем представлено текстовое поле. Психологи утверждают, что первые три слова, которые попадутся Вам на глаза будут, так или иначе, сопровождать вас весь день. Я надеюсь, что всем попались добрые и позитивные слова! Деление на группы «Найди свое семейство». У каждого ученика на столе лежит карточка. На карточке изображен химический элемент. Учащиеся должны определить, к какой группе относится данный химический элемент». Всего 4 семейства: 1 группа – щелочные металлы 2 группа – щелочно-земельные 3 группа – халькогены 4 группа - галогены |
Слайд 1
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
Актуализация знаний (4 мин) Подвод к новой теме урока. Середина урока 3 мин.
Металлическая
Ковалентная связь- образуется между атомами с одинаковым или со сходным значение электроотрицательности.
Полярная связь- образованная между атомами со сходным значением электроотрицательности. (неМе и неМе)
8 мин Выполнение задания - 2 мин. защита постера - 2 мин. 2 мин. 2 мин. Закрепление 8 мин. Конец урока 2 мин.
|
Фронтальная беседа «Пинг понг». (Г)
ФО «Сигналы рукой» Группы оценивают ответ своих соперников, насколько точно они ответили.
Просмотр видеофрагмента для подвода к новой темы. (И). Электроотрицательность - вeличина, характеризующая свойство атомов элемента притягивать к себе электроны, которые участвуют в образовании химических связей, от других атомов в соединениях. Физический смысл понятия электроотрицательность сводится к объяснению способности элемeнта завершить свой незавершенный энергетический уровень при взаимодействии с другими элементами.
Химическая связь
Водородная
Ионная связь –химическая связь, образованная между атомами с разным значением электроотрицательности.(Ме и неМе)
Неполярная связь-образованная между атомами с одинаком значением электроотрицательности. (неМе)
Прием «Инсерт» (Г) Учащиеся читают текст учебника и делают соответствующие пометки: «V» – уже известный материал; «–» – противоречит представлениям; «+» – интересно и неожиданно; «?» – что-то неясно, возникло желание узнать больше. Учащиеся работают простым карандашом, на полях выставляют знаки; заполняют таблицу (вписывают только ключевые слова).
Прием «Ментальная карта».
Материал предоставлен в учебнике и в раздаточном материале. Ваша задача – из теоретического материала выбрать информацию для карты. Вы должны помнить правила ее составления:
Работа с шаростержневыми моделями. (Г) Учитель предлагает учащимся изобразить структурные формулы, а затем изготовить данные молекулы с помощью шаростержневых моделей. 1 группа хлор 2 группа кислород 3 группа соляная кислота 4 группа хлорид натрия
Учащимся необходимо сделать вывод о том, какая молекула более прочная; какое вещество более активное.
ФО «Светофор». У каждого ученика имеются карточки трех цветов светофора: все понятно – зеленый, остались вопросы – желтый, непонятно – красный.
Физкультминутка
Задание №1 Каждому учащемуся выдается карточка с приемом на закрепление. (П) Прием «Вставить пропущенное слово»
Учитель включает слайд с правильными ответами. Учащиеся обмениваются карточками со своими ответами и проводят взаимопроверку.
- Плохо
Дифференцированные задание (И) Учитель даeт карточки с дифференцированными заданиями. Задание №1 Используя числовые значения электроотрицательности, определите, у какой пары наиболее выражены металлические свойства:
Задание №2 Расположите элементы в порядке уменьшения ЭО: хлор, фтор, натрий, водород, фосфор, кислород, алюминий, кремний, магний. (Cl, F, Na, H, P, O, Al, Si, Mg). Задание №3 Прием «Соответствие». Зная численные значения электроотрицательности элементов, установите соответствия между формулой вещества и видом химической связи.
«Словесная оценка» Устная обратная связь учителя и обучающегося.
Обратная связь Прием «Три М одно Д» Обучающимся необходимо назвать три момента, которые хорошо получились на уроке и одно действие, которое улучшит их работу на следующий урок. Рефлексия Прием «Запусти корабль в море знаний». Ребята, которые считают, что хорошо усвоили тему, помещаю свой кораблик в море, а те кто не уверен в этом, остаются в заливе правил (на берегу). Домашнее задание §34, стр. 128-130 Задание № 1 (составьте синквейн): «Синквейн» Составление синквейна по схеме: первая строка – понятие, выраженное существительным, вторая строка – описание двумя прилагательными (причастиями), третья строка – 3 слова глагола, описывающие действие четвёртая строка – 4 значимые слова, выражающие отношение к понятию, пятая строка- слово-синоним понятию, обобщение или расширение смысла. Например:
Задание№ 2 Составить презентацию на тему «Электроотрицательность».
|
одна из групп отвечает на вопрос другой из групп. Слайд с вопросами.
раздаточный материал
Учебник, раздаточный материал.
Составляют ментальную карту формата А3, соблюдая правила. Для работы используют текст учебника, раздаточный материал.
шаростержневые модели
Физкультминутка под музыкальную паузу.
Ответы:
Задание №1
Задание №2 F, O,Cl, P, Si, H, Al Mg, Na. Задание №3 А) 3 В) 1 С)2
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися? |
Оценивание – как Вы планируете проверить уровень усвоения материала учащимися? |
Здоровье и соблюдение техники безопасности. |
|
1. Дифференциация по группам, по заданиям для изучения новой темы. 2. Дифференциация по подаче информации (работа с текстом). 2. Разноуровневые задания на всех учащихся на этапе закрепления. 3. Разноуровневое домашнее задание.
|
1. Формативное оценивание 2. Самооценивание 3. Взаимооценивание |
1.Психологический настрой на урок. 2. Физминутка. 3. Правила Т.Б. при работе в кабинете химии.
|
Приложение
Фронтальная беседа «Пинг понг». (Г)
-
Сколько периодов и групп в периодической системе?
-
Как изменяются свойства элементов по группе и по периоду?
-
Какова особенность строения атома металла? Неметалла?
-
Сколько электронов на внешнем слое атомов главных подгрупп?
Прием «Вставить пропущенное слово»
-
Зная численные значения электроотрицательностей, можно судить о принадлежности соответствующего элемента к …….. или …………..
-
У металлов электроотрицательность, как правило,………., а у неметаллов ………..
-
Электроотрицательность элементов возрастает в периодах ………, а в главных подгруппах- ……..
-
При химических реакциях электроны ……. или ……… к атомам элементов, обладающих ……… электроотрицательностью.
Разноуровневые задания
Задание №1
Используя числовые значения электроотрицательности, определите, у какой пары наиболее выражены металлические свойства:
-
Na-Mg; 2) Mg-Al; 3) Al -Si.
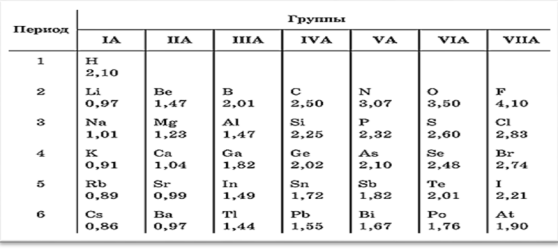
Задание №2
Расположите элементы в порядке уменьшения ЭО: хлор, фтор, натрий, водород, фосфор, кислород, алюминий, кремний, магний. (Cl, F, Na, H, P, O, Al, Si, Mg).
Задание №3
Прием «Соответствие».
Зная численные значения электроотрицательности элементов, установите соответствия между формулой вещества и видом химической связи.
|
формула вещества |
вид химической связи |
|
А) O2 |
1.ионная |
|
B) KCl |
2.ковалентная полярная |
|
C) HF |
3.ковалентная неполярная |
жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
Электроотрицательность
Электроотрицательность
КРАТКОСРОЧНЫЙ ПЛАН
|
Раздел долгосрочного планирования: 8.3В. Виды химических связей |
Школа: КГУ СОШ №25 |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Дата:
|
Ф.И.О. учителя: Запрометова Анастасия Викторовна
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Класс:7
|
Участвовали:
|
Отсутствовали:
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Тема урока: |
Электроотрицательность |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Цели обучения, которые достигаются на данном уроке |
8.1.4.1 -объяснять образование ковалентной связи между атомами на основе электроотрицательности |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Цель урока
|
-Называют понятия «химическая связь», «электроотрицательность», причину и природу химической связи, ее виды. Могут сравнивать элементы по ЭО. Могут объяснять причину образования химической связи. |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Критерий оценки
|
Учащиеся знают понятия «электроотрицательность», «химическая связь» и виды химической связи. Могут сравнивать химические элементы по ЭО. |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Языковые цели
|
Учащиеся будут использовать в речи ключевые термины и понятия по описанию электроотрицательности; сравнивать элементы по ЭО; объяснять причину образования химической связи. |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Привитие ценностей
|
Коммуникативные навыки и ответственность за проделанную работу. Развитие эстетических ценностей при выполнении творческих заданий и оформлении записей в тетради. |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Межпредметные связи |
физика |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Предшествующие знания |
8.1А Движение электрона в атомах
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Ход урока |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Запланированные этапы урока |
Виды упражнений, запланированных на уроке
|
Ресурсы
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
Начало урока 2 мин
|
Здравствуйте, ребята! Я предлагаю Вам посмотреть на слайд. На нем представлено текстовое поле. Психологи утверждают, что первые три слова, которые попадутся Вам на глаза будут, так или иначе, сопровождать вас весь день. Я надеюсь, что всем попались добрые и позитивные слова! Деление на группы «Найди свое семейство». У каждого ученика на столе лежит карточка. На карточке изображен химический элемент. Учащиеся должны определить, к какой группе относится данный химический элемент». Всего 4 семейства: 1 группа – щелочные металлы 2 группа – щелочно-земельные 3 группа – халькогены 4 группа - галогены |
Слайд 1
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
Актуализация знаний (4 мин) Подвод к новой теме урока. Середина урока 3 мин.
Металлическая
Ковалентная связь- образуется между атомами с одинаковым или со сходным значение электроотрицательности.
Полярная связь- образованная между атомами со сходным значением электроотрицательности. (неМе и неМе)
8 мин Выполнение задания - 2 мин. защита постера - 2 мин. 2 мин. 2 мин. Закрепление 8 мин. Конец урока 2 мин.
|
Фронтальная беседа «Пинг понг». (Г)
ФО «Сигналы рукой» Группы оценивают ответ своих соперников, насколько точно они ответили.
Просмотр видеофрагмента для подвода к новой темы. (И). Электроотрицательность - вeличина, характеризующая свойство атомов элемента притягивать к себе электроны, которые участвуют в образовании химических связей, от других атомов в соединениях. Физический смысл понятия электроотрицательность сводится к объяснению способности элемeнта завершить свой незавершенный энергетический уровень при взаимодействии с другими элементами.
Химическая связь
Водородная
Ионная связь –химическая связь, образованная между атомами с разным значением электроотрицательности.(Ме и неМе)
Неполярная связь-образованная между атомами с одинаком значением электроотрицательности. (неМе)
Прием «Инсерт» (Г) Учащиеся читают текст учебника и делают соответствующие пометки: «V» – уже известный материал; «–» – противоречит представлениям; «+» – интересно и неожиданно; «?» – что-то неясно, возникло желание узнать больше. Учащиеся работают простым карандашом, на полях выставляют знаки; заполняют таблицу (вписывают только ключевые слова).
Прием «Ментальная карта».
Материал предоставлен в учебнике и в раздаточном материале. Ваша задача – из теоретического материала выбрать информацию для карты. Вы должны помнить правила ее составления:
Работа с шаростержневыми моделями. (Г) Учитель предлагает учащимся изобразить структурные формулы, а затем изготовить данные молекулы с помощью шаростержневых моделей. 1 группа хлор 2 группа кислород 3 группа соляная кислота 4 группа хлорид натрия
Учащимся необходимо сделать вывод о том, какая молекула более прочная; какое вещество более активное.
ФО «Светофор». У каждого ученика имеются карточки трех цветов светофора: все понятно – зеленый, остались вопросы – желтый, непонятно – красный.
Физкультминутка
Задание №1 Каждому учащемуся выдается карточка с приемом на закрепление. (П) Прием «Вставить пропущенное слово»
Учитель включает слайд с правильными ответами. Учащиеся обмениваются карточками со своими ответами и проводят взаимопроверку.
- Плохо
Дифференцированные задание (И) Учитель даeт карточки с дифференцированными заданиями. Задание №1 Используя числовые значения электроотрицательности, определите, у какой пары наиболее выражены металлические свойства:
Задание №2 Расположите элементы в порядке уменьшения ЭО: хлор, фтор, натрий, водород, фосфор, кислород, алюминий, кремний, магний. (Cl, F, Na, H, P, O, Al, Si, Mg). Задание №3 Прием «Соответствие». Зная численные значения электроотрицательности элементов, установите соответствия между формулой вещества и видом химической связи.
«Словесная оценка» Устная обратная связь учителя и обучающегося.
Обратная связь Прием «Три М одно Д» Обучающимся необходимо назвать три момента, которые хорошо получились на уроке и одно действие, которое улучшит их работу на следующий урок. Рефлексия Прием «Запусти корабль в море знаний». Ребята, которые считают, что хорошо усвоили тему, помещаю свой кораблик в море, а те кто не уверен в этом, остаются в заливе правил (на берегу). Домашнее задание §34, стр. 128-130 Задание № 1 (составьте синквейн): «Синквейн» Составление синквейна по схеме: первая строка – понятие, выраженное существительным, вторая строка – описание двумя прилагательными (причастиями), третья строка – 3 слова глагола, описывающие действие четвёртая строка – 4 значимые слова, выражающие отношение к понятию, пятая строка- слово-синоним понятию, обобщение или расширение смысла. Например:
Задание№ 2 Составить презентацию на тему «Электроотрицательность».
|
одна из групп отвечает на вопрос другой из групп. Слайд с вопросами.
раздаточный материал
Учебник, раздаточный материал.
Составляют ментальную карту формата А3, соблюдая правила. Для работы используют текст учебника, раздаточный материал.
шаростержневые модели
Физкультминутка под музыкальную паузу.
Ответы:
Задание №1
Задание №2 F, O,Cl, P, Si, H, Al Mg, Na. Задание №3 А) 3 В) 1 С)2
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися? |
Оценивание – как Вы планируете проверить уровень усвоения материала учащимися? |
Здоровье и соблюдение техники безопасности. |
|
1. Дифференциация по группам, по заданиям для изучения новой темы. 2. Дифференциация по подаче информации (работа с текстом). 2. Разноуровневые задания на всех учащихся на этапе закрепления. 3. Разноуровневое домашнее задание.
|
1. Формативное оценивание 2. Самооценивание 3. Взаимооценивание |
1.Психологический настрой на урок. 2. Физминутка. 3. Правила Т.Б. при работе в кабинете химии.
|
Приложение
Фронтальная беседа «Пинг понг». (Г)
-
Сколько периодов и групп в периодической системе?
-
Как изменяются свойства элементов по группе и по периоду?
-
Какова особенность строения атома металла? Неметалла?
-
Сколько электронов на внешнем слое атомов главных подгрупп?
Прием «Вставить пропущенное слово»
-
Зная численные значения электроотрицательностей, можно судить о принадлежности соответствующего элемента к …….. или …………..
-
У металлов электроотрицательность, как правило,………., а у неметаллов ………..
-
Электроотрицательность элементов возрастает в периодах ………, а в главных подгруппах- ……..
-
При химических реакциях электроны ……. или ……… к атомам элементов, обладающих ……… электроотрицательностью.
Разноуровневые задания
Задание №1
Используя числовые значения электроотрицательности, определите, у какой пары наиболее выражены металлические свойства:
-
Na-Mg; 2) Mg-Al; 3) Al -Si.

Задание №2
Расположите элементы в порядке уменьшения ЭО: хлор, фтор, натрий, водород, фосфор, кислород, алюминий, кремний, магний. (Cl, F, Na, H, P, O, Al, Si, Mg).
Задание №3
Прием «Соответствие».
Зная численные значения электроотрицательности элементов, установите соответствия между формулой вещества и видом химической связи.
|
формула вещества |
вид химической связи |
|
А) O2 |
1.ионная |
|
B) KCl |
2.ковалентная полярная |
|
C) HF |
3.ковалентная неполярная |

шағым қалдыра аласыз























