
3-сабақ.
Сыныбы: 10«а»
Сабақтың тақырыбы: Газ заңдары. Газдардың молярлық көлемі. Авогадро
заңы.
Сабақтың мақсаты: оқушыларға Авогадро заңының екі салдарын
түсіндіріп, типтік есептер шығарту арқылы
олардың логикалық ойлау қабілеттерін арттыру.
Сабақтың типі: Жаңа материалды меңгерту сабағы
Көрнекіліктер: интерактивті тақта, оқулықтар, электронды оқулықтар, т.б.
Авогадро заңы: Бірдей жағдайда (температура мен қысымда) әртүрлі газдардың бірдей көлемдеріндегі молекулалар саны да бірдей.
Авогадро заңынан екі салдар шығады:
1.Бірдей жағдайда кез к елген газдын 1 моль молшері белгілі бip көлем (молярлық көлем) алады.
Егер берілген жағдайда газдың 1 литрінің массасы белгілі болса, оның молярлық көлемін есептеп табуға болады. Мысалы, қалыпты жағдайда, яғни, Т=273,15К=0°С температурада және 101,325 кПА (1атм=760 мм сынап бағанасы) қысымда 1 л сутек газының массасы 0,09г, ал оның молярлық массасы М(Н2) — 2,0158 г/моль. Олай болса, 1 моль сутек газының алатын көлемі мынадай пропорция құрып табуға болад ы:
Егер, 1 л. сутек газының массасы 0,09 г болса, онда оның молярлық көлемінің массасы 2,0158г болады.
V =2,0158г·1 л/0,09 г= 22,4 л.
Демек, VM(H2)=22,4л/моль.
Осылай көптеген газдардың 1моль мөлшерлерінің қалыпты жағдайдағы көлемдері тежірибе жүзінде шамамен 22,4 л болатындығы анықталды.
Газдың, 1 моль мөлшерінің алатын көлемін молярлық, көлем деп атайды және VM деп белгілейді.
Сонымен:
Кез келген газдын 1 моль мөлшері қалыпты жағдайда шамамен 22,4 л көлем алады: VM = 22,4 л/моль.
Молярлық көлем (V м) деп газ көлемінің (V) зат мөлшерге қатынасын атайды:
VM = V/υ
2.Бірдей жағдайда бip газдың екінші газ бойынша салыстырмалы тығыздығы (D) олардың молярлық (демек, салыстырмалы молекулалық) массаларының қатынасына тең болалы.
Авогадро заңына сүйене отырып, оған былай көз жеткізуге болады:
Физика бойынша: m = V х ρ
Егер заттардың 1 моль мөлшерін қарастырсақ:
М= Vм х ρ
Олай болса, әр газ үшін:
M1 = Vм (1)·ρ (1)
М2 = Vм (2)·ρ (2)
Авогадро заңы бойынша: Vм (1) = Vм (2)
Демек, М1/М2= ρ (1) / ρ (2)
Ал, ρ (1) / ρ (2) = D 6ipінші газдын екінші газ бойынша тығыздығы деп аталады. Әдетте, екінші газдың формуласы D әрпінен кейін индекс түрінде, ал 6ipiнші газдың формуласы одан кейін жақшаға алынып жазылады. Мысалы, хлордың сутек бойынша салыстырмалы тығыздығы Dн2(CI2) деп белгіленеді.
Газдардың салыстырмалы тығыздығын көбінесе, ең жеңіл сутек газы бойынша Dн2 немесе ауа бойынша (Daya) есептейді. Егер белгісіз газдың сутек бойынша немесе ауа бойынша салыстырмалы тығыздығы белгілі болса, онын молярлық (демек, молекулалық) массасын есептеп табуға болады. Ал, салыстырмалы тығыздықты табу үшін олардың бірдей көлемдерінің массаларын тежірибе жүзінде анықтау жеткілікті:
m1= v1 · M1
m2= v2 · M2
Авогадро заңы бойынша: v1 = v2
Демек: m1/m2 = М1/М2 = D.
1— мысал. Массасы 2 г сутек газының, зат мөлшері 0,2 моль оттек газының және азот газының 1025 молекулаларының қалыпты жағдайда алатын көлемдерін есептеңіздер.
Шешуі
а) m(H2)=v(H2) · М(H2);
v(H2)=m(H2)/M(H2) = 2г/2г/моль =1моль;
V(Н2)=v(Н2)·Vm=1моль·22,4л/моль=22,4л.
б) V(О2)=v(О2)·Vm=0,2моль·22,4л/моль=4,48л.
в) N(H2) =v(N2)·NA
v(N2) = N (N2)/ NA=1025/6,02·1023 1моль=16,61моль
V(N2)=v(N2)·VA=16,61 моль·22,4л/молъ=372,093 л.
2 – мысал. Қалыпты жағдайда алынган 2,35 моль оттек, 0,65 моль азот, 1,31 моль көміртек (IV) оксиді және 0,69 моль күкірт (IV) оксиді газдары қоспасының жалпы көлемге қандай?
Шeшyi:
Авогардо заңынан шығатын салдар бойынша кез келген газдың бірдей жағдайда алатын көлемде бірдей. Олай болса, алдымен газдар қоспасының жалпы зат мөлшерін тапқан жөн:
Σvі=(2,35 +0,65 +1,31+0,69) моль=5,0 моль
Газдар коспасының қалыпты жағдайда алатын жалпы көлемі V = v·Vм
ΣV = Vм·Σvi=22,4 л/моль ·5 моль=112 л.
3 – мысал. Массалық үлестері (%) бойынша 35% сутектің және 65% азоттан тұратын газ қоспасындағы әр газдьң көлемдік үлестерін (φ, %) табыңыздар.
Шешуі:
Газдар қоспасының 100 г массасын қарастырамыз. Сонда қоспаның мұндай мөлшеріндегі әр газдың массасы сан жағынан олардың процентік мөлшеріне тең болады:
m(Н2) = m · ω(Н2) = 100·0,35 = 35 г.
m(N2) = m ·ω(N2)= 100·0,65 = 65 г.
Енді әр газдың 100 г қоспадағы зат мөлшерлерін табайық:
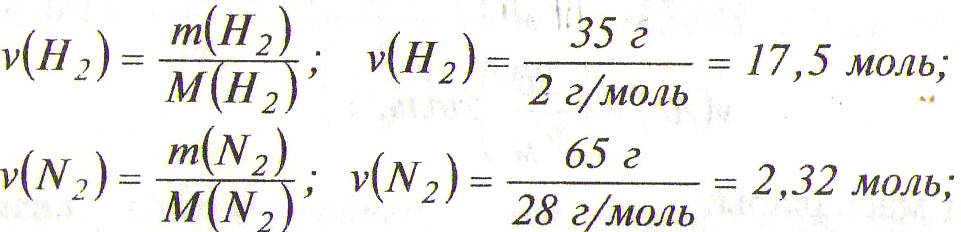
Берілген жағдайда қоспадағы әр газдың молярлық
көлемдері Vм болсын. Онда қоспадағы әр газдың мөлшері:
V (Н2) = v(Н2)·Vм; V(Н2) = 17,5·Vм;
V (N2) = v(N2)·Vм; V(N2) = 2,32·Vм;
Егер газдар берілген жағдайда бip бipiмeн әрекеттеспейді деп ескерсек, онда газдар қоспасының жалпы көлемі әр газдың көлемдерінің қосындысына тең болады.
V= (V (Н2) + V(N2))Vм = Vм (17,5 + 2,32) = Vм·19,82л.
Енді қоспадағы әр газдың көлемдік үлестерін (ω) есептеуге болады:
φ(H2) = V(H2)/ V
φ(H2) = (Vм·17,5)/ (Vм·19,82) = 0,883 немесе 88,3%
φ(N2) = V(N 2)/ V
φ(N2) = (Vм·2,32)/ (Vм·19,82) = 0,117 немесе 11,7%
4-мысал. Оттек, азот, гелий, көміртек (ІҮ) оксиді газдарының салыстырмалы тығыздықтарын табыңыздар
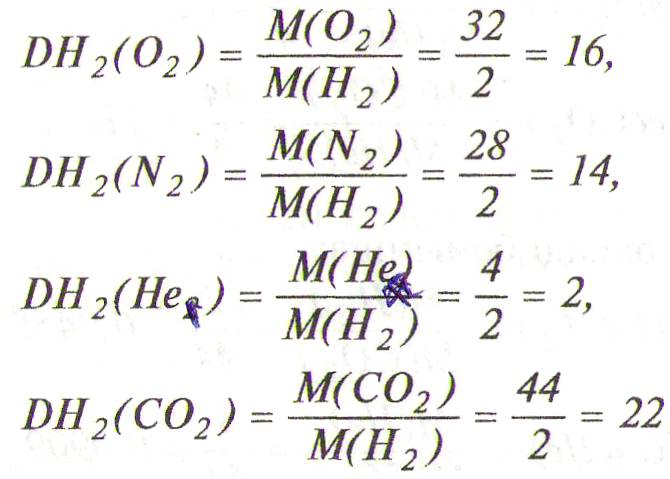
Үйге:
1. Газдар қоспасы көлемді үлестері бойынша 20% көміртек (IV) оксидінен, 50% азоттың және 30% аргоннан тұрады. Қоспадағы әр газдың массалық үлестерін (ω) табыңыздар.
2. Мыс купоросының құрамындағы кристалдың судың проценттік мөлшерін есептеңіздер.
жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
газ заңдары
газ заңдары
3-сабақ.
Сыныбы: 10«а»
Сабақтың тақырыбы: Газ заңдары. Газдардың молярлық көлемі. Авогадро
заңы.
Сабақтың мақсаты: оқушыларға Авогадро заңының екі салдарын
түсіндіріп, типтік есептер шығарту арқылы
олардың логикалық ойлау қабілеттерін арттыру.
Сабақтың типі: Жаңа материалды меңгерту сабағы
Көрнекіліктер: интерактивті тақта, оқулықтар, электронды оқулықтар, т.б.
Авогадро заңы: Бірдей жағдайда (температура мен қысымда) әртүрлі газдардың бірдей көлемдеріндегі молекулалар саны да бірдей.
Авогадро заңынан екі салдар шығады:
1.Бірдей жағдайда кез к елген газдын 1 моль молшері белгілі бip көлем (молярлық көлем) алады.
Егер берілген жағдайда газдың 1 литрінің массасы белгілі болса, оның молярлық көлемін есептеп табуға болады. Мысалы, қалыпты жағдайда, яғни, Т=273,15К=0°С температурада және 101,325 кПА (1атм=760 мм сынап бағанасы) қысымда 1 л сутек газының массасы 0,09г, ал оның молярлық массасы М(Н2) — 2,0158 г/моль. Олай болса, 1 моль сутек газының алатын көлемі мынадай пропорция құрып табуға болад ы:
Егер, 1 л. сутек газының массасы 0,09 г болса, онда оның молярлық көлемінің массасы 2,0158г болады.
V =2,0158г·1 л/0,09 г= 22,4 л.
Демек, VM(H2)=22,4л/моль.
Осылай көптеген газдардың 1моль мөлшерлерінің қалыпты жағдайдағы көлемдері тежірибе жүзінде шамамен 22,4 л болатындығы анықталды.
Газдың, 1 моль мөлшерінің алатын көлемін молярлық, көлем деп атайды және VM деп белгілейді.
Сонымен:
Кез келген газдын 1 моль мөлшері қалыпты жағдайда шамамен 22,4 л көлем алады: VM = 22,4 л/моль.
Молярлық көлем (V м) деп газ көлемінің (V) зат мөлшерге қатынасын атайды:
VM = V/υ
2.Бірдей жағдайда бip газдың екінші газ бойынша салыстырмалы тығыздығы (D) олардың молярлық (демек, салыстырмалы молекулалық) массаларының қатынасына тең болалы.
Авогадро заңына сүйене отырып, оған былай көз жеткізуге болады:
Физика бойынша: m = V х ρ
Егер заттардың 1 моль мөлшерін қарастырсақ:
М= Vм х ρ
Олай болса, әр газ үшін:
M1 = Vм (1)·ρ (1)
М2 = Vм (2)·ρ (2)
Авогадро заңы бойынша: Vм (1) = Vм (2)
Демек, М1/М2= ρ (1) / ρ (2)
Ал, ρ (1) / ρ (2) = D 6ipінші газдын екінші газ бойынша тығыздығы деп аталады. Әдетте, екінші газдың формуласы D әрпінен кейін индекс түрінде, ал 6ipiнші газдың формуласы одан кейін жақшаға алынып жазылады. Мысалы, хлордың сутек бойынша салыстырмалы тығыздығы Dн2(CI2) деп белгіленеді.
Газдардың салыстырмалы тығыздығын көбінесе, ең жеңіл сутек газы бойынша Dн2 немесе ауа бойынша (Daya) есептейді. Егер белгісіз газдың сутек бойынша немесе ауа бойынша салыстырмалы тығыздығы белгілі болса, онын молярлық (демек, молекулалық) массасын есептеп табуға болады. Ал, салыстырмалы тығыздықты табу үшін олардың бірдей көлемдерінің массаларын тежірибе жүзінде анықтау жеткілікті:
m1= v1 · M1
m2= v2 · M2
Авогадро заңы бойынша: v1 = v2
Демек: m1/m2 = М1/М2 = D.
1— мысал. Массасы 2 г сутек газының, зат мөлшері 0,2 моль оттек газының және азот газының 1025 молекулаларының қалыпты жағдайда алатын көлемдерін есептеңіздер.
Шешуі
а) m(H2)=v(H2) · М(H2);
v(H2)=m(H2)/M(H2) = 2г/2г/моль =1моль;
V(Н2)=v(Н2)·Vm=1моль·22,4л/моль=22,4л.
б) V(О2)=v(О2)·Vm=0,2моль·22,4л/моль=4,48л.
в) N(H2) =v(N2)·NA
v(N2) = N (N2)/ NA=1025/6,02·1023 1моль=16,61моль
V(N2)=v(N2)·VA=16,61 моль·22,4л/молъ=372,093 л.
2 – мысал. Қалыпты жағдайда алынган 2,35 моль оттек, 0,65 моль азот, 1,31 моль көміртек (IV) оксиді және 0,69 моль күкірт (IV) оксиді газдары қоспасының жалпы көлемге қандай?
Шeшyi:
Авогардо заңынан шығатын салдар бойынша кез келген газдың бірдей жағдайда алатын көлемде бірдей. Олай болса, алдымен газдар қоспасының жалпы зат мөлшерін тапқан жөн:
Σvі=(2,35 +0,65 +1,31+0,69) моль=5,0 моль
Газдар коспасының қалыпты жағдайда алатын жалпы көлемі V = v·Vм
ΣV = Vм·Σvi=22,4 л/моль ·5 моль=112 л.
3 – мысал. Массалық үлестері (%) бойынша 35% сутектің және 65% азоттан тұратын газ қоспасындағы әр газдьң көлемдік үлестерін (φ, %) табыңыздар.
Шешуі:
Газдар қоспасының 100 г массасын қарастырамыз. Сонда қоспаның мұндай мөлшеріндегі әр газдың массасы сан жағынан олардың процентік мөлшеріне тең болады:
m(Н2) = m · ω(Н2) = 100·0,35 = 35 г.
m(N2) = m ·ω(N2)= 100·0,65 = 65 г.
Енді әр газдың 100 г қоспадағы зат мөлшерлерін табайық:
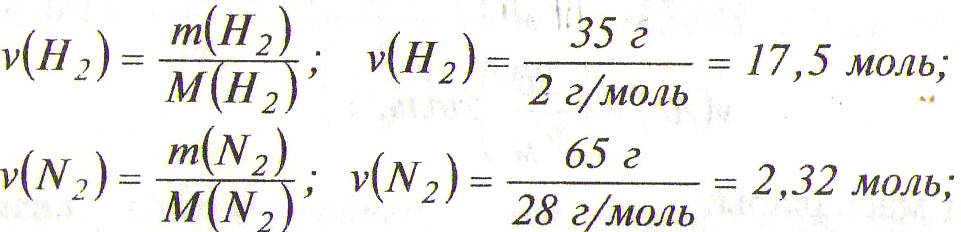
Берілген жағдайда қоспадағы әр газдың молярлық
көлемдері Vм болсын. Онда қоспадағы әр газдың мөлшері:
V (Н2) = v(Н2)·Vм; V(Н2) = 17,5·Vм;
V (N2) = v(N2)·Vм; V(N2) = 2,32·Vм;
Егер газдар берілген жағдайда бip бipiмeн әрекеттеспейді деп ескерсек, онда газдар қоспасының жалпы көлемі әр газдың көлемдерінің қосындысына тең болады.
V= (V (Н2) + V(N2))Vм = Vм (17,5 + 2,32) = Vм·19,82л.
Енді қоспадағы әр газдың көлемдік үлестерін (ω) есептеуге болады:
φ(H2) = V(H2)/ V
φ(H2) = (Vм·17,5)/ (Vм·19,82) = 0,883 немесе 88,3%
φ(N2) = V(N 2)/ V
φ(N2) = (Vм·2,32)/ (Vм·19,82) = 0,117 немесе 11,7%
4-мысал. Оттек, азот, гелий, көміртек (ІҮ) оксиді газдарының салыстырмалы тығыздықтарын табыңыздар
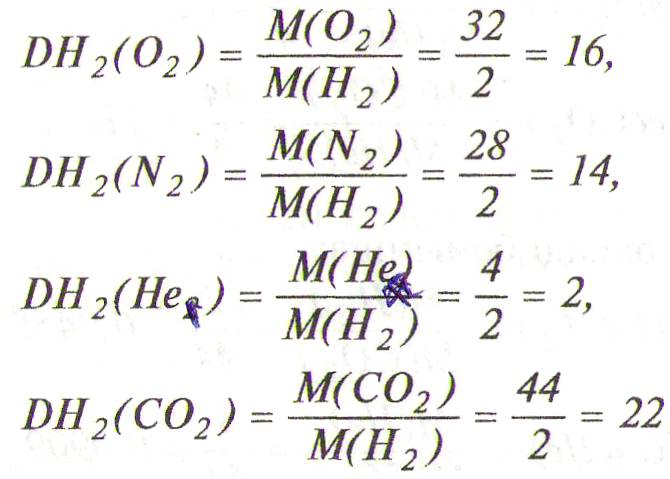
Үйге:
1. Газдар қоспасы көлемді үлестері бойынша 20% көміртек (IV) оксидінен, 50% азоттың және 30% аргоннан тұрады. Қоспадағы әр газдың массалық үлестерін (ω) табыңыздар.
2. Мыс купоросының құрамындағы кристалдың судың проценттік мөлшерін есептеңіздер.

шағым қалдыра аласыз















