Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз

Бонусты жинап картаңызға (kaspi Gold, Halyk bank) шығарып аласыз
Идеал газ күйінің теңдеуі.. Менделеев-Клапейрон теңдеуі . Изопроцестер. Дальтон заңы.

СМЖ 08 ӘН 03
5- қосымша
«Жоғары аграрлық-техникалық колледжі» БҚОӘББ
Оқу сабақ жоспары
(теориялық немесе өндірістік оқыту)
Сабақтың тақырыбы . Идеал газ күйінің теңдеуі.. Менделеев-Клапейрон теңдеуі . Изопроцестер. Дальтон заңы.
Модуль/пән атауы: Физика
Педагог: Кайырлиева К.Т. дайындады
2024 жыл
1.Жалпы мәліметтер:
Курс, топ: ТЖ-111.1қ
Сабақ типі: теория
2.Мақсаты: : Идеал газ, газдардың молекулалық кинетикалық теориясының негізгі теңдеуін білу. Изопроцестер. Изопроцестердің графиктері мен формуласын білу, есептеу
2.1 Оқыту мақсаты: Идеал газ, газдардың молекулалық кинетикалық теориясының негізгі теңдеуін білу. Изопроцестер. Изопроцестердің графиктері мен формуласын білу, есептеу
3. Оқу-жаттығу процесінде білім алушылар меңгеретін күтілетін нәтижелер және (немесе) кәсібидағдылар тізбесі; : Идеал газ, газдардың молекулалық кинетикалық теориясының негізгі теңдеуін біледі. Изопроцестердің графиктері мен формуласын біледі есептейді
Бағалау критерийлері: Менделеев-Клапейрон теңдеуін біледі газдардың молекулалық кинетикалық теориясының негізгі теңдеуін біледі. Изопроцестердің графиктері мен формуласын біледі есептейді
4.Қажетті ресурстар:
4.1 Оқу-әдістемелік жинақ, плакаттар, анықтамалық әдебиеттер, үлестірме карточкалар.
4.2 МП, слайд, электрондық оқулық, видео сабақ.
5. Сабақтың барысы :
Сабақтың түрі:жаңа білімді жеткізу және меңгеру.
Сабақтың әдісі: сыни
тұрғысынан ойлау стратегиясының кейбір элементтері, топтық
жұмыс,(Джигсоәдісі),Блум таксономиясы,ақпараттық-коммуникативтік
технологиясының элементтері.
Психологиялық тренинг. «Тамаша екен» бір біріне жылы ілебіз
айту.
Мысалы:бүгін тамаша екен
себебі: бізде ашық сабақ т.с.с
Сабақтың өту
барысы:
1.Ұйымдастыру бөлімі.(топқа бөлу) «Таңдау» әдісі бойынша : Қысым, Көлем,Температура
2.Білу. (Үй тапсырмасын тексеру).
3. Қызығушылықты ояту.(Бейнебаян)
4.Түсіну. «Идеяны суреттеу» әдісі бойынша жоба қорғау.
5.Қолдану.Джигсо әдісі тапсырмалар орындау
6.Мағынаны танып білу (Жаңа сабақ) (Слайдтар арқылы жаңа сабақ түсіндіру)
7.Талдау.Есептер шығару
8.Жинақтау. Бекіту сұрақтары
9.Бағалау
10. Үйге тапсырма.
Ұйымдастыру кезеңі
Жұмысқа оң психологиялық көңіл-күй жасау..
«Тілек» әдісі. Студенттер шеңбер бойымен тұрып бір – біріне өз тілектерін білдіреді. Мақсаты: тыңдау дағдыларын дамыту, жағымды ахуал қалыптастыру.
Сәлемдесу, жоқ студенттерді белгілеу, назарын сабаққа аудару.
«Таңдау» әдісі. Студенттер тақырыптық терминдер арқылы карточкалардың түсіне қарай геометриялық фигураларды таңдап, 3 топқа бөлінеді.
I топ – «Қысым»
II топ – «Көлем»
III топ – «Температура»
1.Үй тапсырмасын сұрау: «Сұрақ-жауап». Ұяшық таңдау арқылы сұрау.
Үй тапсырмасы,жаңа сабак бойынша әр дұрыс жауапқа, жетондар беру арқылы бағаланады.
1.Зат құрылысының молекула-кинетикалық теориясы негізіне неше тұжырым алынады
2.Молекула-кинетикалық теорияның дамуына үлес қосқан ұлы орыс ғалымы.
3. Заттың ... массасы деп бір мольдің мөлшерінде алынған заттың массасын айтамыз
4. Мольдік масса қандай әрпіпен белгіленеді.
5. Қандай термодинамикалық параметрлерді білесіздер
6. Зат мөлшерінің өлшемі қандай әрпімен белгіленеді
7. Заттың 1 молінің массасын қандай масса деп атайды
8. Зат мөлшерінің формуласын жаз
9. Газдың кинетикалық теориясының негізгі тендеуін жаз
10. Молекула-кинетикалық теориясының негізгі қағидаларын атаңыз
2. «Миға шабуыл» Тақтада видеоролик көрсетіледі. Одан көргендері туралы топтар не көргендерін айтады. Жаңа сабақтың такырыбы мақсаты айтылады.
Ендеше, бүгінгі жаңа сабағымыз «Идеал газ күйінің теңдеуі. Дальтон заңы. Газдың температурасы. Менделеев-Клапейрон теңдеуі . Изопроцестер.Изопроцестердің графиктері»
Дәптерлеріңді ашып, күн жадысын сабақтың тақырыбын жазып алыңыз.
II.Жаңа сабақ. Төңкерілген сабақ: Бүгінгі жаңа сабақ бойынша студенттер түсіндіреді
Әр топқа бір-бір тақырыптан бөлініп беріледі
І. Джигсо әдісі: Әр топқа бір-бір тақырыптан бөлініп беріледі. Мақсат мынадай кітаптан жеке-жеке оқып, топта талдап, басқа топқа түсіндіреді, постер қорғайды.
«Қысым» тобына - Идеал газ күйінің теңдеуін қорытып шығару Айым тобы
Көлем» тобына – газ заңдары изопроцестер соның ішінде изотерма изобаралық процесс Аружан тобы
«Температура» тобына - Изохоралық процесс Дальтон заңы Акнұр тобы
3 топқа берілген тақырыпты постер қорғауды ұсынамын.
Керекті мағлұматтарды дәптерлеріне жазады. Білім алушылар берілген тақырыпты оқиды. Постер қорғайды. Өзгелерді тыңдай отырып, өз білімін толықтырады. Осылайша жаңа тақырыпты өздері ашып, түсінеді.
Постер қорғап болганнан кейін,сабакка шолу жасаймын
Сабақтың басы: Теория беру түсіндіру,
Идеал газ. Реал газ – сипаттауға қиын, өте күрделі газ. Идеал газ - молекулалар арасындағы өзара әсерлесу ескерілмейтін реал газдың физикалық моделі.
Идеал газдардың негізгі қасиеттері:
1) Молекулалар – материалды нүктелер (абсолют серпімді шарлар)
2) Молекулалар қозғалысы Ньютон заңдарына бағынады
3Молекулалар арасында өзара әсер жоқ (ЕР=0;Ек≠0)
4) Молекулалар хаосты қозғалыста
5) Қарастырылып отырған ең аз көлемде бөлшектер (молекулалар) саны көп мөлшерде болады. Авогадро санымен салыстырылады
Идеал газдың жайын МКТ тұрғысынан үш макроскопиялық шамалардың (P,V,T арасындағы байланысты қарастыратын теңдеу - идеал газ күйінің теңдеуі деп аталады.
Бұл теңдеуді орыс ғалымы Д.И. Менделеев қорытып шығарды
Бұл реал газдың моделі болып табылады және ол идеал газ деп аталады. Идеал газ қасиетін түсіндіру оңай. Физикада құбылысты түсіндіру үшін физикалық шамалар қолданылады.
Идеал газдың әрбір молекуласы микроскопиялық сипаттамалар-масса, импульс, орташа жылдамдықпен сипаттaлады. Сонымен бірге, макроскопиялық сипаттамалары микроскопиялық арқылы да өрнектелуі мүмкін (мысалы, газ тығыздығы ρ=n*m0, мұндағы n- молекулалар концентрациясы, mо- бір молекуланың массасы).
Идеал газ күйінің теңдеуін қорытып шығару.
 -универсал газ
тұрақтысы.
-универсал газ
тұрақтысы.
Универсал газ тұрақтысы дегеніміз –заттың 1 молінің температурасын 1 К-ге арттыру үшін оған қанша жылу мөлшерін беру қажет екенін көрсететін физикалық шама.
 -идеал газ күйінің
теңдеуі. Менделеев-Клапейрон
теңдеуі.
-идеал газ күйінің
теңдеуі. Менделеев-Клапейрон
теңдеуі.
 -Клапейрон
теңдеуі.
-Клапейрон
теңдеуі.
Егер газдар бірдей температура
мен қысымда алынған болса, онда химиядан белгілі Авогадро заңы
бойынша бір моль мөлшерде алынған кез келген газдың көлемі
бір-біріне тең болады. Қысымның және температураның өзгерісіне
байланысты процестер тең көлемде өтеді. Мұндай процесті изохоралық
процестер деп атайды. Бұл жағдайда  арақатынастың В тұрақтысы
барлық газдарға бірдей болады,
яғни
арақатынастың В тұрақтысы
барлық газдарға бірдей болады,
яғни

 (2.1)
(2.1)
/2.1/ формуладан мынадай теңдеу шығады:
 (2.2)
(2.2)
Мұндағы VМ-бір моль газдың көлемі.
/2.2/ - теңдеу бір моль идеал газ үшін күй теңдеуі болады. Егер бірнеше моль болса, онда олардың V көлемінің бір мольдің көлемімен байланысы мынадай қарапайым формуламен анықталады:
 (2.3)
(2.3)
/2.3/-формулаға VМ-нің мәнін /2.4/-тең қойсақ, онда
 (2.4)
(2.4)
/2.4/ -формула идеал газдың күйін сипаттайтын физикалық параметрлердің функционалды байланысын көрсетеді. Оны идеал газ күйінің теңдеуі деп немесе Менделеев-Клапейрон теңдеуі деп атайды.
/2.4/ -формула тұрақты R
универсал газ тұрақтысы деп аталады. Ол физикадағы негізгі, маңызды
тұрақтылардың қатарына жатады. Универсал газ тұрақтысының сән мәні:
8,31Дж/моль-1К-1
Газдың қандай күйде тұратынын
білу үшін оның термодинамикалық параметрлерін, яғни қысымды,
температураны, көлемді білу қажет. Термопараметрлердің біреуінің
өзгерісі, оның басқа параметрлерінің өзгеруіне әкеп соғады.
Термодинамикалық параметрлерді байланыстыратын
теңдеу идеал газ күйінің
теңдеуі деп
аталады.  , мұндағы
R=k*NA=8,31ДжК*моль– универсал газ
тұрақтысы деп аталады. Бұл теңдеу Менделеев–Клапейрон
теңдеуі деп те
аталынады.
, мұндағы
R=k*NA=8,31ДжК*моль– универсал газ
тұрақтысы деп аталады. Бұл теңдеу Менделеев–Клапейрон
теңдеуі деп те
аталынады.
.Күй теңдеуінің өзгеше қорытындысын газдардың молекулалық-кинетиктік теориясын негізгі теңдеуін /1.8/ және температураның анықтамасы /2.6/ пайдаланып шығаруға болады. Осы екі теңдеуді жазалық:
 (2.5)
(2.5)
 (2.6)
(2.6)
Температура анықтамасынан бір молекуланың орташа кинетиктік энергиясы мынаған тең:
 (2.7)
(2.7)
/2.7/ теңдеудің оң жақ бөлігінде универсал газ тұрақтысы Авогадро санына бөлінеді, бөліндісі тұрақты болады, демек,
 (2.8)
(2.8)
Мұндағы к-Больцман тұрақтысы деп аталатын тұрақты шама. Оның сан мәні: 1,38*10-23 Дж/К.
/2.7/ теңдеумен анықталатын бір молекуланың кинетиктік энергиясының орташа мәнін /1.8/ формулаға ендіріп, мынаны аламыз:
 (2.9)
(2.9)
/2.9/ формула молекулалар концентрациясының қысым және температурамен байланысын көрсетеді. Бұның дербестік мәні де бар. Қысымы мен температурасы бірдей барлық газдардың молекулаларының концентрациясының мәні бірдей болатыны /2.9/ формуладан көрініп тұр, демек, біз Авогадро заңын таптық /тең көлемдерде, бірдей қысымда және температурада молекулалар саны бірдей болады/.
 екендігін ескере
отырып, қарапайым түрлендіру жасасақ, мынау
шығады:
екендігін ескере
отырып, қарапайым түрлендіру жасасақ, мынау
шығады:
 (2.10)
(2.10)
/2.10/
формулада  , ал
, ал
 ескерілген.
ескерілген.
Күй теңдеуін /2.10/-дан аламыз:
 (2.11)
(2.11)
Дескриптор: . Кельвин және Цельсий температурасында қандай байланыс бар екенін біледі
Идеал газ.Газдардың молекулалық кинетикалық теориясының негізгі теңдеуін жаза алады
Газдың бір параметрінің мәні тағайындалып, қалған екеуінің арасындағы сандық тәуелділікті айқындайтын заңдарды газ заңдары деп атайды.
Параметрлердің біреуінің мәні
өзгермей қалған кезде өтетін процестер
изопроцестер деп аталады. Изопроцестер
табиғатта кең таралған және техникада жиі
пайдаланылады. 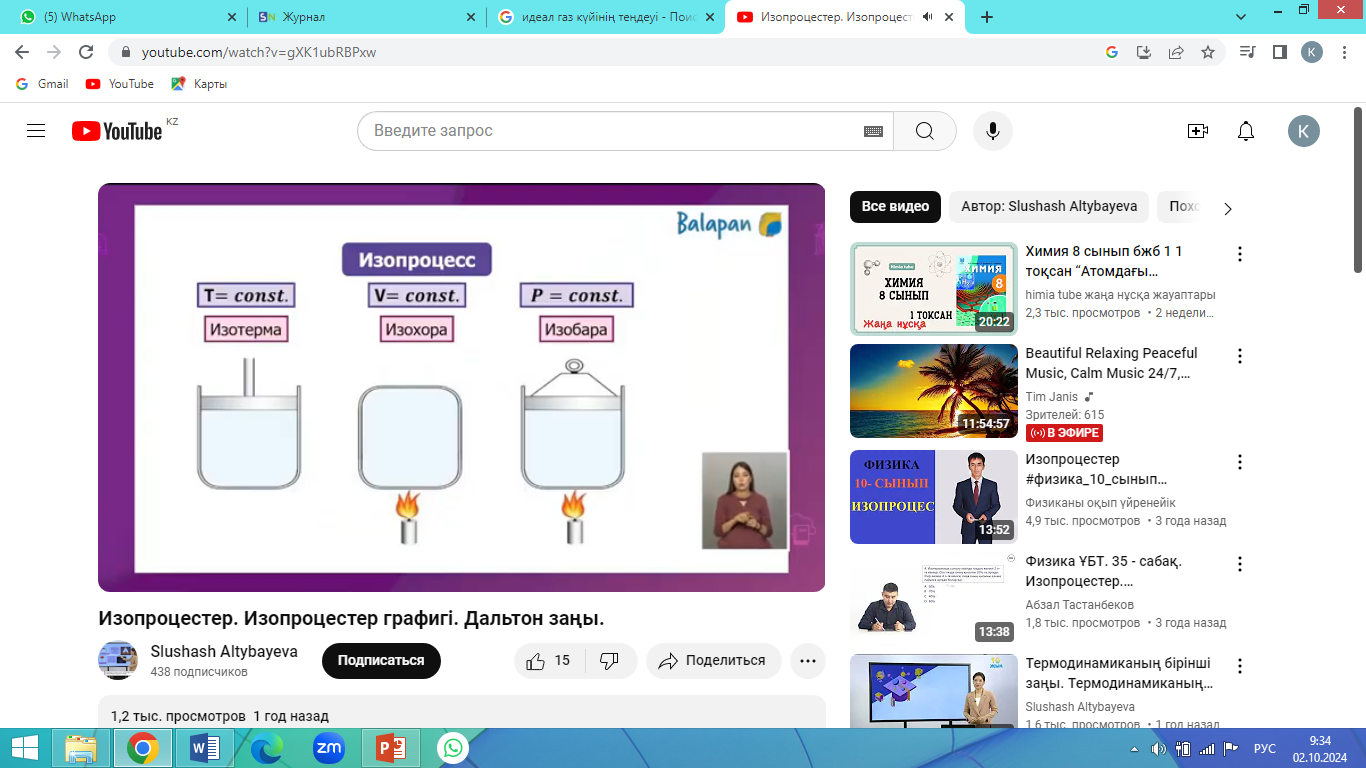
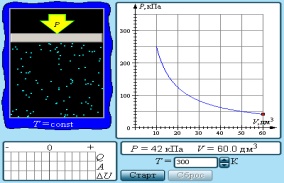
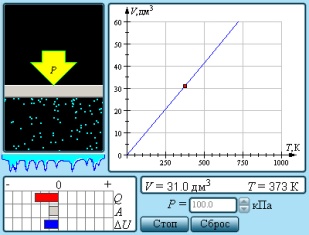
1. Изотермиялық процесс. Ағылшын физигі Р.Бойль 1662 ж. және оған тәуелсіз француз физигі Э.Мариотт тәжірибе жүзінде тұрақты температура кезінде газдың берілген массасы үшін оның қысымының газ алып тұрған көлемге көбейтіндісі тұрақты шамаға тең болатынын тағайындады, яғни pV=const немесе p1V1= p2V2. Бұл заң Бойль–Мариотт заңы деп аталады.
2.
Изобаралық
процесс. Француз физигі Гей–Люссак 1802
ж. тәжірибе жүзінде тұрақты қысымда газдың берілген массасы
көлемінің температураға сызықты тәуелді болатынын тағайындады,
яғни  немесе
немесе
 . Бұл
заң Гей–Люссак
заңы деп
аталады.
. Бұл
заң Гей–Люссак
заңы деп
аталады.
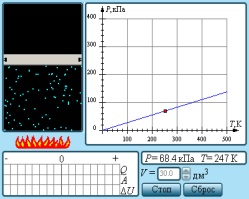
3.
Изохоралық
процесс. Бұл процесті француз физигі
Ж.Шарль зерттеген. 1787 ж. ол тәжірибе жүзінде тұрақты көлемде
берілген газ массасының оның температурасына тура пропорционал
болатынын тағайындады, яғни  немесе
немесе
 .
Бұл Шарль
заңы.
.
Бұл Шарль
заңы.
Авогадро
заңы Температуралары және қысымдары
бірдей кез-келген газдардың бір молінің көлемдері де бірдей
болады. 
Қалыпты жағдайда
( ) кез-келген газдың 1
м3
көлемінде
) кез-келген газдың 1
м3
көлемінде
 молекула болады. Бұл сан
Лошмидт саны деп
аталады.
молекула болады. Бұл сан
Лошмидт саны деп
аталады.
Дальтон заңы
Қоспа газдардың қысымы Дальтон заңының көмегімен анықталады:
Қоспа газдардың қысымы
қоспаны құрайтын жеке газдардың парциаль қысымдарының қосындысына
тең болады: 
Парциаль қысым
деп қоспадағы
басқа газдардың қысымын
ескермеген жағдайдағы жеке газдардың түсіретін қысымын
айтады.
Қоспа газдарға
Менделеев-Клапейрон теңдеуін қолдануға болады.

Адиабаттық процесс. Адиабаттық процесс деп – өте тез өтетін, сондықтан жүйе қоршаған ортамен жылу алмасып үлгіре алмайтын процесті айтамыз. Бұл процесс кезінде жүйе қоршаған ортаға жылу бермейді және сол ортадан жылу алмайды, Адиабаттық процесті жүзеге асыру үшін міндетті түрде келесі шарттар орындалуы керек.
1 .Адиабаттық процестер өте тез өтетін процестер, сондықтан қоршаған орта мен газ жылу алмастырып үлгермейді. Мысалы, велосипед дөңгелегіне насоспен ауа толтырғанда, насос қатты қызады. Әрине, үйкеліске қатысты қызуы болғанмен, ол өте аз. Насостың қатты қызуы ауаның адиабаттық сығылуына байланысты.
-
. II.Студенттерге тақырып бойынша бірнеше сөйлемдер беріледі. Осы сөйлемде көп нүктенің орнына қажетті сөйлемді қою
-
Мақсатым: студенттердің сыни ойлау дағдысын қалыптастыру, тақырыпты ашу,
1. Физикалық диктант
1. Больцман тұрақтысы мен Авагадро тұрақтысы NA-ның көбейтіндісін универсал газ ... деп атайды.
2. Идеал газ күйінің теңдеуі деп – тәуелділік негізінде жеткілікті сиретілген газдың берілген ... күйін сипаттайтын барлық үш макроскопиялық параметр ρ,V және T-ні байланыстыратын теңдеуді айтамыз
3. Газдың бір параметрінің мәні тағайындалып, қалған екі мәні арасындағы сандық тәуелділікті айқындайтын заңдарды ... атайды.
4. Параметрлердің біреуінің мәні өзгермей қалған кезде өтетін процестер ... деп аталады.
5. Изотермиялық процесс дегеніміз – температура тұрақты болғанда макроскопиялық денелердің термодинамикалық жүйесі ... өзгеру процесін айтамыз.
6. Тұрақты температурада газ қысымының көлемге тәуелділігі график түрінде ... деп аталады.
7. Изобаралық процесс деп – қысым тұрақты болғанда ... жүйе күйінің өзгеру процесі.
8. Изобаралық процесс күйіндегі заңды 1802 жылы француз ғалымы ...-... тәжірибе жүзінде тағайындап көрсеткен.
2.Тапсырма:
1.Газдың термодинамикалық температурасы 255 К. Оның Цельсий
шкаласы бойынша температурасы қандай?
2. Кельвин және Цельсий температурасында қандай байланыс бар?
3.Газдың кинетикалық теориясының негізгі тендеуін жаз
3.Есеп
шығару.
І-
топ:Қысым 3*105 Па ауасы бар ыдыстың көлемі
10м3. Оны көлемі
5м3 ыдыспен қосқандағы соңғы қысымды
табыңдар
ІІ-топ: 0 ºС кезіндегі ауа шарының көлемі 820 м3 .Егер ол күн сәулесімен 15 ºС –қа дейін жылынатын болса, онда осы шардың көлемі қандай болады?
Газ массасы мен оның қысымының өзгерісін ескермеуге болады.
ІІІ-топ: Жабық ыдыстағы газдың 27ºС температура кезіндегі қысымы 75 кПа болды. — 13ºCтемпература кезінде қысым қандай болады?
4.Кім жылдам?Ойынның шарты: температураларды шкала бойынша айналдыру, формула жазу
|
К |
ᵒС формула |
|
255 |
|
|
Кельвин және Цельсий температурасында қандай байланыс бар? |
|
|
Газдың кинетикалық теориясының негізгі тендеуін жаз |
-200 |
5.Сәйкестігін» тап
Жеке жұмыс «жалғасын тап»
-
МКТ дегеніміз------------------------
-
Авагадро заңы--------------------
-
Больцман тұрақтысы
|
1 |
Білу |
Изопроцестер дегеніміз не? |
|
|
2 |
Түсіну |
Менделеев-Клапейрон теңдеуін жаз? |
|
|
3 |
Қолдану |
Цилиндрдің поршені
астында көлемі 10 л газды изобаралық түрде
|
|
|
4 |
Талдау |
Изобаралық пен изохоралық процестерді салыстыр? |
|
|
5 |
Жинақтау |
Изопроцестерді ата? |
|
|
6 |
Бағалау |
Термодинамикалық параметрлердің изопроцестер үшін маңызы қандай? |
|
:
Қорытындылау. Студенттердің сұраққа берген жауаптары әдісін пайдаланып класс тайм қосымшасында тест тапсырмасын беру арқылы, сабақты қорытындылаймын

Дескриптор: Изопроцестер. Изопроцестердің графиктері мен формуласын біледі
5. Сабақ бойынша рефлексия: Изопроцестер. Изопроцестердің графиктері мен формуласы кері байланыс жасау.
Сабақтың соңы: Рефлексия:
Не білемін?
Не білдім?
Не білгім келеді?
Студенттер стикерлер арқылы бүгінгі сабақ туралы пікірлерін Jamboard тақтасына жазады.
Үйге тапсырма беру. Идеал газ күйінің теңдеуі Изопроцестер. Изопроцестердің графиктерін оқу