
Комплексонометриялық талдау әдісімен судың кермектілігін анықтау
Жұмыстың мақсаты: Судың кермектілігін анықтауды үйрену.
Жалпы кермектілікті анықтау
Егер талданатын суда кедергі келтіретін иондар болмаса, онда сынамаға яғни ең алдымен 250 мл өлшеуіш конустық колбаға көлемі 100 мл зерттелетін суды цилиндрмен өлшеп құямыз, үстіне 5 мл аммиакты буферлі ерітіндісін қосып, 5-6 тамшы қара-көк қышқылды хром индикаторының ерітіндісін немесе эрихром қара Т қосып (бұл индикатордың ерітіндісін эрихром қара Т қатты индикаторлы қоспаның бірнеше түйіршектеріне алмастыруға болады) араластырады және бюреткадағы ЭДТА ерітіндісімен (0,05 н. Трилон Б) жайлап шарапты-қызыл түстен көкшіл түске өткенге дейін титрлейді. Трилон Б ерітіндісінің көлемін Vж, см3 деп белгілейді.
Жалпы кермектілікті келесі формуламен анықтайды:
Кж=
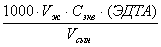 [мг-экв/дм3]
[мг-экв/дм3]
Мұндағы: Кж – жалпы кермектілік, мг-экв/дм3 ; Vж – титрлеуге шығындалған трилон Б ерітіндісінің көлемі, см3 ; Vсын –тәжірибеге алынған сынама көлемі, см3 ; Сэкв(ЭДТА) – ЭДТА ерітіндісінің нормальдік концентрациясы, г-экв/дм3 (эквиваленттердің молярлы концентрациясы, моль/дм3).
|
Алынған судың көлемі V сынама (мл) |
Титрлеуге кеткен Трилон Б V сынама (мл) |
Сэкв(ЭДТА) Трилон Б еретіндсінің нормальдік концентрациясы (г-экв/дм3) |
Кж (мг-экв/л) |
Қорытынды |
|
|
|
|
|
|
Тақырыбы: Кристалды барий хлоридіндегі барийді BaCl2 • 2H2O
анықтау
Сабақ мақсаты: BaCl2 · 2H2O Кристалды барий хлоридіндегі барийді анықтау
Сабақ жоспары:
1. Гравиметриялық талдау әдісі.
2. Аналитикалық таразыда жұмыс істеу ережелері.
3. Гравиметриялық талдаудағы есептеулер.
Қажетті реактивтер: BaCl2, НCl, H2O, H2SO4,
Құрал-жабдықтар аналитикалық таразы, эксикатор, кептіргіш шкаф, бюкс, тигель, шымшуыр ұстағыш,өлшеуіш стақандар, пипетка, варонка, штатив, бюретка, цилиндр
Жұмыс барысы: Кристалды барий хлоридіндегі барийді анықтау
BaCl2 • 2H2O
Өлшендіні алу. Бюксті, алдын ала тазартып жуып алып, кептіргіш шкафта кептіріп, эксикаторда суытып, өлшейді. Кептіру және суыту кезінде бюкстың қақпағы ашық, ал аналитикалық таразыда өлшегенде қақпағын жабады. Аналитикалық таразыда 0,5г криссталды барий хлоридін өлшеп аламыз. бюкске салып, қақпағын жауып, аналитикалық таразыда өлшейді.
Кептіру. Кептіргіш шкафқа бюксті қақпағын ашып, астына ақ қағаз салып, 120-1250С температурада 30-40 мин қояды. Содан соң қыстырғышпен ұстап, эксикаторда суытып алып, аналитикалық таразыда өлшейді. Осылай арасы 1-сағат аралығында қайталап өлшеу керек. Соңғы өлшем алдыңғысынан 0,0002 грамдай айырмашылық болғанша сан мәндерін зертханалық дәптерге жазып, есептеу жүргізеді.
Барий хлоридіндегі BaCl2 · 2H2O барийді тұнбаға түсіру үшін оны BaSO4- ке айналдыру ─ ең қолайлы жағдай. Себебі, оның судағы ерігіштігі 0,0025г/л, сұйытылған қышқылда ерімейді. Қатты қыздырғанда, қақтағанда, оның құрамы өзгермейді.
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
Зертханалық жұмыс.
1. Аналитикалық таразыда 0,5 г кристалды барий хлоридін өлшеп алып, 200-300 мл стаканға өлшендіні салып, үстіне дистилденген 75-100 мл суды құяды. Алынған ерітіндіні шыны таяқшаны шығармай, тұнба түскенше араластырамыз. Оған 2 мл 2 н. HCl ерітіндісін қосады. Оны қайнауға дейін қыздырады, бирақ қайнатпайды. Өйткені – қайнаған кездегі бөлінетін бумен 1-2 тамшы ерітіндісі кемуі мүмкін.
2. Басқа стақанға 40 -50 мл дистілденген су алып оған 5-6 мл 2 н. күкірт қышқылын құямыз және ерітіндіні қайнатамыз. Алдын – ала дайындалған BaCl2 ерітіндісіне ыстық күкірт қышқылы ерітіндісін сыздықтатып шыны таяқшамен араластырып отырып қосамыз, шыны таяқшаны стаканнан алмайды. Тұнба түсірудің басында күкірт қышқылын жайлап қосады, ал соңында 3-5 мл қалғанда жылдамдатады.
3. Тұнбасы бар стаканды қайнап тұрған су моншасына бірнеше уақытқа қояды, содан кейін тоқтатып, ірі кристалды тұнба түскенше күтеміз. Осы үдеріс ірі кристалды тұнбаның түсуіне әсерін тигізеді. Тұнбаның үстіндегі ерітінді тұнық болып, тұнбаның толық түскенін тексереміз. Ол үшін стаканның қабырғасын бойлатып 2 – 3 тамшы күкірт қышқылын жайлап қосамыз. Суық күйінде қосуға болады. Егерде қышқыл тамшы араласқанда, ерітінді түсі өзгермесе, онда тұнба түсіру толық аяқталады . Стаканның бетін келесі кунге суланған фильтр қағазымен жауып қалдырамыз.
Сүзу және шаю. Тұнбаны бөліп алу үшін көк күлсізденген фильтр қағазын пайдаланады. Тұнбаныны таза ерітіндіден бөліп аламыз. Варонканың ішіне салынған сүзгі қағазын жыртып, тесіп алмас үшін, шыны таяқшаның бойымен жайлап лайламай құю керек. Шыны воронкаға фильтрді төрт бүктеп, сумен сулап, тұнбаны таяқша арқылы құйып, сүзеді (фильтрлейді). Тұнбаны бірнеше рет сумен декантациялап шаяды. Тұнбаның толық шайылуын тексеру үшін соңғы воронкадан шыққан 1 – 2 мл сұйықтықты бөлек сынауыққа алып, оған 1 – 2 мл 2 н. азот қышқылы ертіндісін және 3 – 4 тамшы 0,5 н. BaCI2 ерітіндісін қосады. Бұл кезде ерітіндінің түсі лайланған болмау керек. Ерітіндіні сүзгі фильтріне ауыстырады. Воронканы ылғал фильтр кағазбен жауып тұнбаны кептіргіш шкафта 100 – 1100 С та кептіреді.
Кептіру және қақтау. Сүзілген тұнбаны кептіргіш шкафқа қояды. Бос қақталған тигельді өлшейді, оған тұнбаны салып, фильтр қағазбен бірге жалында қыздырып, күйдіреді. Түтін тоқтаған соң, оны (6000 -8000 ) 40-45 минут қыздырады. Тигельді алып, эксикаторда суытып, аналитикалық таразыда өлшейді.
Қыздырудың соңғы өлшем аралықтары 0,0002 г аспағанға дейін жүргізеді. Қыздырған кезде мынадай реакция жүруі мүмкін, бірақ ол тұнбаға әсер етпейді:
BaSO4+2C→BaS+2CO2↑
BaS+2O2→BaSO4
Есептеулер жүргізу.
Кристалды барий хлоридінің өлшемі
1.Кристалды барий хлоридінің сағат әйнегімен массасы
2.Сағат әйнегінің массасы
3.Барий хлоридінің массасы
Тұнба түсетін BaSO4 барий сульфатының өлшемі
бірінші күйдіргендегі тигельдің массасы
екінші күйдіргендегі тигельдің массасы
Барий сульфатының BaSO4 бірінші күйдіргендегі тигельдің массасы
Барий сульфатының BaSO4 екінші күйдіргендегі тигельдің массасы
Барий сульфатының BaSO4 массасы
І өлшеу- бос тигельдің массасы -14,2202 г
ІІ өлшеу- тигель мен тұнба массасы - 14,6897 г
ІІІ өлшеу-тигель мен тұнба массасы - 14,6896г
Масса BaSO4 - 0,4694 г
Ba2+ мөлшерін анықтайды.
233,4 г BaSO4 – 137,3 г Ва
x = 137,3*0,4694/233,4 0,2761 г Ва
Табылған сан 0,4899 г (0,5г) барий хлоридіндегі барийдің мөлшерін көрсетеді:
0,4899г BaCl2 · 2H2O – 0,2761г
Ba 100 г BaCl2 · 2H2O – y г
Ba y= 56,36 %
Анықтауды тексеру: Теориялық шығым арқылы мына пропорциямен есептеу қажет: 244,28 г BaCl2 · 2H2O – 137,3г Ba
100 г BaCl2 · 2H2O – x г Ba
x = 56,20г (56,2%)
Абсолюттік қателікті анықтау: 56,36 - 56,20 = 0,16%
Салыстырмалы қателікті есептеу: 56,20 - 0,16 х=0,16*100/56,20=0,28%
100 - х
\
Сұйық ортаның қышқылдылығын тұрақты сақтап тұру адам ағзасының қызметі үшін маңызы жоғары рН реттеу қызметін буферлі жүйелер атқарады.
Буферлік жүйелердің адам ағзасы үшін маңызы жоғары. Адам қаны буферлік жүйелерге жатады. Адам ағзасында әсіресе, бүйректің бөліп шығару және өкпенің тыныс алу қызметтері үшін буферлік жүйелердің маңызы жоғары.
Буферлік жүйелердің адам ағзасы үшін маңызы жоғары. Адам қаны буферлік жүйелерге жатады. Адам ағзасында әсіресе, бүйректің бөліп шығару және өкпенің тыныс алу қызметтері үшін буферлік жүйелердің маңызы жоғары. Адам ағзасындағы сұйықтықтар (қан, ұлпа сұйықтығы, лимфа т.б.) қасиетінің бірі - олардағы сутегі иондарының тұрақты кон-центрациясын көрсетуі. Ағза сұйықтығының қышқылдылығының тұрақты болуының маңызы зор.
Буферлі жүйелер деп қышқылдың немесе сілтінің аз мөлшерін қосқанда, сонымен қатар сұйылтқанда, сутек иондарының концентрациясы, яғни рН өзгермейтін ерітінділерді айтады.
Адам ағзасындағы рН деңгейін сақтап туру буферлі жүйелердің көмегімен жүзеге асырылады.
Буферлі ерітінділер әдетте әлсіз қышқыл мен кушті негіз тұзының қоспасында (CH3CООH+CH3COONa 4 ацетатты буферлі қоспа) немесе әлсіз негіз бен оның күшті қышқыл тұзының қоспасынан (NH4OH+NH4CI аммиакты буферлі қоспа) тұрады. Сонымен бірге, әлсіз қышқылдардың қышқыл және орта тұздарының (NaHCО3+Na2C03 карбонатты буферлі қоспа) немесе екі кышқыл түздарының қоспасы (NaН2РО4+NaHPО4 фосфатты буферлі коспа) буферлік қасиет көрсетеді.
Буферлі ерітіндіге қышқыл не сілті косқанда, не болмаса оларды сұйылтқанда рН өзгермей түрақты болуын буферлік әсер деп атайды.
Әлсіз қышқыл мен оның сілтілік тұзынаң тұратын буферлі ерітіндіге (CH3COOH+CH3COONa) күшті қышқыл қосқандағы оның буферлік әсерін былай түсіндіреді:
Күшті кышқыддың Н+ иондары тұздың аниондарымен байланысып, әлсіз қышқылдың диссоциацияланбайтын молекулаларын түзеді. Мысалы:
CH3COONa+HCl ↔ CH3COOH+NaCl
ал күшті негіз қосқанда ОН иондары Н+ қосылып Н2О молеқулаларын түзеді:
СНзСООН+NaOH ↔ CH3COONa+H20
Әлсіз негіз бен оның тұзынан тұратын ерітіндінің
NH4OH+NH4CI буферлік әсерін былай түсіндіреді:
Күшті қышқыл қосқанда
NH40H + HC1 → NH4Cl + H20
Күшті негіз қосқанда
NH4CI+NaOH→NH4OH+NaCl
Буферлі ерітінділердің белгілі шамада рН-ты ұстау қасиеті де міне осында жатыр.
Буферлік әсерді су, ондағы еріген қышқыл (негіз) және тұз арасындағы тендікті сақталуымен түсіндіреді.

жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
Комплексонометриялық талдау әдісіменсудың кермектілігін анықтау
Комплексонометриялық талдау әдісіменсудың кермектілігін анықтау
Комплексонометриялық талдау әдісімен судың кермектілігін анықтау
Жұмыстың мақсаты: Судың кермектілігін анықтауды үйрену.
Жалпы кермектілікті анықтау
Егер талданатын суда кедергі келтіретін иондар болмаса, онда сынамаға яғни ең алдымен 250 мл өлшеуіш конустық колбаға көлемі 100 мл зерттелетін суды цилиндрмен өлшеп құямыз, үстіне 5 мл аммиакты буферлі ерітіндісін қосып, 5-6 тамшы қара-көк қышқылды хром индикаторының ерітіндісін немесе эрихром қара Т қосып (бұл индикатордың ерітіндісін эрихром қара Т қатты индикаторлы қоспаның бірнеше түйіршектеріне алмастыруға болады) араластырады және бюреткадағы ЭДТА ерітіндісімен (0,05 н. Трилон Б) жайлап шарапты-қызыл түстен көкшіл түске өткенге дейін титрлейді. Трилон Б ерітіндісінің көлемін Vж, см3 деп белгілейді.
Жалпы кермектілікті келесі формуламен анықтайды:
Кж=
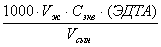 [мг-экв/дм3]
[мг-экв/дм3]
Мұндағы: Кж – жалпы кермектілік, мг-экв/дм3 ; Vж – титрлеуге шығындалған трилон Б ерітіндісінің көлемі, см3 ; Vсын –тәжірибеге алынған сынама көлемі, см3 ; Сэкв(ЭДТА) – ЭДТА ерітіндісінің нормальдік концентрациясы, г-экв/дм3 (эквиваленттердің молярлы концентрациясы, моль/дм3).
|
Алынған судың көлемі V сынама (мл) |
Титрлеуге кеткен Трилон Б V сынама (мл) |
Сэкв(ЭДТА) Трилон Б еретіндсінің нормальдік концентрациясы (г-экв/дм3) |
Кж (мг-экв/л) |
Қорытынды |
|
|
|
|
|
|
Тақырыбы: Кристалды барий хлоридіндегі барийді BaCl2 • 2H2O
анықтау
Сабақ мақсаты: BaCl2 · 2H2O Кристалды барий хлоридіндегі барийді анықтау
Сабақ жоспары:
1. Гравиметриялық талдау әдісі.
2. Аналитикалық таразыда жұмыс істеу ережелері.
3. Гравиметриялық талдаудағы есептеулер.
Қажетті реактивтер: BaCl2, НCl, H2O, H2SO4,
Құрал-жабдықтар аналитикалық таразы, эксикатор, кептіргіш шкаф, бюкс, тигель, шымшуыр ұстағыш,өлшеуіш стақандар, пипетка, варонка, штатив, бюретка, цилиндр
Жұмыс барысы: Кристалды барий хлоридіндегі барийді анықтау
BaCl2 • 2H2O
Өлшендіні алу. Бюксті, алдын ала тазартып жуып алып, кептіргіш шкафта кептіріп, эксикаторда суытып, өлшейді. Кептіру және суыту кезінде бюкстың қақпағы ашық, ал аналитикалық таразыда өлшегенде қақпағын жабады. Аналитикалық таразыда 0,5г криссталды барий хлоридін өлшеп аламыз. бюкске салып, қақпағын жауып, аналитикалық таразыда өлшейді.
Кептіру. Кептіргіш шкафқа бюксті қақпағын ашып, астына ақ қағаз салып, 120-1250С температурада 30-40 мин қояды. Содан соң қыстырғышпен ұстап, эксикаторда суытып алып, аналитикалық таразыда өлшейді. Осылай арасы 1-сағат аралығында қайталап өлшеу керек. Соңғы өлшем алдыңғысынан 0,0002 грамдай айырмашылық болғанша сан мәндерін зертханалық дәптерге жазып, есептеу жүргізеді.
Барий хлоридіндегі BaCl2 · 2H2O барийді тұнбаға түсіру үшін оны BaSO4- ке айналдыру ─ ең қолайлы жағдай. Себебі, оның судағы ерігіштігі 0,0025г/л, сұйытылған қышқылда ерімейді. Қатты қыздырғанда, қақтағанда, оның құрамы өзгермейді.
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
Зертханалық жұмыс.
1. Аналитикалық таразыда 0,5 г кристалды барий хлоридін өлшеп алып, 200-300 мл стаканға өлшендіні салып, үстіне дистилденген 75-100 мл суды құяды. Алынған ерітіндіні шыны таяқшаны шығармай, тұнба түскенше араластырамыз. Оған 2 мл 2 н. HCl ерітіндісін қосады. Оны қайнауға дейін қыздырады, бирақ қайнатпайды. Өйткені – қайнаған кездегі бөлінетін бумен 1-2 тамшы ерітіндісі кемуі мүмкін.
2. Басқа стақанға 40 -50 мл дистілденген су алып оған 5-6 мл 2 н. күкірт қышқылын құямыз және ерітіндіні қайнатамыз. Алдын – ала дайындалған BaCl2 ерітіндісіне ыстық күкірт қышқылы ерітіндісін сыздықтатып шыны таяқшамен араластырып отырып қосамыз, шыны таяқшаны стаканнан алмайды. Тұнба түсірудің басында күкірт қышқылын жайлап қосады, ал соңында 3-5 мл қалғанда жылдамдатады.
3. Тұнбасы бар стаканды қайнап тұрған су моншасына бірнеше уақытқа қояды, содан кейін тоқтатып, ірі кристалды тұнба түскенше күтеміз. Осы үдеріс ірі кристалды тұнбаның түсуіне әсерін тигізеді. Тұнбаның үстіндегі ерітінді тұнық болып, тұнбаның толық түскенін тексереміз. Ол үшін стаканның қабырғасын бойлатып 2 – 3 тамшы күкірт қышқылын жайлап қосамыз. Суық күйінде қосуға болады. Егерде қышқыл тамшы араласқанда, ерітінді түсі өзгермесе, онда тұнба түсіру толық аяқталады . Стаканның бетін келесі кунге суланған фильтр қағазымен жауып қалдырамыз.
Сүзу және шаю. Тұнбаны бөліп алу үшін көк күлсізденген фильтр қағазын пайдаланады. Тұнбаныны таза ерітіндіден бөліп аламыз. Варонканың ішіне салынған сүзгі қағазын жыртып, тесіп алмас үшін, шыны таяқшаның бойымен жайлап лайламай құю керек. Шыны воронкаға фильтрді төрт бүктеп, сумен сулап, тұнбаны таяқша арқылы құйып, сүзеді (фильтрлейді). Тұнбаны бірнеше рет сумен декантациялап шаяды. Тұнбаның толық шайылуын тексеру үшін соңғы воронкадан шыққан 1 – 2 мл сұйықтықты бөлек сынауыққа алып, оған 1 – 2 мл 2 н. азот қышқылы ертіндісін және 3 – 4 тамшы 0,5 н. BaCI2 ерітіндісін қосады. Бұл кезде ерітіндінің түсі лайланған болмау керек. Ерітіндіні сүзгі фильтріне ауыстырады. Воронканы ылғал фильтр кағазбен жауып тұнбаны кептіргіш шкафта 100 – 1100 С та кептіреді.
Кептіру және қақтау. Сүзілген тұнбаны кептіргіш шкафқа қояды. Бос қақталған тигельді өлшейді, оған тұнбаны салып, фильтр қағазбен бірге жалында қыздырып, күйдіреді. Түтін тоқтаған соң, оны (6000 -8000 ) 40-45 минут қыздырады. Тигельді алып, эксикаторда суытып, аналитикалық таразыда өлшейді.
Қыздырудың соңғы өлшем аралықтары 0,0002 г аспағанға дейін жүргізеді. Қыздырған кезде мынадай реакция жүруі мүмкін, бірақ ол тұнбаға әсер етпейді:
BaSO4+2C→BaS+2CO2↑
BaS+2O2→BaSO4
Есептеулер жүргізу.
Кристалды барий хлоридінің өлшемі
1.Кристалды барий хлоридінің сағат әйнегімен массасы
2.Сағат әйнегінің массасы
3.Барий хлоридінің массасы
Тұнба түсетін BaSO4 барий сульфатының өлшемі
бірінші күйдіргендегі тигельдің массасы
екінші күйдіргендегі тигельдің массасы
Барий сульфатының BaSO4 бірінші күйдіргендегі тигельдің массасы
Барий сульфатының BaSO4 екінші күйдіргендегі тигельдің массасы
Барий сульфатының BaSO4 массасы
І өлшеу- бос тигельдің массасы -14,2202 г
ІІ өлшеу- тигель мен тұнба массасы - 14,6897 г
ІІІ өлшеу-тигель мен тұнба массасы - 14,6896г
Масса BaSO4 - 0,4694 г
Ba2+ мөлшерін анықтайды.
233,4 г BaSO4 – 137,3 г Ва
x = 137,3*0,4694/233,4 0,2761 г Ва
Табылған сан 0,4899 г (0,5г) барий хлоридіндегі барийдің мөлшерін көрсетеді:
0,4899г BaCl2 · 2H2O – 0,2761г
Ba 100 г BaCl2 · 2H2O – y г
Ba y= 56,36 %
Анықтауды тексеру: Теориялық шығым арқылы мына пропорциямен есептеу қажет: 244,28 г BaCl2 · 2H2O – 137,3г Ba
100 г BaCl2 · 2H2O – x г Ba
x = 56,20г (56,2%)
Абсолюттік қателікті анықтау: 56,36 - 56,20 = 0,16%
Салыстырмалы қателікті есептеу: 56,20 - 0,16 х=0,16*100/56,20=0,28%
100 - х
\
Сұйық ортаның қышқылдылығын тұрақты сақтап тұру адам ағзасының қызметі үшін маңызы жоғары рН реттеу қызметін буферлі жүйелер атқарады.
Буферлік жүйелердің адам ағзасы үшін маңызы жоғары. Адам қаны буферлік жүйелерге жатады. Адам ағзасында әсіресе, бүйректің бөліп шығару және өкпенің тыныс алу қызметтері үшін буферлік жүйелердің маңызы жоғары.
Буферлік жүйелердің адам ағзасы үшін маңызы жоғары. Адам қаны буферлік жүйелерге жатады. Адам ағзасында әсіресе, бүйректің бөліп шығару және өкпенің тыныс алу қызметтері үшін буферлік жүйелердің маңызы жоғары. Адам ағзасындағы сұйықтықтар (қан, ұлпа сұйықтығы, лимфа т.б.) қасиетінің бірі - олардағы сутегі иондарының тұрақты кон-центрациясын көрсетуі. Ағза сұйықтығының қышқылдылығының тұрақты болуының маңызы зор.
Буферлі жүйелер деп қышқылдың немесе сілтінің аз мөлшерін қосқанда, сонымен қатар сұйылтқанда, сутек иондарының концентрациясы, яғни рН өзгермейтін ерітінділерді айтады.
Адам ағзасындағы рН деңгейін сақтап туру буферлі жүйелердің көмегімен жүзеге асырылады.
Буферлі ерітінділер әдетте әлсіз қышқыл мен кушті негіз тұзының қоспасында (CH3CООH+CH3COONa 4 ацетатты буферлі қоспа) немесе әлсіз негіз бен оның күшті қышқыл тұзының қоспасынан (NH4OH+NH4CI аммиакты буферлі қоспа) тұрады. Сонымен бірге, әлсіз қышқылдардың қышқыл және орта тұздарының (NaHCО3+Na2C03 карбонатты буферлі қоспа) немесе екі кышқыл түздарының қоспасы (NaН2РО4+NaHPО4 фосфатты буферлі коспа) буферлік қасиет көрсетеді.
Буферлі ерітіндіге қышқыл не сілті косқанда, не болмаса оларды сұйылтқанда рН өзгермей түрақты болуын буферлік әсер деп атайды.
Әлсіз қышқыл мен оның сілтілік тұзынаң тұратын буферлі ерітіндіге (CH3COOH+CH3COONa) күшті қышқыл қосқандағы оның буферлік әсерін былай түсіндіреді:
Күшті кышқыддың Н+ иондары тұздың аниондарымен байланысып, әлсіз қышқылдың диссоциацияланбайтын молекулаларын түзеді. Мысалы:
CH3COONa+HCl ↔ CH3COOH+NaCl
ал күшті негіз қосқанда ОН иондары Н+ қосылып Н2О молеқулаларын түзеді:
СНзСООН+NaOH ↔ CH3COONa+H20
Әлсіз негіз бен оның тұзынан тұратын ерітіндінің
NH4OH+NH4CI буферлік әсерін былай түсіндіреді:
Күшті қышқыл қосқанда
NH40H + HC1 → NH4Cl + H20
Күшті негіз қосқанда
NH4CI+NaOH→NH4OH+NaCl
Буферлі ерітінділердің белгілі шамада рН-ты ұстау қасиеті де міне осында жатыр.
Буферлік әсерді су, ондағы еріген қышқыл (негіз) және тұз арасындағы тендікті сақталуымен түсіндіреді.


шағым қалдыра аласыз















