
Тақырыбы: Компоненттері химиялық әрекеттесетін жүйелер. Конгруэнтті балқу нүктесі бар қосылыстар түзетін жүйелер, оладың диаграммасын сызып, талдау жүргізу
Жоспары
- Компоненттері химиялық әрекеттесетін жүйелер.
- Конгруэнтті балқу нүктесі бар қосылыстар түзетін жүйелер
- Оладың диаграммасы
Жүйе компоненттері бір - бірінде балқып еріген кезде олардың химиялық реакцияға түсуі жиі байқалады . Реакция нәтижесінде түзілетін қосылыс бастапқы алынған компоненттерге ыдырамайтын тұрақты қосылыс болса, оны конгруэнтті балқитын қосылыс деп атайды ( латын сөзі congruentis – бірдей болу ). Конгруэнтті балқитын қосылыстар балқыған кезде тепе - теңдіктегі қатты және сұйық фазалардың құрамдары бірдей болады. 36 - суретте конгруэнтті балқитын косылыс түзетін екі компонентті жүйенің балқу диаграммасы берілген .
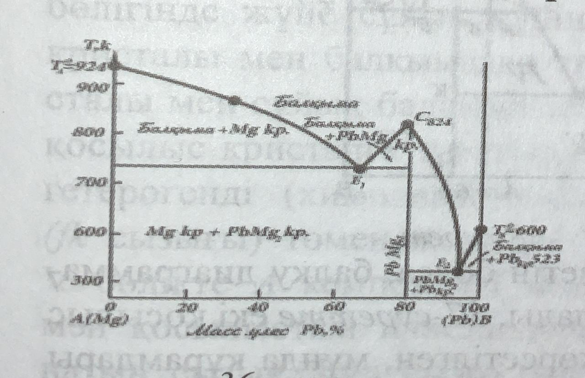
Магний мен қорғасын химиялық әрекеттесіп , PbMg2, қосылысын түзеді . Сондықтан магний мен қорғасын қоспаларының балқымасын суыткан кезде жалпы алғанда , үш қатты фаза кристалға түседі, олар бастапқы алынған компонентте PbMg және Pb кристалдары мен химиялық қосылыстың PbMg2 , кристалы . Балқу диаграммаларында әр қатты фазаның өзіне тән кристалдану қисығы болады : AE кисығы магнийдің , BE қисығы — қорғасынның , СЕ қисығы — қосылыстың кристалдану ( балку ) қисыктары . Химиялық қосылысқа ( PbMg2 , ) магнийдің немесе қорғасынның кристалдарын біртіндеп қосса , қосылыстың балқу температурасы төмендейді . Соған байланысты қосылыстың ликвидус қисығында ( Е1СЕ2 , -қисығы ) максимум нүктесі ( С нүктесі ) пайда болады . Максимум нүктесінің ординатасы қосылыстың балқу температурасын ( T = 824 ) абсциссасы оның құрамын (80 % Pb + 20 % Mg) көрсетеді . С нүктесінен абсцисса осіне түсірілген перпендикуляр диаграмманы екі бөлікке бөледі : бұл бөліктердің әрқайсысын химиялық әрекеттеспейтін екі компонентті жүйенің ( РЬ – PbMg2 , және PbMg2 , - Mg жүйелері) балқу диаграммасы деп қарастыруға болады . Сөйтіп Mg - Pb жүйенің балқу диаграммасын екі қарапайым диаграммадан құралған деуге болады . Егер магнийге химиялық қосылысты ( PbMg2 , ) біртіндеп қосса , магнийдің қоспалардан кристалдану температурасы ТАЕ1. қисығы бойымен төмендейді , ал керісінше , химиялық қосылысқа магнийді қосса , косылыстың балқу температурасы CE1 , қисығы бойынша төмендейді CE1 , және ТВЕ2 ликвидус қисықтары екінші эвтектикалық нүктесінде қиылысады . Сол сияқты CE2 , және ТВ Е2 , ликвидустары химиялық қосылыстың оған қорғасын қосылғандағы және қорғасынның оған химиялық қосылыс қосылғандағы балқу температураларының құрамға байланысты өзгеруін көрсетеді . СЕ2 , және ТЕ2 , қисықтары екінші эвтектикалық нүктеде ( Е2 , нүктесі ) қиылысады. Сөйтіп жүйеде екі эвтектикалық нүкте және екi солидус кисықтары пайда болады . Диаграмманың әр бөліктеріндегі жүйенің фазалық күйлерін жоғарыда қарастырылған қарапайым жүйелердің балку диаграммасындағы сияқты оңай анықтауға болады . Ликвидус қисықтарынан жоғары жатқан бөлікте жүйе бір фазалы ( сұйық балқыма ) , яғни бивариантты ; ликвидус және солидус қисықтарымен қоршалған бөліктерде жүйе екі фазалы ( сұйық балқыма + кристалл ) , моновариантты ; солидус сызықтарынан төмен жатқан бөліктерде жүйе тағы да екі фазалы ( Mg + PbMg2 , кристалдары ; PbMg2 , + Pb кристалдары ) , моновариантты . Диаграммадағы С нүктесі диcтeктика нүктесі деп аталады . С нүктесінде жүйе бір компонентті ( PbMg2 , компоненті) және екі фазалы ( PbMg2 , балкымасы + PbMg2 , кристалы ) , яғни бұл нүктеде жүйе инвариантты : ( E = 1-2 + 1 = 0 ) .
Егер жүйе компоненттері өзара бірнеше қосылыстар түзетін болса, балқу диаграммасында олардың әрқайсысына тән максимум нүктелері болады .
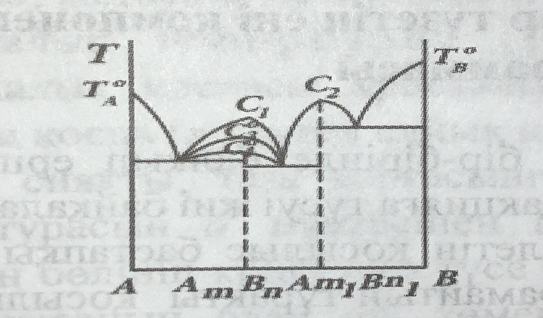
2- суретте екі қосылыс түзілетін жүйенің балқу диаграммасы сызбалық түрде көрсетілген , мұнда құрамдары AmBn және Аm1 Вn1 қосылыстарының ликвидус қисықтарындағы максимум нүктелері С1 , және С2. Бірнеше қосылыс түзетін екі компонентті жүйелерге Ag - Си , Ce - Sn , Cu - Mg т.б. жатады . Жүйеде түзілетін химиялық қосылыстардың тұрақтылығына байланысты олардың ликвидус кисығындағы максимумның формасы әртүрлі болады; қосылыс неғұрлым тұрақты болса , максимум соғұрлым үшкір болып келеді . Үшкір максимум нүктесін сингулярлық нүкте немесе дальтондық нүкте деп атайды ( 37 - сурет , C1 , C2 , нүктелері ) . Бірақ көптеген қосылыстар балқыған кезде азды көпті диссоциацияға ұшырап , бастапқы алынған компоненттерге ыдырайды : Am Bn = ) mA + nB . Максимум нүктесінде бұл кезде қосылыстың таза өзі болмай , оның бастапқы А және В компоненттерімен қоспасы болатындықтан , максимумның формасы доғал болады . Қосылыстың тұрақтылығы азайған сайын максимум доғалдана береді ( 2 - сурет) .
жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
Компоненттері химиялық әрекеттесетін жүйелер
Компоненттері химиялық әрекеттесетін жүйелер
Тақырыбы: Компоненттері химиялық әрекеттесетін жүйелер. Конгруэнтті балқу нүктесі бар қосылыстар түзетін жүйелер, оладың диаграммасын сызып, талдау жүргізу
Жоспары
- Компоненттері химиялық әрекеттесетін жүйелер.
- Конгруэнтті балқу нүктесі бар қосылыстар түзетін жүйелер
- Оладың диаграммасы
Жүйе компоненттері бір - бірінде балқып еріген кезде олардың химиялық реакцияға түсуі жиі байқалады . Реакция нәтижесінде түзілетін қосылыс бастапқы алынған компоненттерге ыдырамайтын тұрақты қосылыс болса, оны конгруэнтті балқитын қосылыс деп атайды ( латын сөзі congruentis – бірдей болу ). Конгруэнтті балқитын қосылыстар балқыған кезде тепе - теңдіктегі қатты және сұйық фазалардың құрамдары бірдей болады. 36 - суретте конгруэнтті балқитын косылыс түзетін екі компонентті жүйенің балқу диаграммасы берілген .

Магний мен қорғасын химиялық әрекеттесіп , PbMg2, қосылысын түзеді . Сондықтан магний мен қорғасын қоспаларының балқымасын суыткан кезде жалпы алғанда , үш қатты фаза кристалға түседі, олар бастапқы алынған компонентте PbMg және Pb кристалдары мен химиялық қосылыстың PbMg2 , кристалы . Балқу диаграммаларында әр қатты фазаның өзіне тән кристалдану қисығы болады : AE кисығы магнийдің , BE қисығы — қорғасынның , СЕ қисығы — қосылыстың кристалдану ( балку ) қисыктары . Химиялық қосылысқа ( PbMg2 , ) магнийдің немесе қорғасынның кристалдарын біртіндеп қосса , қосылыстың балқу температурасы төмендейді . Соған байланысты қосылыстың ликвидус қисығында ( Е1СЕ2 , -қисығы ) максимум нүктесі ( С нүктесі ) пайда болады . Максимум нүктесінің ординатасы қосылыстың балқу температурасын ( T = 824 ) абсциссасы оның құрамын (80 % Pb + 20 % Mg) көрсетеді . С нүктесінен абсцисса осіне түсірілген перпендикуляр диаграмманы екі бөлікке бөледі : бұл бөліктердің әрқайсысын химиялық әрекеттеспейтін екі компонентті жүйенің ( РЬ – PbMg2 , және PbMg2 , - Mg жүйелері) балқу диаграммасы деп қарастыруға болады . Сөйтіп Mg - Pb жүйенің балқу диаграммасын екі қарапайым диаграммадан құралған деуге болады . Егер магнийге химиялық қосылысты ( PbMg2 , ) біртіндеп қосса , магнийдің қоспалардан кристалдану температурасы ТАЕ1. қисығы бойымен төмендейді , ал керісінше , химиялық қосылысқа магнийді қосса , косылыстың балқу температурасы CE1 , қисығы бойынша төмендейді CE1 , және ТВЕ2 ликвидус қисықтары екінші эвтектикалық нүктесінде қиылысады . Сол сияқты CE2 , және ТВ Е2 , ликвидустары химиялық қосылыстың оған қорғасын қосылғандағы және қорғасынның оған химиялық қосылыс қосылғандағы балқу температураларының құрамға байланысты өзгеруін көрсетеді . СЕ2 , және ТЕ2 , қисықтары екінші эвтектикалық нүктеде ( Е2 , нүктесі ) қиылысады. Сөйтіп жүйеде екі эвтектикалық нүкте және екi солидус кисықтары пайда болады . Диаграмманың әр бөліктеріндегі жүйенің фазалық күйлерін жоғарыда қарастырылған қарапайым жүйелердің балку диаграммасындағы сияқты оңай анықтауға болады . Ликвидус қисықтарынан жоғары жатқан бөлікте жүйе бір фазалы ( сұйық балқыма ) , яғни бивариантты ; ликвидус және солидус қисықтарымен қоршалған бөліктерде жүйе екі фазалы ( сұйық балқыма + кристалл ) , моновариантты ; солидус сызықтарынан төмен жатқан бөліктерде жүйе тағы да екі фазалы ( Mg + PbMg2 , кристалдары ; PbMg2 , + Pb кристалдары ) , моновариантты . Диаграммадағы С нүктесі диcтeктика нүктесі деп аталады . С нүктесінде жүйе бір компонентті ( PbMg2 , компоненті) және екі фазалы ( PbMg2 , балкымасы + PbMg2 , кристалы ) , яғни бұл нүктеде жүйе инвариантты : ( E = 1-2 + 1 = 0 ) .
Егер жүйе компоненттері өзара бірнеше қосылыстар түзетін болса, балқу диаграммасында олардың әрқайсысына тән максимум нүктелері болады .

2- суретте екі қосылыс түзілетін жүйенің балқу диаграммасы сызбалық түрде көрсетілген , мұнда құрамдары AmBn және Аm1 Вn1 қосылыстарының ликвидус қисықтарындағы максимум нүктелері С1 , және С2. Бірнеше қосылыс түзетін екі компонентті жүйелерге Ag - Си , Ce - Sn , Cu - Mg т.б. жатады . Жүйеде түзілетін химиялық қосылыстардың тұрақтылығына байланысты олардың ликвидус кисығындағы максимумның формасы әртүрлі болады; қосылыс неғұрлым тұрақты болса , максимум соғұрлым үшкір болып келеді . Үшкір максимум нүктесін сингулярлық нүкте немесе дальтондық нүкте деп атайды ( 37 - сурет , C1 , C2 , нүктелері ) . Бірақ көптеген қосылыстар балқыған кезде азды көпті диссоциацияға ұшырап , бастапқы алынған компоненттерге ыдырайды : Am Bn = ) mA + nB . Максимум нүктесінде бұл кезде қосылыстың таза өзі болмай , оның бастапқы А және В компоненттерімен қоспасы болатындықтан , максимумның формасы доғал болады . Қосылыстың тұрақтылығы азайған сайын максимум доғалдана береді ( 2 - сурет) .

шағым қалдыра аласыз















